第25讲 难溶电解质的溶解平衡 学案(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第25讲 难溶电解质的溶解平衡 学案(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 955.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-27 20:54:46 | ||
图片预览



文档简介
第25讲 难溶电解质的溶解平衡
复习要求 1. 能通过实验证明水溶液中存在的难溶电解质沉淀溶解平衡。2. 了解沉淀的生成、溶解与转化。3. 能利用离子积与溶度积常数的关系判断溶液中难溶电解质的沉淀和溶解情况。
知识体系
考点一 沉淀溶解平衡及溶度积常数
一、 沉淀溶解平衡
1. 概念:在一定温度下,当____________在水中形成饱和溶液时,沉淀速率与溶解速率相等,达到平衡状态。
2. 沉淀溶解平衡的建立
溶质溶解的过程是一个可逆过程:
固体溶质溶液中的溶质
3. 特点(同其他化学平衡):逆、等、定、动、变(适用平衡移动原理)。
二、 溶度积常数
1. 溶度积表达式
AgCl(s)Ag+(aq)+Cl-(aq)
Ksp=c(Ag+)·c(Cl-)
Ag2S(s)2Ag+(aq)+S2-(aq)
Ksp=c2(Ag+)·c(S2-)
(式中的浓度都是平衡浓度)
2. 溶度积和离子积
(1)溶度积常数和Qc比较
以AmBn(s)mAn++nBm-为例:
溶度积(Ksp) 离子积(Qc)
含义 沉淀溶解平衡的平衡常数 溶液中有关离子浓度幂的乘积
表达式 Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度是________ Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度是________
应用 判断在一定条件下沉淀能否生成或溶解:①Qc>Ksp:溶液过饱和,有沉淀析出;②Qc=Ksp:溶液饱和,处于平衡状态;③Qc<Ksp:溶液未饱和,无沉淀析出
(2)Ksp的影响因素
①内因:溶度积与难溶电解质溶解能力的关系:阴、阳离子个数比相同的难溶电解质,溶度积越小,其溶解能力越小;不同类型的难溶电解质,应通过计算才能进行比较溶解能力。
②外因:仅与________有关,与浓度、压强、催化剂等无关。
3. 溶度积意义
(1)利用Ksp判断离子沉淀的先后顺序
①组成相似的难溶物
已知:常温时,AgCl、AgBr、AgI的Ksp分别为1.8×10-10、5.4×10-13、8.5×10-17。将0.001 mol·L-1 AgNO3溶液分别滴入浓度均为0.001 mol·L-1的KCl、KBr、KI溶液中,先后沉淀的物质分别是AgI、AgBr、AgCl。
②组成不相似的难溶物
已知:常温时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。将0.001 mol·L-1 AgNO3溶液分别滴入浓度均为0.001 mol·L-1的KCl和K2CrO4溶液中,先产生AgCl沉淀。
(2)利用Ksp求混合溶液中离子浓度比值
向含有Ca2+、Mg2+的某MnSO4溶液(pH约为5)中加入NH4F溶液,使溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05 mol·L-1,则=100[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]。
(3)利用Ksp计算溶液pH(或沉淀离子的pH范围)
已知:室温下,Ksp[Fe(OH)3]=1×10-37.4、Ksp[Mn(OH)2]=2×10-13,某c(Mn2+)=0.2 mol·L-1的溶液中含有一定量的Fe3+,欲使溶液中c(Fe3+)<10-5 mol·L-1,需控制溶液pH的范围是3.2~8.0。
(4)利用Ksp求化学平衡常数K
已知:常温时,Ksp(FeS)=6.5×10-18,H2S电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。在弱酸性溶液中,FeS(s)+H+(aq)Fe2+(aq)+HS-(aq)的平衡常数K=5×10-5。
【易错辨析】
1. 相同温度下,Ksp小的电解质其溶解能力一定比Ksp大的电解质的溶解能力小。( )
2. 任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示。( )
3. 沉淀达到溶解平衡时,溶液中难溶电解质电离出的各个离子浓度均相等。( )
4. AgCl难溶于水,所以将AgCl加入水中所得溶液中不含Ag+、Cl-。( )
5. 取两支试管,一支加入NaCl溶液,另一支加入等浓度、等体积的NaI溶液,分别加入同一AgNO3溶液,可以通过产生沉淀的顺序来验证AgCl和AgI的Ksp大小。( )
类型1 Ksp的有关计算——单一溶质溶液
1. 常温下,Mg(OH)2的Ksp=1.0×10-11,在c(Mg2+)=0.01 mol·L-1的溶液中,当Mg(OH)2刚开始沉淀时,溶液的pH为__________;若要使其沉淀完全[c(Mg2+)≤1.0×10-5 mol·L-1],pH的范围是__________。
类型2 Ksp的有关计算——混合溶液中离子完全沉淀所需pH(或pH范围)
2. (2024·淮安高三上期中)胆矾是一种用途广泛的中药材,可行肝风,泻肝火。某化学兴趣小组以含铜废料(Cu、CuO、Fe、Ag)制备CuSO4·5H2O,实验流程如下所示:
已知室温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cu(OH)2]=2.0×10-20
上述酸浸液中Cu2+的浓度为0.2 mol·L-1,加NaOH调节pH,使酸浸液中Fe3+完全沉淀(离子浓度小于10-5 mol·L-1)与Cu2+分离,溶液pH值调节的范围为__________________(设加NaOH时溶液体积不变)。
类型3 Ksp的有关计算——利用Ksp求化学平衡常数K
3. (2023·江苏卷)实验室模拟“镁法工业烟气脱硫”并制备MgSO4·H2O,其实验过程可表示为
在搅拌下向氧化镁浆料中匀速缓慢通入SO2气体,生成MgSO3,反应为Mg(OH)2+H2SO3===MgSO3+2H2O,其平衡常数K与Ksp[Mg(OH)2]、Ksp(MgSO3)、Ka1(H2SO3)、Ka2(H2SO3)的代数关系式为K=________________________________________________________________________。
考点二 沉淀溶解平衡移动 沉淀溶解平衡图像
一、 沉淀溶解平衡的影响因素
1. 影响因素
(1)内因:难溶电解质本身的性质。
(2)外因
2. 实例
以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例,下表为外因对溶解平衡的影响
外界条件 移动方向 c(Ag+) Ksp
升高温度 ________ ________ ________
加水(固体有剩余) ________ ________ ________
续表
加入少量AgNO3(s) ______ ______ ______
加入Na2S(s) ______ ______ ______
通入HCl ______ ______ ________
通入NH3 ______ ______ ______
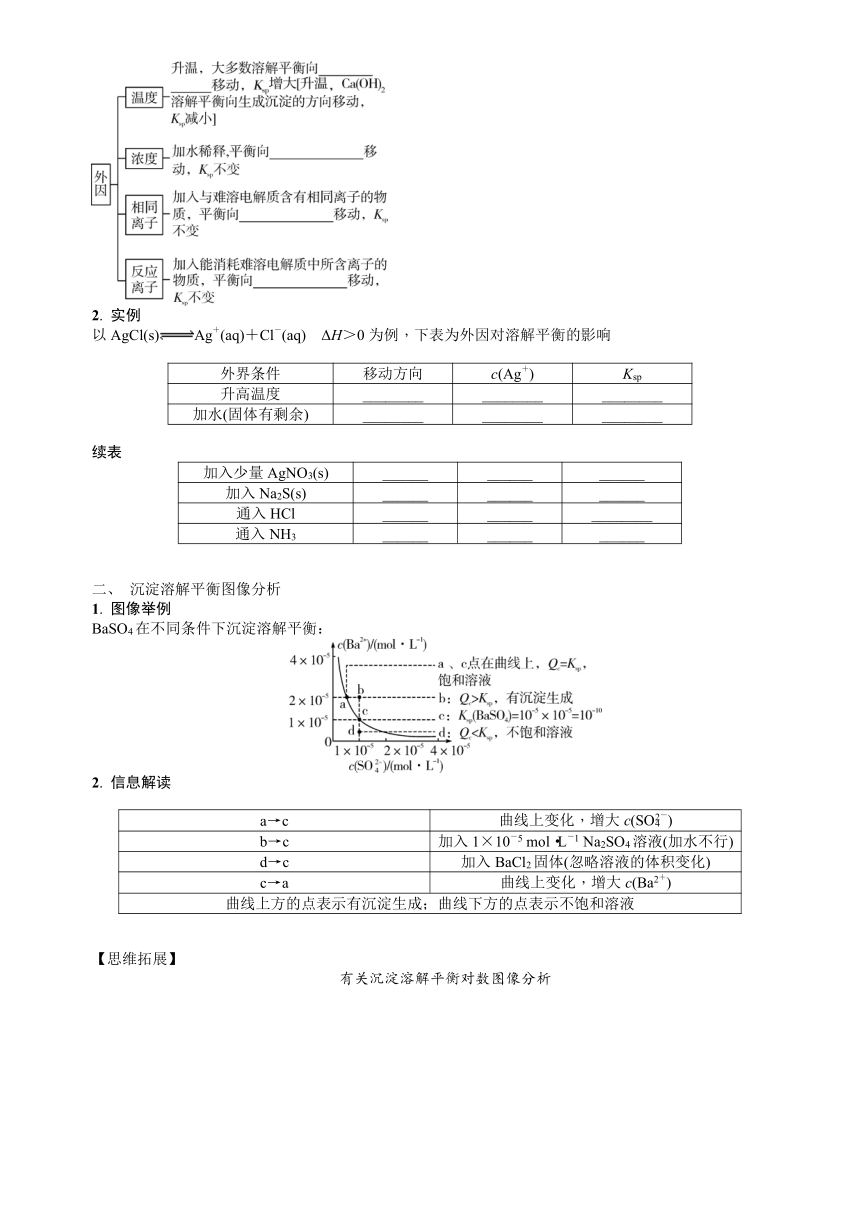
二、 沉淀溶解平衡图像分析
1. 图像举例
BaSO4在不同条件下沉淀溶解平衡:
2. 信息解读
a→c 曲线上变化,增大c(SO)
b→c 加入1×10-5 mol·L-1 Na2SO4溶液(加水不行)
d→c 加入BaCl2固体(忽略溶液的体积变化)
c→a 曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液
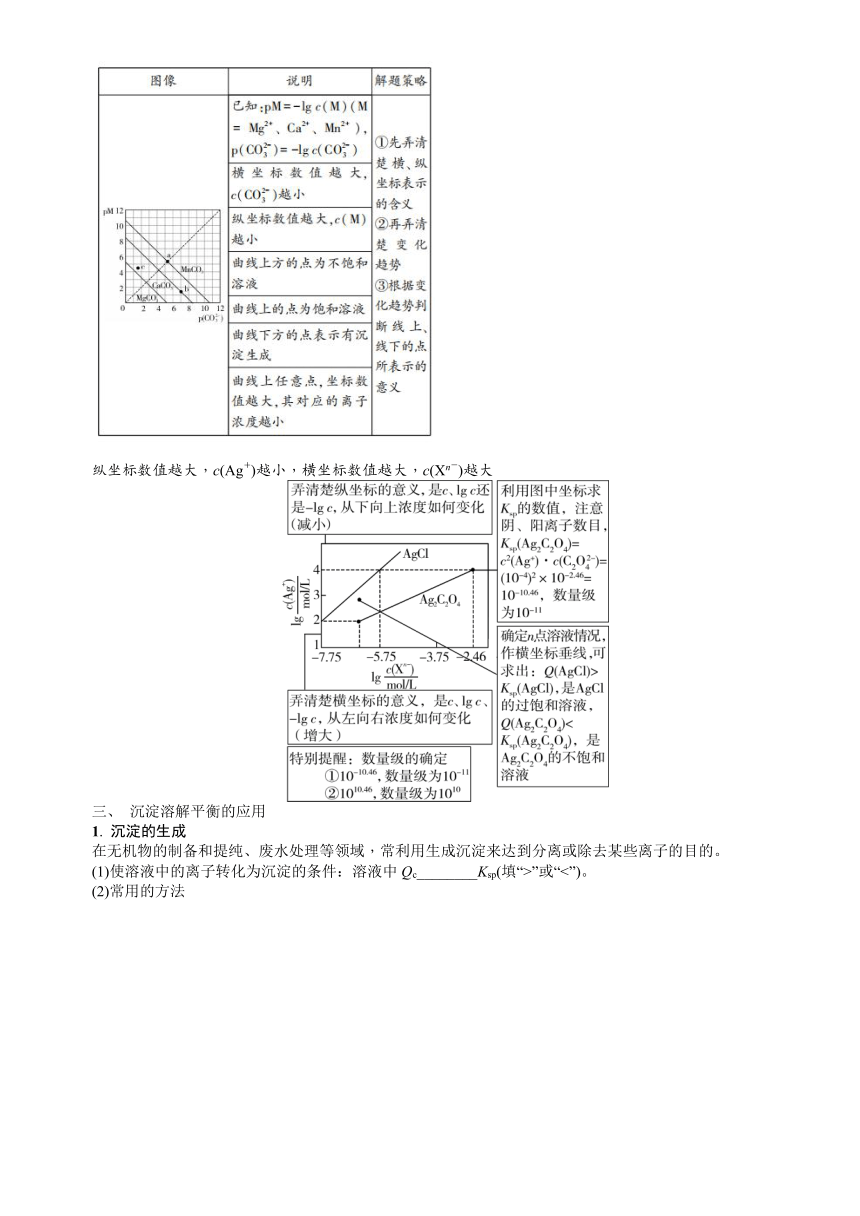
【思维拓展】
有关沉淀溶解平衡对数图像分析
纵坐标数值越大,c(Ag+)越小,横坐标数值越大,c(Xn-)越大
三、 沉淀溶解平衡的应用
1. 沉淀的生成
在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
(1)使溶液中的离子转化为沉淀的条件:溶液中Qc________Ksp(填“>”或“<”)。
(2)常用的方法
2. 沉淀的溶解
(1)原理:不断减少溶解平衡体系中的相应离子,使Q________Ksp,平衡向______________移动。
(2)溶解方法
①酸溶解法,如CaCO3溶于盐酸;
②盐溶液溶解法,如Mg(OH)2溶于NH4Cl溶液;
③配位溶解法,如AgCl溶于氨水。
四、 沉淀的转化
1. 原理:由一种沉淀转化为另一种沉淀的过程,实质是____________________。
2. 沉淀转化规律
(1)一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。
(2)一定条件下溶解能力小的沉淀也可以转化成溶解能力相对较大的沉淀。
以AgCl(s)+I-(aq)AgI(s)+Cl-(aq)为例:
①平衡时,K==。
②若要平衡向右移动,Q=【易错辨析】
1. 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色CuS沉淀,Ksp(CuS)<Ksp(ZnS)。( )
2. 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl,沉淀量不变。( )
3. 在Ag+(aq)+Cl-(aq)AgCl(s)平衡体系中,加入AgNO3固体,可使反应向右移动达到新平衡。( )
4. 向AgCl沉淀中加入KI溶液,由白色沉淀转变成黄色沉淀,是由于Ksp(AgI)5. 升高温度,沉淀溶解平衡一定正向移动。( )
类型1 沉淀溶解及其影响因素
1. 一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)关系如图所示。下列说法正确的是( )
A. a点对应的Ksp最大
B. AgCl在c点的溶解度比b点的大
C. AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
D. b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化
类型2 沉淀溶解双直线图
2. (2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A. a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B. b点时,c(Cl-)=c(CrO),Ksp(AgCl)=Ksp(Ag2CrO4)
C. Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9
D. 向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
类型3 沉淀的转化
3. (2025·连云港模拟)室温下,用0.01 mol·L-1 CuSO4溶液浸泡NiS固体,一段时间后过滤,向滤液中加入氨水,产生蓝色沉淀。已知Ksp(NiS)=1.0×10-21,Ksp(CuS)=1.5×10-36,Ksp(PbS)=9×10-29。下列有关说法正确的是( )
A. 过滤后所得溶液中存在:c(Ni2+)·c(S2-)B. 滤液中加入氨水产生蓝色沉淀的离子方程式:Cu2++2OH-===Cu(OH)2↓
C. 欲使反应NiS(s)+Cu2+Ni2++CuS(s)向右进行,则需满足>×1015
D. 用0.01 mol·L-1 CuSO4溶液浸泡PbS固体,不能得到CuS固体
类型4 Ksp的大小比较
4. (2025·江苏模拟组合题)室温下,下列实验探究方案能达到探究目的的是( )
选项 实验操作和现象 实验结论
A 向盛有5 mL 0.1 mol·L-1 AgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液,有黄色沉淀产生 Ksp(AgCl)>Ksp(AgI)
B 向5 mL NaCl和KI的混合溶液中,滴加1~2滴0.1 mol·L-1 AgNO3溶液,观察到先产生了白色沉淀,后产生了黄色沉淀 Ksp(AgCl)>Ksp(AgI)
C 向盛有10滴0.1 mol·L-1 Na2S溶液的试管中滴入0.1 mol·L-1 ZnSO4溶液,至不再有白色沉淀生成;再向其中加入几滴0.1 mol·L-1 CuSO4溶液,观察到有黑色沉淀产生 Ksp(ZnS)>Ksp(CuS)
D 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 Ksp(BaSO4)>Ksp(BaCO3)
类型5 电解质概念综合
5. MB是一种难溶盐,H2B是一种二元弱酸(Ka1=1.3×10-7,Ka2=2.6×10-15),M2+不发生水解。室温下,将MB溶于一定浓度的一元强酸HA溶液中,直到不再溶解,所得溶液中c2(H+)—c2(M2+)有如图所示线性关系,下列说法错误的是(已知:=2.6,忽略溶液体积的变化)( )
A. 在图示实线对应的pH范围内,溶液中c(M2+)≈c(H2B)
B. MB的溶度积Ksp(MB)≈1.0×10-23
C. 溶液中存在c(HB-)+c(H+)+2c(H2B)=c(A-)+c(OH-)
D. 将0.02 mol MB溶于1.0 L HA溶液中,所需HA的最低浓度为0.30 mol·L-1
素 养 评 估
1. 将足量AgCl(s)溶解在水中,形成悬浊液。已知:AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0,下列叙述错误的是( )
A. 加热悬浊液,使其温度升高,则Ksp(AgCl)增大
B. 加少量水稀释,上述平衡正向移动,c(Ag+)不变
C. 向悬浊液中通入少量氨气,Q(AgCl)D. 加入NaCl固体,则AgCl的溶解度减小,Ksp(AgCl)也减小
2. (2024·淮安中学最后一模)室温下,将Na2CO3溶液与过量CaSO4固体混合,溶液pH随时间变化如图所示。
已知:Ksp(CaSO4)=4.9×10-5,Ksp(CaCO3)=3.4×10-9。
下列说法不正确的是( )
A. 0~600 s内上层清液中存在:c(Na+)+2c(Ca2+)B. 两者混合发生反应:CaSO4(s)+CO(aq)CaCO3(s)+SO(aq)
C. 充分反应后上层清液中eq \f(c(SO),c(CO))约为1.4×104
D. 随着反应的进行,CO+H2OHCO+OH-逆向移动,溶液pH下降
3. (2024·泰州靖江一模)废旧铅蓄电池会导致铅污染,RSR工艺回收铅的化工流程如图所示。
已知:ⅰ. 铅膏的主要成分是PbO2和PbSO4;HBF4是强酸;
ⅱ. Ksp(PbSO4)=1.6×10-8、Ksp(PbCO3)=7.4×10-14。
下列有关说法错误的是( )
A. 步骤②中反应PbSO4(s)+CO(aq)PbCO3(s)+SO(aq)的化学平衡常数K约为2.2×105
B. 操作③需要用的玻璃仪器有烧杯、漏斗、玻璃棒
C. 步骤④发生反应的离子方程式为PbCO3+2H+===Pb2++CO2↑+H2O
D. 副产品M的主要成分是(NH4)2SO3
4. (1)某一反应的平衡常数大于105时,可认为反应能进行完全,某酸浸液含有Cd2+等重金属阳离子,请结合数据说明能否用MnS除去Cd2+:_______________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________。
[Ksp(MnS)=1.2×10-14,Ksp(CdS)=3.6×10-29]。
(2)已知:Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-36,某溶液中的Cu2+加入NiS除去,反应:NiS(s)+Cu2+(aq)CuS(s)+Ni2+(aq),该反应的平衡常数K=__________。
(3)以钛铁矿(主要成分为FeTiO3)为原料制备纳米TiO2。25 ℃时,Ksp[TiO(OH)2]=1×10-29;Ksp[Fe(OH)3]=4×10-38;Ksp[Fe(OH)2]=8×10-16。
Ⅰ. 酸浸:向磨细的钛铁矿中加入浓硫酸,充分反应后,所得溶液中主要含有TiO2+、Fe2+、Fe3+、H+和SO。
Ⅱ. 除铁、沉钛:向溶液中加入铁粉,充分反应,趁热过滤。所得滤液冷却后过滤得到富含TiO2+的溶液;调节除铁后溶液的pH,使TiO2+水解生成TiO(OH)2,过滤。若沉钛后c(TiO2+)<1×10-5 mol·L-1,则需要调节溶液的pH略大于________。
第25讲 难溶电解质的溶解平衡
考点一 沉淀溶解平衡及溶度积常数
知识归纳
一、 1. 难溶电解质
2. > = <
二、 2. (1)平衡浓度 任意浓度 > = < (2)②温度
【易错辨析】
1. × 2. × 3. × 4. × 5. √
命题突破
1. 9.5 ≥11
解析:Mg(OH)2的Ksp=1.0×10-11,在c(Mg2+)=0.01 mol·L-1的溶液中,当Mg(OH)2刚开始沉淀时,c(OH-)== mol·L-1=1.0×10-4.5 mol·L-1,c(H+)= mol·L-1=1.0×10-9.5 mol·L-1,溶液的pH为9.5;若要使其沉淀完全[c(Mg2+)≤1.0×10-5 mol·L-1],c(OH-)≥= mol·L-1=1.0×10-3 mol·L-1,c(H+)= mol·L-1=1.0×10-11 mol·L-1,溶液的pH大于11。
2. 3<pH<4.5
解析:调节pH的步骤中,pH值必须满足的条件是比Fe3+完全转化为Fe(OH)3的pH大,比Cu2+开始沉淀的pH小,使酸浸液中Fe3+完全沉淀与Cu2+分离,Ksp[Fe(OH)3]=1.0×10-38,Fe3+完全沉淀时浓度为10-5 mol·L-1,则对应的OH-浓度为c(OH-)===10-11,即pOH=11,pH=3,同理,Cu2+的浓度为0.2 mol·L-1,可以求得Cu2+开始沉淀的pH为4.5,故3<pH<4.5。
3.
解析:已知下列反应:
①Mg(OH)2+H2SO3===MgSO3+2H2O K
②Mg(OH)2(s)Mg2+(aq)+2OH-(aq) Ksp[Mg(OH)2]
③MgSO3(s)Mg2+(aq)+SO(aq) Ksp(MgSO3)
④H2SO3H++HSO Ka1(H2SO3)
⑤HSOH++SO Ka2(H2SO3)
⑥H2OH++OH- Kw
根据盖斯定律,①=②-③+④+⑤-⑥×2,故K=。
考点二 沉淀溶解平衡移动 沉淀溶解平衡图像
知识归纳
一、 1. (2)沉淀溶解的方向 沉淀溶解的方向 生成沉淀的方向 沉淀溶解的方向
2. 右移 增大 增大 右移 不变 不变 左移 增大 不变 右移 减小 不变 左移 减小 不变 右移 减小 不变
三、 1. (1)>
2. (1)< 沉淀溶解的方向
四、 1. 沉淀溶解平衡的移动
【易错辨析】
1. × 2. × 3. √ 4. √ 5. ×
命题突破
1. C 解析:温度一定,Ksp不变,线上a、b、c三点对应的Ksp相等,A错误;AgCl在c点的溶解度比b点的小,B错误;b点的溶液中加入AgNO3固体,c(Ag+)变大,由Ksp(AgCl)=c(Ag+)·c(Cl-)知,c(Cl-)减小,故沿曲线向a点方向变化,D错误。
2. C 解析:根据图像,由(1.7,5)可得到Ag2CrO4的溶度积Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(1×10-5)2×1×10-1.7=10-11.7,由(4.8,5)可得到AgCl的溶度积Ksp(AgCl)=c(Ag+)·c(Cl-)=1×10-5×1×10-4.8=10-9.8,据此数据计算各选项结果。假设a点坐标为(4,6.5),此时分别计算反应的浓度商Q得,Q(AgCl)=10-10.5,Q(Ag2CrO4)=10-17,二者的浓度商均小于其对应的溶度积Ksp,二者不会生成沉淀,A错误;Ksp为难溶物的溶度积,是一种平衡常数,平衡常数只与温度有关,与浓度无关,根据分析可知,二者的溶度积不相同,B错误;该反应的平衡常数表达式为K=eq \f(c(CrO),c2(Cl-))=eq \f(c(CrO)·c2(Ag+),c2(Cl-)·c2(Ag+))=eq \f(Ksp(Ag2CrO4),K(AgCl))==1×107.9,C正确;向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3,开始沉淀时所需要的c(Ag+)分别为10-8.8和10-5.35,说明此时沉淀Cl-需要的银离子浓度更低,在这种情况下,先沉淀的是AgCl,D错误。故选C。
3. A 解析:Ksp(NiS)>Ksp(CuS),浸泡后,NiS(s)转化为CuS(s),使溶液中c(S2-)减小,则c(Ni2+)·c(S2-)4. C 解析:向盛有5 mL 0.1 mol·L-1 AgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,AgNO3溶液过量,继续滴加几滴NaI溶液,有黄色沉淀产生,不能肯定I-是与AgCl发生的反应,不能得出结论“Ksp(AgCl)>Ksp(AgI)”,A错误;5 mL NaCl和KI的混合溶液中,不知道各自的浓度,如果I-的浓度很大,即使AgI的溶度积小也会产生AgI的沉淀,B错误;由实验用量可知Na2S溶液被ZnSO4溶液充分反应,当加入CuSO4溶液有黑色沉淀生成的现象可知,ZnS转化为更难溶的CuS,发生沉淀的转化,可知CuS的溶度积小,即Ksp(ZnS)>Ksp(CuS),C正确;饱和Na2CO3溶液中加入少量BaSO4,Qc(BaCO3)>Ksp(BaCO3)时生成BaCO3沉淀,BaCO3沉淀可与盐酸反应生成二氧化碳气体,但是Ksp(BaSO4)5. B 解析:在图示实线对应的pH范围内,发生的反应为MB+2HA===MA2+H2B,H2B电离程度很小,可以忽略不计,M2+与H2B的浓度几乎相等,故A正确;由题中:MB+2H+===M2++H2B,Ksp(MB)=c(M2+)×c(B2-),Ka1×Ka2=,由Ka1、Ka2可知H2B酸性极弱,故c(H2B)≈c(M2+),所以Ka1×Ka2≈,即有c2(H+)≈c2(M2+),代入一组数据得Ksp(MB)≈1.0×10-22,B错误;由质子守恒可得出c(HB-)+c(H-)+2c(H2B)=c(A-)+c(OH-),故C正确;由图可知,c(M2+)=0.02 mol·L-1时,溶液中c(H+)=mol·L-1=0.26 mol·L-1,再加上1 L HA溶液中溶解0.02 mol MB时需消耗0.04 mol HA,故所需HA的最低浓度为0.30 mol·L-1,故D正确。
素养评估
1. D 解析:温度升高,溶解度增大,Ksp(AgCl)增大,A正确;加入少量水,平衡右移,但溶液还是饱和溶液,所以Ag+浓度不变,B正确;向悬浊液中通入少量氨气,形成[Ag(NH3)2]+,消耗Ag+,导致Q(AgCl)2. A 解析:根据电荷守恒,溶液呈碱性,A选项的小于号应该改为大于号,A错误;由于CaCO3更容易沉淀,B选项的离子方程式存在,B正确;充分反应后硫酸根浓度比上碳酸根浓度等于CaSO4溶度积比上CaCO3溶度积,C正确;随着反应进行,碳酸根浓度减小,水解平衡左移,溶液pH下降,D正确。故选A。
3. D 解析:废旧铅蓄电池处理后加水通入二氧化硫、碳酸铵,PbO2和二氧化硫发生氧化还原反应,四价铅转化为二价铅生成碳酸铅沉淀、二氧化硫转化为硫酸根生成副产品M硫酸铵;碳酸铅加入HBF4得到Pb(BF4)2和二氧化碳气体,Pb(BF4)2电解得到铅。步骤②中反应PbSO4(s)+CO(aq)??PbCO3(s)+SO(aq)的化学平衡常数K=eq \f(c(SO),c(CO))=eq \f(c(Pb2+)·c(SO),c(Pb2+)·c(CO))=≈2.2×105,A正确;操作③为分离固液的操作,是过滤,需要用的玻璃仪器有烧杯、漏斗、玻璃棒,B正确;HBF4是强酸,和碳酸铅反应生成二氧化碳、水和Pb(BF4)2,故步骤④发生反应的离子方程式为PbCO3+2H+===Pb2++CO2↑+H2O,C正确;副产品M的主要成分是(NH4)2SO4,D错误。故选D。
4. (1)MnS(s)+Cd2+Mn2++CdS(s)的平衡常数K===≈3.3×1014 105,该反应能进行完全,故可以用MnS除去Cd2+
(2)8.43×1014 (3)2
解析:(1)MnS(s)+Cd2+(aq)Mn2+(aq)+CdS(s)的平衡常数K===≈3.3×1014 105,该反应能进行完全,故可以用MnS除去Cd2+。
(2)“除杂”过程中加入NiS除去Cu2+发生的反应是NiS(s)+Cu2+(aq)??CuS(s)+Ni2+(aq),该反应的平衡常数K====≈8.43×1014。
(3)25 ℃时,Ksp[TiO(OH)2]=1×10-29,c(TiO2+)·c2(OH-)=1×10-29,c(TiO2+)<1×10-5 mol·L-1,c(OH-)>= mol·L-1=10-12 mol·L-1,c(H+)<= mol·L-1=10-2 mol·L-1,即需要调整溶液的pH>2。
复习要求 1. 能通过实验证明水溶液中存在的难溶电解质沉淀溶解平衡。2. 了解沉淀的生成、溶解与转化。3. 能利用离子积与溶度积常数的关系判断溶液中难溶电解质的沉淀和溶解情况。
知识体系
考点一 沉淀溶解平衡及溶度积常数
一、 沉淀溶解平衡
1. 概念:在一定温度下,当____________在水中形成饱和溶液时,沉淀速率与溶解速率相等,达到平衡状态。
2. 沉淀溶解平衡的建立
溶质溶解的过程是一个可逆过程:
固体溶质溶液中的溶质
3. 特点(同其他化学平衡):逆、等、定、动、变(适用平衡移动原理)。
二、 溶度积常数
1. 溶度积表达式
AgCl(s)Ag+(aq)+Cl-(aq)
Ksp=c(Ag+)·c(Cl-)
Ag2S(s)2Ag+(aq)+S2-(aq)
Ksp=c2(Ag+)·c(S2-)
(式中的浓度都是平衡浓度)
2. 溶度积和离子积
(1)溶度积常数和Qc比较
以AmBn(s)mAn++nBm-为例:
溶度积(Ksp) 离子积(Qc)
含义 沉淀溶解平衡的平衡常数 溶液中有关离子浓度幂的乘积
表达式 Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度是________ Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度是________
应用 判断在一定条件下沉淀能否生成或溶解:①Qc>Ksp:溶液过饱和,有沉淀析出;②Qc=Ksp:溶液饱和,处于平衡状态;③Qc<Ksp:溶液未饱和,无沉淀析出
(2)Ksp的影响因素
①内因:溶度积与难溶电解质溶解能力的关系:阴、阳离子个数比相同的难溶电解质,溶度积越小,其溶解能力越小;不同类型的难溶电解质,应通过计算才能进行比较溶解能力。
②外因:仅与________有关,与浓度、压强、催化剂等无关。
3. 溶度积意义
(1)利用Ksp判断离子沉淀的先后顺序
①组成相似的难溶物
已知:常温时,AgCl、AgBr、AgI的Ksp分别为1.8×10-10、5.4×10-13、8.5×10-17。将0.001 mol·L-1 AgNO3溶液分别滴入浓度均为0.001 mol·L-1的KCl、KBr、KI溶液中,先后沉淀的物质分别是AgI、AgBr、AgCl。
②组成不相似的难溶物
已知:常温时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12。将0.001 mol·L-1 AgNO3溶液分别滴入浓度均为0.001 mol·L-1的KCl和K2CrO4溶液中,先产生AgCl沉淀。
(2)利用Ksp求混合溶液中离子浓度比值
向含有Ca2+、Mg2+的某MnSO4溶液(pH约为5)中加入NH4F溶液,使溶液中的Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05 mol·L-1,则=100[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]。
(3)利用Ksp计算溶液pH(或沉淀离子的pH范围)
已知:室温下,Ksp[Fe(OH)3]=1×10-37.4、Ksp[Mn(OH)2]=2×10-13,某c(Mn2+)=0.2 mol·L-1的溶液中含有一定量的Fe3+,欲使溶液中c(Fe3+)<10-5 mol·L-1,需控制溶液pH的范围是3.2~8.0。
(4)利用Ksp求化学平衡常数K
已知:常温时,Ksp(FeS)=6.5×10-18,H2S电离常数分别为Ka1=1.1×10-7、Ka2=1.3×10-13。在弱酸性溶液中,FeS(s)+H+(aq)Fe2+(aq)+HS-(aq)的平衡常数K=5×10-5。
【易错辨析】
1. 相同温度下,Ksp小的电解质其溶解能力一定比Ksp大的电解质的溶解能力小。( )
2. 任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示。( )
3. 沉淀达到溶解平衡时,溶液中难溶电解质电离出的各个离子浓度均相等。( )
4. AgCl难溶于水,所以将AgCl加入水中所得溶液中不含Ag+、Cl-。( )
5. 取两支试管,一支加入NaCl溶液,另一支加入等浓度、等体积的NaI溶液,分别加入同一AgNO3溶液,可以通过产生沉淀的顺序来验证AgCl和AgI的Ksp大小。( )
类型1 Ksp的有关计算——单一溶质溶液
1. 常温下,Mg(OH)2的Ksp=1.0×10-11,在c(Mg2+)=0.01 mol·L-1的溶液中,当Mg(OH)2刚开始沉淀时,溶液的pH为__________;若要使其沉淀完全[c(Mg2+)≤1.0×10-5 mol·L-1],pH的范围是__________。
类型2 Ksp的有关计算——混合溶液中离子完全沉淀所需pH(或pH范围)
2. (2024·淮安高三上期中)胆矾是一种用途广泛的中药材,可行肝风,泻肝火。某化学兴趣小组以含铜废料(Cu、CuO、Fe、Ag)制备CuSO4·5H2O,实验流程如下所示:
已知室温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cu(OH)2]=2.0×10-20
上述酸浸液中Cu2+的浓度为0.2 mol·L-1,加NaOH调节pH,使酸浸液中Fe3+完全沉淀(离子浓度小于10-5 mol·L-1)与Cu2+分离,溶液pH值调节的范围为__________________(设加NaOH时溶液体积不变)。
类型3 Ksp的有关计算——利用Ksp求化学平衡常数K
3. (2023·江苏卷)实验室模拟“镁法工业烟气脱硫”并制备MgSO4·H2O,其实验过程可表示为
在搅拌下向氧化镁浆料中匀速缓慢通入SO2气体,生成MgSO3,反应为Mg(OH)2+H2SO3===MgSO3+2H2O,其平衡常数K与Ksp[Mg(OH)2]、Ksp(MgSO3)、Ka1(H2SO3)、Ka2(H2SO3)的代数关系式为K=________________________________________________________________________。
考点二 沉淀溶解平衡移动 沉淀溶解平衡图像
一、 沉淀溶解平衡的影响因素
1. 影响因素
(1)内因:难溶电解质本身的性质。
(2)外因
2. 实例
以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例,下表为外因对溶解平衡的影响
外界条件 移动方向 c(Ag+) Ksp
升高温度 ________ ________ ________
加水(固体有剩余) ________ ________ ________
续表
加入少量AgNO3(s) ______ ______ ______
加入Na2S(s) ______ ______ ______
通入HCl ______ ______ ________
通入NH3 ______ ______ ______
二、 沉淀溶解平衡图像分析
1. 图像举例
BaSO4在不同条件下沉淀溶解平衡:
2. 信息解读
a→c 曲线上变化,增大c(SO)
b→c 加入1×10-5 mol·L-1 Na2SO4溶液(加水不行)
d→c 加入BaCl2固体(忽略溶液的体积变化)
c→a 曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液
【思维拓展】
有关沉淀溶解平衡对数图像分析
纵坐标数值越大,c(Ag+)越小,横坐标数值越大,c(Xn-)越大
三、 沉淀溶解平衡的应用
1. 沉淀的生成
在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
(1)使溶液中的离子转化为沉淀的条件:溶液中Qc________Ksp(填“>”或“<”)。
(2)常用的方法
2. 沉淀的溶解
(1)原理:不断减少溶解平衡体系中的相应离子,使Q________Ksp,平衡向______________移动。
(2)溶解方法
①酸溶解法,如CaCO3溶于盐酸;
②盐溶液溶解法,如Mg(OH)2溶于NH4Cl溶液;
③配位溶解法,如AgCl溶于氨水。
四、 沉淀的转化
1. 原理:由一种沉淀转化为另一种沉淀的过程,实质是____________________。
2. 沉淀转化规律
(1)一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现。
(2)一定条件下溶解能力小的沉淀也可以转化成溶解能力相对较大的沉淀。
以AgCl(s)+I-(aq)AgI(s)+Cl-(aq)为例:
①平衡时,K==。
②若要平衡向右移动,Q=
1. 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色CuS沉淀,Ksp(CuS)<Ksp(ZnS)。( )
2. 在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl,沉淀量不变。( )
3. 在Ag+(aq)+Cl-(aq)AgCl(s)平衡体系中,加入AgNO3固体,可使反应向右移动达到新平衡。( )
4. 向AgCl沉淀中加入KI溶液,由白色沉淀转变成黄色沉淀,是由于Ksp(AgI)
类型1 沉淀溶解及其影响因素
1. 一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)关系如图所示。下列说法正确的是( )
A. a点对应的Ksp最大
B. AgCl在c点的溶解度比b点的大
C. AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
D. b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化
类型2 沉淀溶解双直线图
2. (2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A. a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B. b点时,c(Cl-)=c(CrO),Ksp(AgCl)=Ksp(Ag2CrO4)
C. Ag2CrO4+2Cl-2AgCl+CrO的平衡常数K=107.9
D. 向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
类型3 沉淀的转化
3. (2025·连云港模拟)室温下,用0.01 mol·L-1 CuSO4溶液浸泡NiS固体,一段时间后过滤,向滤液中加入氨水,产生蓝色沉淀。已知Ksp(NiS)=1.0×10-21,Ksp(CuS)=1.5×10-36,Ksp(PbS)=9×10-29。下列有关说法正确的是( )
A. 过滤后所得溶液中存在:c(Ni2+)·c(S2-)
C. 欲使反应NiS(s)+Cu2+Ni2++CuS(s)向右进行,则需满足>×1015
D. 用0.01 mol·L-1 CuSO4溶液浸泡PbS固体,不能得到CuS固体
类型4 Ksp的大小比较
4. (2025·江苏模拟组合题)室温下,下列实验探究方案能达到探究目的的是( )
选项 实验操作和现象 实验结论
A 向盛有5 mL 0.1 mol·L-1 AgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液,有黄色沉淀产生 Ksp(AgCl)>Ksp(AgI)
B 向5 mL NaCl和KI的混合溶液中,滴加1~2滴0.1 mol·L-1 AgNO3溶液,观察到先产生了白色沉淀,后产生了黄色沉淀 Ksp(AgCl)>Ksp(AgI)
C 向盛有10滴0.1 mol·L-1 Na2S溶液的试管中滴入0.1 mol·L-1 ZnSO4溶液,至不再有白色沉淀生成;再向其中加入几滴0.1 mol·L-1 CuSO4溶液,观察到有黑色沉淀产生 Ksp(ZnS)>Ksp(CuS)
D 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 Ksp(BaSO4)>Ksp(BaCO3)
类型5 电解质概念综合
5. MB是一种难溶盐,H2B是一种二元弱酸(Ka1=1.3×10-7,Ka2=2.6×10-15),M2+不发生水解。室温下,将MB溶于一定浓度的一元强酸HA溶液中,直到不再溶解,所得溶液中c2(H+)—c2(M2+)有如图所示线性关系,下列说法错误的是(已知:=2.6,忽略溶液体积的变化)( )
A. 在图示实线对应的pH范围内,溶液中c(M2+)≈c(H2B)
B. MB的溶度积Ksp(MB)≈1.0×10-23
C. 溶液中存在c(HB-)+c(H+)+2c(H2B)=c(A-)+c(OH-)
D. 将0.02 mol MB溶于1.0 L HA溶液中,所需HA的最低浓度为0.30 mol·L-1
素 养 评 估
1. 将足量AgCl(s)溶解在水中,形成悬浊液。已知:AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0,下列叙述错误的是( )
A. 加热悬浊液,使其温度升高,则Ksp(AgCl)增大
B. 加少量水稀释,上述平衡正向移动,c(Ag+)不变
C. 向悬浊液中通入少量氨气,Q(AgCl)
2. (2024·淮安中学最后一模)室温下,将Na2CO3溶液与过量CaSO4固体混合,溶液pH随时间变化如图所示。
已知:Ksp(CaSO4)=4.9×10-5,Ksp(CaCO3)=3.4×10-9。
下列说法不正确的是( )
A. 0~600 s内上层清液中存在:c(Na+)+2c(Ca2+)
C. 充分反应后上层清液中eq \f(c(SO),c(CO))约为1.4×104
D. 随着反应的进行,CO+H2OHCO+OH-逆向移动,溶液pH下降
3. (2024·泰州靖江一模)废旧铅蓄电池会导致铅污染,RSR工艺回收铅的化工流程如图所示。
已知:ⅰ. 铅膏的主要成分是PbO2和PbSO4;HBF4是强酸;
ⅱ. Ksp(PbSO4)=1.6×10-8、Ksp(PbCO3)=7.4×10-14。
下列有关说法错误的是( )
A. 步骤②中反应PbSO4(s)+CO(aq)PbCO3(s)+SO(aq)的化学平衡常数K约为2.2×105
B. 操作③需要用的玻璃仪器有烧杯、漏斗、玻璃棒
C. 步骤④发生反应的离子方程式为PbCO3+2H+===Pb2++CO2↑+H2O
D. 副产品M的主要成分是(NH4)2SO3
4. (1)某一反应的平衡常数大于105时,可认为反应能进行完全,某酸浸液含有Cd2+等重金属阳离子,请结合数据说明能否用MnS除去Cd2+:_______________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________。
[Ksp(MnS)=1.2×10-14,Ksp(CdS)=3.6×10-29]。
(2)已知:Ksp(NiS)=1.07×10-21,Ksp(CuS)=1.27×10-36,某溶液中的Cu2+加入NiS除去,反应:NiS(s)+Cu2+(aq)CuS(s)+Ni2+(aq),该反应的平衡常数K=__________。
(3)以钛铁矿(主要成分为FeTiO3)为原料制备纳米TiO2。25 ℃时,Ksp[TiO(OH)2]=1×10-29;Ksp[Fe(OH)3]=4×10-38;Ksp[Fe(OH)2]=8×10-16。
Ⅰ. 酸浸:向磨细的钛铁矿中加入浓硫酸,充分反应后,所得溶液中主要含有TiO2+、Fe2+、Fe3+、H+和SO。
Ⅱ. 除铁、沉钛:向溶液中加入铁粉,充分反应,趁热过滤。所得滤液冷却后过滤得到富含TiO2+的溶液;调节除铁后溶液的pH,使TiO2+水解生成TiO(OH)2,过滤。若沉钛后c(TiO2+)<1×10-5 mol·L-1,则需要调节溶液的pH略大于________。
第25讲 难溶电解质的溶解平衡
考点一 沉淀溶解平衡及溶度积常数
知识归纳
一、 1. 难溶电解质
2. > = <
二、 2. (1)平衡浓度 任意浓度 > = < (2)②温度
【易错辨析】
1. × 2. × 3. × 4. × 5. √
命题突破
1. 9.5 ≥11
解析:Mg(OH)2的Ksp=1.0×10-11,在c(Mg2+)=0.01 mol·L-1的溶液中,当Mg(OH)2刚开始沉淀时,c(OH-)== mol·L-1=1.0×10-4.5 mol·L-1,c(H+)= mol·L-1=1.0×10-9.5 mol·L-1,溶液的pH为9.5;若要使其沉淀完全[c(Mg2+)≤1.0×10-5 mol·L-1],c(OH-)≥= mol·L-1=1.0×10-3 mol·L-1,c(H+)= mol·L-1=1.0×10-11 mol·L-1,溶液的pH大于11。
2. 3<pH<4.5
解析:调节pH的步骤中,pH值必须满足的条件是比Fe3+完全转化为Fe(OH)3的pH大,比Cu2+开始沉淀的pH小,使酸浸液中Fe3+完全沉淀与Cu2+分离,Ksp[Fe(OH)3]=1.0×10-38,Fe3+完全沉淀时浓度为10-5 mol·L-1,则对应的OH-浓度为c(OH-)===10-11,即pOH=11,pH=3,同理,Cu2+的浓度为0.2 mol·L-1,可以求得Cu2+开始沉淀的pH为4.5,故3<pH<4.5。
3.
解析:已知下列反应:
①Mg(OH)2+H2SO3===MgSO3+2H2O K
②Mg(OH)2(s)Mg2+(aq)+2OH-(aq) Ksp[Mg(OH)2]
③MgSO3(s)Mg2+(aq)+SO(aq) Ksp(MgSO3)
④H2SO3H++HSO Ka1(H2SO3)
⑤HSOH++SO Ka2(H2SO3)
⑥H2OH++OH- Kw
根据盖斯定律,①=②-③+④+⑤-⑥×2,故K=。
考点二 沉淀溶解平衡移动 沉淀溶解平衡图像
知识归纳
一、 1. (2)沉淀溶解的方向 沉淀溶解的方向 生成沉淀的方向 沉淀溶解的方向
2. 右移 增大 增大 右移 不变 不变 左移 增大 不变 右移 减小 不变 左移 减小 不变 右移 减小 不变
三、 1. (1)>
2. (1)< 沉淀溶解的方向
四、 1. 沉淀溶解平衡的移动
【易错辨析】
1. × 2. × 3. √ 4. √ 5. ×
命题突破
1. C 解析:温度一定,Ksp不变,线上a、b、c三点对应的Ksp相等,A错误;AgCl在c点的溶解度比b点的小,B错误;b点的溶液中加入AgNO3固体,c(Ag+)变大,由Ksp(AgCl)=c(Ag+)·c(Cl-)知,c(Cl-)减小,故沿曲线向a点方向变化,D错误。
2. C 解析:根据图像,由(1.7,5)可得到Ag2CrO4的溶度积Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(1×10-5)2×1×10-1.7=10-11.7,由(4.8,5)可得到AgCl的溶度积Ksp(AgCl)=c(Ag+)·c(Cl-)=1×10-5×1×10-4.8=10-9.8,据此数据计算各选项结果。假设a点坐标为(4,6.5),此时分别计算反应的浓度商Q得,Q(AgCl)=10-10.5,Q(Ag2CrO4)=10-17,二者的浓度商均小于其对应的溶度积Ksp,二者不会生成沉淀,A错误;Ksp为难溶物的溶度积,是一种平衡常数,平衡常数只与温度有关,与浓度无关,根据分析可知,二者的溶度积不相同,B错误;该反应的平衡常数表达式为K=eq \f(c(CrO),c2(Cl-))=eq \f(c(CrO)·c2(Ag+),c2(Cl-)·c2(Ag+))=eq \f(Ksp(Ag2CrO4),K(AgCl))==1×107.9,C正确;向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3,开始沉淀时所需要的c(Ag+)分别为10-8.8和10-5.35,说明此时沉淀Cl-需要的银离子浓度更低,在这种情况下,先沉淀的是AgCl,D错误。故选C。
3. A 解析:Ksp(NiS)>Ksp(CuS),浸泡后,NiS(s)转化为CuS(s),使溶液中c(S2-)减小,则c(Ni2+)·c(S2-)
素养评估
1. D 解析:温度升高,溶解度增大,Ksp(AgCl)增大,A正确;加入少量水,平衡右移,但溶液还是饱和溶液,所以Ag+浓度不变,B正确;向悬浊液中通入少量氨气,形成[Ag(NH3)2]+,消耗Ag+,导致Q(AgCl)
3. D 解析:废旧铅蓄电池处理后加水通入二氧化硫、碳酸铵,PbO2和二氧化硫发生氧化还原反应,四价铅转化为二价铅生成碳酸铅沉淀、二氧化硫转化为硫酸根生成副产品M硫酸铵;碳酸铅加入HBF4得到Pb(BF4)2和二氧化碳气体,Pb(BF4)2电解得到铅。步骤②中反应PbSO4(s)+CO(aq)??PbCO3(s)+SO(aq)的化学平衡常数K=eq \f(c(SO),c(CO))=eq \f(c(Pb2+)·c(SO),c(Pb2+)·c(CO))=≈2.2×105,A正确;操作③为分离固液的操作,是过滤,需要用的玻璃仪器有烧杯、漏斗、玻璃棒,B正确;HBF4是强酸,和碳酸铅反应生成二氧化碳、水和Pb(BF4)2,故步骤④发生反应的离子方程式为PbCO3+2H+===Pb2++CO2↑+H2O,C正确;副产品M的主要成分是(NH4)2SO4,D错误。故选D。
4. (1)MnS(s)+Cd2+Mn2++CdS(s)的平衡常数K===≈3.3×1014 105,该反应能进行完全,故可以用MnS除去Cd2+
(2)8.43×1014 (3)2
解析:(1)MnS(s)+Cd2+(aq)Mn2+(aq)+CdS(s)的平衡常数K===≈3.3×1014 105,该反应能进行完全,故可以用MnS除去Cd2+。
(2)“除杂”过程中加入NiS除去Cu2+发生的反应是NiS(s)+Cu2+(aq)??CuS(s)+Ni2+(aq),该反应的平衡常数K====≈8.43×1014。
(3)25 ℃时,Ksp[TiO(OH)2]=1×10-29,c(TiO2+)·c2(OH-)=1×10-29,c(TiO2+)<1×10-5 mol·L-1,c(OH-)>= mol·L-1=10-12 mol·L-1,c(H+)<= mol·L-1=10-2 mol·L-1,即需要调整溶液的pH>2。
同课章节目录
