2.3.2离子键、配位键与金属键 同步课时作业(含解析)高二化学鲁科版(2019)选择性必修二
文档属性
| 名称 | 2.3.2离子键、配位键与金属键 同步课时作业(含解析)高二化学鲁科版(2019)选择性必修二 |  | |
| 格式 | docx | ||
| 文件大小 | 528.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 08:46:47 | ||
图片预览




文档简介
(13)2.3.2离子键、配位键与金属键——高二化学鲁科版(2019)选择性必修二同步课时作业
1.下列物质不是配合物的是( )
A. B.
C. D.
2.下列物质中,不能作为配合物的配位体的是( )
A. B. C. D.
3.下列配合物中,中心离子配位数最多的是( )
A. B.
C. D.
4.0.01mol在水溶液中用过量硝酸银溶液处理,生成0.02molAgCl沉淀。已知该中Cr3+形成六个配位键,则其结构是( )
A. B.
C. D.
5.下列各现象与配位化合物无关的是( )
A.铜的化合物在固态时颜色各异,而溶于水(可溶)后溶液都呈现蓝色
B.在溶液中滴加溶液显血红色
C.在硝酸银溶液中逐滴加入稀氨水,先生成沉淀,然后沉淀消失
D.澄清石灰水中通入足量,先生成沉淀,然后沉淀消失
6.已知:当过渡金属配合物具有强反馈键的配体且过渡金属价层达到18个电子时,配合物比较稳定。下列具有强反馈键配体的配合物中,不稳定的是( )
A.(表示) B.
C. D.
7.(见图)是一种常见的离子液体,可作为晶型转变的诱导剂,中咪唑环存在(大π键),下列有关说法不正确的是( )
A.该物质与传统的有机溶剂相比,具有难挥发的优点
B.1 mol该物质含有2个甲基
C.N原子杂化类型为
D.中含有配位键
8.下列工业生产或处理过程涉及的物质转化关系不正确的是( )
A.消除污染物:
B.去除难溶物:
C.合成聚合物:
D.制备配合物:
9.没有对物质结构的认识,同学们对化学的学习将是无源之水、无本之木,下列关于铁元素的相关说法,正确的是( )
A.的电子有23种空间运动状态
B.Fe的价电子轨道表示式为
C.Fe的26个电子在原子轨道中做圆周运动
D.铁原子中没有空轨道,不可能形成配合物
10.常温下,。下列说法不正确的是
A.HCN的中心原子采用sp杂化
B.浓度均为0.1的HCN和NaCN的溶液中存在:
C.HCN的空间结构为直线型
D.与都具有一定的配位能力
11.同一周期主族元素W、Z、X、Y原子序数依次增大,X原子的最外层电子数是W原子的次外层电子数的3倍,由四种元素原子形成的阴离子结构如图,下列说法正确的是( )
A.Z位于元素周期表第2周期ⅥA族
B.以W为中心原子形成的VSEPR模型为平面三角形
C.该阴离子中含有配位键
D.最高价氧化物对应水化物的酸性:Y>Z>W
12.乙酰乙酸乙酯存在酮式与烯醇式的互变异构,其中烯醇式可与结合产生紫色,其结构如图所示,下列有关该配离子的说法正确的是( )
A.有23种空间运动状态的电子
B.该配离子中含有6个配体
C.该配离子中碳原子的杂化类型有、杂化
D.该配离子中含有的化学键有离子键、极性键、非极性键、配位键
13.金属元素钴(Co)形成的多种配合物应用广泛。下列说法错误的是( )
A.中钴元素的化合价为+3
B.等物质的量的和中σ键数目之比为9:2
C.中配体的配位原子都是N原子
D.向溶有(配位数为6)的溶液中滴加足量的溶液,形成2mol沉淀。则其配离子为
14.ⅢA族元素能与其他元素组成结构、性质各异的化合物。回答下列问题:
(1)基态B原子核外电子的运动状态有__________种,基态原子的价电子轨道表示式为__________。
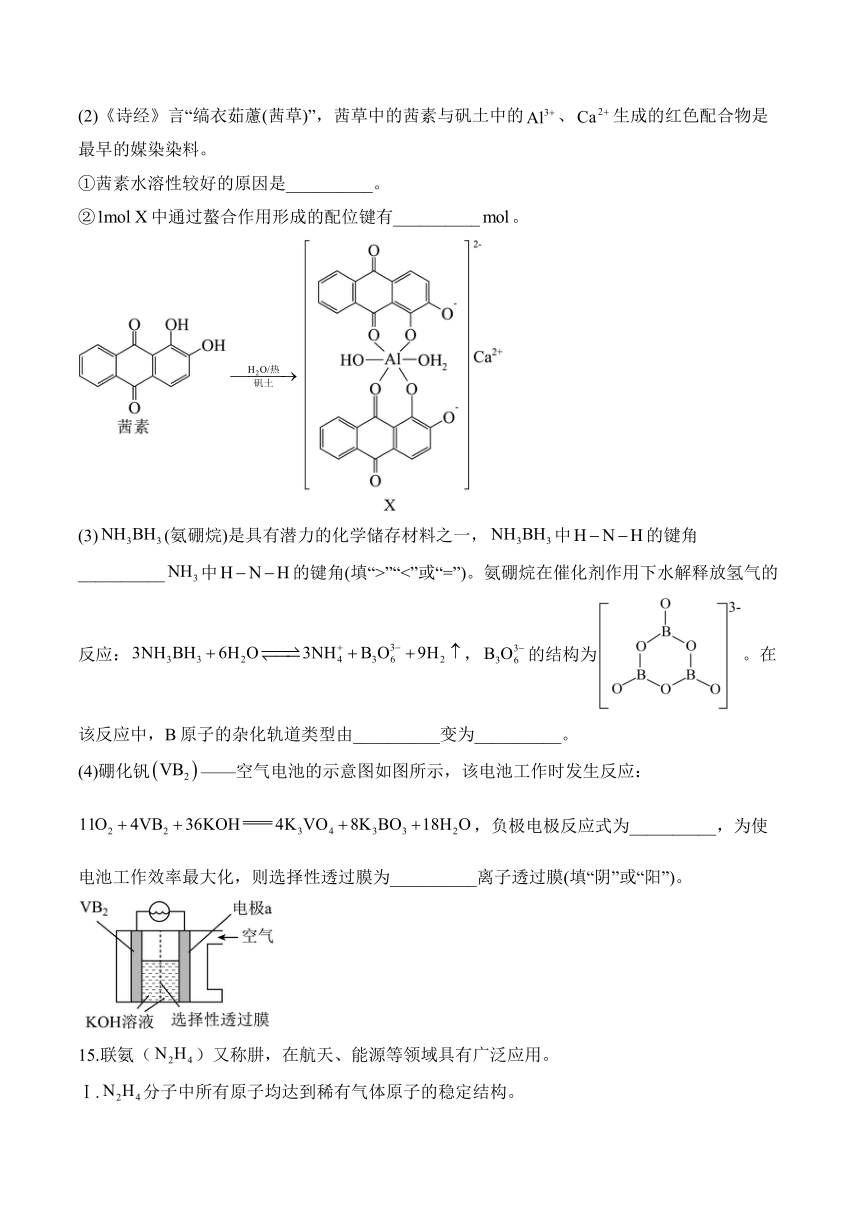
(2)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的、生成的红色配合物是最早的媒染染料。
①茜素水溶性较好的原因是__________。
②中通过螯合作用形成的配位键有__________。
(3)(氨硼烷)是具有潜力的化学储存材料之一,中的键角__________中的键角(填“>”“<”或“=”)。氨硼烷在催化剂作用下水解释放氢气的反应:,的结构为。在该反应中,B原子的杂化轨道类型由__________变为__________。
(4)硼化钒——空气电池的示意图如图所示,该电池工作时发生反应:,负极电极反应式为__________,为使电池工作效率最大化,则选择性透过膜为__________离子透过膜(填“阴”或“阳”)。
15.联氨()又称肼,在航天、能源等领域具有广泛应用。
Ⅰ.分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出的电子式___________。
(2)晶体受热熔化时,破坏的作用力有___________。
A.范德华力 B.氢键 C.共价键 D.离子键
(3)酸碱质子理论提出:凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱。
①由可知是___________。
A.酸 B.碱
②选择足量的盐酸或NaOH溶液与充分反应,生成盐的化学式为___________。
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:。
(4)①结合化学反应原理分析,该反应可自发进行的原因是___________。
②和作为火箭推进剂的主要原因是___________。
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是___________。
A. B. C.
(6)被还原的离子方程式如下,完成方程式并配平___________。
当转移个电子数时,生成金属钴___________克。
(7)金属钴可以形成多种配合物。一种配合物由组成,实验显示的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入溶液,只能沉淀出三分之一的。
①该配合物的化学式是___________。
A.
B.
C.
②该配合物的配体有___________。
答案以及解析
1.答案:B
解析:A.中铜离子提供空轨道、水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故A不选;
B.中没有配位键,不属于配合物,故B选;
C.中铜离子提供空轨道、水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故C不选;
D.中银离子提供空轨道、提供孤电子对而形成配位键,所以该物质属于配合物,故D不选;
故选:B。
2.答案:D
解析:A.是共价化合物,氨原子分别与3个氢原子通过一对共用电子对结合,电子式为,有孤对电子,可以作为配体,故A不选;B.CO分子C与O原子之间形成3对共用电子对,电子式为:,含有1个键,C 原子或 O 原子含有1对孤电子对,可以作为配体,故B不选;C.存在孤对电子,可以作为配体,故C不选:D.中形成4个共价键,没有孤对电子,不可以作为配体,故D选故选 D。
3.答案:A
解析:A.中,与6个形成6个配位键,配位数为6。
4.答案:B
解析:A.若其结构为,则与硝酸银反应后生成沉淀,故A错误;B.根据题意知,氯化铬和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铭化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬的化学式可能为,故B正确;C.根据题意知,中形成六个配位键,而该结构中只存在五个配位键,故C错误;D.若其结构为的配位键为6,且与硝酸银不产生,故D错误;答案选B。
5.答案:D
解析:A. 铜的化合物在固态时颜色各异,而溶于水(可溶)后溶液都呈现蓝色,因为形成了水合铜离子而呈蓝色,故A不选;
B. 在溶液中滴加溶液显血红色,因为铁离子与生成了等络离子而呈血红色,故B不选;
C. 在硝酸银溶液中逐滴加入稀氨水,先生成氢氧化银沉淀,然后沉淀消失,氢氧化银溶于氨水生成银氨络离子而溶解,故C不选;
D. 澄清石灰水中通入足量,先生成沉淀,然后生成碳酸氢钙溶于水,沉淀消失,与配位化合物无关,故D选;
故选D。
6.答案:B
解析:基态价电子排布式为,中含键,中Fe的价层电子数=6+2×6=18,稳定,A不符合题意;基态Mn原子价电子排布式为,中Mn价层电子数=7+2+2×5=19,不稳定,B符合题意;基态Co原子价电子排布式为,中Co价层电子数=9+1+2×4=18,稳定,C不符合题意;基态价电子排布式为,中Fe价层电子数=6+2×6=18,稳定,D不符合题意。
7.答案:C
解析:是一种离子液体,由于离子间的强烈作用,与传统的有机溶剂相比,具有难挥发的优点,A正确;由所给结构可知,1 mol 中含有2 mol(即2个)甲基,B正确;中咪唑环存在,即五元环中3个C原子、2个N原子均参与形成大π键,N原子不可能采取杂化,均为杂化,C错误;中存在配位键,其中P原子提供空轨道,F提供孤电子对,D正确。
8.答案:B
解析:A.消除二氧化硫污染物的反应为二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵溶液与空气中的氧气反应生成硫酸铵,则物质转化关系能实现,故A正确;
B.难溶碳酸钙的溶解度小于微溶的硫酸钙,所以用硫酸钠溶液难以将碳酸钙转化为硫酸钙,硫酸钙与盐酸不反应,故B错误;
C.一定条件下乙炔与氯化氢发生加成反应生成氯乙烯,一定条件下氯乙烯发生加聚反应生成聚氯乙烯,则物质转化关系能实现,故C正确;
D.硫酸铜溶液能与过量氨水反应生成硫酸四氨合铜,向反应后的溶液中加入乙醇降低硫酸四氨合铜的溶解度,过滤、洗涤、干燥能达到制备一水硫酸四氨合铜的实验目的,故D正确;
故选B。
9.答案:B
解析:A.电子的空间运动状态数是指的轨道数,的电子排布式是,只占据了14个轨道,A项错误;
B.Fe的价电子排布式是,轨道表示式为,B项正确;
C.Fe的26个电子在各自轨道中做绕核运动,半径不确定,不是圆周运动,C项错误;
D.铁原子有空轨道,可形成配合物,D项错误
故选B。
10.答案:B
解析:A.HCN的中心C原子结合了2个其它原子,因此该C原子采用sp杂化,A正确;
B.HCN是一元弱酸,主要以电解质分子存在,只有极少量HCN发生电离产生、。NaCN是强碱弱酸盐,属于强电解质,在水中完全电离产生、,电离方程式为,故c()=0.1mol/L;当混合溶液中二者浓度都是0.1mol·L-1时,的水解程度大于HCN的电离程度,因此溶液中c(HCN)>0.1mol/L,由于c()=0.1mol/L,故浓度均为0.1mol·L-1的HCN和NaCN的溶液中存在:c(HCN)>c(),B错误;
C.HCN分子中的中心C原子采用sp杂化,因此分子呈直线型,键角是180°,C正确;
D.与的N原子上都有孤电子对,因此它们都具有一定的配位能力,D正确;
故合理选项是B。
11.答案:C
解析:同一周期主族元素W、Z、X、Y原子序数依次增大,由阴离子的结构可知,阴离子中W、Z、X、Y形成共价键的数目分别为4、2、4、1,X原子的最外层电子数是W原子的次外层电子数的3倍,则W为B元素、Z为C元素、X为O元素、Y为F元素。
A.碳元素位于元素周期表第2周期ⅣA族,故A错误;
B.由阴离子的结构可知,阴离子中硼原子的价层电子对数为4,分子的VSEPR模型为四面体形,故B错误;
C.由阴离子的结构可知,阴离子中具有空轨道的硼原子与具有孤对电子的氟离子形成配位键,故C正确;
D.氟元素的非金属性强,只有正化合价,不存在最高价氧化物对应水化物,故D错误;
故选C。
12.答案:C
解析:A.Fe的原子序数为26,Fe原子失去4s能级上的2个电子和3d能级的1个电子形成,则的电子排布式为,电子占有轨道数为14,有14种空间运动状态的电子,选项A错误;
B.该配离子中含有6个配位键,有3个配体,选项B错误;
C.双键上的C原子形成3个σ键且无孤电子对,采用杂化,饱和C原子价层电子对数为4,采用杂化,选项C正确;
D.该配离子中含有的化学键有极性键、非极性键、配位键,不含离子键,选项D错误;
答案选C。
13.答案:C
解析:已知中的配体为和,则中Co元素的化合价为+3,A正确;等物质的量的和中键数目之比为,B正确;中配体为和分子中的配位原子是N,由于C的电负性小于N,对孤对电子的束缚力更弱,更容易形成配位键,即配体的配位原子为C原子,C错误;向溶有(配位数为6)的溶液中滴加足量的溶液,形成2mol沉淀,则该配位化合物为,则其配离子为,D正确。
14.答案:(1)5;
(2)茜素含有亲水性的羟基、酮羰基,易与水形成氢键;茜素和水分子均为极性分子;4
(3)>;;
(4);阴
解析:(1)基态B原子有5个电子核外电子的运动状态有5种,基态原子的价电子轨道表示式为;
(2)①茜素水溶性较好的原因是茜素含有亲水性的羟基、酮羰基,易与水形成氢键;茜素和水分子均为极性分子。
②X中1个茜素分子上的两个氧原子和铝离子通过螯合作用形成2个配位键,X中两个茜素分子通过螯合作用形成4个配位键,中通过螯合作用形成的配位键有4。
(3)(氨硼烷)是具有潜力的化学储存材料之一,中的键角>中的键角因为氨气分子中存在孤电子对,孤电子对对成键电子对的作用力大于成键电子对之间的作用力,使得成键电子对之间的键角变小。氨硼烷在催化剂作用下水解释放氢气的反应:,的结构为。中B不含孤电子对,含有四个成键电子对,所以价电子对数为4,是sp3杂化,中B不含孤电子对,含有四个成键电子对,所以价电子对数为3,是杂化,在该反应中,B原子的杂化轨道类型由sp3变为;
(4)负极电极反应式为,为使电池工作效率最大化,则选择性透过膜为阴离子透过膜使得氢氧根可以在负极被消耗,并且生成的阴离子可以进入正极附近。
15.答案:(1)
(2)AB
(3)B;
(4),任意温度下可自发进行;具有强还原性、具有强氧化性,两者剧烈反应,放出大量热,产生大量气体,为火箭提供推力
(5)B
(6);354
(7)B;
解析:(1)为共价化合物,分子中所有原子均达到稀有气体原子的稳定结构,电子式;
(2)氢键是H与N、O、F等电负性大的元素原子相结合的一种特殊分子间或分子内相互作用力;晶体为分子晶体且分子间存在氢键,受热熔化时,破坏的作用力有A.范德华力、B.氢键;故选AB;
(3)①凡是能接受质子的分子或离子称为碱,则由可知是碱,故选B;
②结合①分析可知,中2个氮能接受2个质子,为碱,则可以与足量的盐酸反应生成;
(4)①的反应可以自发进行,该反应为放热的熵增反应,故该反应可自发进行的原因是:,任意温度下可自发进行。
②具有强还原性、具有强氧化性,两者剧烈反应,放出大量热,产生大量气体,为火箭提供推力,故和可以作为火箭推进剂;
(5)钴为27号元素,基态钴原子核外电子排布为,为基态钴原子、为激发态钴原子、为失去1个电子形成的离子,再失去1个电子为第二电离能大于第一电离能,激发态原子较基态原子更容易失去1个电子,故选B;
(6)反应中Co化合价由+2降低为0、氮化合价由-2升高为0,结合电子守恒可知,反应为;电子转移关系为:,转移个电子数时,为12mol电子,生成6mol钴,质量为6mol×59g/mol=354g;
(7)①向该配合物的水溶液加入溶液,只能沉淀出三分之一的,则有三分之一的氯离子处于外界、三分之二的处于内界,故该配合物的化学式是B.;
②结合其化学式可知,该配合物的配体有。
1.下列物质不是配合物的是( )
A. B.
C. D.
2.下列物质中,不能作为配合物的配位体的是( )
A. B. C. D.
3.下列配合物中,中心离子配位数最多的是( )
A. B.
C. D.
4.0.01mol在水溶液中用过量硝酸银溶液处理,生成0.02molAgCl沉淀。已知该中Cr3+形成六个配位键,则其结构是( )
A. B.
C. D.
5.下列各现象与配位化合物无关的是( )
A.铜的化合物在固态时颜色各异,而溶于水(可溶)后溶液都呈现蓝色
B.在溶液中滴加溶液显血红色
C.在硝酸银溶液中逐滴加入稀氨水,先生成沉淀,然后沉淀消失
D.澄清石灰水中通入足量,先生成沉淀,然后沉淀消失
6.已知:当过渡金属配合物具有强反馈键的配体且过渡金属价层达到18个电子时,配合物比较稳定。下列具有强反馈键配体的配合物中,不稳定的是( )
A.(表示) B.
C. D.
7.(见图)是一种常见的离子液体,可作为晶型转变的诱导剂,中咪唑环存在(大π键),下列有关说法不正确的是( )
A.该物质与传统的有机溶剂相比,具有难挥发的优点
B.1 mol该物质含有2个甲基
C.N原子杂化类型为
D.中含有配位键
8.下列工业生产或处理过程涉及的物质转化关系不正确的是( )
A.消除污染物:
B.去除难溶物:
C.合成聚合物:
D.制备配合物:
9.没有对物质结构的认识,同学们对化学的学习将是无源之水、无本之木,下列关于铁元素的相关说法,正确的是( )
A.的电子有23种空间运动状态
B.Fe的价电子轨道表示式为
C.Fe的26个电子在原子轨道中做圆周运动
D.铁原子中没有空轨道,不可能形成配合物
10.常温下,。下列说法不正确的是
A.HCN的中心原子采用sp杂化
B.浓度均为0.1的HCN和NaCN的溶液中存在:
C.HCN的空间结构为直线型
D.与都具有一定的配位能力
11.同一周期主族元素W、Z、X、Y原子序数依次增大,X原子的最外层电子数是W原子的次外层电子数的3倍,由四种元素原子形成的阴离子结构如图,下列说法正确的是( )
A.Z位于元素周期表第2周期ⅥA族
B.以W为中心原子形成的VSEPR模型为平面三角形
C.该阴离子中含有配位键
D.最高价氧化物对应水化物的酸性:Y>Z>W
12.乙酰乙酸乙酯存在酮式与烯醇式的互变异构,其中烯醇式可与结合产生紫色,其结构如图所示,下列有关该配离子的说法正确的是( )
A.有23种空间运动状态的电子
B.该配离子中含有6个配体
C.该配离子中碳原子的杂化类型有、杂化
D.该配离子中含有的化学键有离子键、极性键、非极性键、配位键
13.金属元素钴(Co)形成的多种配合物应用广泛。下列说法错误的是( )
A.中钴元素的化合价为+3
B.等物质的量的和中σ键数目之比为9:2
C.中配体的配位原子都是N原子
D.向溶有(配位数为6)的溶液中滴加足量的溶液,形成2mol沉淀。则其配离子为
14.ⅢA族元素能与其他元素组成结构、性质各异的化合物。回答下列问题:
(1)基态B原子核外电子的运动状态有__________种,基态原子的价电子轨道表示式为__________。
(2)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的、生成的红色配合物是最早的媒染染料。
①茜素水溶性较好的原因是__________。
②中通过螯合作用形成的配位键有__________。
(3)(氨硼烷)是具有潜力的化学储存材料之一,中的键角__________中的键角(填“>”“<”或“=”)。氨硼烷在催化剂作用下水解释放氢气的反应:,的结构为。在该反应中,B原子的杂化轨道类型由__________变为__________。
(4)硼化钒——空气电池的示意图如图所示,该电池工作时发生反应:,负极电极反应式为__________,为使电池工作效率最大化,则选择性透过膜为__________离子透过膜(填“阴”或“阳”)。
15.联氨()又称肼,在航天、能源等领域具有广泛应用。
Ⅰ.分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出的电子式___________。
(2)晶体受热熔化时,破坏的作用力有___________。
A.范德华力 B.氢键 C.共价键 D.离子键
(3)酸碱质子理论提出:凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱。
①由可知是___________。
A.酸 B.碱
②选择足量的盐酸或NaOH溶液与充分反应,生成盐的化学式为___________。
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:。
(4)①结合化学反应原理分析,该反应可自发进行的原因是___________。
②和作为火箭推进剂的主要原因是___________。
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是___________。
A. B. C.
(6)被还原的离子方程式如下,完成方程式并配平___________。
当转移个电子数时,生成金属钴___________克。
(7)金属钴可以形成多种配合物。一种配合物由组成,实验显示的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入溶液,只能沉淀出三分之一的。
①该配合物的化学式是___________。
A.
B.
C.
②该配合物的配体有___________。
答案以及解析
1.答案:B
解析:A.中铜离子提供空轨道、水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故A不选;
B.中没有配位键,不属于配合物,故B选;
C.中铜离子提供空轨道、水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故C不选;
D.中银离子提供空轨道、提供孤电子对而形成配位键,所以该物质属于配合物,故D不选;
故选:B。
2.答案:D
解析:A.是共价化合物,氨原子分别与3个氢原子通过一对共用电子对结合,电子式为,有孤对电子,可以作为配体,故A不选;B.CO分子C与O原子之间形成3对共用电子对,电子式为:,含有1个键,C 原子或 O 原子含有1对孤电子对,可以作为配体,故B不选;C.存在孤对电子,可以作为配体,故C不选:D.中形成4个共价键,没有孤对电子,不可以作为配体,故D选故选 D。
3.答案:A
解析:A.中,与6个形成6个配位键,配位数为6。
4.答案:B
解析:A.若其结构为,则与硝酸银反应后生成沉淀,故A错误;B.根据题意知,氯化铬和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铭化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬的化学式可能为,故B正确;C.根据题意知,中形成六个配位键,而该结构中只存在五个配位键,故C错误;D.若其结构为的配位键为6,且与硝酸银不产生,故D错误;答案选B。
5.答案:D
解析:A. 铜的化合物在固态时颜色各异,而溶于水(可溶)后溶液都呈现蓝色,因为形成了水合铜离子而呈蓝色,故A不选;
B. 在溶液中滴加溶液显血红色,因为铁离子与生成了等络离子而呈血红色,故B不选;
C. 在硝酸银溶液中逐滴加入稀氨水,先生成氢氧化银沉淀,然后沉淀消失,氢氧化银溶于氨水生成银氨络离子而溶解,故C不选;
D. 澄清石灰水中通入足量,先生成沉淀,然后生成碳酸氢钙溶于水,沉淀消失,与配位化合物无关,故D选;
故选D。
6.答案:B
解析:基态价电子排布式为,中含键,中Fe的价层电子数=6+2×6=18,稳定,A不符合题意;基态Mn原子价电子排布式为,中Mn价层电子数=7+2+2×5=19,不稳定,B符合题意;基态Co原子价电子排布式为,中Co价层电子数=9+1+2×4=18,稳定,C不符合题意;基态价电子排布式为,中Fe价层电子数=6+2×6=18,稳定,D不符合题意。
7.答案:C
解析:是一种离子液体,由于离子间的强烈作用,与传统的有机溶剂相比,具有难挥发的优点,A正确;由所给结构可知,1 mol 中含有2 mol(即2个)甲基,B正确;中咪唑环存在,即五元环中3个C原子、2个N原子均参与形成大π键,N原子不可能采取杂化,均为杂化,C错误;中存在配位键,其中P原子提供空轨道,F提供孤电子对,D正确。
8.答案:B
解析:A.消除二氧化硫污染物的反应为二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵溶液与空气中的氧气反应生成硫酸铵,则物质转化关系能实现,故A正确;
B.难溶碳酸钙的溶解度小于微溶的硫酸钙,所以用硫酸钠溶液难以将碳酸钙转化为硫酸钙,硫酸钙与盐酸不反应,故B错误;
C.一定条件下乙炔与氯化氢发生加成反应生成氯乙烯,一定条件下氯乙烯发生加聚反应生成聚氯乙烯,则物质转化关系能实现,故C正确;
D.硫酸铜溶液能与过量氨水反应生成硫酸四氨合铜,向反应后的溶液中加入乙醇降低硫酸四氨合铜的溶解度,过滤、洗涤、干燥能达到制备一水硫酸四氨合铜的实验目的,故D正确;
故选B。
9.答案:B
解析:A.电子的空间运动状态数是指的轨道数,的电子排布式是,只占据了14个轨道,A项错误;
B.Fe的价电子排布式是,轨道表示式为,B项正确;
C.Fe的26个电子在各自轨道中做绕核运动,半径不确定,不是圆周运动,C项错误;
D.铁原子有空轨道,可形成配合物,D项错误
故选B。
10.答案:B
解析:A.HCN的中心C原子结合了2个其它原子,因此该C原子采用sp杂化,A正确;
B.HCN是一元弱酸,主要以电解质分子存在,只有极少量HCN发生电离产生、。NaCN是强碱弱酸盐,属于强电解质,在水中完全电离产生、,电离方程式为,故c()=0.1mol/L;当混合溶液中二者浓度都是0.1mol·L-1时,的水解程度大于HCN的电离程度,因此溶液中c(HCN)>0.1mol/L,由于c()=0.1mol/L,故浓度均为0.1mol·L-1的HCN和NaCN的溶液中存在:c(HCN)>c(),B错误;
C.HCN分子中的中心C原子采用sp杂化,因此分子呈直线型,键角是180°,C正确;
D.与的N原子上都有孤电子对,因此它们都具有一定的配位能力,D正确;
故合理选项是B。
11.答案:C
解析:同一周期主族元素W、Z、X、Y原子序数依次增大,由阴离子的结构可知,阴离子中W、Z、X、Y形成共价键的数目分别为4、2、4、1,X原子的最外层电子数是W原子的次外层电子数的3倍,则W为B元素、Z为C元素、X为O元素、Y为F元素。
A.碳元素位于元素周期表第2周期ⅣA族,故A错误;
B.由阴离子的结构可知,阴离子中硼原子的价层电子对数为4,分子的VSEPR模型为四面体形,故B错误;
C.由阴离子的结构可知,阴离子中具有空轨道的硼原子与具有孤对电子的氟离子形成配位键,故C正确;
D.氟元素的非金属性强,只有正化合价,不存在最高价氧化物对应水化物,故D错误;
故选C。
12.答案:C
解析:A.Fe的原子序数为26,Fe原子失去4s能级上的2个电子和3d能级的1个电子形成,则的电子排布式为,电子占有轨道数为14,有14种空间运动状态的电子,选项A错误;
B.该配离子中含有6个配位键,有3个配体,选项B错误;
C.双键上的C原子形成3个σ键且无孤电子对,采用杂化,饱和C原子价层电子对数为4,采用杂化,选项C正确;
D.该配离子中含有的化学键有极性键、非极性键、配位键,不含离子键,选项D错误;
答案选C。
13.答案:C
解析:已知中的配体为和,则中Co元素的化合价为+3,A正确;等物质的量的和中键数目之比为,B正确;中配体为和分子中的配位原子是N,由于C的电负性小于N,对孤对电子的束缚力更弱,更容易形成配位键,即配体的配位原子为C原子,C错误;向溶有(配位数为6)的溶液中滴加足量的溶液,形成2mol沉淀,则该配位化合物为,则其配离子为,D正确。
14.答案:(1)5;
(2)茜素含有亲水性的羟基、酮羰基,易与水形成氢键;茜素和水分子均为极性分子;4
(3)>;;
(4);阴
解析:(1)基态B原子有5个电子核外电子的运动状态有5种,基态原子的价电子轨道表示式为;
(2)①茜素水溶性较好的原因是茜素含有亲水性的羟基、酮羰基,易与水形成氢键;茜素和水分子均为极性分子。
②X中1个茜素分子上的两个氧原子和铝离子通过螯合作用形成2个配位键,X中两个茜素分子通过螯合作用形成4个配位键,中通过螯合作用形成的配位键有4。
(3)(氨硼烷)是具有潜力的化学储存材料之一,中的键角>中的键角因为氨气分子中存在孤电子对,孤电子对对成键电子对的作用力大于成键电子对之间的作用力,使得成键电子对之间的键角变小。氨硼烷在催化剂作用下水解释放氢气的反应:,的结构为。中B不含孤电子对,含有四个成键电子对,所以价电子对数为4,是sp3杂化,中B不含孤电子对,含有四个成键电子对,所以价电子对数为3,是杂化,在该反应中,B原子的杂化轨道类型由sp3变为;
(4)负极电极反应式为,为使电池工作效率最大化,则选择性透过膜为阴离子透过膜使得氢氧根可以在负极被消耗,并且生成的阴离子可以进入正极附近。
15.答案:(1)
(2)AB
(3)B;
(4),任意温度下可自发进行;具有强还原性、具有强氧化性,两者剧烈反应,放出大量热,产生大量气体,为火箭提供推力
(5)B
(6);354
(7)B;
解析:(1)为共价化合物,分子中所有原子均达到稀有气体原子的稳定结构,电子式;
(2)氢键是H与N、O、F等电负性大的元素原子相结合的一种特殊分子间或分子内相互作用力;晶体为分子晶体且分子间存在氢键,受热熔化时,破坏的作用力有A.范德华力、B.氢键;故选AB;
(3)①凡是能接受质子的分子或离子称为碱,则由可知是碱,故选B;
②结合①分析可知,中2个氮能接受2个质子,为碱,则可以与足量的盐酸反应生成;
(4)①的反应可以自发进行,该反应为放热的熵增反应,故该反应可自发进行的原因是:,任意温度下可自发进行。
②具有强还原性、具有强氧化性,两者剧烈反应,放出大量热,产生大量气体,为火箭提供推力,故和可以作为火箭推进剂;
(5)钴为27号元素,基态钴原子核外电子排布为,为基态钴原子、为激发态钴原子、为失去1个电子形成的离子,再失去1个电子为第二电离能大于第一电离能,激发态原子较基态原子更容易失去1个电子,故选B;
(6)反应中Co化合价由+2降低为0、氮化合价由-2升高为0,结合电子守恒可知,反应为;电子转移关系为:,转移个电子数时,为12mol电子,生成6mol钴,质量为6mol×59g/mol=354g;
(7)①向该配合物的水溶液加入溶液,只能沉淀出三分之一的,则有三分之一的氯离子处于外界、三分之二的处于内界,故该配合物的化学式是B.;
②结合其化学式可知,该配合物的配体有。
