四川省成都七中实验学校2015-2016学年高一(下)期中化学试卷(解析版)
文档属性
| 名称 | 四川省成都七中实验学校2015-2016学年高一(下)期中化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 150.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-02 17:23:27 | ||
图片预览




文档简介
2015-2016学年四川省成都七中实验学校高一(下)期中化学试卷
一.选择题(只有一个正确答案1-17题各3分,共51分)
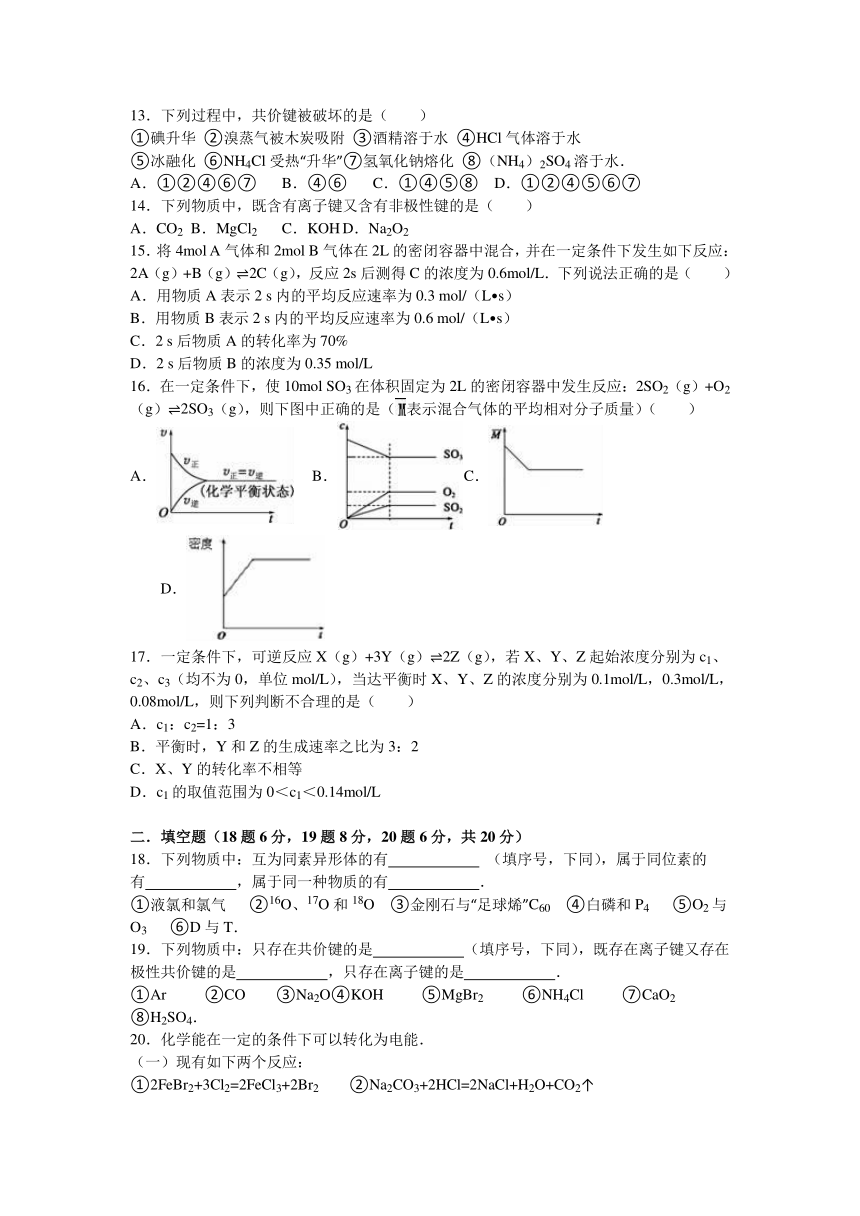
1.下列反应中,既属于氧化还原反应,又是放热热反应的是( )
A.铝片与稀盐酸的反应 B.Ba(OH)2 8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.盐酸在烧碱溶液反应
2.X、Y、Z三种短周期元素在周期表中的位置如右图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.一定条件下,X2与Al反应得到AlX
3.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
A.D元素处于元素周期表中第3周期VIA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
4.下列图示的装置属于原电池的是( )
A. B. C. D.
5.已知空气﹣锌电池的电极反应为锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O;碳棒:O2+2H2O+4e﹣=4OH﹣,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化 C.负极,被还原 D.负极,被氧化
6.13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N 与14N 互为同位素
D.232Th转化成233U是化学变化
7.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1molA﹣A键和1molB﹣B键可放出xkJ能量
C.断裂2molA﹣B键需要吸收ykJ能量
D.2molAB的总能量高于1molA2和1molB2的总能量
8.下列化学用语使用正确的是( )
A.NH4Cl的电子式:
B.用电子式表示氯化氢分子的形成过程:
C.氧化钠的电子式:
D.R2+离子核外有a个电子,b个中子,R原子表示为: R
9.高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
A.放电时正极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.该原电池,Zn作正极,可用石墨等作负极
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
10.有a、b、c、d四种金属,将a与b用导线连结起来浸入盐酸中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化;如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
A.d、b、a、c B.b、a、d、c C.d、a、b、c D.d、c、a、b
11.能说明氯的非金属性比硫强的事实是( )
A.氯化氢的酸性强于硫化氢
B.氯化氢的稳定性比硫化氢强
C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
12.已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性:X+<W3+ D.原子半径:X<W
13.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
A.①②④⑥⑦ B.④⑥ C.①④⑤⑧ D.①②④⑤⑥⑦
14.下列物质中,既含有离子键又含有非极性键的是( )
A.CO2 B.MgCl2 C.KOH D.Na2O2
15.将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
A.用物质A表示2 s内的平均反应速率为0.3 mol/(L s)
B.用物质B表示2 s内的平均反应速率为0.6 mol/(L s)
C.2 s后物质A的转化率为70%
D.2 s后物质B的浓度为0.35 mol/L
16.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),则下图中正确的是(表示混合气体的平均相对分子质量)( )
A. B. C. D.
17.一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
二.填空题(18题6分,19题8分,20题6分,共20分)
18.下列物质中:互为同素异形体的有 (填序号,下同),属于同位素的有 ,属于同一种物质的有 .
①液氯和氯气 ②16O、17O和18O ③金刚石与“足球烯”C60 ④白磷和P4 ⑤O2与O3 ⑥D与T.
19.下列物质中:只存在共价键的是 (填序号,下同),既存在离子键又存在极性共价键的是 ,只存在离子键的是 .
①Ar ②CO ③Na2O④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO2 ⑧H2SO4.
20.化学能在一定的条件下可以转化为电能.
(一)现有如下两个反应:
①2FeBr2+3Cl2=2FeCl3+2Br2 ②Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 .
(二)请根据Fe+CuSO4=FeSO4+Cu反应,选择适宜的材料和试剂设计一个原电池
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称.
(3)写出该原电池电极反应式:正极: ;负极: .
21.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
①比较Na3N中两种微粒的半径r(Na+) r(N3﹣)(填“>”“<”或“=”),
②Na3N与水反应属于 反应(填“氧化还原”或“非氧化还原”);
③Na3N与盐酸反应生成两种盐的化学式为 ;
④写出化合物Na3N的电子式: .
三.实验题和推断题(21题13分、22题8分,共21分)
22.A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语回答下列问题:
(1)用电子式表示AmC的形成过程 .
(2)Cm﹣、E(m﹣1)﹣的还原性强弱顺序为: ,(用离子符号表示)能证明其还原性强弱的离子方程式为 .
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为: .
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式 .该溶液的溶质含有的化学键类型是 .
(5)HmD和 HmC沸点较高的是 (填化学式),原因是 .
(6)在A、B、C、E单质中,符合下列转化关系的是 (填元素符号).
23.某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
①该研究小组在设计方案时.考虑了浓度、 、 等因素对过氧化氢分解速率的影响.
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 .
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
催化剂(MnO2) 操作情况 观察结果 反应完成所需的时间
粉末状 混合不振荡 剧烈反应,带火星的木条复燃 3.5分钟
块状 反应较慢,火星红亮但木条未复燃 30分钟
①写出H2O2发生的化学反应方程式 .
②实验结果说明催化剂作用的大小与 有关.
四.计算题(23题8分,共8分)
24.在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol L﹣1.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.请回答下列问题:
(1)前2s以N2O4的浓度变化表示的平均反应速率为 ;
(2)平衡时,NO2的体积分数为 ;
(3)平衡时,N2O4的转化率为 ;
(4)平衡时,混合气体的平均摩尔质量为 .
2015-2016学年四川省成都七中实验学校高一(下)期中化学试卷
参考答案与试题解析
一.选择题(只有一个正确答案1-17题各3分,共51分)
1.下列反应中,既属于氧化还原反应,又是放热热反应的是( )
A.铝片与稀盐酸的反应 B.Ba(OH)2 8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.盐酸在烧碱溶液反应
【考点】吸热反应和放热反应.
【分析】存在元素的化合价变化的反应为氧化还原反应;常见的放热反应有:绝大多数的化合反应,所有的燃烧,金属与水或酸的反应,铝热反应,酸碱中和反应等;常见的吸热反应有:Ba(OH)2 8H2O与NH4Cl反应、大多数的分解反应、C(或氢气)参加的氧化还原反应等,据此分析.
【解答】解:A、金属与水或酸的反应均为放热反应,故铝和稀盐酸为放热反应,且有化合价的改变,故为氧化还原反应,故A正确;
B、Ba(OH)2 8H2O与NH4Cl反应为吸热反应,且不是氧化还原反应,故B错误;
C、灼热的碳与二氧化碳反应,是以碳为还原剂的氧化还原反应,故为吸热反应,故C错误;
D、盐酸和烧碱反应为酸碱中和反应,为放热反应,但不是氧化还原反应,故D错误.
故选A.
2.X、Y、Z三种短周期元素在周期表中的位置如右图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.一定条件下,X2与Al反应得到AlX
【考点】元素周期律和元素周期表的综合应用.
【分析】X、Y、Z是短周期元素,X通过共用三对电子形成X2分子,则X为氮元素,根据X、Y、Z在周期表中相对位置可知,Y为硫元素,Z为氯元素,结合元素性质的递变规律分析解答.
【解答】解:X、Y、Z是短周期元素,X通过共用三对电子形成X2分子,则X为氮元素,根据X、Y、Z在周期表中相对位置可知,Y为硫元素,Z为氯元素.
A.化合物NCl3中,N原子形成3个N﹣Cl键,N原子、Cl原子都满足8电子的稳定结构,故A正确;
B.硫元素形成的亚硫酸,氯元素形成的次氯酸,都属于弱酸,故B错误;
C.氯气有强氧化性,能与硫化氢发生反应:Cl2+H2S=2HCl+S↓,属于置换反应,故C正确;
D.氮元素核外有5个电子,非金属性强,一定条件下,N2与Al反应得到AlN,故D正确.
故选:B.
3.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
A.D元素处于元素周期表中第3周期VIA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
【考点】原子结构与元素周期律的关系.
【分析】A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;若B为第三周元素,则2x=8,x=4,A为碳,C为硅,B和D找不出符合题意的元素,
A、根据D为硅,利用电子排布来分析其位置;
B、利用电子层数越多,半径越大,在同一周期从左到右原子半径在减小来分析;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体;
D、高温下,碳与二氧化硅能发生反应,常温下钠与水反应.
【解答】解:A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;
A、因硅有3个电子层,最外层电子数为4,则在周期表中的第三周期第ⅣA族,故A错误;
B、电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则半径关系为C>D>B>A,故B错误;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体,物理性质不同,故C错误;
D、因C+SiO2Si+2CO↑,2Na+2H20═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故D正确;
故选D.
4.下列图示的装置属于原电池的是( )
A. B. C. D.
【考点】原电池和电解池的工作原理.
【分析】根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
【解答】解:A、两电极材料相同,不能形成原电池,故A错误;
B、两电极材料不同,锌较活泼,能与硫酸铜溶液反应,形成闭合回路,所以能形成原电池,故B正确;
C、乙醇溶液不导电,不能形成原电池,故C错误;
D、该装置不能形成闭合回路,所以不能构成原电池,故D错误;
故选B.
5.已知空气﹣锌电池的电极反应为锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O;碳棒:O2+2H2O+4e﹣=4OH﹣,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化 C.负极,被还原 D.负极,被氧化
【考点】原电池和电解池的工作原理.
【分析】根据化合价变化判断氧化还原反应,原电池中较活泼的金属做负极,发生氧化反应.
【解答】解:锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O,电极反应中锌的化合价升高,被氧化,原电池中较活泼的金属做负极,发生氧化反应,则锌为原电池的负极,被氧化.
故选:D.
6.13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N 与14N 互为同位素
D.232Th转化成233U是化学变化
【考点】同位素及其应用.
【分析】13C、15N、14N的质量数分别为13、15、14,质子数分别为6、7、7,利用质子数=电子数,质子数+中子数=质量数及同位素的概念来解答.
【解答】解:A.13C与15N的中子数分别为7、8,故A错误;
B.13C为原子,C60为单质,二者不是同素异形体,故B错误;
C.15N与14N为质子数都是7,但中子数不同的原子,则互为同位素,故C正确;
D.原子是化学变化中的最小微粒,232Th转化成233U是原子间的转化,不属于化学变化,故D错误;
故选C.
7.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1molA﹣A键和1molB﹣B键可放出xkJ能量
C.断裂2molA﹣B键需要吸收ykJ能量
D.2molAB的总能量高于1molA2和1molB2的总能量
【考点】化学反应中能量转化的原因.
【分析】A、根据反应物的能量高于生成物的能量时,反应是放热反应;
B、根据旧键的断裂吸收能量,新键的生成释放能量;
C、根据旧键的断裂吸收能量;
D、根据图象可判断反应物与生成物的总能量.
【解答】解:A、因反应物的能量高于生成物的能量时,反应是放热反应,故A错误;
B、因旧键的断裂吸收能量,而不是释放能量,故B错误;
C、因旧键的断裂吸收能量,由图可知断裂2molA﹣B键需要吸收ykJ能量,故C正确;
D、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故D错误;
故选C.
8.下列化学用语使用正确的是( )
A.NH4Cl的电子式:
B.用电子式表示氯化氢分子的形成过程:
C.氧化钠的电子式:
D.R2+离子核外有a个电子,b个中子,R原子表示为: R
【考点】电子式;用电子式表示简单的离子化合物和共价化合物的形成.
【分析】A、氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
B、HCl是共价化合物;
C、相同离子不能合并;
D、阳离子中质子数=核外电子数+电荷数,质量数=质子数+中子数,表示核素的原子符号应写出质子数和质量数.
【解答】解:A、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:,故A错误;
B、氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程:,故B错误;
C、氧化钠中存在钠离子和氧离子,相同离子不能合并,故氧化钠的电子式为:,故C错误;
D、R2+离子核外有a个电子,阳离子中质子数=核外电子数+电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子符号为a+2a+b+2R,故D正确.
故选D.
9.高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
A.放电时正极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.该原电池,Zn作正极,可用石墨等作负极
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
【考点】原电池和电解池的工作原理.
【分析】根据电池总反应3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,可知,放电时,Zn被氧化,应为电池的负极,电极反应式为3Zn﹣6e﹣+6OH﹣═3Zn(OH)2,K2FeO4为电池的正极,发生还原反应,电极反应式为2FeO42﹣+6e﹣+8H2O═2Fe(OH)3+10OH﹣,结合电极反应式解答该题.
【解答】解:A.K2FeO4为电池的正极,发生还原反应,生成Fe(OH)3,电极反应式为2FeO42﹣+6e﹣+8H2O═2Fe(OH)3+10OH﹣,故A错误;
B.Zn被氧化生成Zn(OH)2,应为负极,故B错误;
C.放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D.放电时,正极生成OH﹣,溶液碱性增强,故D正确.
故选D.
10.有a、b、c、d四种金属,将a与b用导线连结起来浸入盐酸中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化;如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
A.d、b、a、c B.b、a、d、c C.d、a、b、c D.d、c、a、b
【考点】常见金属的活动性顺序及其应用;原电池和电解池的工作原理.
【分析】在原电池中,较为活泼的金属为负极,易腐蚀;金属的活泼性越强,越易与酸反应,反应越剧烈;结合金属之间置换反应的特点判断金属的强弱.
【解答】解:将a与b用导线连结起来浸入盐酸中,b不易腐蚀,说明b为正极,a为负极,则金属活动性a>b;
将a、d分别投入等浓度的盐酸中,d比a反应剧烈,说明金属活动性d>a;
将Cu浸入b的盐溶液里,无明显变化,说明铜不能置换出b,b活动性比铜强;
如果把Cu浸入c的盐溶液里,有c的单质析出,说明活动性Cu>c,则活动性d>a>b>Cu>c,
故选C.
11.能说明氯的非金属性比硫强的事实是( )
A.氯化氢的酸性强于硫化氢
B.氯化氢的稳定性比硫化氢强
C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
【考点】非金属在元素周期表中的位置及其性质递变的规律.
【分析】利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱,以此来解答.
【解答】解:A.可以根据元素最高价含氧酸的酸性来比较元素的非金属性,氯化氢的酸性强于硫化氢,无法说明非金属性的强弱,故A错误;
B.氯化氢的稳定性比硫化氢强,则Cl的非金属性比S的强,故B正确;
C.物质能否与水反应,与非金属性强弱无关,所以判断比较非金属性的强弱,故C错误;
D.最外层电子数多的元素非金属性不一定强,如Br最外层有7个电子,O最外层6个电子,但是非金属性O比Br强,所以不能直接根据最外层电子数多少判断比较非金属性的强弱,故D错误.
故选B.
12.已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性:X+<W3+ D.原子半径:X<W
【考点】原子结构与元素的性质.
【分析】元素周期表前三周期元素的离子aW3+、bX+、cY2﹣、dZ﹣具有相同电子层结构,核外电子数相等,所以a﹣3=b﹣1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,以此解答该题.
【解答】解:元素周期表前三周期元素的离子aW3+、bX+、cY2﹣、dZ﹣具有相同电子层结构,核外电子数相等,所以a﹣3=b﹣1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.离子的电子层结构相同,则c+2=d+1,则质子数d>c,故A错误;
B.非金属性越强,其氢化物的稳定性越强,非金属性Y<Z,则氢化物的稳定性H2Y<HZ,故B错误;
C.元素的金属性越强,其阳离子的氧化性越弱,金属性Na>Al,则离子的氧化性:X+<W3+,故C正确;
D.W是Al元素、X是Na元素,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径W<X,故D错误;
故选C.
13.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
A.①②④⑥⑦ B.④⑥ C.①④⑤⑧ D.①②④⑤⑥⑦
【考点】化学键.
【分析】发生化学变化及电离时化学键被破坏,一般非金属元素之间形成共价键,以此来解答.
【解答】解:①碘升华,破坏的为分子间作用力,故不选;
②溴蒸气被木炭吸附,破坏的为分子间作用力,故不选;
③酒精溶于水,不发生电离,破坏的为分子间作用力,故不选;
④HCl气体溶于水,发生电离,H﹣Cl共价键被破坏,故选;
⑤冰融化,破坏的为分子间作用力,故不选;
⑥NH4Cl受热“升华”,发生化学变化,生成氨气和HCl,N﹣H共价键破坏,故选;
⑦氢氧化钠熔化,离子键被破坏,故不选;
⑧(NH4)2SO4溶于水,发生电离,离子键被破坏,故不选;
故选B.
14.下列物质中,既含有离子键又含有非极性键的是( )
A.CO2 B.MgCl2 C.KOH D.Na2O2
【考点】离子键的形成;极性键和非极性键.
【分析】活泼金属和活泼非金属之间易形成离子键,非金属之间易形成共价键,同种非金属元素间形成非极性共价键,不同种非金属元素间形成极性共价键,据此分析.
【解答】解、A、二氧化碳中存在的化学键是非金属元素之间形成的共价键,故A错误;
B、氯化镁中存在的化学键是活泼金属和活泼非金属之间形成的离子键,故B错误;
C、氢氧化钾中存在的化学键既有钾离子和氢氧根离子之间的离子键,也有氧元素和氢元素之间的极性共价键,故C错误;
D、过氧化钠中存在的化学键有钠离子和过氧根之间的离子键,也有氧元素和氧元素之间的非极性共价键,故D正确;
故选D.
15.将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
A.用物质A表示2 s内的平均反应速率为0.3 mol/(L s)
B.用物质B表示2 s内的平均反应速率为0.6 mol/(L s)
C.2 s后物质A的转化率为70%
D.2 s后物质B的浓度为0.35 mol/L
【考点】化学平衡建立的过程.
【分析】反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g) 2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
根据概念计算选项中的速率、转化率和浓度.
【解答】解:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g) 2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
A、用物质A表示2 s内的平均反应速率==0.3 mol/(L s),故A正确;
B、用物质B表示2 s内的平均反应速率==0.15 mol/(L s)故B错误;
C、2 s后物质A的转化率=×100%=30%,故C错误;
D、2 s后物质B的浓度==0.7mol/L,故D错误;
故选A.
16.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),则下图中正确的是(表示混合气体的平均相对分子质量)( )
A. B. C. D.
【考点】化学平衡建立的过程.
【分析】A.开始投入SO3,它是生成物,只有逆反应速率,正反应速率为0;
B.据方程式可知SO2比O2生成的多;
C.反应向逆反应进行,据M=分析;
D.反应向逆反应进行,据ρ=分析.
【解答】解:A.开始投入SO3,它是生成物,只有逆反应速率,正反应速率为0,图象上v正、v逆标反了,故A错误;
B.据方程式可知SO2比O2生成的多,下面两条线标的物质反了,故B错误;
C.据M=,气体的总质量不变,而反应向逆反应方向进行,n变大,故M变小,后来平衡不变了,故C正确;
D.反应向逆反应进行,据ρ=,气体的总质量不变,体积固定,ρ始终不变,故D错误.
故选C.
17.一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
【考点】化学平衡的计算.
【分析】A.根据反应速率之比等于化学计量数之比判断;
B.反应达到平衡状态时,正逆反应速率相等;
C.根据起始量以及转化量判断转化率关系;
D.从可逆反应的特点的角度分析.
【解答】解:X(g)+3Y(g)2Z(g)
起始:c1 c2 c3
平衡:0.1moL/L 0.3mol/L 0.08mol/L
A.由方程式可知,反应物的物质的量浓度的变化量与化学计量数成正比,则( c1﹣0.1moL/L):(c2﹣0.3mol/L)=1:3,则c1:c2=l:3,故A正确;
B.平衡时,Y和Z的生成速率之比为3:2,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C.反应起始时c1:c2=l:3,由方程式可知,反应物的物质的量变化量与化学计量数呈正比,转化的物质的量也为1:3,则转化率应相等,故C错误;
D.如反应向正反应进行,则c1最小为0,如反应向逆反应方向进行,则c1最大为0.14,因反应为可逆反应,反应物不可能完全转化,则C1的取值范围为0<c1<0.14,故D正确.
故选C.
二.填空题(18题6分,19题8分,20题6分,共20分)
18.下列物质中:互为同素异形体的有 ③⑤ (填序号,下同),属于同位素的有 ②⑥ ,属于同一种物质的有 ①④ .
①液氯和氯气 ②16O、17O和18O ③金刚石与“足球烯”C60 ④白磷和P4 ⑤O2与O3 ⑥D与T.
【考点】同素异形体;核素;同位素及其应用.
【分析】具有相同质子数,不同中子数或同一元素的不同核素互为同位素;
由同种元素形成的不同种单质互为同素异形体;
分子式相同、结构也相同的物质为同一种物质,据此分析.
【解答】解:①液氯是液态的氯气,故和氯气是同一种物质;
②16O、17O和18O是同一种元素的不同种原子,故互为同位素;
③金刚石与“足球烯”C60 是同种元素形成的不同种单质,故互为同素异形体;
④白磷即P4,故是同一种物质;
⑤O2与O3 是同种元素形成的不同种单质,故互为同素异形体;
⑥D与T是同一种元素的不同种原子,故互为同位素;
故答案为:③⑤;②⑥;①④.
19.下列物质中:只存在共价键的是 ②⑧ (填序号,下同),既存在离子键又存在极性共价键的是 ④⑥ ,只存在离子键的是 ③⑤ .
①Ar ②CO ③Na2O④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO2 ⑧H2SO4.
【考点】化学键.
【分析】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属元素形成非极性共价键,不同种非金属元素形成极性共价键,以此来解答.
【解答】解:①Ar不含化学键;
②CO中只含C、O之间的极性共价键;
③Na2O中只含离子键;
④KOH中含离子键和O﹣H极性共价键;
⑤MgBr2中只含离子键;
⑥NH4Cl中含离子键和极性共价键;
⑦CaO2中含离子键和O﹣O非极性共价键;
⑧H2SO4中极性共价键,
则只存在共价键的是②⑧,既存在离子键又存在极性共价键的是④⑥,只存在离子键的是③⑤.
故答案为:②⑧;④⑥;③⑤.
20.化学能在一定的条件下可以转化为电能.
(一)现有如下两个反应:
①2FeBr2+3Cl2=2FeCl3+2Br2 ②Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 ① (填反应序号),理由是 反应①是氧化还原反应,有电子转移 .
(二)请根据Fe+CuSO4=FeSO4+Cu反应,选择适宜的材料和试剂设计一个原电池
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称.
(3)写出该原电池电极反应式:正极: Cu2++2e﹣=Cu ;负极: Fe﹣2e﹣=Fe2+ .
【考点】原电池和电解池的工作原理.
【分析】(一)从原电池反应必须是氧化还原反应的角度分析;
(二)(1)原电池的构成条件:有活泼性不同的两个电极;有电解质溶液;形成闭合回路;自发的氧化还原反应;
(2)电极中负极比正极活泼,是失电子的极,电解质中的阳离子在正极得电子.
【解答】解:(一)原电池是将化学能转变为电能的装置,只有氧化还原反应才有电子的转移,而①为氧化还原反应,能设计成原电池,②为非氧化还原反应,不可以设计成原电池,
故答案为:①;①为氧化还原反应,可以设计成原电池;
(二)(1)根据自发的氧化还原反应:金属锌失电子,为负极,正极可以用活泼性较差的金属铜,溶液中的铜离子得电子,必须用可溶的铜盐作电解质,结合原电池的构成条件,装置为:,故答案为:;
(2)负极是失去电子的极,金属要比正极活泼,所以Cu为正极,正极是电解质中的阳离子发生得电子的还原反应,即Cu2+2e﹣=Cu;负极为锌,金属锌失电子生成锌离子,即Zn﹣2e﹣=Zn2+;
故答案为:Cu2+2e﹣=Cu;Zn﹣2e﹣=Zn2+.
21.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
①比较Na3N中两种微粒的半径r(Na+) < r(N3﹣)(填“>”“<”或“=”),
②Na3N与水反应属于 非氧化还原 反应(填“氧化还原”或“非氧化还原”);
③Na3N与盐酸反应生成两种盐的化学式为 NH4Cl、NaCl ;
④写出化合物Na3N的电子式: .
【考点】微粒半径大小的比较;电子式.
【分析】①电子层结构相同的离子,核电荷数越大离子半径越小;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠;
④Na3N属于离子化合物,由钠离子与氮离子构成.
【解答】解:①电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径r(Na+)<r(N3﹣),
故答案为:<;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化,属于非氧化还原反应,
故答案为:非氧化还原;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠,
故答案为:NH4Cl、NaCl;
④Na3N属于离子化合物,由钠离子与氮离子构成,电子式为:,故答案为:.
三.实验题和推断题(21题13分、22题8分,共21分)
22.A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语回答下列问题:
(1)用电子式表示AmC的形成过程 .
(2)Cm﹣、E(m﹣1)﹣的还原性强弱顺序为: S2﹣>Cl﹣ ,(用离子符号表示)能证明其还原性强弱的离子方程式为 Cl2+S2﹣=2Cl﹣+S↓ .
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为: Cl2+2OH﹣=Cl﹣+ClO﹣+H2O .
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式 H2S+OH﹣=HS﹣+H2O .该溶液的溶质含有的化学键类型是 离子键和共价键 .
(5)HmD和 HmC沸点较高的是 H2O (填化学式),原因是 水分子间存在氢键 .
(6)在A、B、C、E单质中,符合下列转化关系的是 Na、S (填元素符号).
【考点】位置结构性质的相互关系应用.
【分析】A、B、C、D、E是位于短周期的主族元素,①热稳定性:HmD>HmC,则非金属性D大于C且二者位于同一主族,所以D位于第二周期、C位于第三周期;
②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构,则E的原子序数比C大1,二者位于同一周期,都属于第三周期;
③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小且二者都为主族元素,则A位于第IA族、B位于第IIIA主族;
④A与B质子数之和是D质子数的3倍,D为第二周期元素,则A和B的质子数之和在9到27之间,A位于第IA族、B位于第IIIA主族,如果A是Li、B是B元素,二者质子数之和不是3的倍数,所以A是Na、B是Al元素,D是O元素,D和C位于同一主族,则C是S元素,E是Cl元素,m=2,再结合物质结构性质解答.
【解答】解:A、B、C、D、E是位于短周期的主族元素,①热稳定性:HmD>HmC,则非金属性D大于C且二者位于同一主族,所以D位于第二周期、C位于第三周期;
②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构,则E的原子序数比C大1,二者位于同一周期,都属于第三周期;
③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小且二者都为主族元素,则A位于第IA族、B位于第IIIA主族;
④A与B质子数之和是D质子数的3倍,D为第二周期元素,则A和B的质子数之和在9到27之间,A位于第IA族、B位于第IIIA主族,如果A是Li、B是B元素,二者质子数之和不是3的倍数,所以A是Na、B是Al元素,D是O元素,D和C位于同一主族,则C是S元素,E是Cl元素,m=2,
(1)A是Na、C是S元素,则AmC是Na2S,用电子式表示硫化钠的形成过程为:,
故答案为:;
(2)元素的非金属性越强,其简单阴离子的还原性越弱,S元素的非金属性小于Cl元素,所以Cm﹣、E(m﹣1)﹣的还原性强弱顺序为S2﹣>Cl﹣,氯气能氧化硫离子生成硫单质,反应方程式为Cl2+S2﹣=2Cl﹣+S↓,故答案为:S2﹣>Cl﹣;Cl2+S2﹣=2Cl﹣+S↓
(3)E是氯气,A与D形成的化合物的水溶液是NaOH,二者反应生成氯化钠、次氯酸钠和水,离子反应方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,
故答案为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
(4)常温下,将等物质的量浓度的H2S溶液和A的最高价氧化物对应的水化物为NaOH溶液按体积比1:1混合,二者反应生成硫氢化钠,离子方程式为H2S+OH﹣=HS﹣+H2O,该溶液的溶质是硫氢化钠,硫氢化钠中钠离子和硫氢根离子之间存在离子键、S原子和H原子之间存在共价键,所以硫氢化钠中含有的化学键类型是离子键和共价键,故答案为:H2S+OH﹣=HS﹣+H2O;离子键和共价键;
(5)H2S中不含氢键,H2O中含有氢键,氢键的存在导致物质的沸点升高,所以沸点较高的是H2O,
故答案为:H2O;水分子间存在氢键;
(6)A、B、C、E单质分别是Na、Al、S、Cl2,根据单质能连续被氧化可知,符合条件的是Na和S,故答案为:Na、S.
23.某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
①该研究小组在设计方案时.考虑了浓度、 温度 、 催化剂 等因素对过氧化氢分解速率的影响.
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快 .
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
催化剂(MnO2) 操作情况 观察结果 反应完成所需的时间
粉末状 混合不振荡 剧烈反应,带火星的木条复燃 3.5分钟
块状 反应较慢,火星红亮但木条未复燃 30分钟
①写出H2O2发生的化学反应方程式 2H2O22H2O+O2↑ .
②实验结果说明催化剂作用的大小与 接触面积 有关.
【考点】探究温度、压强对化学反应速率的影响;催化剂的作用;化学反应速率的影响因素.
【分析】(1)过氧化氢溶液是实验室制取氧气的重要药品,在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响设计实验方案来证明时,要注意实验的控制变量,以确保实验结果的准确性;
(2)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;由实验现象可知,催化剂作用大小的影响因素.
【解答】解:(1)①根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明过氧化氢的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明过氧化氢的分解速率与浓度有关;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明过氧化氢的分解速率与温度、催化剂有关,故答案为:温度;催化剂;
②分析表中数据可以看出,浓度越大,反应速率越快,加热能加快过氧化氢的分解,有催化剂是分解速率快,
故答案为:温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快;
(2)①H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O22H2O+O2↑,故答案为:2H2O22H2O+O2↑;
②因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明接触面积对反应速率有影响,故答案为:接触面积.
四.计算题(23题8分,共8分)
24.在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol L﹣1.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.请回答下列问题:
(1)前2s以N2O4的浓度变化表示的平均反应速率为 0.005mol L﹣1s﹣1 ;
(2)平衡时,NO2的体积分数为 75% ;
(3)平衡时,N2O4的转化率为 60% ;
(4)平衡时,混合气体的平均摩尔质量为 57.5g mol﹣1 .
【考点】化学平衡的计算.
【分析】2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度;
依据化学平衡三段式列式计算,反应进行到60s时,体系已达平衡,此时容器内压强为开始时的1.6倍,设消耗N2O4的物质的量为x,列式计算
N2O4═2NO2,
起始量(mol) 0.5 0
变化量(mol) x 2x
平衡量(mol)0.5﹣x 2x
0.5﹣x+2x=0.5×1.6
x=0.3mol
【解答】解:2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度;
依据化学平衡三段式列式计算,反应进行到60s时,体系已达平衡,此时容器内压强为开始时的1.6倍,设消耗N2O4的物质的量为x,列式计算
N2O4═2NO2,
起始量(mol) 0.5 0
变化量(mol) x 2x
平衡量(mol)0.5﹣x 2x
0.5﹣x+2x=0.5×1.6
x=0.3mol
(1)2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度为=0.005mol/L.s;
故答案为:0.005mol/L.s;
(2)平衡时,NO2的体积分数=×100%=×100%=75%;
故答案为:75%;
(3)平衡时,N2O4的转化率=×100%=60%;
故答案为:60%;
(4)平衡时,混合气体的平均摩尔质量===57.5g/mol;
故答案为:57.5g mol﹣1;
2016年6月2日
一.选择题(只有一个正确答案1-17题各3分,共51分)
1.下列反应中,既属于氧化还原反应,又是放热热反应的是( )
A.铝片与稀盐酸的反应 B.Ba(OH)2 8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.盐酸在烧碱溶液反应
2.X、Y、Z三种短周期元素在周期表中的位置如右图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.一定条件下,X2与Al反应得到AlX
3.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
A.D元素处于元素周期表中第3周期VIA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
4.下列图示的装置属于原电池的是( )
A. B. C. D.
5.已知空气﹣锌电池的电极反应为锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O;碳棒:O2+2H2O+4e﹣=4OH﹣,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化 C.负极,被还原 D.负极,被氧化
6.13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N 与14N 互为同位素
D.232Th转化成233U是化学变化
7.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1molA﹣A键和1molB﹣B键可放出xkJ能量
C.断裂2molA﹣B键需要吸收ykJ能量
D.2molAB的总能量高于1molA2和1molB2的总能量
8.下列化学用语使用正确的是( )
A.NH4Cl的电子式:
B.用电子式表示氯化氢分子的形成过程:
C.氧化钠的电子式:
D.R2+离子核外有a个电子,b个中子,R原子表示为: R
9.高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
A.放电时正极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.该原电池,Zn作正极,可用石墨等作负极
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
10.有a、b、c、d四种金属,将a与b用导线连结起来浸入盐酸中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化;如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
A.d、b、a、c B.b、a、d、c C.d、a、b、c D.d、c、a、b
11.能说明氯的非金属性比硫强的事实是( )
A.氯化氢的酸性强于硫化氢
B.氯化氢的稳定性比硫化氢强
C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
12.已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性:X+<W3+ D.原子半径:X<W
13.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
A.①②④⑥⑦ B.④⑥ C.①④⑤⑧ D.①②④⑤⑥⑦
14.下列物质中,既含有离子键又含有非极性键的是( )
A.CO2 B.MgCl2 C.KOH D.Na2O2
15.将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
A.用物质A表示2 s内的平均反应速率为0.3 mol/(L s)
B.用物质B表示2 s内的平均反应速率为0.6 mol/(L s)
C.2 s后物质A的转化率为70%
D.2 s后物质B的浓度为0.35 mol/L
16.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),则下图中正确的是(表示混合气体的平均相对分子质量)( )
A. B. C. D.
17.一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
二.填空题(18题6分,19题8分,20题6分,共20分)
18.下列物质中:互为同素异形体的有 (填序号,下同),属于同位素的有 ,属于同一种物质的有 .
①液氯和氯气 ②16O、17O和18O ③金刚石与“足球烯”C60 ④白磷和P4 ⑤O2与O3 ⑥D与T.
19.下列物质中:只存在共价键的是 (填序号,下同),既存在离子键又存在极性共价键的是 ,只存在离子键的是 .
①Ar ②CO ③Na2O④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO2 ⑧H2SO4.
20.化学能在一定的条件下可以转化为电能.
(一)现有如下两个反应:
①2FeBr2+3Cl2=2FeCl3+2Br2 ②Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 .
(二)请根据Fe+CuSO4=FeSO4+Cu反应,选择适宜的材料和试剂设计一个原电池
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称.
(3)写出该原电池电极反应式:正极: ;负极: .
21.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
①比较Na3N中两种微粒的半径r(Na+) r(N3﹣)(填“>”“<”或“=”),
②Na3N与水反应属于 反应(填“氧化还原”或“非氧化还原”);
③Na3N与盐酸反应生成两种盐的化学式为 ;
④写出化合物Na3N的电子式: .
三.实验题和推断题(21题13分、22题8分,共21分)
22.A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语回答下列问题:
(1)用电子式表示AmC的形成过程 .
(2)Cm﹣、E(m﹣1)﹣的还原性强弱顺序为: ,(用离子符号表示)能证明其还原性强弱的离子方程式为 .
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为: .
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式 .该溶液的溶质含有的化学键类型是 .
(5)HmD和 HmC沸点较高的是 (填化学式),原因是 .
(6)在A、B、C、E单质中,符合下列转化关系的是 (填元素符号).
23.某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
①该研究小组在设计方案时.考虑了浓度、 、 等因素对过氧化氢分解速率的影响.
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 .
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
催化剂(MnO2) 操作情况 观察结果 反应完成所需的时间
粉末状 混合不振荡 剧烈反应,带火星的木条复燃 3.5分钟
块状 反应较慢,火星红亮但木条未复燃 30分钟
①写出H2O2发生的化学反应方程式 .
②实验结果说明催化剂作用的大小与 有关.
四.计算题(23题8分,共8分)
24.在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol L﹣1.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.请回答下列问题:
(1)前2s以N2O4的浓度变化表示的平均反应速率为 ;
(2)平衡时,NO2的体积分数为 ;
(3)平衡时,N2O4的转化率为 ;
(4)平衡时,混合气体的平均摩尔质量为 .
2015-2016学年四川省成都七中实验学校高一(下)期中化学试卷
参考答案与试题解析
一.选择题(只有一个正确答案1-17题各3分,共51分)
1.下列反应中,既属于氧化还原反应,又是放热热反应的是( )
A.铝片与稀盐酸的反应 B.Ba(OH)2 8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.盐酸在烧碱溶液反应
【考点】吸热反应和放热反应.
【分析】存在元素的化合价变化的反应为氧化还原反应;常见的放热反应有:绝大多数的化合反应,所有的燃烧,金属与水或酸的反应,铝热反应,酸碱中和反应等;常见的吸热反应有:Ba(OH)2 8H2O与NH4Cl反应、大多数的分解反应、C(或氢气)参加的氧化还原反应等,据此分析.
【解答】解:A、金属与水或酸的反应均为放热反应,故铝和稀盐酸为放热反应,且有化合价的改变,故为氧化还原反应,故A正确;
B、Ba(OH)2 8H2O与NH4Cl反应为吸热反应,且不是氧化还原反应,故B错误;
C、灼热的碳与二氧化碳反应,是以碳为还原剂的氧化还原反应,故为吸热反应,故C错误;
D、盐酸和烧碱反应为酸碱中和反应,为放热反应,但不是氧化还原反应,故D错误.
故选A.
2.X、Y、Z三种短周期元素在周期表中的位置如右图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.一定条件下,X2与Al反应得到AlX
【考点】元素周期律和元素周期表的综合应用.
【分析】X、Y、Z是短周期元素,X通过共用三对电子形成X2分子,则X为氮元素,根据X、Y、Z在周期表中相对位置可知,Y为硫元素,Z为氯元素,结合元素性质的递变规律分析解答.
【解答】解:X、Y、Z是短周期元素,X通过共用三对电子形成X2分子,则X为氮元素,根据X、Y、Z在周期表中相对位置可知,Y为硫元素,Z为氯元素.
A.化合物NCl3中,N原子形成3个N﹣Cl键,N原子、Cl原子都满足8电子的稳定结构,故A正确;
B.硫元素形成的亚硫酸,氯元素形成的次氯酸,都属于弱酸,故B错误;
C.氯气有强氧化性,能与硫化氢发生反应:Cl2+H2S=2HCl+S↓,属于置换反应,故C正确;
D.氮元素核外有5个电子,非金属性强,一定条件下,N2与Al反应得到AlN,故D正确.
故选:B.
3.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
A.D元素处于元素周期表中第3周期VIA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
【考点】原子结构与元素周期律的关系.
【分析】A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;若B为第三周元素,则2x=8,x=4,A为碳,C为硅,B和D找不出符合题意的元素,
A、根据D为硅,利用电子排布来分析其位置;
B、利用电子层数越多,半径越大,在同一周期从左到右原子半径在减小来分析;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体;
D、高温下,碳与二氧化硅能发生反应,常温下钠与水反应.
【解答】解:A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;
A、因硅有3个电子层,最外层电子数为4,则在周期表中的第三周期第ⅣA族,故A错误;
B、电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则半径关系为C>D>B>A,故B错误;
C、二氧化碳是分子晶体,而二氧化硅中是原子晶体,物理性质不同,故C错误;
D、因C+SiO2Si+2CO↑,2Na+2H20═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故D正确;
故选D.
4.下列图示的装置属于原电池的是( )
A. B. C. D.
【考点】原电池和电解池的工作原理.
【分析】根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
【解答】解:A、两电极材料相同,不能形成原电池,故A错误;
B、两电极材料不同,锌较活泼,能与硫酸铜溶液反应,形成闭合回路,所以能形成原电池,故B正确;
C、乙醇溶液不导电,不能形成原电池,故C错误;
D、该装置不能形成闭合回路,所以不能构成原电池,故D错误;
故选B.
5.已知空气﹣锌电池的电极反应为锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O;碳棒:O2+2H2O+4e﹣=4OH﹣,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化 C.负极,被还原 D.负极,被氧化
【考点】原电池和电解池的工作原理.
【分析】根据化合价变化判断氧化还原反应,原电池中较活泼的金属做负极,发生氧化反应.
【解答】解:锌片:Zn+2OH﹣﹣2e﹣=ZnO+H2O,电极反应中锌的化合价升高,被氧化,原电池中较活泼的金属做负极,发生氧化反应,则锌为原电池的负极,被氧化.
故选:D.
6.13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N 与14N 互为同位素
D.232Th转化成233U是化学变化
【考点】同位素及其应用.
【分析】13C、15N、14N的质量数分别为13、15、14,质子数分别为6、7、7,利用质子数=电子数,质子数+中子数=质量数及同位素的概念来解答.
【解答】解:A.13C与15N的中子数分别为7、8,故A错误;
B.13C为原子,C60为单质,二者不是同素异形体,故B错误;
C.15N与14N为质子数都是7,但中子数不同的原子,则互为同位素,故C正确;
D.原子是化学变化中的最小微粒,232Th转化成233U是原子间的转化,不属于化学变化,故D错误;
故选C.
7.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1molA﹣A键和1molB﹣B键可放出xkJ能量
C.断裂2molA﹣B键需要吸收ykJ能量
D.2molAB的总能量高于1molA2和1molB2的总能量
【考点】化学反应中能量转化的原因.
【分析】A、根据反应物的能量高于生成物的能量时,反应是放热反应;
B、根据旧键的断裂吸收能量,新键的生成释放能量;
C、根据旧键的断裂吸收能量;
D、根据图象可判断反应物与生成物的总能量.
【解答】解:A、因反应物的能量高于生成物的能量时,反应是放热反应,故A错误;
B、因旧键的断裂吸收能量,而不是释放能量,故B错误;
C、因旧键的断裂吸收能量,由图可知断裂2molA﹣B键需要吸收ykJ能量,故C正确;
D、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故D错误;
故选C.
8.下列化学用语使用正确的是( )
A.NH4Cl的电子式:
B.用电子式表示氯化氢分子的形成过程:
C.氧化钠的电子式:
D.R2+离子核外有a个电子,b个中子,R原子表示为: R
【考点】电子式;用电子式表示简单的离子化合物和共价化合物的形成.
【分析】A、氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
B、HCl是共价化合物;
C、相同离子不能合并;
D、阳离子中质子数=核外电子数+电荷数,质量数=质子数+中子数,表示核素的原子符号应写出质子数和质量数.
【解答】解:A、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:,故A错误;
B、氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程:,故B错误;
C、氧化钠中存在钠离子和氧离子,相同离子不能合并,故氧化钠的电子式为:,故C错误;
D、R2+离子核外有a个电子,阳离子中质子数=核外电子数+电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子符号为a+2a+b+2R,故D正确.
故选D.
9.高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
A.放电时正极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.该原电池,Zn作正极,可用石墨等作负极
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
【考点】原电池和电解池的工作原理.
【分析】根据电池总反应3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH,可知,放电时,Zn被氧化,应为电池的负极,电极反应式为3Zn﹣6e﹣+6OH﹣═3Zn(OH)2,K2FeO4为电池的正极,发生还原反应,电极反应式为2FeO42﹣+6e﹣+8H2O═2Fe(OH)3+10OH﹣,结合电极反应式解答该题.
【解答】解:A.K2FeO4为电池的正极,发生还原反应,生成Fe(OH)3,电极反应式为2FeO42﹣+6e﹣+8H2O═2Fe(OH)3+10OH﹣,故A错误;
B.Zn被氧化生成Zn(OH)2,应为负极,故B错误;
C.放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D.放电时,正极生成OH﹣,溶液碱性增强,故D正确.
故选D.
10.有a、b、c、d四种金属,将a与b用导线连结起来浸入盐酸中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化;如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
A.d、b、a、c B.b、a、d、c C.d、a、b、c D.d、c、a、b
【考点】常见金属的活动性顺序及其应用;原电池和电解池的工作原理.
【分析】在原电池中,较为活泼的金属为负极,易腐蚀;金属的活泼性越强,越易与酸反应,反应越剧烈;结合金属之间置换反应的特点判断金属的强弱.
【解答】解:将a与b用导线连结起来浸入盐酸中,b不易腐蚀,说明b为正极,a为负极,则金属活动性a>b;
将a、d分别投入等浓度的盐酸中,d比a反应剧烈,说明金属活动性d>a;
将Cu浸入b的盐溶液里,无明显变化,说明铜不能置换出b,b活动性比铜强;
如果把Cu浸入c的盐溶液里,有c的单质析出,说明活动性Cu>c,则活动性d>a>b>Cu>c,
故选C.
11.能说明氯的非金属性比硫强的事实是( )
A.氯化氢的酸性强于硫化氢
B.氯化氢的稳定性比硫化氢强
C.氯气能与水反应而硫不能
D.氯原子最外电子层上有7个电子而硫最外电子层上有6个电子
【考点】非金属在元素周期表中的位置及其性质递变的规律.
【分析】利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱,以此来解答.
【解答】解:A.可以根据元素最高价含氧酸的酸性来比较元素的非金属性,氯化氢的酸性强于硫化氢,无法说明非金属性的强弱,故A错误;
B.氯化氢的稳定性比硫化氢强,则Cl的非金属性比S的强,故B正确;
C.物质能否与水反应,与非金属性强弱无关,所以判断比较非金属性的强弱,故C错误;
D.最外层电子数多的元素非金属性不一定强,如Br最外层有7个电子,O最外层6个电子,但是非金属性O比Br强,所以不能直接根据最外层电子数多少判断比较非金属性的强弱,故D错误.
故选B.
12.已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性:X+<W3+ D.原子半径:X<W
【考点】原子结构与元素的性质.
【分析】元素周期表前三周期元素的离子aW3+、bX+、cY2﹣、dZ﹣具有相同电子层结构,核外电子数相等,所以a﹣3=b﹣1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,以此解答该题.
【解答】解:元素周期表前三周期元素的离子aW3+、bX+、cY2﹣、dZ﹣具有相同电子层结构,核外电子数相等,所以a﹣3=b﹣1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.离子的电子层结构相同,则c+2=d+1,则质子数d>c,故A错误;
B.非金属性越强,其氢化物的稳定性越强,非金属性Y<Z,则氢化物的稳定性H2Y<HZ,故B错误;
C.元素的金属性越强,其阳离子的氧化性越弱,金属性Na>Al,则离子的氧化性:X+<W3+,故C正确;
D.W是Al元素、X是Na元素,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径W<X,故D错误;
故选C.
13.下列过程中,共价键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水
⑤冰融化 ⑥NH4Cl受热“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水.
A.①②④⑥⑦ B.④⑥ C.①④⑤⑧ D.①②④⑤⑥⑦
【考点】化学键.
【分析】发生化学变化及电离时化学键被破坏,一般非金属元素之间形成共价键,以此来解答.
【解答】解:①碘升华,破坏的为分子间作用力,故不选;
②溴蒸气被木炭吸附,破坏的为分子间作用力,故不选;
③酒精溶于水,不发生电离,破坏的为分子间作用力,故不选;
④HCl气体溶于水,发生电离,H﹣Cl共价键被破坏,故选;
⑤冰融化,破坏的为分子间作用力,故不选;
⑥NH4Cl受热“升华”,发生化学变化,生成氨气和HCl,N﹣H共价键破坏,故选;
⑦氢氧化钠熔化,离子键被破坏,故不选;
⑧(NH4)2SO4溶于水,发生电离,离子键被破坏,故不选;
故选B.
14.下列物质中,既含有离子键又含有非极性键的是( )
A.CO2 B.MgCl2 C.KOH D.Na2O2
【考点】离子键的形成;极性键和非极性键.
【分析】活泼金属和活泼非金属之间易形成离子键,非金属之间易形成共价键,同种非金属元素间形成非极性共价键,不同种非金属元素间形成极性共价键,据此分析.
【解答】解、A、二氧化碳中存在的化学键是非金属元素之间形成的共价键,故A错误;
B、氯化镁中存在的化学键是活泼金属和活泼非金属之间形成的离子键,故B错误;
C、氢氧化钾中存在的化学键既有钾离子和氢氧根离子之间的离子键,也有氧元素和氢元素之间的极性共价键,故C错误;
D、过氧化钠中存在的化学键有钠离子和过氧根之间的离子键,也有氧元素和氧元素之间的非极性共价键,故D正确;
故选D.
15.将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),反应2s后测得C的浓度为0.6mol/L.下列说法正确的是( )
A.用物质A表示2 s内的平均反应速率为0.3 mol/(L s)
B.用物质B表示2 s内的平均反应速率为0.6 mol/(L s)
C.2 s后物质A的转化率为70%
D.2 s后物质B的浓度为0.35 mol/L
【考点】化学平衡建立的过程.
【分析】反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g) 2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
根据概念计算选项中的速率、转化率和浓度.
【解答】解:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol;
2A(g)+B(g) 2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s末量(mol) 2.8 1.4 1.2
A、用物质A表示2 s内的平均反应速率==0.3 mol/(L s),故A正确;
B、用物质B表示2 s内的平均反应速率==0.15 mol/(L s)故B错误;
C、2 s后物质A的转化率=×100%=30%,故C错误;
D、2 s后物质B的浓度==0.7mol/L,故D错误;
故选A.
16.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),则下图中正确的是(表示混合气体的平均相对分子质量)( )
A. B. C. D.
【考点】化学平衡建立的过程.
【分析】A.开始投入SO3,它是生成物,只有逆反应速率,正反应速率为0;
B.据方程式可知SO2比O2生成的多;
C.反应向逆反应进行,据M=分析;
D.反应向逆反应进行,据ρ=分析.
【解答】解:A.开始投入SO3,它是生成物,只有逆反应速率,正反应速率为0,图象上v正、v逆标反了,故A错误;
B.据方程式可知SO2比O2生成的多,下面两条线标的物质反了,故B错误;
C.据M=,气体的总质量不变,而反应向逆反应方向进行,n变大,故M变小,后来平衡不变了,故C正确;
D.反应向逆反应进行,据ρ=,气体的总质量不变,体积固定,ρ始终不变,故D错误.
故选C.
17.一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
【考点】化学平衡的计算.
【分析】A.根据反应速率之比等于化学计量数之比判断;
B.反应达到平衡状态时,正逆反应速率相等;
C.根据起始量以及转化量判断转化率关系;
D.从可逆反应的特点的角度分析.
【解答】解:X(g)+3Y(g)2Z(g)
起始:c1 c2 c3
平衡:0.1moL/L 0.3mol/L 0.08mol/L
A.由方程式可知,反应物的物质的量浓度的变化量与化学计量数成正比,则( c1﹣0.1moL/L):(c2﹣0.3mol/L)=1:3,则c1:c2=l:3,故A正确;
B.平衡时,Y和Z的生成速率之比为3:2,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C.反应起始时c1:c2=l:3,由方程式可知,反应物的物质的量变化量与化学计量数呈正比,转化的物质的量也为1:3,则转化率应相等,故C错误;
D.如反应向正反应进行,则c1最小为0,如反应向逆反应方向进行,则c1最大为0.14,因反应为可逆反应,反应物不可能完全转化,则C1的取值范围为0<c1<0.14,故D正确.
故选C.
二.填空题(18题6分,19题8分,20题6分,共20分)
18.下列物质中:互为同素异形体的有 ③⑤ (填序号,下同),属于同位素的有 ②⑥ ,属于同一种物质的有 ①④ .
①液氯和氯气 ②16O、17O和18O ③金刚石与“足球烯”C60 ④白磷和P4 ⑤O2与O3 ⑥D与T.
【考点】同素异形体;核素;同位素及其应用.
【分析】具有相同质子数,不同中子数或同一元素的不同核素互为同位素;
由同种元素形成的不同种单质互为同素异形体;
分子式相同、结构也相同的物质为同一种物质,据此分析.
【解答】解:①液氯是液态的氯气,故和氯气是同一种物质;
②16O、17O和18O是同一种元素的不同种原子,故互为同位素;
③金刚石与“足球烯”C60 是同种元素形成的不同种单质,故互为同素异形体;
④白磷即P4,故是同一种物质;
⑤O2与O3 是同种元素形成的不同种单质,故互为同素异形体;
⑥D与T是同一种元素的不同种原子,故互为同位素;
故答案为:③⑤;②⑥;①④.
19.下列物质中:只存在共价键的是 ②⑧ (填序号,下同),既存在离子键又存在极性共价键的是 ④⑥ ,只存在离子键的是 ③⑤ .
①Ar ②CO ③Na2O④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO2 ⑧H2SO4.
【考点】化学键.
【分析】一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属元素形成非极性共价键,不同种非金属元素形成极性共价键,以此来解答.
【解答】解:①Ar不含化学键;
②CO中只含C、O之间的极性共价键;
③Na2O中只含离子键;
④KOH中含离子键和O﹣H极性共价键;
⑤MgBr2中只含离子键;
⑥NH4Cl中含离子键和极性共价键;
⑦CaO2中含离子键和O﹣O非极性共价键;
⑧H2SO4中极性共价键,
则只存在共价键的是②⑧,既存在离子键又存在极性共价键的是④⑥,只存在离子键的是③⑤.
故答案为:②⑧;④⑥;③⑤.
20.化学能在一定的条件下可以转化为电能.
(一)现有如下两个反应:
①2FeBr2+3Cl2=2FeCl3+2Br2 ②Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 ① (填反应序号),理由是 反应①是氧化还原反应,有电子转移 .
(二)请根据Fe+CuSO4=FeSO4+Cu反应,选择适宜的材料和试剂设计一个原电池
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称.
(3)写出该原电池电极反应式:正极: Cu2++2e﹣=Cu ;负极: Fe﹣2e﹣=Fe2+ .
【考点】原电池和电解池的工作原理.
【分析】(一)从原电池反应必须是氧化还原反应的角度分析;
(二)(1)原电池的构成条件:有活泼性不同的两个电极;有电解质溶液;形成闭合回路;自发的氧化还原反应;
(2)电极中负极比正极活泼,是失电子的极,电解质中的阳离子在正极得电子.
【解答】解:(一)原电池是将化学能转变为电能的装置,只有氧化还原反应才有电子的转移,而①为氧化还原反应,能设计成原电池,②为非氧化还原反应,不可以设计成原电池,
故答案为:①;①为氧化还原反应,可以设计成原电池;
(二)(1)根据自发的氧化还原反应:金属锌失电子,为负极,正极可以用活泼性较差的金属铜,溶液中的铜离子得电子,必须用可溶的铜盐作电解质,结合原电池的构成条件,装置为:,故答案为:;
(2)负极是失去电子的极,金属要比正极活泼,所以Cu为正极,正极是电解质中的阳离子发生得电子的还原反应,即Cu2+2e﹣=Cu;负极为锌,金属锌失电子生成锌离子,即Zn﹣2e﹣=Zn2+;
故答案为:Cu2+2e﹣=Cu;Zn﹣2e﹣=Zn2+.
21.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
①比较Na3N中两种微粒的半径r(Na+) < r(N3﹣)(填“>”“<”或“=”),
②Na3N与水反应属于 非氧化还原 反应(填“氧化还原”或“非氧化还原”);
③Na3N与盐酸反应生成两种盐的化学式为 NH4Cl、NaCl ;
④写出化合物Na3N的电子式: .
【考点】微粒半径大小的比较;电子式.
【分析】①电子层结构相同的离子,核电荷数越大离子半径越小;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠;
④Na3N属于离子化合物,由钠离子与氮离子构成.
【解答】解:①电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径r(Na+)<r(N3﹣),
故答案为:<;
②Na3N与水反应生成NaOH与氨气,元素化合价没有发生变化,属于非氧化还原反应,
故答案为:非氧化还原;
③Na3N与盐酸反应生成两种盐为氯化铵与氯化钠,
故答案为:NH4Cl、NaCl;
④Na3N属于离子化合物,由钠离子与氮离子构成,电子式为:,故答案为:.
三.实验题和推断题(21题13分、22题8分,共21分)
22.A、B、C、D、E是位于短周期的主族元素.已知:①热稳定性:HmD>HmC;②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍.依据上述信息用相应的化学用语回答下列问题:
(1)用电子式表示AmC的形成过程 .
(2)Cm﹣、E(m﹣1)﹣的还原性强弱顺序为: S2﹣>Cl﹣ ,(用离子符号表示)能证明其还原性强弱的离子方程式为 Cl2+S2﹣=2Cl﹣+S↓ .
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为: Cl2+2OH﹣=Cl﹣+ClO﹣+H2O .
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:1混合,写出该反应的离子方程式 H2S+OH﹣=HS﹣+H2O .该溶液的溶质含有的化学键类型是 离子键和共价键 .
(5)HmD和 HmC沸点较高的是 H2O (填化学式),原因是 水分子间存在氢键 .
(6)在A、B、C、E单质中,符合下列转化关系的是 Na、S (填元素符号).
【考点】位置结构性质的相互关系应用.
【分析】A、B、C、D、E是位于短周期的主族元素,①热稳定性:HmD>HmC,则非金属性D大于C且二者位于同一主族,所以D位于第二周期、C位于第三周期;
②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构,则E的原子序数比C大1,二者位于同一周期,都属于第三周期;
③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小且二者都为主族元素,则A位于第IA族、B位于第IIIA主族;
④A与B质子数之和是D质子数的3倍,D为第二周期元素,则A和B的质子数之和在9到27之间,A位于第IA族、B位于第IIIA主族,如果A是Li、B是B元素,二者质子数之和不是3的倍数,所以A是Na、B是Al元素,D是O元素,D和C位于同一主族,则C是S元素,E是Cl元素,m=2,再结合物质结构性质解答.
【解答】解:A、B、C、D、E是位于短周期的主族元素,①热稳定性:HmD>HmC,则非金属性D大于C且二者位于同一主族,所以D位于第二周期、C位于第三周期;
②Cm﹣、E(m﹣1)﹣ 具有相同的电子层结构,则E的原子序数比C大1,二者位于同一周期,都属于第三周期;
③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小且二者都为主族元素,则A位于第IA族、B位于第IIIA主族;
④A与B质子数之和是D质子数的3倍,D为第二周期元素,则A和B的质子数之和在9到27之间,A位于第IA族、B位于第IIIA主族,如果A是Li、B是B元素,二者质子数之和不是3的倍数,所以A是Na、B是Al元素,D是O元素,D和C位于同一主族,则C是S元素,E是Cl元素,m=2,
(1)A是Na、C是S元素,则AmC是Na2S,用电子式表示硫化钠的形成过程为:,
故答案为:;
(2)元素的非金属性越强,其简单阴离子的还原性越弱,S元素的非金属性小于Cl元素,所以Cm﹣、E(m﹣1)﹣的还原性强弱顺序为S2﹣>Cl﹣,氯气能氧化硫离子生成硫单质,反应方程式为Cl2+S2﹣=2Cl﹣+S↓,故答案为:S2﹣>Cl﹣;Cl2+S2﹣=2Cl﹣+S↓
(3)E是氯气,A与D形成的化合物的水溶液是NaOH,二者反应生成氯化钠、次氯酸钠和水,离子反应方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,
故答案为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
(4)常温下,将等物质的量浓度的H2S溶液和A的最高价氧化物对应的水化物为NaOH溶液按体积比1:1混合,二者反应生成硫氢化钠,离子方程式为H2S+OH﹣=HS﹣+H2O,该溶液的溶质是硫氢化钠,硫氢化钠中钠离子和硫氢根离子之间存在离子键、S原子和H原子之间存在共价键,所以硫氢化钠中含有的化学键类型是离子键和共价键,故答案为:H2S+OH﹣=HS﹣+H2O;离子键和共价键;
(5)H2S中不含氢键,H2O中含有氢键,氢键的存在导致物质的沸点升高,所以沸点较高的是H2O,
故答案为:H2O;水分子间存在氢键;
(6)A、B、C、E单质分别是Na、Al、S、Cl2,根据单质能连续被氧化可知,符合条件的是Na和S,故答案为:Na、S.
23.某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
①该研究小组在设计方案时.考虑了浓度、 温度 、 催化剂 等因素对过氧化氢分解速率的影响.
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快 .
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
催化剂(MnO2) 操作情况 观察结果 反应完成所需的时间
粉末状 混合不振荡 剧烈反应,带火星的木条复燃 3.5分钟
块状 反应较慢,火星红亮但木条未复燃 30分钟
①写出H2O2发生的化学反应方程式 2H2O22H2O+O2↑ .
②实验结果说明催化剂作用的大小与 接触面积 有关.
【考点】探究温度、压强对化学反应速率的影响;催化剂的作用;化学反应速率的影响因素.
【分析】(1)过氧化氢溶液是实验室制取氧气的重要药品,在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响设计实验方案来证明时,要注意实验的控制变量,以确保实验结果的准确性;
(2)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;由实验现象可知,催化剂作用大小的影响因素.
【解答】解:(1)①根据表中给出的数据,无催化剂不加热的情况下,不同浓度的过氧化氢溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的过氧化氢溶液都分解,说明过氧化氢的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明过氧化氢的分解速率与浓度有关;比较同一浓度的过氧化氢溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明过氧化氢的分解速率与温度、催化剂有关,故答案为:温度;催化剂;
②分析表中数据可以看出,浓度越大,反应速率越快,加热能加快过氧化氢的分解,有催化剂是分解速率快,
故答案为:温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快;
(2)①H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O22H2O+O2↑,故答案为:2H2O22H2O+O2↑;
②因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明接触面积对反应速率有影响,故答案为:接触面积.
四.计算题(23题8分,共8分)
24.在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol L﹣1.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.请回答下列问题:
(1)前2s以N2O4的浓度变化表示的平均反应速率为 0.005mol L﹣1s﹣1 ;
(2)平衡时,NO2的体积分数为 75% ;
(3)平衡时,N2O4的转化率为 60% ;
(4)平衡时,混合气体的平均摩尔质量为 57.5g mol﹣1 .
【考点】化学平衡的计算.
【分析】2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度;
依据化学平衡三段式列式计算,反应进行到60s时,体系已达平衡,此时容器内压强为开始时的1.6倍,设消耗N2O4的物质的量为x,列式计算
N2O4═2NO2,
起始量(mol) 0.5 0
变化量(mol) x 2x
平衡量(mol)0.5﹣x 2x
0.5﹣x+2x=0.5×1.6
x=0.3mol
【解答】解:2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度;
依据化学平衡三段式列式计算,反应进行到60s时,体系已达平衡,此时容器内压强为开始时的1.6倍,设消耗N2O4的物质的量为x,列式计算
N2O4═2NO2,
起始量(mol) 0.5 0
变化量(mol) x 2x
平衡量(mol)0.5﹣x 2x
0.5﹣x+2x=0.5×1.6
x=0.3mol
(1)2秒时,NO2的浓度为0.02摩/升,则转化的N2O4的浓度为0.01mol/L,则前2秒,以N2O4的浓度变化表示的平均反应速度为=0.005mol/L.s;
故答案为:0.005mol/L.s;
(2)平衡时,NO2的体积分数=×100%=×100%=75%;
故答案为:75%;
(3)平衡时,N2O4的转化率=×100%=60%;
故答案为:60%;
(4)平衡时,混合气体的平均摩尔质量===57.5g/mol;
故答案为:57.5g mol﹣1;
2016年6月2日
同课章节目录
