1.1.2构造原理与电子排布式 课件(共24张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.2构造原理与电子排布式 课件(共24张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 00:00:00 | ||
图片预览




文档简介
(共24张PPT)
第一节 原子结构
第2课时 构造原理和电子排布式
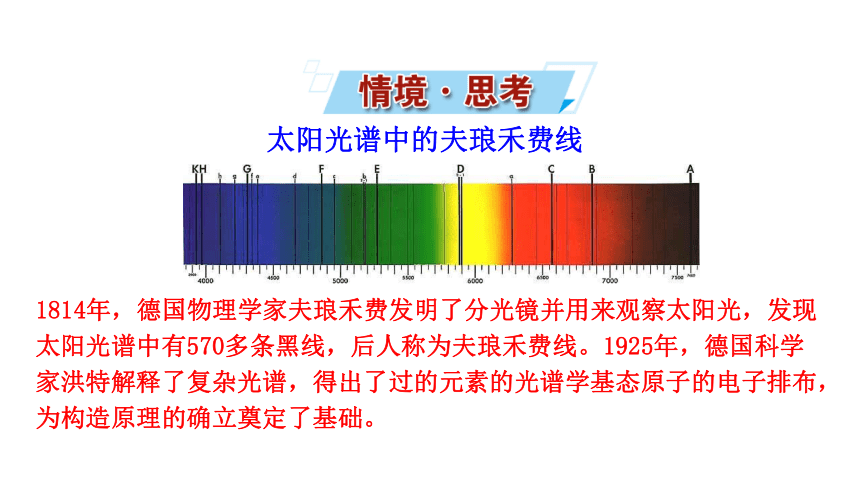
太阳光谱中的夫琅禾费线
1814年,德国物理学家夫琅禾费发明了分光镜并用来观察太阳光,发现太阳光谱中有570多条黑线,后人称为夫琅禾费线。1925年,德国科学家洪特解释了复杂光谱,得出了过的元素的光谱学基态原子的电子排布,为构造原理的确立奠定了基础。
1.知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2.知道1~36号元素基态原子核外电子的排布。
1.通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。(宏观辨识与微观探析)
2.结合原子核外电子排布规律及核外电子排布的原则建立观点、结论和证据之间的逻辑关系。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
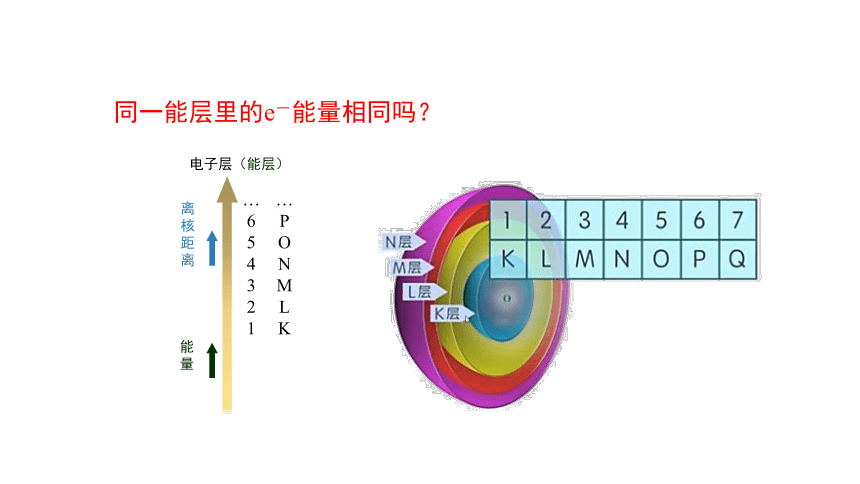
同一能层里的e-能量相同吗?
电子层(能层)
离核距离
能量
…654321
…PONMLK
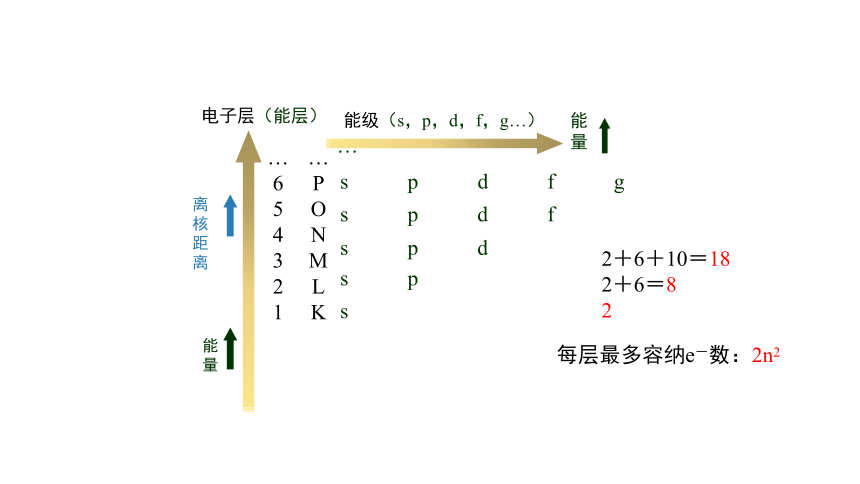
能级(s,p,d,f,g…)
能量
电子层(能层)
离核距离
能量
…654321
…PONMLK
s
s p
s p d
s p d f
s p d f g
…
每层最多容纳e-数:2n2
2+6+10=18
2+6=8
2
电子层(能层)
离核距离
能量
…654321
…PONMLK
能级(s,p,d,f,g…)
能量
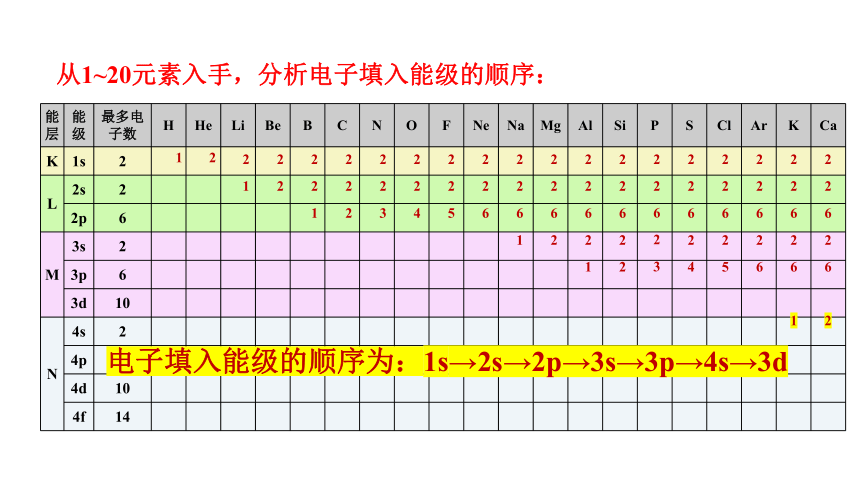
从1~20元素入手,分析电子填入能级的顺序:
能层 能级 最多电子数 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
K 1s 2
L 2s 2
2p 6
M 3s 2
3p 6
3d 10
N 4s 2
4p 6
4d 10
4f 14
电子填入能级的顺序为:1s→2s→2p→3s→3p→4s→3d
1
2
2
1
2
2
2
2
1
2
2
2
2
2
3
2
2
4
2
2
5
2
2
6
2
2
6
1
2
2
6
2
2
2
6
2
1
2
2
6
2
2
2
2
6
2
3
2
2
6
2
4
2
2
6
2
5
2
2
6
2
6
2
2
6
2
6
1
2
2
6
2
6
2
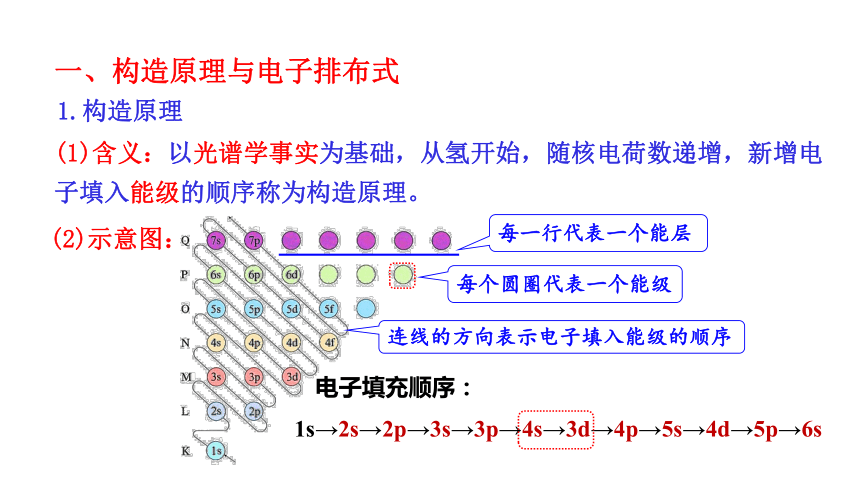
一、构造原理与电子排布式
(1)含义:以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
每一行代表一个能层
每个圆圈代表一个能级
连线的方向表示电子填入能级的顺序
电子填充顺序:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s
(2)示意图:
1.构造原理
构造原理呈现的能级交错源于 ,即钾和钙的光谱证实它们的最外层电子是4s1和4s2,是经验的,而不是任何理论推导的结果。构造原理是一个 ,是个假想过程。
4s
3d
光谱学事实
思维模型
构造原理中的电子排布顺序,其实质是各能级的能量高低顺序。
(3)能级交错
随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的。电子是按3p→ → 的顺序而不是按3p→3d→4s的顺序填充的,这种现象被称为能级交错。
2.电子排布式
(1)表示方法:按照构造原理,电子填满了一个能级再填入下一个能级
基态原子的电子排布式
如13Al:
1s2 2s22p6 3s23p1
能层
能级
能级上的电子数
21Sc:
1s2 2s22p6 3s23p6 3d14s2
【特别提醒】能层低的能级要写在左边,而不是按照构造原理顺序书写。
21Sc最后两个能级填充顺序4s23d1,但是在书写时为3d14s2。
请根据构造原理,写出下列元素原子或离子的电子排布式:
(1)N
(2)Ne
(3)S2- __________________
(4)Ca2+ 。
(5)32Ge ___________________________
(6)35Br__________________________
1s22s22p3
1s22s22p6
1s22s22p63s23p6
1s22s22p63s23p6
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p5
【注意】书写时,不能按构造原理填充顺序写,而是按能层顺序写。能层低的能级要写在左边。
【思考讨论】
1.按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2
Ne 2s22p6
Ar 3s23p6
Kr 4s 24p6
Xe 5s 25p6
Rn 6s 26p6
通式:ns2np6
(2)能级交错
电子按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充
19K:
26Fe:
1s2 2s22p6 3s23p6 4s1
1s2 2s22p6 3s23p6 3d64s2
能量:4s<3d
3.简化电子排布式
内层电子排布用相应稀有气体元素符号加“[ ]”来表示
19K:
26Fe:
[Ar] 4s1
[Ar] 3d64s2
N:[He]2s22p3 Na:[Ne]3s1 Ca:[Ar]4s2
写出第8号元素氧、第14号元素硅和第23号元素钒的简化电子排布式?
O: [He]2s22p4
Si: [Ne]3s23p2
V: [Ar]3d34s2
4.价层电子排布(外围电子排布)
价电子层:化学反应中可能发生电子变动的能级
为突出化合价与电子排布的关系
温馨提示:
主族元素的价层电子为最外层电子,
过渡元素含次外层部分能级。
26Fe:
3d64s2
N: 2s22p3 Na:3s1 K:4s1 Ca:4s2
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。以Cr为例,电子排布不符合构造原理。
【特别提醒】
24Cr:
1s22s22p63s23p6
3d44s2
按构造原理
3d54s1
半充满状态时,较稳定
3d54s1
(或[Ar]3d54s1)
29Cu:
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
1. 写出下列基态原子的核外电子排布式、简化电子排布式和价层电子排布。
(1)9F:_____________________________;
(2)16S:_________________________________;
(3)19K:_______________________________;
(4)21Sc:______________________________________。
1s22s22p5 [He]2s22p5 2s22p5
1s22s22p63s23p4 [Ne]3s23p4 3s23p4
1s22s22p63s23p64s1 [Ar]4s1 4s1
1s22s22p63s23p63d14s2 [Ar]3d14s2 3d14s2
2.请写出K+、S2-、29Cu2+的电子排布式。
K+:1s22s22p63s23p6 S2-:1s22s22p63s23p6
Cu2+:1s22s22p63s23p63d9
【巩固练习】
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
能层
能级
符号:K L M N O P Q
能量:K → Q依次升高
符号:s、p、d、f
能级数=能层序数
1.下列基态原子与离子的电子排布式错误的是 ( )
A.K:1s22s22p63s23p64s1
B.F-:1s22s22p6
C.Fe:1s22s22p63s23p63d54s2
D.Kr:1s22s22p63s23p63d104s24p6
C
2.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)D.E(5s)>E(4s)>E(4f)>E(3d)
B
3.下列原子或离子的核外电子排布式,正确的是( )
A.16S2-:1s22s22p63s23p4
B.21Sc:1s22s22p63s23p64s23d1
C.18Ar:1s22s22p63s23p6
D.9F:2s22p5
C
4.按要求填空:
(1)基态B原子的电子排布式为____________ 。
(2)Se原子序数为_______,其核外M层电子的排布式为___________。
(3)Li3N晶体中氮以N3-形式存在,基态N3-的电子排布式为____________。
(4)写出基态镓(Ga)原子的电子排布式:
________________ __________________ 。
1s22s22p1或[He]2s22p1
34
3s23p63d10
1s22s22p6
1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1
5.(1)(2023·浙江6月选考)基态N原子的价层电子排布式是_______。
(2)(2023·全国乙卷)基态Fe原子的价电子排布式为________。
(3)(2023·北京等级考)基态S原子价层电子排布式是_________。
(4)(2023·海南等级考)锑和磷同族,锑原子基态的价层电子排布式为_____________ 。
2s22p3
3d64s2
3s23p4
5s25p3
第一节 原子结构
第2课时 构造原理和电子排布式
太阳光谱中的夫琅禾费线
1814年,德国物理学家夫琅禾费发明了分光镜并用来观察太阳光,发现太阳光谱中有570多条黑线,后人称为夫琅禾费线。1925年,德国科学家洪特解释了复杂光谱,得出了过的元素的光谱学基态原子的电子排布,为构造原理的确立奠定了基础。
1.知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。
2.知道1~36号元素基态原子核外电子的排布。
1.通过认识原子结构及核外电子排布,辨识微观粒子的运动状态不同于宏观物体的运动状态。(宏观辨识与微观探析)
2.结合原子核外电子排布规律及核外电子排布的原则建立观点、结论和证据之间的逻辑关系。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
同一能层里的e-能量相同吗?
电子层(能层)
离核距离
能量
…654321
…PONMLK
能级(s,p,d,f,g…)
能量
电子层(能层)
离核距离
能量
…654321
…PONMLK
s
s p
s p d
s p d f
s p d f g
…
每层最多容纳e-数:2n2
2+6+10=18
2+6=8
2
电子层(能层)
离核距离
能量
…654321
…PONMLK
能级(s,p,d,f,g…)
能量
从1~20元素入手,分析电子填入能级的顺序:
能层 能级 最多电子数 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
K 1s 2
L 2s 2
2p 6
M 3s 2
3p 6
3d 10
N 4s 2
4p 6
4d 10
4f 14
电子填入能级的顺序为:1s→2s→2p→3s→3p→4s→3d
1
2
2
1
2
2
2
2
1
2
2
2
2
2
3
2
2
4
2
2
5
2
2
6
2
2
6
1
2
2
6
2
2
2
6
2
1
2
2
6
2
2
2
2
6
2
3
2
2
6
2
4
2
2
6
2
5
2
2
6
2
6
2
2
6
2
6
1
2
2
6
2
6
2
一、构造原理与电子排布式
(1)含义:以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
每一行代表一个能层
每个圆圈代表一个能级
连线的方向表示电子填入能级的顺序
电子填充顺序:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s
(2)示意图:
1.构造原理
构造原理呈现的能级交错源于 ,即钾和钙的光谱证实它们的最外层电子是4s1和4s2,是经验的,而不是任何理论推导的结果。构造原理是一个 ,是个假想过程。
4s
3d
光谱学事实
思维模型
构造原理中的电子排布顺序,其实质是各能级的能量高低顺序。
(3)能级交错
随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的。电子是按3p→ → 的顺序而不是按3p→3d→4s的顺序填充的,这种现象被称为能级交错。
2.电子排布式
(1)表示方法:按照构造原理,电子填满了一个能级再填入下一个能级
基态原子的电子排布式
如13Al:
1s2 2s22p6 3s23p1
能层
能级
能级上的电子数
21Sc:
1s2 2s22p6 3s23p6 3d14s2
【特别提醒】能层低的能级要写在左边,而不是按照构造原理顺序书写。
21Sc最后两个能级填充顺序4s23d1,但是在书写时为3d14s2。
请根据构造原理,写出下列元素原子或离子的电子排布式:
(1)N
(2)Ne
(3)S2- __________________
(4)Ca2+ 。
(5)32Ge ___________________________
(6)35Br__________________________
1s22s22p3
1s22s22p6
1s22s22p63s23p6
1s22s22p63s23p6
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p5
【注意】书写时,不能按构造原理填充顺序写,而是按能层顺序写。能层低的能级要写在左边。
【思考讨论】
1.按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2
Ne 2s22p6
Ar 3s23p6
Kr 4s 24p6
Xe 5s 25p6
Rn 6s 26p6
通式:ns2np6
(2)能级交错
电子按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充
19K:
26Fe:
1s2 2s22p6 3s23p6 4s1
1s2 2s22p6 3s23p6 3d64s2
能量:4s<3d
3.简化电子排布式
内层电子排布用相应稀有气体元素符号加“[ ]”来表示
19K:
26Fe:
[Ar] 4s1
[Ar] 3d64s2
N:[He]2s22p3 Na:[Ne]3s1 Ca:[Ar]4s2
写出第8号元素氧、第14号元素硅和第23号元素钒的简化电子排布式?
O: [He]2s22p4
Si: [Ne]3s23p2
V: [Ar]3d34s2
4.价层电子排布(外围电子排布)
价电子层:化学反应中可能发生电子变动的能级
为突出化合价与电子排布的关系
温馨提示:
主族元素的价层电子为最外层电子,
过渡元素含次外层部分能级。
26Fe:
3d64s2
N: 2s22p3 Na:3s1 K:4s1 Ca:4s2
当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。以Cr为例,电子排布不符合构造原理。
【特别提醒】
24Cr:
1s22s22p63s23p6
3d44s2
按构造原理
3d54s1
半充满状态时,较稳定
3d54s1
(或[Ar]3d54s1)
29Cu:
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
1. 写出下列基态原子的核外电子排布式、简化电子排布式和价层电子排布。
(1)9F:_____________________________;
(2)16S:_________________________________;
(3)19K:_______________________________;
(4)21Sc:______________________________________。
1s22s22p5 [He]2s22p5 2s22p5
1s22s22p63s23p4 [Ne]3s23p4 3s23p4
1s22s22p63s23p64s1 [Ar]4s1 4s1
1s22s22p63s23p63d14s2 [Ar]3d14s2 3d14s2
2.请写出K+、S2-、29Cu2+的电子排布式。
K+:1s22s22p63s23p6 S2-:1s22s22p63s23p6
Cu2+:1s22s22p63s23p63d9
【巩固练习】
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
能层
能级
符号:K L M N O P Q
能量:K → Q依次升高
符号:s、p、d、f
能级数=能层序数
1.下列基态原子与离子的电子排布式错误的是 ( )
A.K:1s22s22p63s23p64s1
B.F-:1s22s22p6
C.Fe:1s22s22p63s23p63d54s2
D.Kr:1s22s22p63s23p63d104s24p6
C
2.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
B
3.下列原子或离子的核外电子排布式,正确的是( )
A.16S2-:1s22s22p63s23p4
B.21Sc:1s22s22p63s23p64s23d1
C.18Ar:1s22s22p63s23p6
D.9F:2s22p5
C
4.按要求填空:
(1)基态B原子的电子排布式为____________ 。
(2)Se原子序数为_______,其核外M层电子的排布式为___________。
(3)Li3N晶体中氮以N3-形式存在,基态N3-的电子排布式为____________。
(4)写出基态镓(Ga)原子的电子排布式:
________________ __________________ 。
1s22s22p1或[He]2s22p1
34
3s23p63d10
1s22s22p6
1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1
5.(1)(2023·浙江6月选考)基态N原子的价层电子排布式是_______。
(2)(2023·全国乙卷)基态Fe原子的价电子排布式为________。
(3)(2023·北京等级考)基态S原子价层电子排布式是_________。
(4)(2023·海南等级考)锑和磷同族,锑原子基态的价层电子排布式为_____________ 。
2s22p3
3d64s2
3s23p4
5s25p3
