1.2.1原子结构与元素周期表课件(共30张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.2.1原子结构与元素周期表课件(共30张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 00:00:00 | ||
图片预览










文档简介
(共30张PPT)
第二节 原子结构与元素的性质
第1课时 原子结构与元素周期表
德米特里·伊万诺维奇·门捷列夫(1834-1907)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。
1869年3月2日,门捷列夫经过苦苦思索,惊喜地发现,当所有的已知元素按相对原子质量递增的顺序排列起来,并且性质相似元素依一定的间隔出现。世界上第一章元素周期表出现了。
1.知道元素周期表中分区、周期和族的元素原子核外电子排布特征。
2.了解元素周期表的应用价值。
1.通过认识原子结构及价层电子排布与元素在周期表中的位置,建立原子核外电子排布规律与周期表中周期、族、分区划分的周期性变化规律的深层关联。(宏观辨识与微观探析)
2.通过对元素周期表发展史的了解,认识科学家对元素周期表经历的探索过程。(科学态度与社会责任)
3.通过对构造原理与元素周期表分区关系的分析,了解元素周期表是微观上原子核外电子排布的宏观表达方式。(宏观辨识与微观探析)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
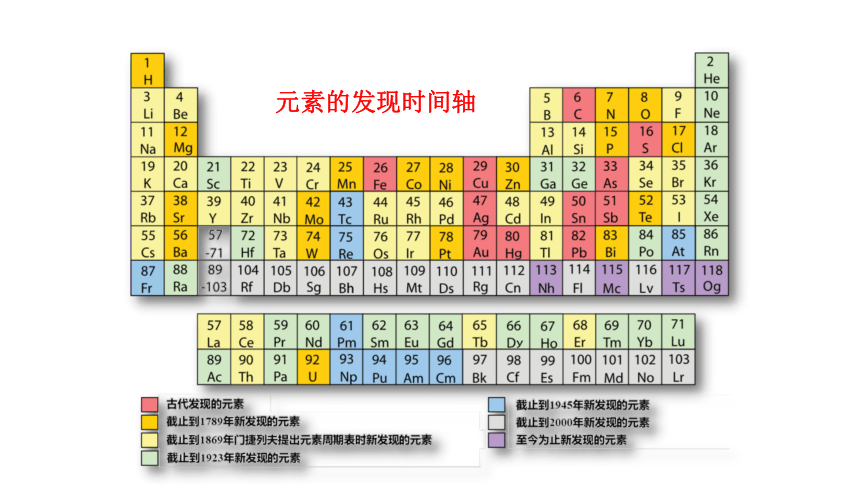
元素的发现时间轴
联合国教科文组织总干事阿祖莱说:“化学元素周期表不仅仅是对宇宙中所有已知原子进行排序的列表,它本质上是帮助我们更好地了解我们周围世界的一个窗口。”
元素周期律元素的性质随着原子序数递增发生现周期性的重复。
1869年,门捷列夫的第一张元素周期表
原子序数是按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号。
1913年,英国物理学家莫塞莱
原子序数即原子核电荷数
元素周期律元素的性质随元素原子的核电荷数递增发生周期性递变。
一、原子的结构与元素周期表
(一)元素周期律、元素周期系和元素周期表
1.元素周期律
(1)定义:元素的性质随原子的核电荷数递增发生周期性递变,这一规律叫做元素周期律
(2)实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
2.元素周期系
定义:元素按其原子核电荷数递增排列的序列称为元素周期系。
这个序列中的元素性质随着核电荷数的递增发生周期性的重复。
3.元素周期表
(1)含义:元素周期表是呈现元素周期系的表格。
(2)元素周期系与元素周期表的关系:
(3)元素周期系只有一个,元素周期表多种多样。第一张元素周期表是由门捷列夫制作的。
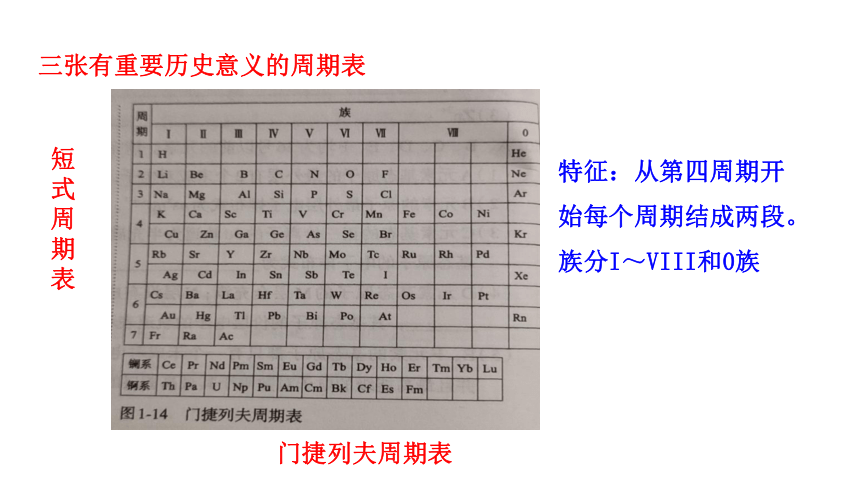
门捷列夫周期表
短式周期表
三张有重要历史意义的周期表
特征:从第四周期开始每个周期结成两段。
族分I~VIII和0族
维尔纳的特长式周期表
… … …
H … He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
Rb Sr Y Zr Nb Mo … Ru Rh Pd Ag Cd In Sn Sb Te I Xe
Cs Ba La Ce Nd Pr … … Sm Eu Gd Tb Ho Er Tm Yb … … Ta W … Os Ir Pt Au Hg Tl Pb Bi … … …
… Ra Laα Th … … … … … U … … … … Ac … … … … … … … … … … … … Pbα Biα Teα … …
1905年,配位化学鼻祖维尔纳制做了一张周期表称为特长式周期表,每个周期一行,各族元素、过渡元素、稀有气体、镧系和锕系,各有各的位置,同族元素上下对齐,维尔纳的周期表与现在的周期表相似,但也有差异。比如没有确定镧系和锕系的元素种类,Be、Mg的位置与现今周期表不同。
三张有重要历史意义的周期表
波尔元素周期表
1922年,玻尔也绘制了一张元素周期表,玻尔已经开始用原子结构来解释元素周期系
三张有重要历史意义的周期表
形形色色的元素周期表
思考
1.如何从原子结构角度解释周期元素种数?
周期 序数 价层电子 填入的能级 电子数 元素
种数
1
2
3
4
5
6
7
1s
2s→2p
3s → 3p
4s → 3d → 4p
5s → 4d → 5p
6s → 4f → 5d → 6p
7s → 5f → 6d → 7p
2
8
8
18
18
32
32
2
8
8
18
18
32
32
每周期的元素种数
=
除第一周期外,以ns开始、np结束递增的核电荷数(或电子数)
(二)构造原理与元素周期表
周期序数=基态原子的能层数
周期 IA 族元素 0族元素 原子序数 电子排布式 原子序数 电子排布式
一
二
三
四
五
六
1
3
11
19
37
55
1s1
[He] 2s1
[Ne] 3s1
[Ar] 4s1
[Kr]5s1
[Xe]6s1
2
10
18
36
54
86
1s2
1s2 2s2 2p6
1s2 2s2 2p6 3s2 3p6
1s2 2s2 2p6 3s2 3p63d104s24p6
1s2 2s2 2p6 3s2 3p63d104s24p6 4d105s25p6
1s2 2s2 2p6 3s2 3p63d104s24p6 4d105s25p64f145d106s26p6
随着元素原子核电荷数递增,每到出现碱金属,就开始建立一个新的周期,并开始新的能层,随后最外层上的电子数逐渐增多,最后达到8个电子,以稀有气体结束,形成一个完整的周期。
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
能级组之间能量相差较大,
能级组之内能量相差很小
能级组
能量相近的合并成一组
共七个能级组,也就形成了7个周期 。
ns→(n-2)f→(n-1)d →np
再探元素周期表
(1)元素周期表共有几个周期?每个周期有多少种元素?
为什么第一周期结尾元素的电子排布跟同族的其他周期元素的不同?
(2)元素周期表共有多少列?元素周期表可分为哪些族?
7 个
2,8,8,18,18,32,32
只有一个电子层,能级只有1s能级
18列
Ⅰ~ⅦA族、Ⅰ~ⅦB 和Ⅷ、0族
主族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价电子排布
2.原子核外电子排布与族的关系
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
①主族元素
主族序数=最外层电子数=价层电子数
ns1~2或ns2np1~5
② 0族元素
各族元素价电子的排布特点:
He为1s2,其他为ns2np6
③过渡元素
(以第四周期为例)
族 价层电子排布通式
Ⅰ B
Ⅱ B
Ⅲ B
Ⅳ B
Ⅴ B
Ⅵ B
Ⅶ B
Ⅷ
(n-1)d1ns2
(n-1)d2ns2
(n-1)d3ns2
(n-1)d5ns1
(n-1)d5ns2
(n-1)d6~8ns2
(n-1)d10ns1
(n-1)d10ns2
ⅢB-ⅦB:
价层电子数= 副族序数
第Ⅷ族族序数=该族第1列元素的价层电子数
ⅠB-ⅡB:
副族序数 =
最外层电子数
(n-1)d1~10 ns1~2
钯为4d10除外
【讨论】
(1) 为什么副族元素又称为过渡元素?
从金属元素过渡到非金属元素的中间元素
(2)过渡元素价层电子数跟它们的族序数有什么关系?
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
写出它们的价层电子排布通式。
(n-1)d1~10ns1~2 (除镧系和锕系)
第Ⅷ族有3列元素,其族序数等于该族的第1列元素的价层电子数
3.原子核外电子排布与分区的关系
s区
ns1~2
p区
ns2np1~6
d区
(n-1)d1~9 ns1~2
钯为4d10除外
ds区
(n-1)d10ns1~2
f区 (n-2)f0~14(n-2)d0~2ns2
f区
以最后填入的电子的能级符号作为该区的符号。
He例外
s区
d区
ds区
p区
(1)s区、d区、ds区、 p区分别有几个列?
【讨论】
s区有2列,d区有8列,ds区有2列、 p区有6列。
(2)为什么s区(H除外)、d区、ds区的元素都是金属元素?
最外层电子数为1~2个( 始终不超过2 ),即为ns1-2(Pd例外),容易失去电子(H除外)
(3)处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
(4) Cr和Cu的价层电子排布符合构造原理么?还有哪些不符合?
不符合;Cr的价层电子排布式为3d54s1,Cu的价层电子排布式为3d104s1,不符合构造原理(它们的3d轨道达到半充满或全充满结构,是一种能量较低的稳定结构)
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
Nb、Mo、Ru、Rh、Pd、Ag、Pt、Au、La、Ce、Gd、Ac、Th、Pa、U、Np、Cm等的基态原子电子排布均不符合构造原理
第八周期应有50种元素
2+18+14+10+6=50
8s
→5g
→6f
→7d
→8p
1.原子的电子排布与周期的划分
2.原子的电子排布与族的划分
主族元素:族序数=原子的最外层电子数=价电子数
副族元素:大多数族序数=(n-1)d+ns的电子数=价电子数
3.原子的电子构型和元素的分区
周期序数=能层数
5个区:s区、d区、ds区、p区、f区
1.下列关于原子核外电子排布与元素在周期表中位置关系的叙述中,正确的是( )
A.原子价电子排布为ns2np1~6的元素一定是主族元素
B.基态原子最外电子层的p能级上有5个电子的元素一定是第ⅦA族元素
C.原子的价电子排布为(n-1)d6~8ns2的元素一定位于第ⅢB~ⅦB族
D.基态原子N能层上只有1个电子的元素一定是主族元素
B
2.价层电子构型为3d104s1的元素在周期表中位于( )
A.第五周期第ⅠB族
B.第五周期第ⅡB族
C.第四周期第ⅦB族
D.第四周期第ⅠB族
D
3.已知某元素基态原子的价电子排布为(n-1)dansb(a、b均为大于0的正整数),下列有关说法正确的是( )
A.该元素一定位于元素周期表中的d区
B.该元素一定位于元素周期表中的ds区
C.该元素的族序数为a+b
D.该元素一定为金属元素
D
4.下列各组元素都属于p区的是( )
A.原子序数为1、2、7的元素
B.O、S、P
C.Fe、Ar、Cl
D.Na、Li、Mg
B
5.指出下列元素是主族元素还是副族元素,及其在元素周期表中的位置。
(1)1s22s22p63s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(2)[Kr]4d105s25p2是 族元素,位于周期表中第 周期第 族,属于 区元素。
(3)[Ar]3d14s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(4)[Ar]3d104s1是 族元素,位于周期表中第 周期第 族,
属于 区元素。
主
三
ⅡA
s
主
五
ⅣA
p
副
四
ⅢB
d
副
四
ⅠB
ds
第二节 原子结构与元素的性质
第1课时 原子结构与元素周期表
德米特里·伊万诺维奇·门捷列夫(1834-1907)是俄罗斯伟大的化学家,自然科学基本定律化学元素周期表的创始人。
1869年3月2日,门捷列夫经过苦苦思索,惊喜地发现,当所有的已知元素按相对原子质量递增的顺序排列起来,并且性质相似元素依一定的间隔出现。世界上第一章元素周期表出现了。
1.知道元素周期表中分区、周期和族的元素原子核外电子排布特征。
2.了解元素周期表的应用价值。
1.通过认识原子结构及价层电子排布与元素在周期表中的位置,建立原子核外电子排布规律与周期表中周期、族、分区划分的周期性变化规律的深层关联。(宏观辨识与微观探析)
2.通过对元素周期表发展史的了解,认识科学家对元素周期表经历的探索过程。(科学态度与社会责任)
3.通过对构造原理与元素周期表分区关系的分析,了解元素周期表是微观上原子核外电子排布的宏观表达方式。(宏观辨识与微观探析)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
元素的发现时间轴
联合国教科文组织总干事阿祖莱说:“化学元素周期表不仅仅是对宇宙中所有已知原子进行排序的列表,它本质上是帮助我们更好地了解我们周围世界的一个窗口。”
元素周期律元素的性质随着原子序数递增发生现周期性的重复。
1869年,门捷列夫的第一张元素周期表
原子序数是按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号。
1913年,英国物理学家莫塞莱
原子序数即原子核电荷数
元素周期律元素的性质随元素原子的核电荷数递增发生周期性递变。
一、原子的结构与元素周期表
(一)元素周期律、元素周期系和元素周期表
1.元素周期律
(1)定义:元素的性质随原子的核电荷数递增发生周期性递变,这一规律叫做元素周期律
(2)实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
2.元素周期系
定义:元素按其原子核电荷数递增排列的序列称为元素周期系。
这个序列中的元素性质随着核电荷数的递增发生周期性的重复。
3.元素周期表
(1)含义:元素周期表是呈现元素周期系的表格。
(2)元素周期系与元素周期表的关系:
(3)元素周期系只有一个,元素周期表多种多样。第一张元素周期表是由门捷列夫制作的。
门捷列夫周期表
短式周期表
三张有重要历史意义的周期表
特征:从第四周期开始每个周期结成两段。
族分I~VIII和0族
维尔纳的特长式周期表
… … …
H … He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
Rb Sr Y Zr Nb Mo … Ru Rh Pd Ag Cd In Sn Sb Te I Xe
Cs Ba La Ce Nd Pr … … Sm Eu Gd Tb Ho Er Tm Yb … … Ta W … Os Ir Pt Au Hg Tl Pb Bi … … …
… Ra Laα Th … … … … … U … … … … Ac … … … … … … … … … … … … Pbα Biα Teα … …
1905年,配位化学鼻祖维尔纳制做了一张周期表称为特长式周期表,每个周期一行,各族元素、过渡元素、稀有气体、镧系和锕系,各有各的位置,同族元素上下对齐,维尔纳的周期表与现在的周期表相似,但也有差异。比如没有确定镧系和锕系的元素种类,Be、Mg的位置与现今周期表不同。
三张有重要历史意义的周期表
波尔元素周期表
1922年,玻尔也绘制了一张元素周期表,玻尔已经开始用原子结构来解释元素周期系
三张有重要历史意义的周期表
形形色色的元素周期表
思考
1.如何从原子结构角度解释周期元素种数?
周期 序数 价层电子 填入的能级 电子数 元素
种数
1
2
3
4
5
6
7
1s
2s→2p
3s → 3p
4s → 3d → 4p
5s → 4d → 5p
6s → 4f → 5d → 6p
7s → 5f → 6d → 7p
2
8
8
18
18
32
32
2
8
8
18
18
32
32
每周期的元素种数
=
除第一周期外,以ns开始、np结束递增的核电荷数(或电子数)
(二)构造原理与元素周期表
周期序数=基态原子的能层数
周期 IA 族元素 0族元素 原子序数 电子排布式 原子序数 电子排布式
一
二
三
四
五
六
1
3
11
19
37
55
1s1
[He] 2s1
[Ne] 3s1
[Ar] 4s1
[Kr]5s1
[Xe]6s1
2
10
18
36
54
86
1s2
1s2 2s2 2p6
1s2 2s2 2p6 3s2 3p6
1s2 2s2 2p6 3s2 3p63d104s24p6
1s2 2s2 2p6 3s2 3p63d104s24p6 4d105s25p6
1s2 2s2 2p6 3s2 3p63d104s24p6 4d105s25p64f145d106s26p6
随着元素原子核电荷数递增,每到出现碱金属,就开始建立一个新的周期,并开始新的能层,随后最外层上的电子数逐渐增多,最后达到8个电子,以稀有气体结束,形成一个完整的周期。
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
能级组之间能量相差较大,
能级组之内能量相差很小
能级组
能量相近的合并成一组
共七个能级组,也就形成了7个周期 。
ns→(n-2)f→(n-1)d →np
再探元素周期表
(1)元素周期表共有几个周期?每个周期有多少种元素?
为什么第一周期结尾元素的电子排布跟同族的其他周期元素的不同?
(2)元素周期表共有多少列?元素周期表可分为哪些族?
7 个
2,8,8,18,18,32,32
只有一个电子层,能级只有1s能级
18列
Ⅰ~ⅦA族、Ⅰ~ⅦB 和Ⅷ、0族
主族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价电子排布
2.原子核外电子排布与族的关系
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
①主族元素
主族序数=最外层电子数=价层电子数
ns1~2或ns2np1~5
② 0族元素
各族元素价电子的排布特点:
He为1s2,其他为ns2np6
③过渡元素
(以第四周期为例)
族 价层电子排布通式
Ⅰ B
Ⅱ B
Ⅲ B
Ⅳ B
Ⅴ B
Ⅵ B
Ⅶ B
Ⅷ
(n-1)d1ns2
(n-1)d2ns2
(n-1)d3ns2
(n-1)d5ns1
(n-1)d5ns2
(n-1)d6~8ns2
(n-1)d10ns1
(n-1)d10ns2
ⅢB-ⅦB:
价层电子数= 副族序数
第Ⅷ族族序数=该族第1列元素的价层电子数
ⅠB-ⅡB:
副族序数 =
最外层电子数
(n-1)d1~10 ns1~2
钯为4d10除外
【讨论】
(1) 为什么副族元素又称为过渡元素?
从金属元素过渡到非金属元素的中间元素
(2)过渡元素价层电子数跟它们的族序数有什么关系?
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
写出它们的价层电子排布通式。
(n-1)d1~10ns1~2 (除镧系和锕系)
第Ⅷ族有3列元素,其族序数等于该族的第1列元素的价层电子数
3.原子核外电子排布与分区的关系
s区
ns1~2
p区
ns2np1~6
d区
(n-1)d1~9 ns1~2
钯为4d10除外
ds区
(n-1)d10ns1~2
f区 (n-2)f0~14(n-2)d0~2ns2
f区
以最后填入的电子的能级符号作为该区的符号。
He例外
s区
d区
ds区
p区
(1)s区、d区、ds区、 p区分别有几个列?
【讨论】
s区有2列,d区有8列,ds区有2列、 p区有6列。
(2)为什么s区(H除外)、d区、ds区的元素都是金属元素?
最外层电子数为1~2个( 始终不超过2 ),即为ns1-2(Pd例外),容易失去电子(H除外)
(3)处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
(4) Cr和Cu的价层电子排布符合构造原理么?还有哪些不符合?
不符合;Cr的价层电子排布式为3d54s1,Cu的价层电子排布式为3d104s1,不符合构造原理(它们的3d轨道达到半充满或全充满结构,是一种能量较低的稳定结构)
(5) 预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
Nb、Mo、Ru、Rh、Pd、Ag、Pt、Au、La、Ce、Gd、Ac、Th、Pa、U、Np、Cm等的基态原子电子排布均不符合构造原理
第八周期应有50种元素
2+18+14+10+6=50
8s
→5g
→6f
→7d
→8p
1.原子的电子排布与周期的划分
2.原子的电子排布与族的划分
主族元素:族序数=原子的最外层电子数=价电子数
副族元素:大多数族序数=(n-1)d+ns的电子数=价电子数
3.原子的电子构型和元素的分区
周期序数=能层数
5个区:s区、d区、ds区、p区、f区
1.下列关于原子核外电子排布与元素在周期表中位置关系的叙述中,正确的是( )
A.原子价电子排布为ns2np1~6的元素一定是主族元素
B.基态原子最外电子层的p能级上有5个电子的元素一定是第ⅦA族元素
C.原子的价电子排布为(n-1)d6~8ns2的元素一定位于第ⅢB~ⅦB族
D.基态原子N能层上只有1个电子的元素一定是主族元素
B
2.价层电子构型为3d104s1的元素在周期表中位于( )
A.第五周期第ⅠB族
B.第五周期第ⅡB族
C.第四周期第ⅦB族
D.第四周期第ⅠB族
D
3.已知某元素基态原子的价电子排布为(n-1)dansb(a、b均为大于0的正整数),下列有关说法正确的是( )
A.该元素一定位于元素周期表中的d区
B.该元素一定位于元素周期表中的ds区
C.该元素的族序数为a+b
D.该元素一定为金属元素
D
4.下列各组元素都属于p区的是( )
A.原子序数为1、2、7的元素
B.O、S、P
C.Fe、Ar、Cl
D.Na、Li、Mg
B
5.指出下列元素是主族元素还是副族元素,及其在元素周期表中的位置。
(1)1s22s22p63s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(2)[Kr]4d105s25p2是 族元素,位于周期表中第 周期第 族,属于 区元素。
(3)[Ar]3d14s2是 族元素,位于周期表中第 周期第 族,
属于 区元素。
(4)[Ar]3d104s1是 族元素,位于周期表中第 周期第 族,
属于 区元素。
主
三
ⅡA
s
主
五
ⅣA
p
副
四
ⅢB
d
副
四
ⅠB
ds
