2.2.1分子结构的测定 多样的分子结构 价层电子对互斥模型课件 (共38张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.1分子结构的测定 多样的分子结构 价层电子对互斥模型课件 (共38张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 00:38:16 | ||
图片预览






文档简介
(共38张PPT)
第二节 分子的空间结构
第1课时 分子结构的测定 多样的分子 空间结构 价层电子对互斥理论
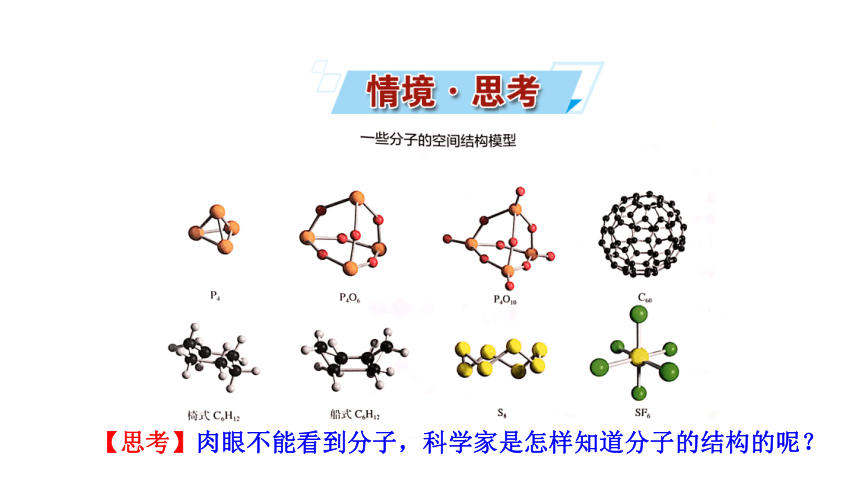
【思考】肉眼不能看到分子,科学家是怎样知道分子的结构的呢?
1.结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测。
2.知道分子的结构可以通过波谱等技术进行测定。
1.通过认识分子结构,能够辨识分子结构的多样性及复杂性。(宏观辨识与微观探析)
2.结合价层电子对互斥理论与分子的空间结构,能够论证证据与模型的建立及其发展之间的关系。(证据推理与模型认知)
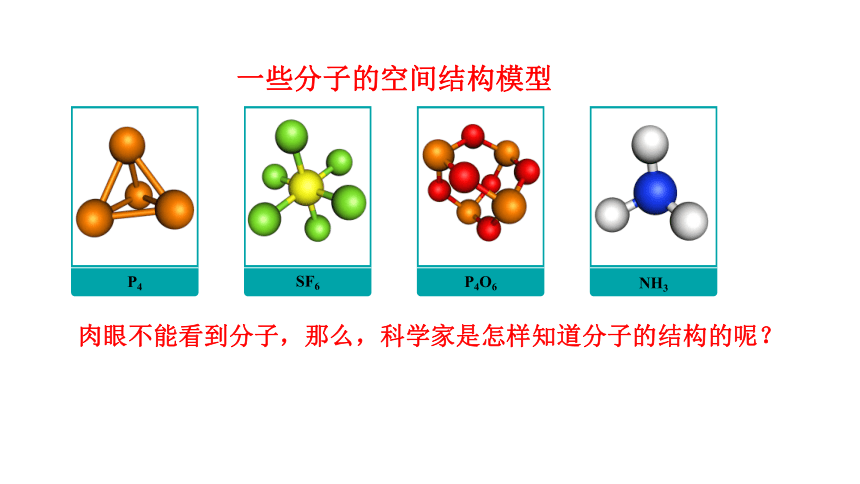
P4O6
SF6
NH3
P4
肉眼不能看到分子,那么,科学家是怎样知道分子的结构的呢?
一些分子的空间结构模型
早年的科学家主要靠对物质的化学性质进行系统总结得出规律
分子结构
推测
如今,科学家应用了许多测定分子结构的现代仪器和方法,如
红外光谱、质谱法、晶体X射线衍射(下一章讲)等
测定
一、分子结构的测定
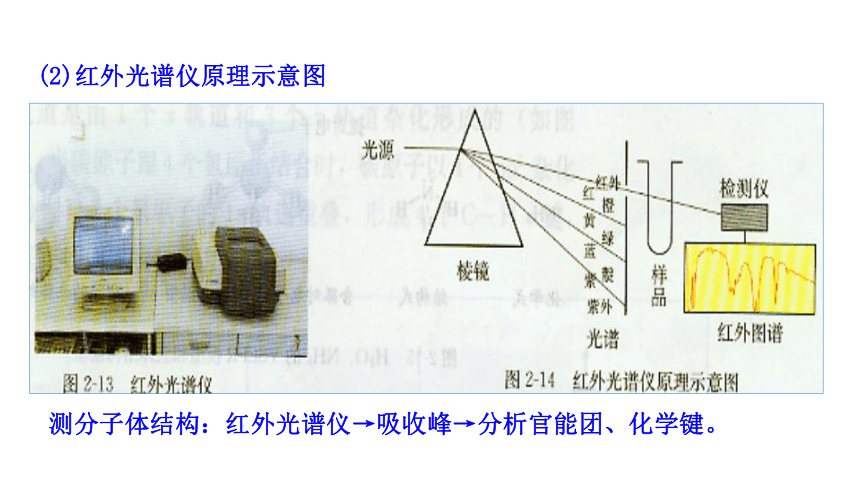
(1)原理:红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到谱图上呈现吸收峰。通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
1.红外光谱法
红外光谱仪
测分子体结构:红外光谱仪→吸收峰→分析官能团、化学键。
(2)红外光谱仪原理示意图
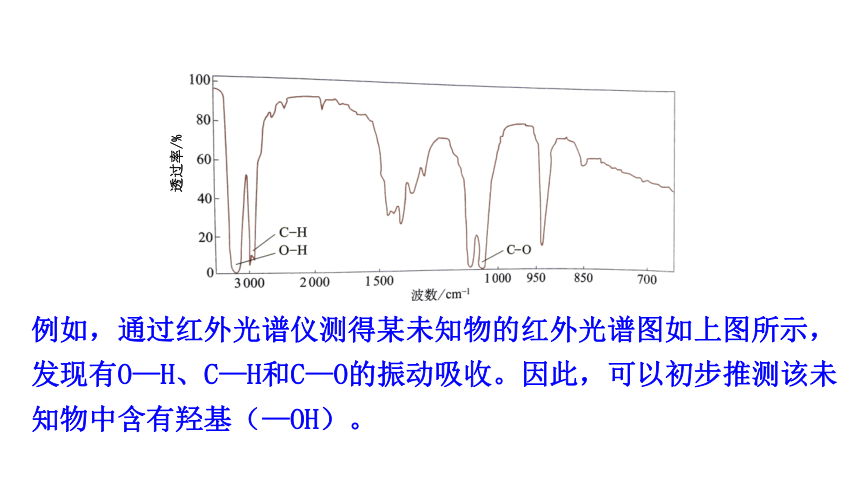
例如,通过红外光谱仪测得某未知物的红外光谱图如上图所示,发现有O—H、C—H和C—O的振动吸收。因此,可以初步推测该未知物中含有羟基(—OH)。
透过率/%
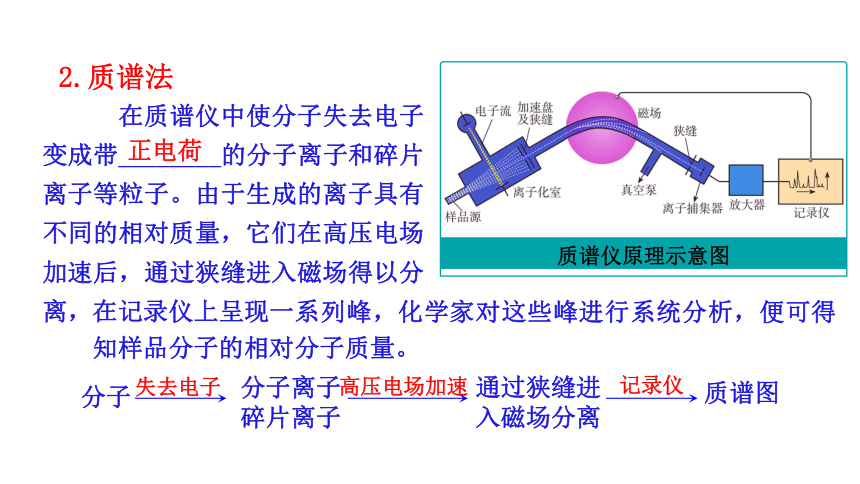
在质谱仪中使分子失去电子变成带________的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系
质谱仪原理示意图
列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。
正电荷
分子
分子离子
碎片离子
失去电子
高压电场加速
通过狭缝进
入磁场分离
记录仪
质谱图
2.质谱法
30
40
50
60
100
70
80
110
90
65
91
92
相对丰度/%
质荷比( )
m
z
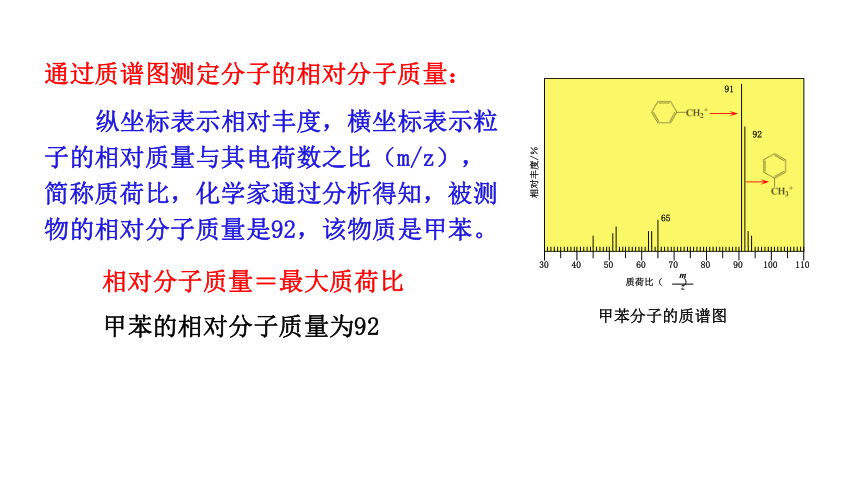
甲苯分子的质谱图
纵坐标表示相对丰度,横坐标表示粒子的相对质量与其电荷数之比(m/z),简称质荷比,化学家通过分析得知,被测物的相对分子质量是92,该物质是甲苯。
通过质谱图测定分子的相对分子质量:
相对分子质量=最大质荷比
甲苯的相对分子质量为92
在多原子构成的分子中,由于原子间排列的空间顺序不一样,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。这就是所谓的分子的立体构型。
二、多样的分子空间结构
1.双原子分子(直线形)
O2
HCl
直线形180°
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型 CO2
H2O
O
:
:
:
C
O
:
:
:
:
:
H
:
O
H
:
:
:
O=C=O
180°
直线形
V形
105°
2.三原子(AB2型)分子的空间结构——直线形和V形
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型 CH2O
NH3
H
:
C
O
:
:
:
:
:
H
H
:
N
H
:
:
:
H
120°
107°
平面三角形
三角锥形
3.四原子(AB3型)分子的空间结构——平面三角形和三角锥形
四原子分子其他空间结构(直线形、正四面体形)
(平面三角形,三角锥形)
C2H2 180°
P4 60°正四面体形
BF3
平面正三角形 120°
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型 CH4
109°28'
正四面体形
H
:
C
H
:
:
:
H
H
4.五原子(AB4型)分子的空间结构——正四面体形
P4O6
SF6
P4
P4O10
C60
S8
椅式C6H12
船式C6H12
5.其他多原子分子
同为三原子分子,CO2 和 H2O 分子的空间结构却不同
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
【思考与讨论】
三、价层电子对互斥理论
分子的立体构型是“价层电子对”相互排斥的结果。
----又称“VSEPR模型”可用来预测分子的立体结构
1、中心原子:对ABn型分子,B围绕A成键,则A 为中心原子。n值为中心原子结合的原子数
2、价层电子对:分子中的中心原子A上的电子对
(1)σ键电子对:中心原子A上形成σ键的电子对--- σ键电子对数 = 中心原子结合的原子数n
(2)中心原子上的孤电子对:未用于形成共价键的中心原子A上的电子对
价层电子对数 = σ键电子对数 + 中心原子上的孤电子对数
如何确定中心原子上的孤电子对数?
【方法1】:写出分子的电子式,可快速确定
O C O
::
::
:
:
:
:
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
H2O
CO2
NH3
CH4
2
0
1
0
【方法2】:用公式计算
中心原子上的孤电子对数=
(a - xb)
2
a----中心原子的价电子数
x----与中心原子结合的原子数
b----与中心原子结合的原子最多能接受的电子数
(H为1,其它原子等于“8 – 该原子的价电子数”)
【例】:SO2 a = 6
x = 2
b = 2
孤电子对数=1
【注意】:用公式计算时,阴、阳离子a不同
中心原子上的孤电子对数=
(a - xb)
2
阳离子 a = 中心原子的价电子数 – 离子的电荷数
阴离子 a = 中心原子的价电子数 + 离子的电荷数
分子或离子 中心原子 a x b 中心原子上的
孤电子对数
SO2 S 6 2 2 1
NH4+ N 5-1=4 4 1 0
CO32- C 4+2=6 3 2 0
计算价层电子对数=中心原子的σ键电子对数+孤电子对数
代表物 电子式 中心原子结合的原子数 σ键 电子对数 孤电子数 价层电子对数
H2O
NH3
CO2
CH4
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O C O
::
::
:
:
:
:
2
3
4
2
2
2
4
3
1
4
4
0
4
2
0
2
价层电子对(σ键电子对和未成键的孤电子对)
由于斥力作用,若有两对价层电子,则夹角180°;若有三对价层电子,夹角120°;若有四对价层电子,夹角109°。
一个分子或离子中的价层电子对在空间的分布
3.确定价层电子对互斥模型(VSEPR模型)
直线形
价层电子对数目:
平面三角形
四面体形
三角双锥形
八面体形
VSEPR模型
4.VSEPR模型的应用——预测分子或离子空间结构
(1)基本思路:ABn型分子
无孤对电子:
有孤对电子:
价层电子对数
→
VSEPR
模型
VSEPR模型即分子空间结构
略去孤对电子,剩下是分子或离子空间结构
分子或 离子 价层电子对数 VSEPR模型及名称 分子或离子
空间结构及名称
CO2
CH4
(2)具体实例
①中心原子不含孤电子对
2 直线形 直线形
3 平面三角形 平面三角形
4 正四面体形 正四面体形
②中心原子含孤电子对
分子或 离子 价层电子对数 孤电子对数 VSEPR模型 及名称 分子或离子的
空间结构及名称
NH3
H2O
H3O+
SO2
4 1 四面体形 三角锥形
4 2 四面体形 V形
4 1 四面体形 三角锥形
3 1 平面三角形 V形
A的价层电子对数 δ键电子对数 孤对电子对数 VSEPR 模型名称 分子的空间结构
2 2 0
3 3 0
2 1
BeCl2 CO2
(直线形)
BF3 BCl3
(平面三角形)
SnBr2 PbCl2
(V形)
直线形
平面三角形
平面三角形
【小结】分子空间结构的确定
A的价层电子对数 δ成键电子对数 孤对电子对数 VSEPR模型名称 分子的空间结构
4 4 0
3 1
2 2
CH4 CCl4
(正四面体)
NH3 PH3
(三角锥)
H2O H2S
(V形)
正四面体
正四面体
正四面体
A的价层电子对数 δ成键电 子对数 孤对电子对数 VSEPR模型名称 分子空间结构
5 5 0
6 6 0
4 2
三角双锥
(PCl5)
正八面体
( SF6)
平面正方形
( XeF4)
八
面
体
思考:【2021年全国乙卷】H2O的键角小于CH4 、NH3的,分析原因。
CH4
H2O
NH3
提示:CH4、H2O、NH3的价层电子对均为4,VSEPR模型均为四面体形,但由于孤电子对有较大的斥力,孤电子对越多,与成键电子对之间的排斥力越大,键角越小。
(1)由于孤电子对有较大斥力,含孤电子对的分子的实测键角几乎都小于VSEPR模型的预测值。
(3)价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子。
(2)价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。随着孤电子对数目的增多,成键电子对与成键电子对之间的斥力减小,键角也减小。
【特别提醒】
价层电子对数
价层电子对
互斥理论
VSEPR模型
略去孤电子对
分子的空间结构
σ键电子对
中心原子上的
孤电子对数目
2.价层电子对互斥理论
1.分子结构的测定
红外光谱——化学键或官能团
质谱——相对分子质量
1.下列分子结构与分子中共价键键角对应错误的是( )
A.直线形分子:180°
B.平面正三角形:120°
C.三角锥形:109°28′
D.正四面体形:109°28′
C
2.下列有关价层电子对互斥理论的描述正确的是( )
A.价层电子对就是σ键电子对
B.孤电子对数由分子式来确定
C.分子的空间结构是价层电子对互斥的结果
D.孤电子对数等于π键数
C
4.下列分子或离子的中心原子上未用于成键的价电子对最多的是( )
A.H2O B.HCl C.NH4+ D.PCl3
3.下列分子中,空间结构不是直线形的是( )
A.CO B.H2O C.CO2 D.C2H2
B
A
5.运用价层电子对互斥理论推测下列分子或离子的空间结构。
(1)BeCl2 ; (2)SCl2 ;
(3)SO32- ; (4)PF3 ;
直线形
V形
三角锥形
三角锥形
(5)H2Se ; (6)BBr3 ;
(7)CHCl3 ; (8)SiF4 。
V形
平面三角形
四面体形
正四面体形
第二节 分子的空间结构
第1课时 分子结构的测定 多样的分子 空间结构 价层电子对互斥理论
【思考】肉眼不能看到分子,科学家是怎样知道分子的结构的呢?
1.结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测。
2.知道分子的结构可以通过波谱等技术进行测定。
1.通过认识分子结构,能够辨识分子结构的多样性及复杂性。(宏观辨识与微观探析)
2.结合价层电子对互斥理论与分子的空间结构,能够论证证据与模型的建立及其发展之间的关系。(证据推理与模型认知)
P4O6
SF6
NH3
P4
肉眼不能看到分子,那么,科学家是怎样知道分子的结构的呢?
一些分子的空间结构模型
早年的科学家主要靠对物质的化学性质进行系统总结得出规律
分子结构
推测
如今,科学家应用了许多测定分子结构的现代仪器和方法,如
红外光谱、质谱法、晶体X射线衍射(下一章讲)等
测定
一、分子结构的测定
(1)原理:红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到谱图上呈现吸收峰。通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
1.红外光谱法
红外光谱仪
测分子体结构:红外光谱仪→吸收峰→分析官能团、化学键。
(2)红外光谱仪原理示意图
例如,通过红外光谱仪测得某未知物的红外光谱图如上图所示,发现有O—H、C—H和C—O的振动吸收。因此,可以初步推测该未知物中含有羟基(—OH)。
透过率/%
在质谱仪中使分子失去电子变成带________的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系
质谱仪原理示意图
列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。
正电荷
分子
分子离子
碎片离子
失去电子
高压电场加速
通过狭缝进
入磁场分离
记录仪
质谱图
2.质谱法
30
40
50
60
100
70
80
110
90
65
91
92
相对丰度/%
质荷比( )
m
z
甲苯分子的质谱图
纵坐标表示相对丰度,横坐标表示粒子的相对质量与其电荷数之比(m/z),简称质荷比,化学家通过分析得知,被测物的相对分子质量是92,该物质是甲苯。
通过质谱图测定分子的相对分子质量:
相对分子质量=最大质荷比
甲苯的相对分子质量为92
在多原子构成的分子中,由于原子间排列的空间顺序不一样,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。这就是所谓的分子的立体构型。
二、多样的分子空间结构
1.双原子分子(直线形)
O2
HCl
直线形180°
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型 CO2
H2O
O
:
:
:
C
O
:
:
:
:
:
H
:
O
H
:
:
:
O=C=O
180°
直线形
V形
105°
2.三原子(AB2型)分子的空间结构——直线形和V形
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型 CH2O
NH3
H
:
C
O
:
:
:
:
:
H
H
:
N
H
:
:
:
H
120°
107°
平面三角形
三角锥形
3.四原子(AB3型)分子的空间结构——平面三角形和三角锥形
四原子分子其他空间结构(直线形、正四面体形)
(平面三角形,三角锥形)
C2H2 180°
P4 60°正四面体形
BF3
平面正三角形 120°
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间填充模型 球棍模型 CH4
109°28'
正四面体形
H
:
C
H
:
:
:
H
H
4.五原子(AB4型)分子的空间结构——正四面体形
P4O6
SF6
P4
P4O10
C60
S8
椅式C6H12
船式C6H12
5.其他多原子分子
同为三原子分子,CO2 和 H2O 分子的空间结构却不同
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
【思考与讨论】
三、价层电子对互斥理论
分子的立体构型是“价层电子对”相互排斥的结果。
----又称“VSEPR模型”可用来预测分子的立体结构
1、中心原子:对ABn型分子,B围绕A成键,则A 为中心原子。n值为中心原子结合的原子数
2、价层电子对:分子中的中心原子A上的电子对
(1)σ键电子对:中心原子A上形成σ键的电子对--- σ键电子对数 = 中心原子结合的原子数n
(2)中心原子上的孤电子对:未用于形成共价键的中心原子A上的电子对
价层电子对数 = σ键电子对数 + 中心原子上的孤电子对数
如何确定中心原子上的孤电子对数?
【方法1】:写出分子的电子式,可快速确定
O C O
::
::
:
:
:
:
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
H2O
CO2
NH3
CH4
2
0
1
0
【方法2】:用公式计算
中心原子上的孤电子对数=
(a - xb)
2
a----中心原子的价电子数
x----与中心原子结合的原子数
b----与中心原子结合的原子最多能接受的电子数
(H为1,其它原子等于“8 – 该原子的价电子数”)
【例】:SO2 a = 6
x = 2
b = 2
孤电子对数=1
【注意】:用公式计算时,阴、阳离子a不同
中心原子上的孤电子对数=
(a - xb)
2
阳离子 a = 中心原子的价电子数 – 离子的电荷数
阴离子 a = 中心原子的价电子数 + 离子的电荷数
分子或离子 中心原子 a x b 中心原子上的
孤电子对数
SO2 S 6 2 2 1
NH4+ N 5-1=4 4 1 0
CO32- C 4+2=6 3 2 0
计算价层电子对数=中心原子的σ键电子对数+孤电子对数
代表物 电子式 中心原子结合的原子数 σ键 电子对数 孤电子数 价层电子对数
H2O
NH3
CO2
CH4
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O C O
::
::
:
:
:
:
2
3
4
2
2
2
4
3
1
4
4
0
4
2
0
2
价层电子对(σ键电子对和未成键的孤电子对)
由于斥力作用,若有两对价层电子,则夹角180°;若有三对价层电子,夹角120°;若有四对价层电子,夹角109°。
一个分子或离子中的价层电子对在空间的分布
3.确定价层电子对互斥模型(VSEPR模型)
直线形
价层电子对数目:
平面三角形
四面体形
三角双锥形
八面体形
VSEPR模型
4.VSEPR模型的应用——预测分子或离子空间结构
(1)基本思路:ABn型分子
无孤对电子:
有孤对电子:
价层电子对数
→
VSEPR
模型
VSEPR模型即分子空间结构
略去孤对电子,剩下是分子或离子空间结构
分子或 离子 价层电子对数 VSEPR模型及名称 分子或离子
空间结构及名称
CO2
CH4
(2)具体实例
①中心原子不含孤电子对
2 直线形 直线形
3 平面三角形 平面三角形
4 正四面体形 正四面体形
②中心原子含孤电子对
分子或 离子 价层电子对数 孤电子对数 VSEPR模型 及名称 分子或离子的
空间结构及名称
NH3
H2O
H3O+
SO2
4 1 四面体形 三角锥形
4 2 四面体形 V形
4 1 四面体形 三角锥形
3 1 平面三角形 V形
A的价层电子对数 δ键电子对数 孤对电子对数 VSEPR 模型名称 分子的空间结构
2 2 0
3 3 0
2 1
BeCl2 CO2
(直线形)
BF3 BCl3
(平面三角形)
SnBr2 PbCl2
(V形)
直线形
平面三角形
平面三角形
【小结】分子空间结构的确定
A的价层电子对数 δ成键电子对数 孤对电子对数 VSEPR模型名称 分子的空间结构
4 4 0
3 1
2 2
CH4 CCl4
(正四面体)
NH3 PH3
(三角锥)
H2O H2S
(V形)
正四面体
正四面体
正四面体
A的价层电子对数 δ成键电 子对数 孤对电子对数 VSEPR模型名称 分子空间结构
5 5 0
6 6 0
4 2
三角双锥
(PCl5)
正八面体
( SF6)
平面正方形
( XeF4)
八
面
体
思考:【2021年全国乙卷】H2O的键角小于CH4 、NH3的,分析原因。
CH4
H2O
NH3
提示:CH4、H2O、NH3的价层电子对均为4,VSEPR模型均为四面体形,但由于孤电子对有较大的斥力,孤电子对越多,与成键电子对之间的排斥力越大,键角越小。
(1)由于孤电子对有较大斥力,含孤电子对的分子的实测键角几乎都小于VSEPR模型的预测值。
(3)价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子。
(2)价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。随着孤电子对数目的增多,成键电子对与成键电子对之间的斥力减小,键角也减小。
【特别提醒】
价层电子对数
价层电子对
互斥理论
VSEPR模型
略去孤电子对
分子的空间结构
σ键电子对
中心原子上的
孤电子对数目
2.价层电子对互斥理论
1.分子结构的测定
红外光谱——化学键或官能团
质谱——相对分子质量
1.下列分子结构与分子中共价键键角对应错误的是( )
A.直线形分子:180°
B.平面正三角形:120°
C.三角锥形:109°28′
D.正四面体形:109°28′
C
2.下列有关价层电子对互斥理论的描述正确的是( )
A.价层电子对就是σ键电子对
B.孤电子对数由分子式来确定
C.分子的空间结构是价层电子对互斥的结果
D.孤电子对数等于π键数
C
4.下列分子或离子的中心原子上未用于成键的价电子对最多的是( )
A.H2O B.HCl C.NH4+ D.PCl3
3.下列分子中,空间结构不是直线形的是( )
A.CO B.H2O C.CO2 D.C2H2
B
A
5.运用价层电子对互斥理论推测下列分子或离子的空间结构。
(1)BeCl2 ; (2)SCl2 ;
(3)SO32- ; (4)PF3 ;
直线形
V形
三角锥形
三角锥形
(5)H2Se ; (6)BBr3 ;
(7)CHCl3 ; (8)SiF4 。
V形
平面三角形
四面体形
正四面体形
