3.2.2共价晶体 课件 (共24张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.2共价晶体 课件 (共24张PPT) 2024-2025学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 00:49:38 | ||
图片预览





文档简介
(共24张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第2课时 共价晶体
金刚石俗称"金刚钻"。也就是我们常说的钻石的原身,它是一种由碳元素组成的矿物,是自然界由单质元素组成的粒子物质,是碳同素异形体
(金刚石,石墨烯,富勒烯,碳纳米管,蓝丝黛尔石等)。金刚石的用途非常广泛,例如:工艺品和工业中的切割工具。
石墨可以在高温、高压下形成人造金刚石, 也是贵重宝石。中国也拥有制造金刚石的技术。需要注意,石墨与金刚石物理性质完全不同。
【思考】金刚石与石墨是相同的晶体吗?
掌握共价晶体的概念,能够区分共价晶体和分子晶体。
了解金刚石等典型共价晶体的结构特征,能描述金刚石、二氧化硅等共价晶体的结构与性质的关系。
1. 运用“结构决定性质、性质反映结构”的化学观,从微观角度分析比较分子晶体、共价晶体的本质区别及性质上的差异。(宏观辨识与微观探析)
2. 通过建立模型解决分子晶体、共价晶体的相关问题。(证据推理与模型认知)
通过金刚石晶体的结构认识晶体内粒子和粒子间的作用力是什么?
组成的粒子:_______
粒子间的作用力: _______
金刚石的多面体外形
晶体结构
晶胞示意图
晶胞示意图
原子
共价键
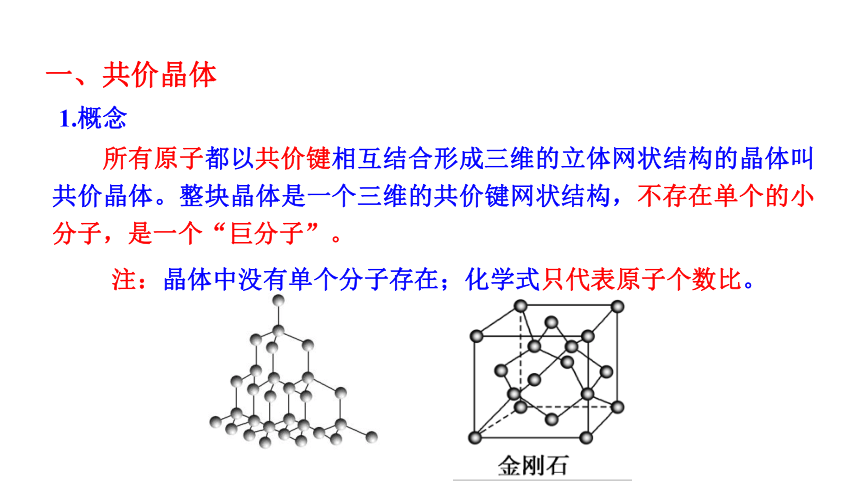
所有原子都以共价键相互结合形成三维的立体网状结构的晶体叫共价晶体。整块晶体是一个三维的共价键网状结构,不存在单个的小分子,是一个“巨分子”。
1.概念
一、共价晶体
注:晶体中没有单个分子存在;化学式只代表原子个数比。
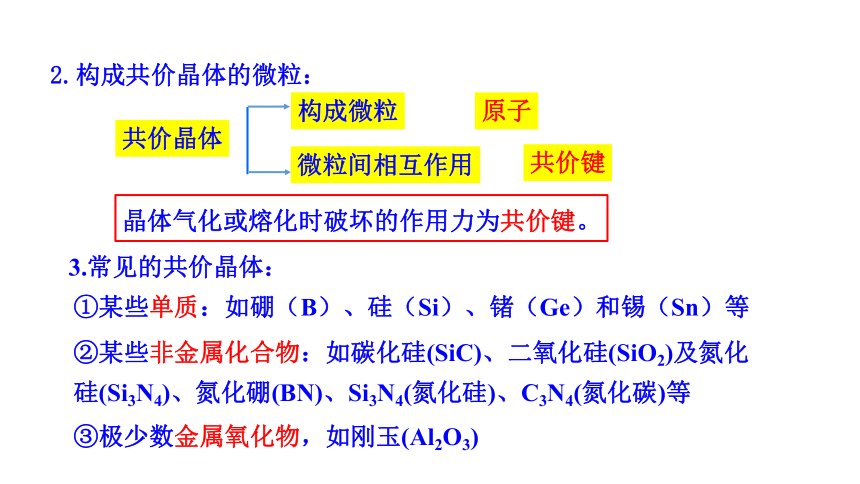
2.构成共价晶体的微粒:
3.常见的共价晶体:
①某些单质:如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等
②某些非金属化合物:如碳化硅(SiC)、二氧化硅(SiO2)及氮化
硅(Si3N4)、氮化硼(BN)、Si3N4(氮化硅)、C3N4(氮化碳)等
③极少数金属氧化物,如刚玉(Al2O3)
共价晶体
构成微粒
微粒间相互作用
原子
共价键
晶体气化或熔化时破坏的作用力为共价键。
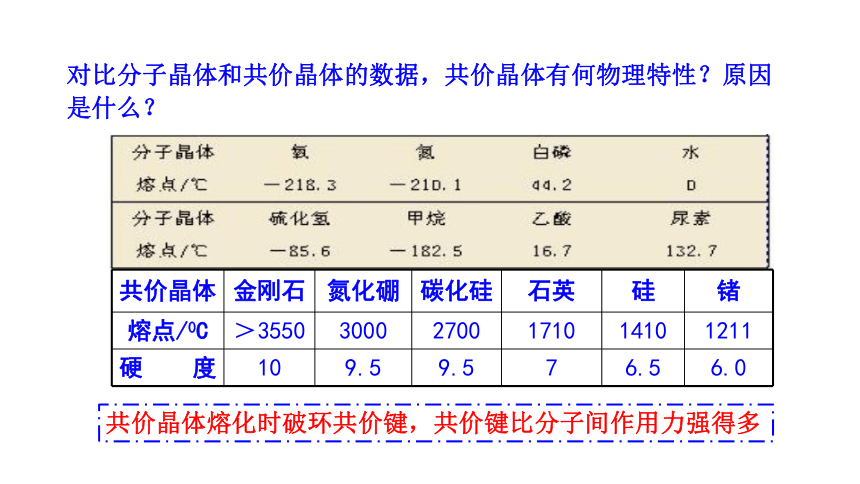
对比分子晶体和共价晶体的数据,共价晶体有何物理特性?原因是什么?
共价晶体熔化时破环共价键,共价键比分子间作用力强得多
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/0C >3550 3000 2700 1710 1410 1211
硬 度 10 9.5 9.5 7 6.5 6.0
4.共价晶体的物理性质:
①熔点很高
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。
②硬度很大
③一般不导电,但晶体硅是半导体
④难溶于一般溶剂
二、典型共价晶体
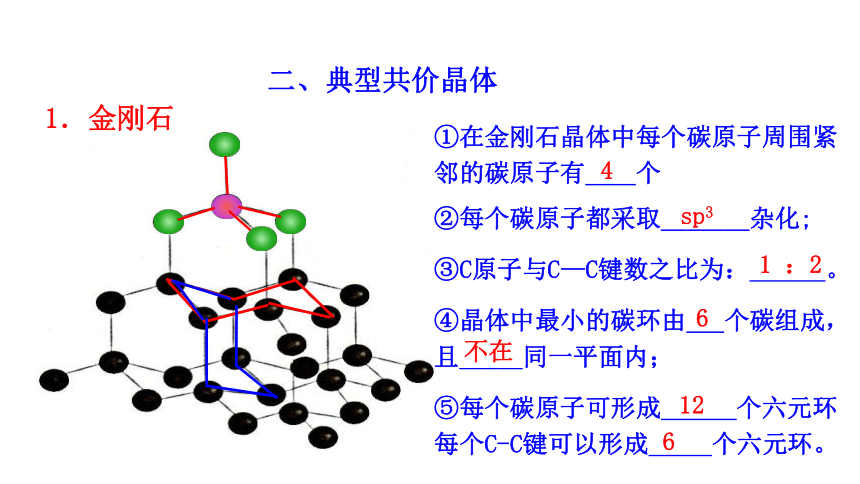
1.金刚石
①在金刚石晶体中每个碳原子周围紧邻的碳原子有 个
②每个碳原子都采取_______杂化;
③C原子与C—C键数之比为: 。
④晶体中最小的碳环由___个碳组成,且_____同一平面内;
⑤每个碳原子可形成 个六元环 每个C-C键可以形成 个六元环。
4
sp3
1 :2
6
不在
12
6
⑥金刚石晶胞中C原子配位数为___
4
⑦金刚石晶胞中含有的C原子数为___
8
⑧12g 金刚石含有_____个C原子,含有_____ 个C-C键
NA
2NA
配位数:一个C原子周围最邻近的C原子数
用Si代替C原子形成的是什么晶体?
预测硅的熔点和金刚石的熔点,哪个高?
金刚石和硅的结构相似,Si-Si键键长大于C-C键的,因此对应的键能较小,熔点较低;
2.二氧化硅晶体
每两个硅原子之间增加一个氧原子,即形成SiO2的晶体结构。
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α -SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
石英的左、右型晶体
石英晶体中的硅氧四面体相连构成的螺旋链
180
109 28
Si
O
共价键
二氧化硅晶体结构示意图
SiO2的结构特征:
① 在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 .
②在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
4
2
1:2
4
2
⑤60g 二氧化硅含有_____个Si原子
含有_____个O原子
含有_____ 个Si-O键
NA
2NA
4NA
③ 在SiO2 晶体中,最小环为 元环。
④每个环中平均含有硅原子
每个环中平均含有Si-O键
硅原子个数与Si-O 共价键个数之是 ;
氧原子个数与Si-O 共价键个数之比是 。
12
=6×1/12=1/2
=12×1/6=2
1:4
1:2
单晶硅
硅太阳能电池
硅制作的芯片
二氧化硅-光导纤维
晶体SiO2的多种重要用途:
制造: 水泥、玻璃、人造宝石、单晶硅、硅光电池、芯片、 光导纤维
1.金刚石、二氧化硅的比较:
金刚石 二氧化硅
晶体形状
晶体中的键或作用力
由最少原子形成环的形状与个数
中心原子成键数
每个环上键的平均数
正四面体空间网状
共价键
共价键
6个原子不共面
12个原子不共面
4
4
6×1/6=1
12×1/6=2
正四面体空间网状
【小结】
2.分子晶体与共价晶体的比较
晶体类型 共价晶体 分子晶体
概 念
组成微粒
作用力
熔沸点
硬 度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
用Si代替部分C原子形成的是什么晶体?
碳化硅又称金钢砂或耐火砂,英文名 Silicon Carbide,化学式 SiC。 纯碳化硅是无色透明的晶体。
共价晶体间比较熔沸点高低的方法:
键长越短,键能越大,对应共价晶体的熔沸点、硬度越大。
【练习】晶体硅、碳化硅(SiC )的结构与金刚石相似,比较这三种共价晶体的熔沸点高低?
金刚石 > SiC > 晶体硅
结构相似的共价晶体,原子半径越小,键长越短,共价键越强,键能越大,晶体的熔、沸点越高。
结构
性质
应用
共价晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
典 型 晶 体
结 构 特 征
1. 关于SiO2晶体的叙述中,正确的是( )
A. 通常状况下,60 g SiO2晶体中含有的分子数为NA
B. 60 g SiO2晶体中,含有2NA个Si—O键
C. 晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D. SiO2晶体中含有1个硅原子和2个氧原子
C
2、下列各组物质的晶体中,化学键的类型相同,晶体的类型也相同的是( )
A. SO2和SiO2 B. CO2和H2O
C. BN和HCl D. CCl4和KCl
B
3、下列物质的晶体直接由原子构成的一组是( )①CO2 ②SiO2 ③晶体Si ④白磷 ⑤氨基乙酸 ⑥Fe ⑦Na2O ⑧固态He
A. ①②③④⑤⑥⑦⑧ B. ②③④⑥⑧
C. ②③⑧ D. ①②⑤⑦⑧
C
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第2课时 共价晶体
金刚石俗称"金刚钻"。也就是我们常说的钻石的原身,它是一种由碳元素组成的矿物,是自然界由单质元素组成的粒子物质,是碳同素异形体
(金刚石,石墨烯,富勒烯,碳纳米管,蓝丝黛尔石等)。金刚石的用途非常广泛,例如:工艺品和工业中的切割工具。
石墨可以在高温、高压下形成人造金刚石, 也是贵重宝石。中国也拥有制造金刚石的技术。需要注意,石墨与金刚石物理性质完全不同。
【思考】金刚石与石墨是相同的晶体吗?
掌握共价晶体的概念,能够区分共价晶体和分子晶体。
了解金刚石等典型共价晶体的结构特征,能描述金刚石、二氧化硅等共价晶体的结构与性质的关系。
1. 运用“结构决定性质、性质反映结构”的化学观,从微观角度分析比较分子晶体、共价晶体的本质区别及性质上的差异。(宏观辨识与微观探析)
2. 通过建立模型解决分子晶体、共价晶体的相关问题。(证据推理与模型认知)
通过金刚石晶体的结构认识晶体内粒子和粒子间的作用力是什么?
组成的粒子:_______
粒子间的作用力: _______
金刚石的多面体外形
晶体结构
晶胞示意图
晶胞示意图
原子
共价键
所有原子都以共价键相互结合形成三维的立体网状结构的晶体叫共价晶体。整块晶体是一个三维的共价键网状结构,不存在单个的小分子,是一个“巨分子”。
1.概念
一、共价晶体
注:晶体中没有单个分子存在;化学式只代表原子个数比。
2.构成共价晶体的微粒:
3.常见的共价晶体:
①某些单质:如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等
②某些非金属化合物:如碳化硅(SiC)、二氧化硅(SiO2)及氮化
硅(Si3N4)、氮化硼(BN)、Si3N4(氮化硅)、C3N4(氮化碳)等
③极少数金属氧化物,如刚玉(Al2O3)
共价晶体
构成微粒
微粒间相互作用
原子
共价键
晶体气化或熔化时破坏的作用力为共价键。
对比分子晶体和共价晶体的数据,共价晶体有何物理特性?原因是什么?
共价晶体熔化时破环共价键,共价键比分子间作用力强得多
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/0C >3550 3000 2700 1710 1410 1211
硬 度 10 9.5 9.5 7 6.5 6.0
4.共价晶体的物理性质:
①熔点很高
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。
②硬度很大
③一般不导电,但晶体硅是半导体
④难溶于一般溶剂
二、典型共价晶体
1.金刚石
①在金刚石晶体中每个碳原子周围紧邻的碳原子有 个
②每个碳原子都采取_______杂化;
③C原子与C—C键数之比为: 。
④晶体中最小的碳环由___个碳组成,且_____同一平面内;
⑤每个碳原子可形成 个六元环 每个C-C键可以形成 个六元环。
4
sp3
1 :2
6
不在
12
6
⑥金刚石晶胞中C原子配位数为___
4
⑦金刚石晶胞中含有的C原子数为___
8
⑧12g 金刚石含有_____个C原子,含有_____ 个C-C键
NA
2NA
配位数:一个C原子周围最邻近的C原子数
用Si代替C原子形成的是什么晶体?
预测硅的熔点和金刚石的熔点,哪个高?
金刚石和硅的结构相似,Si-Si键键长大于C-C键的,因此对应的键能较小,熔点较低;
2.二氧化硅晶体
每两个硅原子之间增加一个氧原子,即形成SiO2的晶体结构。
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α -SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
石英的左、右型晶体
石英晶体中的硅氧四面体相连构成的螺旋链
180
109 28
Si
O
共价键
二氧化硅晶体结构示意图
SiO2的结构特征:
① 在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 .
②在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
4
2
1:2
4
2
⑤60g 二氧化硅含有_____个Si原子
含有_____个O原子
含有_____ 个Si-O键
NA
2NA
4NA
③ 在SiO2 晶体中,最小环为 元环。
④每个环中平均含有硅原子
每个环中平均含有Si-O键
硅原子个数与Si-O 共价键个数之是 ;
氧原子个数与Si-O 共价键个数之比是 。
12
=6×1/12=1/2
=12×1/6=2
1:4
1:2
单晶硅
硅太阳能电池
硅制作的芯片
二氧化硅-光导纤维
晶体SiO2的多种重要用途:
制造: 水泥、玻璃、人造宝石、单晶硅、硅光电池、芯片、 光导纤维
1.金刚石、二氧化硅的比较:
金刚石 二氧化硅
晶体形状
晶体中的键或作用力
由最少原子形成环的形状与个数
中心原子成键数
每个环上键的平均数
正四面体空间网状
共价键
共价键
6个原子不共面
12个原子不共面
4
4
6×1/6=1
12×1/6=2
正四面体空间网状
【小结】
2.分子晶体与共价晶体的比较
晶体类型 共价晶体 分子晶体
概 念
组成微粒
作用力
熔沸点
硬 度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
用Si代替部分C原子形成的是什么晶体?
碳化硅又称金钢砂或耐火砂,英文名 Silicon Carbide,化学式 SiC。 纯碳化硅是无色透明的晶体。
共价晶体间比较熔沸点高低的方法:
键长越短,键能越大,对应共价晶体的熔沸点、硬度越大。
【练习】晶体硅、碳化硅(SiC )的结构与金刚石相似,比较这三种共价晶体的熔沸点高低?
金刚石 > SiC > 晶体硅
结构相似的共价晶体,原子半径越小,键长越短,共价键越强,键能越大,晶体的熔、沸点越高。
结构
性质
应用
共价晶体
构 成 微 粒
微粒间的作用力
物 理 特 性
典 型 晶 体
结 构 特 征
1. 关于SiO2晶体的叙述中,正确的是( )
A. 通常状况下,60 g SiO2晶体中含有的分子数为NA
B. 60 g SiO2晶体中,含有2NA个Si—O键
C. 晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D. SiO2晶体中含有1个硅原子和2个氧原子
C
2、下列各组物质的晶体中,化学键的类型相同,晶体的类型也相同的是( )
A. SO2和SiO2 B. CO2和H2O
C. BN和HCl D. CCl4和KCl
B
3、下列物质的晶体直接由原子构成的一组是( )①CO2 ②SiO2 ③晶体Si ④白磷 ⑤氨基乙酸 ⑥Fe ⑦Na2O ⑧固态He
A. ①②③④⑤⑥⑦⑧ B. ②③④⑥⑧
C. ②③⑧ D. ①②⑤⑦⑧
C
