人教版初中化学课件九下9. 3溶液的浓度(共33张PPT)
文档属性
| 名称 | 人教版初中化学课件九下9. 3溶液的浓度(共33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 716.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-02 00:00:00 | ||
图片预览









文档简介
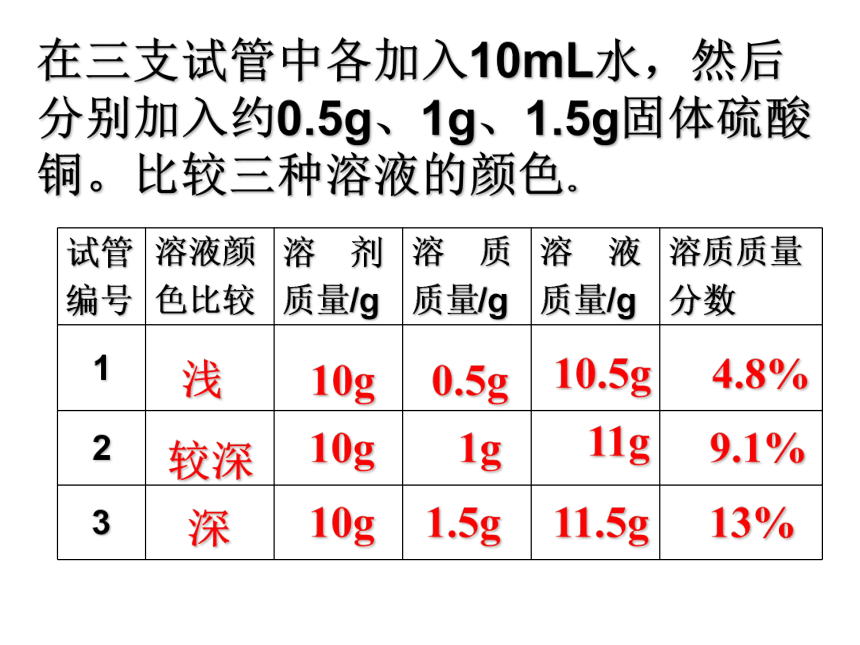
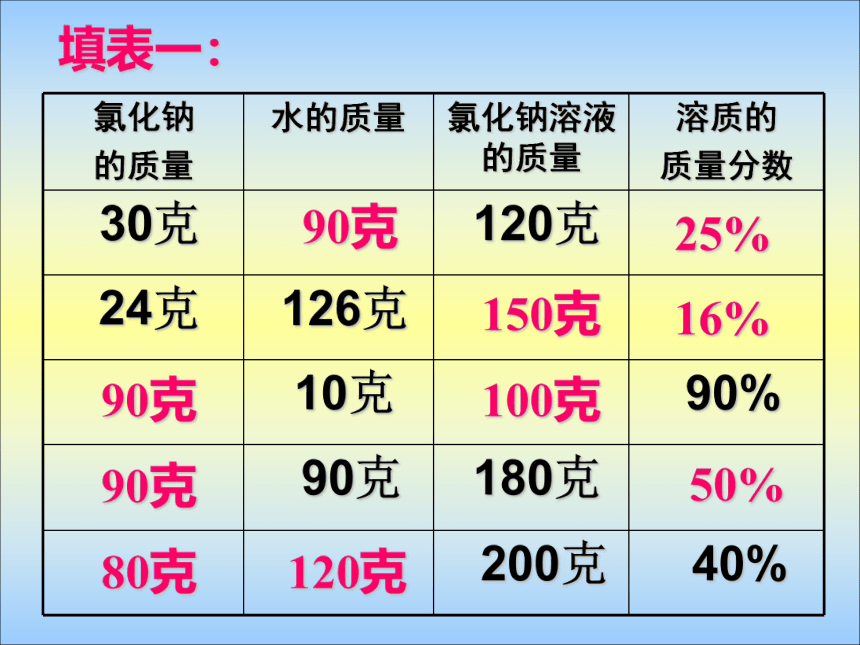
课件33张PPT。课题3 溶液 的浓度在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜。比较三种溶液的颜色。浅较深深10g10g10g0.5g1g1.5g10.5g11g11.5g4.8%9.1%13%一、溶质质量分数1、定义:是溶质质量和溶液质量之比 。2、公式:溶质质量溶液质量?100% 溶质质量分数=溶质的质量 =溶液质量 ×溶质质量分数填表一:90克25%150克16%90克100克90克50%80克120克[题型一] :有关溶质、溶剂和溶液之间的换算 二、有关溶质质量分数的计算溶质质量溶液质量?100% 溶质质量分数=溶液质量 = 溶质质量 + 溶剂质量计算的依据 :例题1:在农业生产上,常需要用质量分数为16%
的氯化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各多少?解:所需氯化钠的质量为:
150kg ?16% = 24kg需要水的质量为:150kg - 24kg = 126kg答:配150kg质量分数为16%的氯化钠溶液
需24kg 氯化钠和126kg水1、A克氯化钠固体完全溶解于B克水中,求溶液中溶质的质量分数。
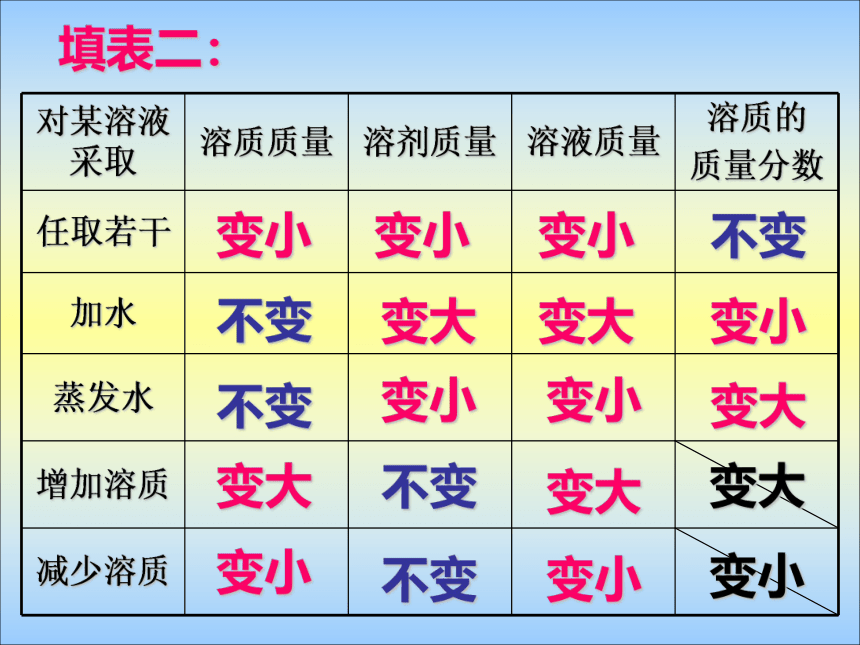
2、A克氯化钠固体完全溶解于一定量水中,配成V毫升,密度为ρ克/厘米3的溶液,求溶液中溶质的质量分数。 课堂练习 :3、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 %填表二:变小变小变小不变不变变大变大变小不变变小变小变大变大不变变大变小不变变小变大变小变一:同时加入10克水和5克溶质,求溶质质量分数。 变二:同时加入10克水和减去5克溶质,求溶质质量分数。 变三:同时蒸发10克水和加入5克溶质,求溶质质量分数。 变四:同时蒸发10克水和减去5克溶质,求溶质质量分数。 例题:向90克10%的氯化钠溶液分别加入10克水或10克氯化钠后,求溶质质量分数分别是多少? 例题:有50g质量分数为5%的硝酸钾溶液,若将其溶质质量分数提高到10%,可采用的方法是:( )
A、蒸发掉25g水
B、蒸发掉23.75g水
C、加入2g硝酸钾晶体
D、加入50g溶质质量分数为5%的硝酸钾溶液 A 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 在实验室如何配制50克6%的食盐溶液 ?
1、需要什么仪器,其作用是什么?
2、操作步骤如何?关键是找出溶质和溶液的质量配制溶质质量分数一定的溶液如何配制50g质量分数为6%的氯化钠溶液1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,2、称量用托盘天平称所需NaCl质量,倒入烧杯中用量筒量取所需的水的体积,倒入盛有NaCl
的烧杯中3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)3g47g相当于47m L用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒实验步骤:1、计算所需溶质和溶剂的质量;
2、分别称或量出所需的溶质和溶剂;
3、将溶质和溶剂在烧杯中混合,搅拌至溶质完全溶解。若用液体配制呢?[例题] :200C时,氯化钠溶解度为36克, (1)若将32克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(2)若将36克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(3)若将38克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少? 从上面例题中你得到什么启示?说明什么问题? 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较 例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略[题型二]:要考虑溶解度的溶质质量分数的计算计算的依据 :对于某温度下的饱和(或过饱和)溶液实际溶解的溶质质量实际形成的溶液质量?100% 溶质质量分数=对于某温度下的不饱和溶液溶质质量溶液质量?100% 溶质质量分数=(未溶解的固体不能当成溶质来计算) 向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的 硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%X = 答:略需要水的质量= 245 g– 50g = 195g例3:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V?1.84g/mL ?98% = 98g ?10%V = 答:略小试牛刀:1、配制100mL密度为1.1g/mL的20%的NaCl溶液
需要多少克NaCl和多少mL水?2、配制500m L20%的硫酸溶液(密度为1.14g/mL)
需要98%硫酸溶液(密度为1.84g / mL )多少mL ?解:所需NaCl的质量为:100mL?1.1g/mL?20% = 22g所需水的质量为:100mL? 1.1g/mL – 22g = 88g答:略解:设需要98%硫酸的体积为V500mL? 1.14g/mL?20%= V? 1.84g/mL ?98%V=答:略 实验室用100g稀硫酸和多少g锌恰好完全反应可制得0.8g氢气。H2SO4 + Zn = ZnSO4 + H2?98 65100g X答:略A解:设所需锌的质量为 XX=66.3gH2SO4 + Zn = ZnSO4 + H2?65 2X 0.8gB解:设所需锌的质量为 XX=26g下面哪种解法正确?注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题:100g 9.8%硫酸跟多少克锌反应?同时生成
多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 例2 :3.25g锌刚好跟100g盐酸反应完全,求盐酸溶质
的质量分数。解:设盐酸溶质的质量分数为x%Zn + 2HCl = ZnCl2 + H2?65 733.25g 100g?X%X%==36.5%答:略练习1:实验室用100g稀硫酸和一定量的锌完全反应
在,制得0.8g氢气。求该稀硫酸溶质的质量分数。解:设稀硫酸溶质的质量分数为xH2SO4 + Zn = ZnSO4 + H2?98 2100g? x 0.8gX==39.2%答:略? [例题3]: 32.5克锌与280克稀硫酸恰好完全反应,
求:
(1)??? 生成氢气多少克?
(2)??? 所用硫酸溶液中溶质质量分数是多少?
(3)??生成物溶液中溶质质量分数是多少?用“挖水法”和“整体法”求生成物溶液的质量 用“挖水法”和“整体法”求生成物溶液的质量 “挖水法”:将反应物溶液中的水的质量计算出来,就是生成物中水的质量。(因水不参加反应,反应前后质量不变,变化的仅仅是溶质。)“整体法”:将所有加入烧杯的物质总质量减去反应后不属于烧杯中溶液的物质的质量,就是反应后的溶液质量。(一般产生的气体或沉淀要减掉,或者没有反应完的反应物要减掉。)??1、100克40%的氢氧化钠溶液恰好与200克硫酸铜溶液完全反应,求:
(1)生成沉淀多少克?
(2)硫酸铜溶液中溶质质量分数?
(3)生成物溶液中溶质质量分数?
拓展练习 1:1、3.25克锌刚好跟100g盐酸完全反应,求:(1)盐酸溶质的质量分数。(2)反应后所得溶液的溶质质量分数巩固练习 :2、5.6克铁与多少克10%的硫酸铜溶液恰好完全反应?反应后所得溶液的溶质质量分数是多少?3、含碳酸钙80%的石灰石200克可跟多少克10%的盐酸完全反应?生成多少克二氧化碳?反应后所得溶液的溶质质量分数??2、100克40%的氢氧化钠溶液恰好与200克
硫酸溶液完全反应,生成硫酸钠和水。求:
(1)生成硫酸钠多少克?
(2)硫酸溶液中溶质质量分数?
(3)生成溶液中溶质质量分数?
拓展练习 2:巩固练习:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)1.A克氯化钠固体完全溶解于B克水中,求溶液中溶质的质量分数。
2.A克氯化钠固体完全溶解于一定量水中,配成V毫升,密度为ρ克/厘米3的溶液,求溶液中溶质的质量分数。
3.向90克10%的氯化钠溶液中加入10克氯化钠,同时蒸发掉10克后,求所得溶液中溶质的质量分数。
4.采用什么方法可以使200克10%的氯化钠溶液变成30%的氯化钠溶液?求应加入多少克溶质或蒸发掉多少克水? 课堂练习 :再见!
的氯化钠溶液来选种。现要配制150kg这种溶液,
需要氯化钠和水的质量各多少?解:所需氯化钠的质量为:
150kg ?16% = 24kg需要水的质量为:150kg - 24kg = 126kg答:配150kg质量分数为16%的氯化钠溶液
需24kg 氯化钠和126kg水1、A克氯化钠固体完全溶解于B克水中,求溶液中溶质的质量分数。
2、A克氯化钠固体完全溶解于一定量水中,配成V毫升,密度为ρ克/厘米3的溶液,求溶液中溶质的质量分数。 课堂练习 :3、20g 10%的盐水中倒出一半,求:剩余溶液的溶质的质量分数。剩余溶液的溶质质量分数不变,仍是 10 %填表二:变小变小变小不变不变变大变大变小不变变小变小变大变大不变变大变小不变变小变大变小变一:同时加入10克水和5克溶质,求溶质质量分数。 变二:同时加入10克水和减去5克溶质,求溶质质量分数。 变三:同时蒸发10克水和加入5克溶质,求溶质质量分数。 变四:同时蒸发10克水和减去5克溶质,求溶质质量分数。 例题:向90克10%的氯化钠溶液分别加入10克水或10克氯化钠后,求溶质质量分数分别是多少? 例题:有50g质量分数为5%的硝酸钾溶液,若将其溶质质量分数提高到10%,可采用的方法是:( )
A、蒸发掉25g水
B、蒸发掉23.75g水
C、加入2g硝酸钾晶体
D、加入50g溶质质量分数为5%的硝酸钾溶液 A 从上述解题过程中,你得到什么规律?求溶质的质量分数的关键是什么? 在实验室如何配制50克6%的食盐溶液 ?
1、需要什么仪器,其作用是什么?
2、操作步骤如何?关键是找出溶质和溶液的质量配制溶质质量分数一定的溶液如何配制50g质量分数为6%的氯化钠溶液1、计算:配制时所需NaCl质量为__________,
所需水的质量_____,2、称量用托盘天平称所需NaCl质量,倒入烧杯中用量筒量取所需的水的体积,倒入盛有NaCl
的烧杯中3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl溶解4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)3g47g相当于47m L用固体配制一定溶质质量分数的溶液 主要仪器:托盘天平、烧杯、量筒、玻璃棒实验步骤:1、计算所需溶质和溶剂的质量;
2、分别称或量出所需的溶质和溶剂;
3、将溶质和溶剂在烧杯中混合,搅拌至溶质完全溶解。若用液体配制呢?[例题] :200C时,氯化钠溶解度为36克, (1)若将32克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(2)若将36克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少?
(3)若将38克氯化钠溶于100克水里,所得溶液中溶质的质量分数是多少? 从上面例题中你得到什么启示?说明什么问题? 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较 例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略[题型二]:要考虑溶解度的溶质质量分数的计算计算的依据 :对于某温度下的饱和(或过饱和)溶液实际溶解的溶质质量实际形成的溶液质量?100% 溶质质量分数=对于某温度下的不饱和溶液溶质质量溶液质量?100% 溶质质量分数=(未溶解的固体不能当成溶质来计算) 向20%的某浓溶液中加水后溶液、溶质和溶剂的质量如何变化? 如何解决有关溶液稀释的计算? ? [题型三] :有关溶液稀释或浓缩的计算计算的依据 : 稀释前溶质质量 = 稀释后溶质质量 浓缩前溶质质量 = 浓缩后溶质质量例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的 硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%X = 答:略需要水的质量= 245 g– 50g = 195g例3:配制10%硫酸98g,要98%硫酸(密度为1.84g/m L )多少mL ?解:设需要98%硫酸的体积为V V?1.84g/mL ?98% = 98g ?10%V = 答:略小试牛刀:1、配制100mL密度为1.1g/mL的20%的NaCl溶液
需要多少克NaCl和多少mL水?2、配制500m L20%的硫酸溶液(密度为1.14g/mL)
需要98%硫酸溶液(密度为1.84g / mL )多少mL ?解:所需NaCl的质量为:100mL?1.1g/mL?20% = 22g所需水的质量为:100mL? 1.1g/mL – 22g = 88g答:略解:设需要98%硫酸的体积为V500mL? 1.14g/mL?20%= V? 1.84g/mL ?98%V=答:略 实验室用100g稀硫酸和多少g锌恰好完全反应可制得0.8g氢气。H2SO4 + Zn = ZnSO4 + H2?98 65100g X答:略A解:设所需锌的质量为 XX=66.3gH2SO4 + Zn = ZnSO4 + H2?65 2X 0.8gB解:设所需锌的质量为 XX=26g下面哪种解法正确?注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题:100g 9.8%硫酸跟多少克锌反应?同时生成
多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:100g?9.8%=9.8g设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 例2 :3.25g锌刚好跟100g盐酸反应完全,求盐酸溶质
的质量分数。解:设盐酸溶质的质量分数为x%Zn + 2HCl = ZnCl2 + H2?65 733.25g 100g?X%X%==36.5%答:略练习1:实验室用100g稀硫酸和一定量的锌完全反应
在,制得0.8g氢气。求该稀硫酸溶质的质量分数。解:设稀硫酸溶质的质量分数为xH2SO4 + Zn = ZnSO4 + H2?98 2100g? x 0.8gX==39.2%答:略? [例题3]: 32.5克锌与280克稀硫酸恰好完全反应,
求:
(1)??? 生成氢气多少克?
(2)??? 所用硫酸溶液中溶质质量分数是多少?
(3)??生成物溶液中溶质质量分数是多少?用“挖水法”和“整体法”求生成物溶液的质量 用“挖水法”和“整体法”求生成物溶液的质量 “挖水法”:将反应物溶液中的水的质量计算出来,就是生成物中水的质量。(因水不参加反应,反应前后质量不变,变化的仅仅是溶质。)“整体法”:将所有加入烧杯的物质总质量减去反应后不属于烧杯中溶液的物质的质量,就是反应后的溶液质量。(一般产生的气体或沉淀要减掉,或者没有反应完的反应物要减掉。)??1、100克40%的氢氧化钠溶液恰好与200克硫酸铜溶液完全反应,求:
(1)生成沉淀多少克?
(2)硫酸铜溶液中溶质质量分数?
(3)生成物溶液中溶质质量分数?
拓展练习 1:1、3.25克锌刚好跟100g盐酸完全反应,求:(1)盐酸溶质的质量分数。(2)反应后所得溶液的溶质质量分数巩固练习 :2、5.6克铁与多少克10%的硫酸铜溶液恰好完全反应?反应后所得溶液的溶质质量分数是多少?3、含碳酸钙80%的石灰石200克可跟多少克10%的盐酸完全反应?生成多少克二氧化碳?反应后所得溶液的溶质质量分数??2、100克40%的氢氧化钠溶液恰好与200克
硫酸溶液完全反应,生成硫酸钠和水。求:
(1)生成硫酸钠多少克?
(2)硫酸溶液中溶质质量分数?
(3)生成溶液中溶质质量分数?
拓展练习 2:巩固练习:40g10%NaOH溶液跟多少克10%盐酸完全反应?反应后溶液的溶质的质量分数是多少?解:设稀盐酸的质量为X,反应后生成的NaCl的质量为YNaOH + HCl = NaCl + H2O40g?10% X ?10% Y40 36.5 58.5 X = 36.5gY=5.85gNaCl% = 答:略 (NaOH + HCl = NaCl + H2O)1.A克氯化钠固体完全溶解于B克水中,求溶液中溶质的质量分数。
2.A克氯化钠固体完全溶解于一定量水中,配成V毫升,密度为ρ克/厘米3的溶液,求溶液中溶质的质量分数。
3.向90克10%的氯化钠溶液中加入10克氯化钠,同时蒸发掉10克后,求所得溶液中溶质的质量分数。
4.采用什么方法可以使200克10%的氯化钠溶液变成30%的氯化钠溶液?求应加入多少克溶质或蒸发掉多少克水? 课堂练习 :再见!
同课章节目录
