第3章 有机合成及其应用 合成高分子化合物 分层作业18(含答案) 有机化合物结构的测定--2025鲁科版化学选择性必修3同步练习题
文档属性
| 名称 | 第3章 有机合成及其应用 合成高分子化合物 分层作业18(含答案) 有机化合物结构的测定--2025鲁科版化学选择性必修3同步练习题 |

|
|
| 格式 | docx | ||
| 文件大小 | 593.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 09:34:51 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学选择性必修3
分层作业18 有机化合物结构的测定
A级必备知识基础练
题组1.有机化合物分子式的确定
1.燃烧法是测定有机物分子式的一种重要方法。完全燃烧0.2 mol某烃后,测得生成17.92 L(标准状况下)二氧化碳,生成18 g水,则该烃的分子式为 ( )
A.C2H6 B.C3H8
C.C4H10 D.C8H18
2.某有机物分子,C、H、O三种元素的原子数之和为13,其分子中的电子总数为42。充分燃烧该有机物,所生成的CO2和水蒸气在相同状况下的体积之比为3∶4,则该有机物的分子式为( )
A.C6H6O B.C2H6O
C.C4H8O2 D.C3H8O2
3.某羧酸酯的分子式为C16H22O5,1 mol该酯完全水解得到1 mol羧酸和2 mol乙醇,该羧酸的分子式为 ( )
A.C12H6O5 B.C12H18O5
C.C12H12O4 D.C12H14O5
题组2.有机化合物结构式的确定
4.(2024·泉州高二检测)分析下列物质,对核磁共振氢谱图信号种数的判断正确的是( )
A. 4种
B. 2种
C. 2种
D. 4种
5.有机物甲能发生银镜反应,甲催化加氢还原为乙,1 mol乙与足量金属钠反应放出22.4 L H2(标准状况),据此推断乙一定不是( )
A.CH2OH—CH2OH
B.CH2OH—CHOH—CH3
C.HOOC—COOH
D.HOOCCH2CH2OH
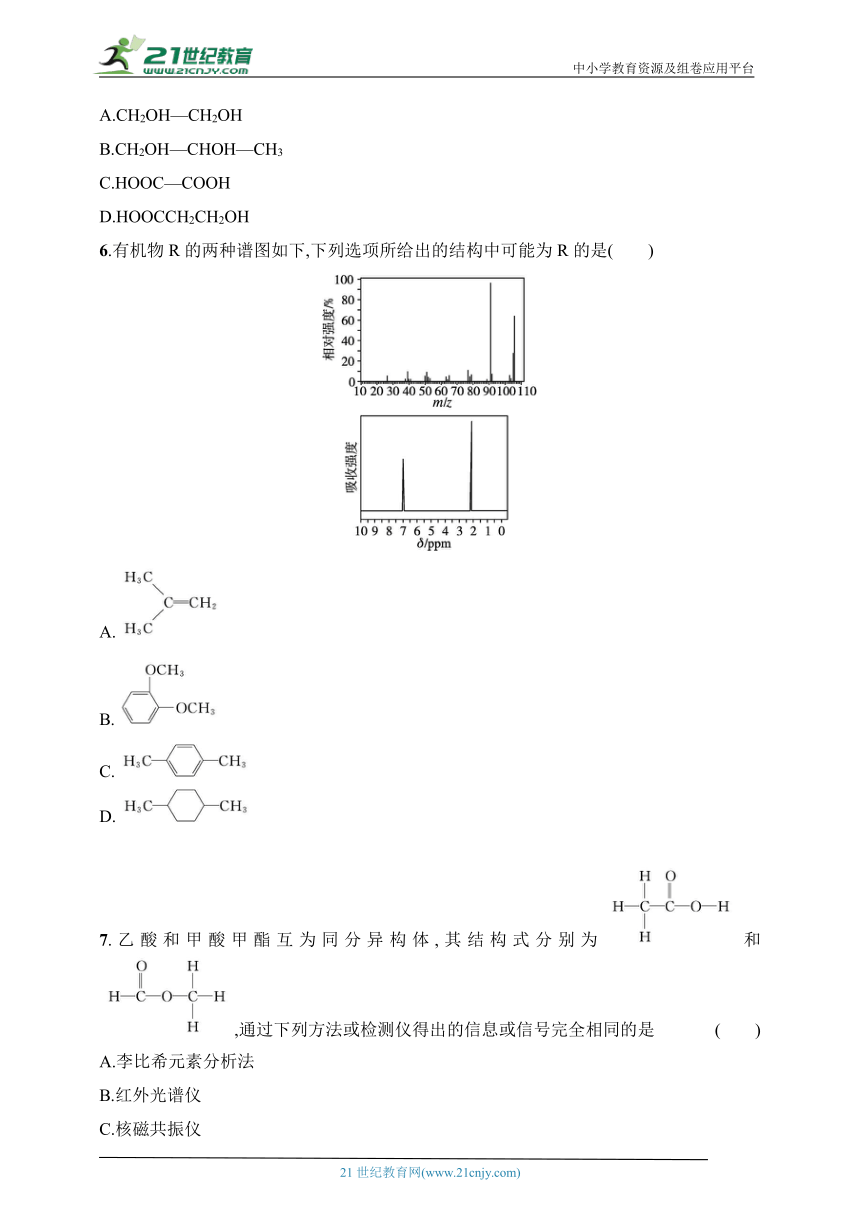
6.有机物R的两种谱图如下,下列选项所给出的结构中可能为R的是( )
A.
B.
C.
D.
7.乙酸和甲酸甲酯互为同分异构体,其结构式分别为和,通过下列方法或检测仪得出的信息或信号完全相同的是 ( )
A.李比希元素分析法
B.红外光谱仪
C.核磁共振仪
D.质谱仪
8.电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图装置是用燃烧法确定有机物M分子式的常用装置。
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是 ;
(2)C装置中浓硫酸的作用是 ;
(3)若准确称取有机物M(只含C、H、O三种元素中的两种或三种)0.70 g,充分燃烧后,A管质量增加2.2 g,B管质量增加0.9 g,则该有机物的实验式为 ;
(4)已知在相同条件下该M蒸气相对氢气的密度为35,则M的分子式为 。若有机物M不能使溴水褪色,且其核磁共振氢谱图只有一组吸收峰,则M的结构简式为 。
B级关键能力提升练
以下选择题中有1~2个选项符合题意。
9.在氧气中充分燃烧0.2 mol某有机物,得到0.4 mol CO2和10.8 g H2O,由此可得出的结论是( )
A.1个该有机物分子中只含有2个碳原子和6个氢原子
B.该有机物中碳原子和氢原子的个数比为1∶3
C.1个该有机物分子中含有2个CO2和3个H2O
D.1个该有机物分子中含有2个碳原子和6个氢原子,可能含有氧原子
10.某有机化合物的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为51.52%,其余为氧,该化合物分子中最多含多少个结构( )
A.1个 B.2个
C.3个 D.4个
11.已知某气态烃A在标准状况下的密度是3.214 g·L-1,取7.2 g A在足量O2中充分燃烧,把燃烧后的产物全部通过浓硫酸,浓硫酸质量增加10.8 g,再把剩余气体通过碱石灰,碱石灰质量增加22 g,下列说法正确的是( )
A.该烃的摩尔质量为72
B.该烃的分子式为C5H12
C.该烃化学性质稳定,不能发生氧化反应
D.该烃分子中一个氢原子被溴原子取代后,可形成8种同分异构体
12.某有机物(仅含碳、氢、氧)的相对分子质量在50~100之间,经分析得知,其中氧元素质量分数为36.37%。有关其同分异构体数目的说法错误的是 ( )
A.属于酯类的有4种
B.属于羧酸的有2种
C.既含有羟基又含有醛基的有3种
D.存在分子中含有六元环的同分异构体
13.(2024·聊城检测)有机物X是一种重要的有机合成中间体。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图如图所示。
(2)将10.0 g X在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图中有2组吸收峰,峰面积之比为3∶1。
下列有关说法中正确的是( )
A.有机物X的分子式为C5H8O2
B.有机物X的相对分子质量为55
C.有机物X的结构简式为CHO(CH2)3CHO
D.与X官能团种类、数量完全相同的同分异构体还有3种
14.(1)有机化合物A的红外光谱图如图。
A的结构简式为 。
(2)有机化合物B可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的B为无色黏稠液体,易溶于水。为研究B的组成与结构,进行了如下实验。
实验步骤 解释或实验结论
①称取B 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 B的相对分子质量为
②将此9.0 g B在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g B的分子式为
③另取B 9.0 g,与足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) 写出B中官能团的结构简式:
④B的核磁共振氢谱图如图: B中含有 种氢原子
⑤综上所述,B的结构简式为
15.请回答下列问题:
(1)有机物A的分子式为C3H6O3,其分子结构中含有羧基和羟基,核磁共振氢谱图中有4组峰,
峰面积之比为1∶2∶2∶1,则该有机物的键线式为 。
(2)有机物B可用作食品防腐剂、防霉剂、硝酸纤维素溶剂和增塑剂等。
已知:①有机物B的红外光谱图如图所示;
②其核磁共振氢谱图中有3组吸收峰,峰面积之比为3∶2∶1;
③质谱图表明其相对分子质量为74。
有机物B中所含官能团的名称是 ;有机物B的结构简式为 。
(3)汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物。为了测定其中一种有毒有机物C的结构,做如下实验:
①将9.2 g该有机物C完全燃烧,生成标准状况下15.68 L的CO2和7.2 g水。
②用质谱仪测定其相对分子质量,得到如下图所示的质谱图。
由图可知有机物C的相对分子质量是 ,结合实验数据确定有机物C的分子式为 。
C级学科素养拔高练
16.对有机化合物X的组成、结构、性质进行观察、分析,得到实验结果如下:
①X为无色晶体,微溶于水,易溶于Na2CO3溶液;
②完全燃烧166 mg有机化合物X,得到352 mg CO2和54 mg H2O;
③X分子中只有2种不同化学环境的氢原子;
④X的相对分子质量在100~200之间。
根据以上信息回答下列问题:
(1)X的分子式为 ,结构简式为 。
(2)X的一种同分异构体(与X具有相同的官能团)在一定条件下可发生分子内脱水反应生成一种含有五元环的有机化合物Y,则Y的结构简式为 。
(3)X的某些同分异构体具有如下性质:
a.能发生水解反应
b.能发生银镜反应
c.能与氯化铁溶液发生显色反应
请写出可能的结构简式: (任写两种)。
参考答案
分层作业18 有机化合物结构的测定
1.C 解析 标准状况下二氧化碳的体积为17.92 L,则0.2 mol烃中碳原子的物质的量为n(C)==0.8 mol,生成水的质量为18 g,0.2 mol烃中氢原子的物质的量为n(H)=×2=2 mol,所以1 mol烃中含碳原子的物质的量为4 mol,含氢原子的物质的量为10 mol,该烃的分子式为C4H10,故选C。
2.D 解析 因该有机物燃烧生成的CO2和水蒸气在相同状况下的体积之比为3∶4,所以可设该有机物的分子式为(C3H8)nOm,由题意得:11n+m=13和26n+8m=42,解得n=1、m=2,故该有机物的分子式为C3H8O2。
3.D 解析 羧酸酯的分子式为C16H22O5,1 mol该酯完全水解可得到1 mol羧酸和2 mol乙醇,说明酯中含有2个酯基,设羧酸为M,则反应的化学方程式为C16H22O5+2H2OM+2C2H6O,由元素守恒可知M的分子式为C12H14O5。
4.B 解析 共有5种不同化学环境的H原子,A错误;结构对称,共有2种不同化学环境的氢原子,B正确;共有3种不同化学环境的H原子,C错误;结构对称,共有2种不同化学环境的H原子,D错误。
5.C 解析 1 mol乙能与Na反应放出1 mol H2,证明乙中含有两个与Na反应的官能团;甲能发生银镜反应,证明有醛基,醛基加氢反应后,产物中应有—CH2OH,所以乙一定不是HOOC—COOH,故选C。
6.C 解析 由质谱图可知,R的相对分子质量是106,由核磁共振氢谱图知,分子内有2种H原子,且数目之比为3∶2。C项有机物分子式为C8H10,其相对分子质量为106,分子内有2种等效氢原子,且数目之比为3∶2,符合已知条件。
7.A 解析 二者互为同分异构体,则通过李比希元素分析法得出的信息完全相同,A项符合题意;官能团不同,红外光谱信号不同,B项不符合题意;二者含有的氢原子的种类和个数虽然相同,但峰出现的位置不同,核磁共振氢谱图信号不完全相同,C项不符合题意;二者的相对分子质量相等,用质谱仪测定的最大质荷比相同,但信号不完全相同,D项不符合题意。
8.答案 (1)g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)
(2)吸收水分,得到干燥纯净的O2 (3)CH2
(4)C5H10
解析 (1)H2O2分解产生氧气中含有水,应干燥后才可与有机物反应,生成二氧化碳和水,用无水氯化钙吸收水,用NaOH吸收二氧化碳,整套装置为D→C→E→B→A,干燥管的两端可以颠倒,各导管接口顺序为g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)。
(2)C中浓硫酸作用是吸收水分,得到干燥纯净的O2。
(3)B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2,E为有机物燃烧装置,m(CO2)=2.2 g,n(CO2)=0.05 mol,m(H2O)=0.9 g,则n(H2O)=0.05 mol,则m(C)+m(H)=12×0.05 g+2×0.05 g=0.7 g,所以有机物中不含氧元素,又n(C)∶n(H)=0.05∶(0.05×2)=1∶2,所以该有机物的实验式为CH2。
(4)在相同条件下M蒸气相对氢气的密度为35,则M的相对分子质量为35×2=70,设M的分子式为(CH2)n,则n==5,M的分子式为C5H10;若有机物M不能使溴水褪色,且其核磁共振氢谱图中只有一组吸收峰,说明M中不存在不饱和键,则M为环戊烷,其结构简式为。
9.BD 解析 在氧气中充分燃烧0.2 mol某有机物,得到0.4 mol CO2(含0.4 mol C原子)和10.8 g H2O,即0.6 mol H2O(含1.2 mol H原子),根据元素守恒,可知1个该有机物分子中含有2个碳原子和6个氢原子,无法确定其是否含有氧原子,故B、D正确。
10.B 解析 由题意知,O的质量分数为100%-51.52%=48.48%,该有机化合物的相对分子质量大于110,小于150,所以1分子该有机化合物中O原子个数大于110×48.48%÷16=3.3,小于150×48.48%÷16=4.5,即O原子为4个,所以该有机化合物的相对分子质量==132,其中C、H的相对原子质量之和为132-16×4=68,可确定该有机化合物的分子式为C5H8O4,该分子的不饱和度为2,因此分子中最多含有2个羰基结构,B正确。
11.BD 解析 气态烃A在标准状况下的密度是3.214 g·L-1,则该气体摩尔质量为M=3.214 g·L-1×22.4 L· mol-1≈72 g· mol-1,取7.2 g A在足量O2中充分燃烧,把燃烧后的产物全部通过浓硫酸,浓硫酸质量增加10.8 g,则m(H2O)=10.8 g,n(H2O)=0.6 mol,再把剩余气体通过碱石灰,碱石灰质量增加22 g,则m(CO2)=22 g,n(CO2)=0.5 mol,所以该烃分子式为C5H12。该烃的摩尔质量为72 g· mol-1,故A错误;该烃的分子式为C5H12,故B正确;该烃可以燃烧,燃烧为氧化反应,故C错误;该烃分子中一个氢原子被溴原子取代后得到C5H11Br,C5H11—有8种不同的结构,故D正确。
12.C 解析 氧元素质量分数为36.37%,若分子中含有一个氧原子,相对分子质量约为44,若含有两个氧原子,相对分子质量约为88;该有机物的相对分子质量在50~100之间,所以该有机物的相对分子质量为88,分子式为C4H8O2。若该有机物属于酯类,则有甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯4种,A正确;若属于羧酸,有丁酸、2-甲基丙酸2种,B正确;既含有羟基又含有醛基的有2-羟基丁醛、3-羟基丁醛、4-羟基丁醛、2-甲基-2-羟基丙醛、2-甲基-3-羟基丙醛5种,C错误;存在分子中含有六元环的同分异构体,D正确。
13.AD 解析 无水CaCl2增重7.2 g,说明燃烧生成水7.2 g,n(H)=×2=0.8 mol,m(H)=0.8 g,KOH浓溶液增重22.0 g,说明生成CO2 22 g,n(CO2)==0.5 mol,m(C)=6 g,剩余的是氧元素的质量,m(O)=10.0 g-0. 8 g-6 g=3.2 g,n(O)=0.2 mol,则该分子中碳、氢、氧原子的个数比是0.5 mol∶0.8 mol∶0.2 mol=5∶8∶2,则有机物X的实验式是C5H8O2,由质谱图可知X的相对分子质量是100,则X的分子式是C5H8O2,故A正确,B错误;有机物X中含有醛基,核磁共振氢谱图中有2组吸收峰,则分子中含有两种氢原子,又因为分子式是C5H8O2,且两种氢原子之比是3∶1,所以X的结构简式为(CH3)2C(CHO)2,故C错误;有机物X含有两个醛基,符合条件的同分异构体有CH3CH2CH(CHO)2、CH3CH(CHO)CH2CHO、OHCCH2CH2CH2CHO共3种,故D正确。
14.答案 (1)CH3CH2OCH2CH3
(2)①90 ②C3H6O3 ③—COOH、—OH ④4
⑤
解析 (1)由A的红外光谱图可知,A分子中含有对称的甲基、对称的亚甲基和醚键,则A为乙醚,结构简式为CH3CH2OCH2CH3。
(2)①由B的密度是相同条件下H2的45倍,可知B的相对分子质量为45×2=90。
②由题意可知,B的物质的量n(B)=0.1 mol,n(C)=n(CO2)==0.3 mol,n(H)=2n(H2O)=×2=0.6 mol,n(O)=
=0.3 mol,n(B)∶n(C)∶n(H)∶n(O)=0.1 mol∶0.3 mol∶0.6 mol∶0.3 mol=1∶3∶6∶3,则B的分子式为C3H6O3。
③0.1 mol B与足量的NaHCO3反应放出0.1 mol CO2,说明B分子中含有1个羧基,与足量金属钠反应生成0.1 mol H2,说明B分子中还含有1个羟基。
④B分子的核磁共振氢谱图中有4组吸收峰,峰面积之比为1∶1∶1∶3,可知B中含有4种氢原子。
⑤B的分子式为C3H6O3,分子中含有1个羟基和1个羧基,且核磁共振氢谱图中峰面积比为1∶1∶1∶3,则B的结构简式为。
15.答案 (1)
(2)羧基 CH3CH2COOH (3)92 C7H8
解析 (1)有机物A的分子式为C3H6O3,其分子结构中含有羧基和羟基,核磁共振氢谱图中峰面积之比为1∶2∶2∶1,说明没有甲基,则该有机物的键线式为。
(2)由质谱图表明有机物B的相对分子质量为74,由红外光谱可知有机物B含有羰基、羟基、碳氧单键,所以有机物B至少有2个氧原子;核磁共振氢谱图中峰面积之比为3∶2∶1,说明有机物B至少有6个氢原子,B的相对分子质量为74,可推断有机物B的分子式为C3H6O2,结构简式为CH3CH2COOH或CH3COCH2OH。有机物B可用作食品防腐剂、防霉剂、硝酸纤维素溶剂和增塑剂等,说明有机物B中含有羧基,所以有机物B的结构简式为CH3CH2COOH。
(3)由质谱图可知,有机物C的相对分子质量为92。将9.2 g该有机物(物质的量为0.1 mol)完全燃烧,生成标准状况下15.68 L CO2(物质的量为0.7 mol)和7.2 g水(物质的量为0.4 mol),根据碳氢守恒得有机物C的分子式为C7H8Ox,根据相对分子质量得x=0,所以有机物C的分子式为C7H8。
16.答案 (1)C8H6O4
(2)
(3)、(答案合理即可)
解析 (1)由①可知,X可能为有机酸;由②可知,166 mg X完全燃烧生成CO2的物质的量为=8×10-3 mol,生成H2O的物质的量为=3×10-3 mol,则166 mg X中含C元素的质量为8×10-3 mol×12×103 mg· mol-1=96 mg,含H元素的质量为3×10-3 mol×1×103 mg· mol-1×2=6 mg,则含O元素的质量为166 mg-96 mg-6 mg=64 mg,O元素的物质的量为=4×10-3 mol,则X中C、H、O的原子个数比为(8×10-3 mol)∶(3×10-3 mol×2)∶(4×10-3 mol)=4∶3∶2,则X的实验式为C4H3O2,结合③④可知,X的分子式为C8H6O4,结构简式为。
(2)X的一种同分异构体(与X具有相同的官能团)在一定条件下可发生分子内脱水反应生成一种含有五元环的有机化合物Y,则X的同分异构体为邻苯二甲酸,Y的结构简式为。
(3)X的某些同分异构体具有如下性质:a.能发生水解反应,则分子中有酯基;b.能发生银镜反应,则分子中有醛基;c.能与氯化铁溶液发生显色反应,则分子中有酚羟基。其可能的结构有、等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学选择性必修3
分层作业18 有机化合物结构的测定
A级必备知识基础练
题组1.有机化合物分子式的确定
1.燃烧法是测定有机物分子式的一种重要方法。完全燃烧0.2 mol某烃后,测得生成17.92 L(标准状况下)二氧化碳,生成18 g水,则该烃的分子式为 ( )
A.C2H6 B.C3H8
C.C4H10 D.C8H18
2.某有机物分子,C、H、O三种元素的原子数之和为13,其分子中的电子总数为42。充分燃烧该有机物,所生成的CO2和水蒸气在相同状况下的体积之比为3∶4,则该有机物的分子式为( )
A.C6H6O B.C2H6O
C.C4H8O2 D.C3H8O2
3.某羧酸酯的分子式为C16H22O5,1 mol该酯完全水解得到1 mol羧酸和2 mol乙醇,该羧酸的分子式为 ( )
A.C12H6O5 B.C12H18O5
C.C12H12O4 D.C12H14O5
题组2.有机化合物结构式的确定
4.(2024·泉州高二检测)分析下列物质,对核磁共振氢谱图信号种数的判断正确的是( )
A. 4种
B. 2种
C. 2种
D. 4种
5.有机物甲能发生银镜反应,甲催化加氢还原为乙,1 mol乙与足量金属钠反应放出22.4 L H2(标准状况),据此推断乙一定不是( )
A.CH2OH—CH2OH
B.CH2OH—CHOH—CH3
C.HOOC—COOH
D.HOOCCH2CH2OH
6.有机物R的两种谱图如下,下列选项所给出的结构中可能为R的是( )
A.
B.
C.
D.
7.乙酸和甲酸甲酯互为同分异构体,其结构式分别为和,通过下列方法或检测仪得出的信息或信号完全相同的是 ( )
A.李比希元素分析法
B.红外光谱仪
C.核磁共振仪
D.质谱仪
8.电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图装置是用燃烧法确定有机物M分子式的常用装置。
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是 ;
(2)C装置中浓硫酸的作用是 ;
(3)若准确称取有机物M(只含C、H、O三种元素中的两种或三种)0.70 g,充分燃烧后,A管质量增加2.2 g,B管质量增加0.9 g,则该有机物的实验式为 ;
(4)已知在相同条件下该M蒸气相对氢气的密度为35,则M的分子式为 。若有机物M不能使溴水褪色,且其核磁共振氢谱图只有一组吸收峰,则M的结构简式为 。
B级关键能力提升练
以下选择题中有1~2个选项符合题意。
9.在氧气中充分燃烧0.2 mol某有机物,得到0.4 mol CO2和10.8 g H2O,由此可得出的结论是( )
A.1个该有机物分子中只含有2个碳原子和6个氢原子
B.该有机物中碳原子和氢原子的个数比为1∶3
C.1个该有机物分子中含有2个CO2和3个H2O
D.1个该有机物分子中含有2个碳原子和6个氢原子,可能含有氧原子
10.某有机化合物的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为51.52%,其余为氧,该化合物分子中最多含多少个结构( )
A.1个 B.2个
C.3个 D.4个
11.已知某气态烃A在标准状况下的密度是3.214 g·L-1,取7.2 g A在足量O2中充分燃烧,把燃烧后的产物全部通过浓硫酸,浓硫酸质量增加10.8 g,再把剩余气体通过碱石灰,碱石灰质量增加22 g,下列说法正确的是( )
A.该烃的摩尔质量为72
B.该烃的分子式为C5H12
C.该烃化学性质稳定,不能发生氧化反应
D.该烃分子中一个氢原子被溴原子取代后,可形成8种同分异构体
12.某有机物(仅含碳、氢、氧)的相对分子质量在50~100之间,经分析得知,其中氧元素质量分数为36.37%。有关其同分异构体数目的说法错误的是 ( )
A.属于酯类的有4种
B.属于羧酸的有2种
C.既含有羟基又含有醛基的有3种
D.存在分子中含有六元环的同分异构体
13.(2024·聊城检测)有机物X是一种重要的有机合成中间体。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图如图所示。
(2)将10.0 g X在足量O2中充分燃烧,并将其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图中有2组吸收峰,峰面积之比为3∶1。
下列有关说法中正确的是( )
A.有机物X的分子式为C5H8O2
B.有机物X的相对分子质量为55
C.有机物X的结构简式为CHO(CH2)3CHO
D.与X官能团种类、数量完全相同的同分异构体还有3种
14.(1)有机化合物A的红外光谱图如图。
A的结构简式为 。
(2)有机化合物B可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的B为无色黏稠液体,易溶于水。为研究B的组成与结构,进行了如下实验。
实验步骤 解释或实验结论
①称取B 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 B的相对分子质量为
②将此9.0 g B在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g B的分子式为
③另取B 9.0 g,与足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) 写出B中官能团的结构简式:
④B的核磁共振氢谱图如图: B中含有 种氢原子
⑤综上所述,B的结构简式为
15.请回答下列问题:
(1)有机物A的分子式为C3H6O3,其分子结构中含有羧基和羟基,核磁共振氢谱图中有4组峰,
峰面积之比为1∶2∶2∶1,则该有机物的键线式为 。
(2)有机物B可用作食品防腐剂、防霉剂、硝酸纤维素溶剂和增塑剂等。
已知:①有机物B的红外光谱图如图所示;
②其核磁共振氢谱图中有3组吸收峰,峰面积之比为3∶2∶1;
③质谱图表明其相对分子质量为74。
有机物B中所含官能团的名称是 ;有机物B的结构简式为 。
(3)汽车污染主要来源于汽车配件及材料,它们都会产生大量的有毒有机物。为了测定其中一种有毒有机物C的结构,做如下实验:
①将9.2 g该有机物C完全燃烧,生成标准状况下15.68 L的CO2和7.2 g水。
②用质谱仪测定其相对分子质量,得到如下图所示的质谱图。
由图可知有机物C的相对分子质量是 ,结合实验数据确定有机物C的分子式为 。
C级学科素养拔高练
16.对有机化合物X的组成、结构、性质进行观察、分析,得到实验结果如下:
①X为无色晶体,微溶于水,易溶于Na2CO3溶液;
②完全燃烧166 mg有机化合物X,得到352 mg CO2和54 mg H2O;
③X分子中只有2种不同化学环境的氢原子;
④X的相对分子质量在100~200之间。
根据以上信息回答下列问题:
(1)X的分子式为 ,结构简式为 。
(2)X的一种同分异构体(与X具有相同的官能团)在一定条件下可发生分子内脱水反应生成一种含有五元环的有机化合物Y,则Y的结构简式为 。
(3)X的某些同分异构体具有如下性质:
a.能发生水解反应
b.能发生银镜反应
c.能与氯化铁溶液发生显色反应
请写出可能的结构简式: (任写两种)。
参考答案
分层作业18 有机化合物结构的测定
1.C 解析 标准状况下二氧化碳的体积为17.92 L,则0.2 mol烃中碳原子的物质的量为n(C)==0.8 mol,生成水的质量为18 g,0.2 mol烃中氢原子的物质的量为n(H)=×2=2 mol,所以1 mol烃中含碳原子的物质的量为4 mol,含氢原子的物质的量为10 mol,该烃的分子式为C4H10,故选C。
2.D 解析 因该有机物燃烧生成的CO2和水蒸气在相同状况下的体积之比为3∶4,所以可设该有机物的分子式为(C3H8)nOm,由题意得:11n+m=13和26n+8m=42,解得n=1、m=2,故该有机物的分子式为C3H8O2。
3.D 解析 羧酸酯的分子式为C16H22O5,1 mol该酯完全水解可得到1 mol羧酸和2 mol乙醇,说明酯中含有2个酯基,设羧酸为M,则反应的化学方程式为C16H22O5+2H2OM+2C2H6O,由元素守恒可知M的分子式为C12H14O5。
4.B 解析 共有5种不同化学环境的H原子,A错误;结构对称,共有2种不同化学环境的氢原子,B正确;共有3种不同化学环境的H原子,C错误;结构对称,共有2种不同化学环境的H原子,D错误。
5.C 解析 1 mol乙能与Na反应放出1 mol H2,证明乙中含有两个与Na反应的官能团;甲能发生银镜反应,证明有醛基,醛基加氢反应后,产物中应有—CH2OH,所以乙一定不是HOOC—COOH,故选C。
6.C 解析 由质谱图可知,R的相对分子质量是106,由核磁共振氢谱图知,分子内有2种H原子,且数目之比为3∶2。C项有机物分子式为C8H10,其相对分子质量为106,分子内有2种等效氢原子,且数目之比为3∶2,符合已知条件。
7.A 解析 二者互为同分异构体,则通过李比希元素分析法得出的信息完全相同,A项符合题意;官能团不同,红外光谱信号不同,B项不符合题意;二者含有的氢原子的种类和个数虽然相同,但峰出现的位置不同,核磁共振氢谱图信号不完全相同,C项不符合题意;二者的相对分子质量相等,用质谱仪测定的最大质荷比相同,但信号不完全相同,D项不符合题意。
8.答案 (1)g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)
(2)吸收水分,得到干燥纯净的O2 (3)CH2
(4)C5H10
解析 (1)H2O2分解产生氧气中含有水,应干燥后才可与有机物反应,生成二氧化碳和水,用无水氯化钙吸收水,用NaOH吸收二氧化碳,整套装置为D→C→E→B→A,干燥管的两端可以颠倒,各导管接口顺序为g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)。
(2)C中浓硫酸作用是吸收水分,得到干燥纯净的O2。
(3)B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2,E为有机物燃烧装置,m(CO2)=2.2 g,n(CO2)=0.05 mol,m(H2O)=0.9 g,则n(H2O)=0.05 mol,则m(C)+m(H)=12×0.05 g+2×0.05 g=0.7 g,所以有机物中不含氧元素,又n(C)∶n(H)=0.05∶(0.05×2)=1∶2,所以该有机物的实验式为CH2。
(4)在相同条件下M蒸气相对氢气的密度为35,则M的相对分子质量为35×2=70,设M的分子式为(CH2)n,则n==5,M的分子式为C5H10;若有机物M不能使溴水褪色,且其核磁共振氢谱图中只有一组吸收峰,说明M中不存在不饱和键,则M为环戊烷,其结构简式为。
9.BD 解析 在氧气中充分燃烧0.2 mol某有机物,得到0.4 mol CO2(含0.4 mol C原子)和10.8 g H2O,即0.6 mol H2O(含1.2 mol H原子),根据元素守恒,可知1个该有机物分子中含有2个碳原子和6个氢原子,无法确定其是否含有氧原子,故B、D正确。
10.B 解析 由题意知,O的质量分数为100%-51.52%=48.48%,该有机化合物的相对分子质量大于110,小于150,所以1分子该有机化合物中O原子个数大于110×48.48%÷16=3.3,小于150×48.48%÷16=4.5,即O原子为4个,所以该有机化合物的相对分子质量==132,其中C、H的相对原子质量之和为132-16×4=68,可确定该有机化合物的分子式为C5H8O4,该分子的不饱和度为2,因此分子中最多含有2个羰基结构,B正确。
11.BD 解析 气态烃A在标准状况下的密度是3.214 g·L-1,则该气体摩尔质量为M=3.214 g·L-1×22.4 L· mol-1≈72 g· mol-1,取7.2 g A在足量O2中充分燃烧,把燃烧后的产物全部通过浓硫酸,浓硫酸质量增加10.8 g,则m(H2O)=10.8 g,n(H2O)=0.6 mol,再把剩余气体通过碱石灰,碱石灰质量增加22 g,则m(CO2)=22 g,n(CO2)=0.5 mol,所以该烃分子式为C5H12。该烃的摩尔质量为72 g· mol-1,故A错误;该烃的分子式为C5H12,故B正确;该烃可以燃烧,燃烧为氧化反应,故C错误;该烃分子中一个氢原子被溴原子取代后得到C5H11Br,C5H11—有8种不同的结构,故D正确。
12.C 解析 氧元素质量分数为36.37%,若分子中含有一个氧原子,相对分子质量约为44,若含有两个氧原子,相对分子质量约为88;该有机物的相对分子质量在50~100之间,所以该有机物的相对分子质量为88,分子式为C4H8O2。若该有机物属于酯类,则有甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯4种,A正确;若属于羧酸,有丁酸、2-甲基丙酸2种,B正确;既含有羟基又含有醛基的有2-羟基丁醛、3-羟基丁醛、4-羟基丁醛、2-甲基-2-羟基丙醛、2-甲基-3-羟基丙醛5种,C错误;存在分子中含有六元环的同分异构体,D正确。
13.AD 解析 无水CaCl2增重7.2 g,说明燃烧生成水7.2 g,n(H)=×2=0.8 mol,m(H)=0.8 g,KOH浓溶液增重22.0 g,说明生成CO2 22 g,n(CO2)==0.5 mol,m(C)=6 g,剩余的是氧元素的质量,m(O)=10.0 g-0. 8 g-6 g=3.2 g,n(O)=0.2 mol,则该分子中碳、氢、氧原子的个数比是0.5 mol∶0.8 mol∶0.2 mol=5∶8∶2,则有机物X的实验式是C5H8O2,由质谱图可知X的相对分子质量是100,则X的分子式是C5H8O2,故A正确,B错误;有机物X中含有醛基,核磁共振氢谱图中有2组吸收峰,则分子中含有两种氢原子,又因为分子式是C5H8O2,且两种氢原子之比是3∶1,所以X的结构简式为(CH3)2C(CHO)2,故C错误;有机物X含有两个醛基,符合条件的同分异构体有CH3CH2CH(CHO)2、CH3CH(CHO)CH2CHO、OHCCH2CH2CH2CHO共3种,故D正确。
14.答案 (1)CH3CH2OCH2CH3
(2)①90 ②C3H6O3 ③—COOH、—OH ④4
⑤
解析 (1)由A的红外光谱图可知,A分子中含有对称的甲基、对称的亚甲基和醚键,则A为乙醚,结构简式为CH3CH2OCH2CH3。
(2)①由B的密度是相同条件下H2的45倍,可知B的相对分子质量为45×2=90。
②由题意可知,B的物质的量n(B)=0.1 mol,n(C)=n(CO2)==0.3 mol,n(H)=2n(H2O)=×2=0.6 mol,n(O)=
=0.3 mol,n(B)∶n(C)∶n(H)∶n(O)=0.1 mol∶0.3 mol∶0.6 mol∶0.3 mol=1∶3∶6∶3,则B的分子式为C3H6O3。
③0.1 mol B与足量的NaHCO3反应放出0.1 mol CO2,说明B分子中含有1个羧基,与足量金属钠反应生成0.1 mol H2,说明B分子中还含有1个羟基。
④B分子的核磁共振氢谱图中有4组吸收峰,峰面积之比为1∶1∶1∶3,可知B中含有4种氢原子。
⑤B的分子式为C3H6O3,分子中含有1个羟基和1个羧基,且核磁共振氢谱图中峰面积比为1∶1∶1∶3,则B的结构简式为。
15.答案 (1)
(2)羧基 CH3CH2COOH (3)92 C7H8
解析 (1)有机物A的分子式为C3H6O3,其分子结构中含有羧基和羟基,核磁共振氢谱图中峰面积之比为1∶2∶2∶1,说明没有甲基,则该有机物的键线式为。
(2)由质谱图表明有机物B的相对分子质量为74,由红外光谱可知有机物B含有羰基、羟基、碳氧单键,所以有机物B至少有2个氧原子;核磁共振氢谱图中峰面积之比为3∶2∶1,说明有机物B至少有6个氢原子,B的相对分子质量为74,可推断有机物B的分子式为C3H6O2,结构简式为CH3CH2COOH或CH3COCH2OH。有机物B可用作食品防腐剂、防霉剂、硝酸纤维素溶剂和增塑剂等,说明有机物B中含有羧基,所以有机物B的结构简式为CH3CH2COOH。
(3)由质谱图可知,有机物C的相对分子质量为92。将9.2 g该有机物(物质的量为0.1 mol)完全燃烧,生成标准状况下15.68 L CO2(物质的量为0.7 mol)和7.2 g水(物质的量为0.4 mol),根据碳氢守恒得有机物C的分子式为C7H8Ox,根据相对分子质量得x=0,所以有机物C的分子式为C7H8。
16.答案 (1)C8H6O4
(2)
(3)、(答案合理即可)
解析 (1)由①可知,X可能为有机酸;由②可知,166 mg X完全燃烧生成CO2的物质的量为=8×10-3 mol,生成H2O的物质的量为=3×10-3 mol,则166 mg X中含C元素的质量为8×10-3 mol×12×103 mg· mol-1=96 mg,含H元素的质量为3×10-3 mol×1×103 mg· mol-1×2=6 mg,则含O元素的质量为166 mg-96 mg-6 mg=64 mg,O元素的物质的量为=4×10-3 mol,则X中C、H、O的原子个数比为(8×10-3 mol)∶(3×10-3 mol×2)∶(4×10-3 mol)=4∶3∶2,则X的实验式为C4H3O2,结合③④可知,X的分子式为C8H6O4,结构简式为。
(2)X的一种同分异构体(与X具有相同的官能团)在一定条件下可发生分子内脱水反应生成一种含有五元环的有机化合物Y,则X的同分异构体为邻苯二甲酸,Y的结构简式为。
(3)X的某些同分异构体具有如下性质:a.能发生水解反应,则分子中有酯基;b.能发生银镜反应,则分子中有醛基;c.能与氯化铁溶液发生显色反应,则分子中有酚羟基。其可能的结构有、等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
