专题4 生活中常用的有机物——烃的含氧衍生物 分层作业16 (含答案)羧酸的性质及应用--2025苏教版化学选择性必修3同步练习题
文档属性
| 名称 | 专题4 生活中常用的有机物——烃的含氧衍生物 分层作业16 (含答案)羧酸的性质及应用--2025苏教版化学选择性必修3同步练习题 |  | |
| 格式 | docx | ||
| 文件大小 | 670.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-29 10:02:13 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学选择性必修3
专题4分层作业16 羧酸的性质及应用
必备知识基础练
1.[2024河北衡水期中]化学与生活密切相关。下列物质的用途错误的是( )
A.95%酒精常用于杀菌消毒
B.氯仿常用作有机溶剂
C.苯甲酸可用作食品防腐剂
D.丙烯可用于制备聚丙烯塑料
2.在同温同压下,一定量的某有机物与过量Na反应得到V1 L 氢气,另一份等量的有机物与足量的NaHCO3溶液反应得到V2 L二氧化碳,若V1=V2,则该有机物可能是( )
A.
B.HOOC—COOH
C.HOCH2CH2OH
D.CH3COOH
3.己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:
下列说法正确的是( )
A.苯与溴水混合,充分振荡后静置,下层溶液呈橙红色
B.环己醇与乙醇互为同系物
C.环己烷分子中所有碳原子共平面
D.1 mol己二酸与足量NaHCO3溶液反应生成88 g CO2
4.Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )
A.遇FeCl3溶液显紫色
B.属于芳香族化合物
C.分子中有3个手性碳原子
D.可发生加成、氧化和水解反应
5.A是相对分子质量为28的烃,它的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成乙酸乙酯(CH3COOCH2CH3),合成路线如图所示。
回答下列问题:
(1)写出A的结构简式: 。
(2)写出B→C转化的化学方程式: 。
(3)实验室用如图所示的装置制取乙酸乙酯,他们在试管a中按顺序加入碎瓷片、乙醇、浓硫酸和乙酸,然后加热。
①在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
②试管b中观察到的现象是 。试管a中生成乙酸乙酯的化学方程式为 。b使用饱和Na2CO3溶液的作用是除去乙酸、吸收乙醇、 。
(4)工业上用A和CH3COOH在一定条件下直接反应制得乙酸乙酯。
①反应类型是 (填“加成”或“取代”)反应。
②与实验室制法相比,工业制法的优点是 。
6.某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱进行下述实验。该校学生设计了下图的实验装置(夹持仪器已略去)。
(1)某学生检查装置A的气密性时,先关闭止水夹,从左管向U形管内加水,至左管液面高于右管液面,静置一段时间后,若U形管两侧液面差不发生变化,则气密性良好。你认为该学生的操作正确与否 (填“正确”或“错误”),大理石与乙酸溶液反应的离子方程式为
。
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ,反应的离子方程式为 。
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是 ,改进该装置的方法是 。
(4)在相同温度下,相同物质的量浓度的下列溶液,其pH由大到小排列的顺序为 (填字母)。
a.NaHCO3溶液
b.Na2CO3溶液
c.CH3COONa溶液
d.溶液
关键能力提升练
7.绿原酸亦称“绿吉酸”(结构如图所示),其抗氧化能力强,还具有抗艾滋病毒、抗肿瘤细胞、抗菌、提高中枢兴奋、抗过敏等功能。若等物质的量的绿原酸在一定条件下分别与Na、NaOH溶液、NaHCO3溶液反应,则消耗的Na、NaOH、NaHCO3的物质的量之比为( )
A.6∶4∶1 B.6∶3∶1
C.6∶3∶3 D.6∶7∶3
8.如下三种有机化合物是某些药物中的有效成分,下列关于它们的说法正确的是( )
对羟基桂皮酸
布洛芬
阿司匹林
A.三种有机化合物都是芳香烃
B.向等物质的量的三种有机化合物中加入足量的NaOH溶液,阿司匹林消耗的NaOH的量最多
C.三种有机化合物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种(不考虑立体异构)
D.1 mol 对羟基桂皮酸最多可以与1 mol Br2反应
9.乙酸乙酯的制备实验过程如下:
步骤1:在一支试管中加入3 mL 乙醇,然后边振荡边缓缓加入2 mL 浓硫酸和2 mL乙酸,再加入几片碎瓷片,加热并收集蒸出的乙酸乙酯粗品。
步骤2:向盛有乙酸乙酯粗品的试管中滴加1~2滴KMnO4溶液,振荡,紫红色褪去。
步骤3:向盛有Na2CO3溶液的试管中滴加乙酸乙酯粗品,振荡,有气泡产生。
下列说法正确的是( )
A.步骤1中使用过量的乙醇能提高乙酸的转化率
B.步骤1中使用碎瓷片的目的是作反应的催化剂
C.步骤2中紫红色变浅说明乙酸乙酯粗品含有乙烯
D.步骤3中发生反应的离子方程式为C+2H+H2O+CO2↑
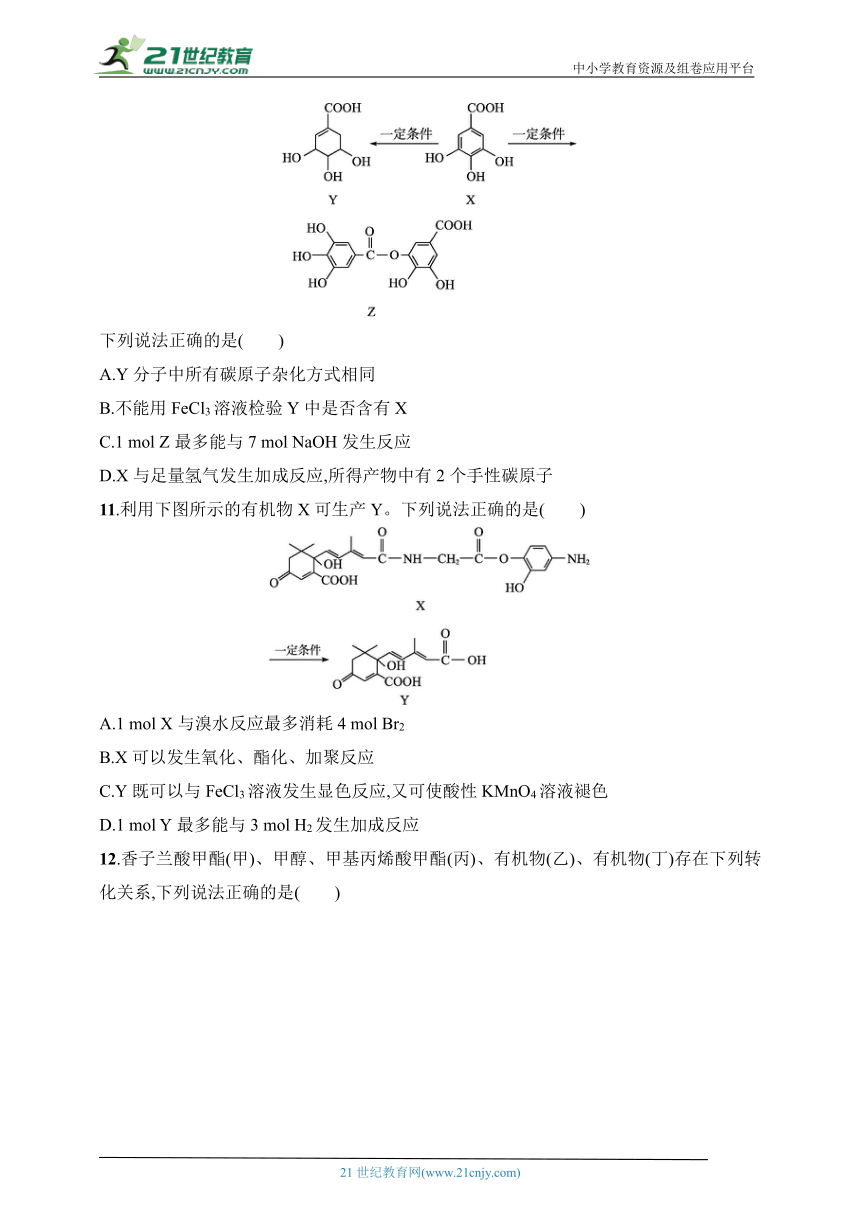
10.[2024河北石家庄期中]五倍子是种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。
下列说法正确的是( )
A.Y分子中所有碳原子杂化方式相同
B.不能用FeCl3溶液检验Y中是否含有X
C.1 mol Z最多能与7 mol NaOH发生反应
D.X与足量氢气发生加成反应,所得产物中有2个手性碳原子
11.利用下图所示的有机物X可生产Y。下列说法正确的是( )
A.1 mol X与溴水反应最多消耗4 mol Br2
B.X可以发生氧化、酯化、加聚反应
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1 mol Y最多能与3 mol H2发生加成反应
12.香子兰酸甲酯(甲)、甲醇、甲基丙烯酸甲酯(丙)、有机物(乙)、有机物(丁)存在下列转化关系,下列说法正确的是( )
A.丙的分子式为C5H10O2
B.乙→丁的反应类型为取代反应
C.乙、丁中的官能团种类均为3种
D.甲的同分异构体中含有苯环且取代基与甲完全相同的有9种
学科素养创新练
13.乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯(CH3COOCH2CH2CH2CH3)的反应装置示意图和有关信息如下:
物质 乙酸 正丁醇 乙酸丁酯
熔点/ ℃ 16.6 -89.5 -73.5
沸点/ ℃ 117.9 117 126.0
1.1 0.80 0.88
(1)乙酸丁酯粗产品的制备。
在干燥的50 mL 圆底烧瓶中,装入沸石,加入12.0 mL 正丁醇和16.0 mL 冰醋酸(过量),再加3~4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。写出制备乙酸丁酯的化学方程式: 。
装置中冷水应从 (填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是 。
(2)乙酸丁酯的精制。
①将乙酸丁酯粗产品用如下的操作进行精制:a.水洗、b.蒸馏、c.用无水MgSO4干燥、d.用10%碳酸钠溶液洗涤。正确的操作步骤是 (填字母)。
A.abcd B.cadb
C.dacb D.cdab
②在乙酸丁酯的精制中,用10%碳酸钠溶液洗涤的主要目的是 。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填字母)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率。
测量分水器内由乙酸与丁醇反应生成水的体积为1.8 mL ,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率约为 。
分层作业16 羧酸的性质及应用
1.A 解析 体积分数为75%的酒精常用于杀菌消毒,故A错误;四氯化碳俗称氯仿,是良好的有机溶剂,故B正确;苯甲酸可用作食品防腐剂,故C正确;丙烯通过聚合反应生成聚丙烯来制备塑料,故D正确。
2.A 解析 一定量的有机物与过量Na反应得到V1 L 氢气,说明分子中含有—OH或—COOH,另一份等量的该有机物与足量的NaHCO3溶液反应得到V2 L 二氧化碳,说明分子中含有—COOH,反应关系式为2—OH~H2,2—COOH~H2,以及—COOH~NaHCO3~CO2,若同温同压下,V1=V2,说明该有机物的分子中含有—OH和—COOH且二者数目相等。
3.D 解析 苯的密度比水小,苯与溴水混合,充分振荡后静置,有机层在上层,应是上层溶液呈橙红色,故A错误;环己醇含有六元碳环,和乙醇结构不相似,分子组成也不相差若干CH2原子团,不互为同系物,故B错误;环己烷分子中的碳原子均为饱和碳原子,与每个碳原子直接相连的4个原子形成四面体结构,因此所有碳原子不可能共平面,故C错误;1 mol己二酸与足量NaHCO3溶液反应生成2 mol CO2,即88 g CO2,故D正确。
4.A 解析 该物质不含酚羟基,遇氯化铁溶液不显紫色,A错误;含有苯环,属于芳香族化合物,B正确;分子中有3个手性碳原子,如图,C正确;分子中含有苯环、碳碳双键和酯基,故能发生加成反应、氧化反应和水解反应,D正确。
5.答案 (1)CH2CH2
(2)2CH3CH2OH+O22CH3CHO+2H2O
(3)①防倒吸 ②液体分为两层,上层为透明油状液体,有香味 CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O 冷凝酯蒸气、减小酯在水中的溶解度(利于分层)
(4)①加成 ②原子利用率高
解析 A的产量通常用来衡量一个国家的石油化工水平,则A为CH2CH2,B为CH3CH2OH,C为CH3CHO,D为CH3COOH。
(1)A为乙烯,结构简式为CH2CH2。
(2)乙醇和O2在催化剂、加热条件下生成乙醛,化学方程式为2CH3CH2OH+O22CH3CHO+2H2O。
(3)①在实验中球形干燥管除起冷凝作用外,另一个重要作用是防倒吸。②试管b中观察到的现象是液体分为两层,上层为乙酸乙酯,则上层为透明油状液体,有香味;试管a中乙醇与乙酸在浓硫酸、加热条件下反应生成乙酸乙酯;b使用饱和Na2CO3溶液的作用除了除去乙酸、吸收乙醇外,还有冷凝酯蒸气、减小酯在水中的溶解度(利于分层)等作用。
(4)①工业上用A和CH3COOH在一定条件下直接反应制得乙酸乙酯,只有一种生成物,该反应属于加成反应;②与实验室制法相比,工业制法的优点是原子利用率高。
6.答案 (1)正确 2CH3COOH+CaCO32CH3COO-+Ca2++H2O+CO2↑ (2)溶液变浑浊 +CO2+H2O+HC (3)乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应生成苯酚 在A和B之间加一个吸收装置,内盛饱和NaHCO3溶液 (4)bdac
解析 (4)酸性:CH3COOH>H2CO3>>HC,故溶液碱性:Na2CO3>>NaHCO3>CH3COONa。
7.A 解析 绿原酸中含有酚羟基、酯基、醇羟基、羧基,具有酚类、酯类、醇类、羧酸类物质的化学性质,钠能与羟基、羧基反应,氢氧化钠能与酚羟基、羧基和酯基反应,碳酸氢钠能与羧基反应。该有机物分子结构中含有5个羟基(2个酚羟基和3个醇羟基)、1个酯基、1个羧基,所以等物质的量的该有机物消耗钠、氢氧化钠、碳酸氢钠的物质的量之比为6∶4∶1,故选A。
8.B 解析 由结构简式可知,三种有机化合物都含有氧原子,属于烃的衍生物,A项错误;1 mol 对羟基桂皮酸消耗2 mol NaOH,1 mol 布洛芬消耗1 mol NaOH,1 mol 阿司匹林消耗3 mol NaOH,则等物质的量的三种有机物中阿司匹林消耗氢氧化钠的量最多,B项正确;阿司匹林结构不对称,苯环上的氢原子被氯原子取代所得一氯代物有4种,C项错误;1 mol 对羟基桂皮酸分子最多可以与3 mol Br2反应,D项错误。
9.A 解析 乙酸与乙醇的酯化反应为可逆反应,提高一种反应物的用量,可以使平衡正向移动,提高另一种反应物的转化率,A正确;碎瓷片的作用是防止暴沸,浓硫酸是催化剂,B错误;步骤2中紫红色变浅也可能是因为含有溶解在乙酸乙酯中的未反应的乙醇,C错误;乙酸为弱酸,离子方程式应为C+2CH3COOHH2O+CO2↑+2CH3COO-,D错误。
10.D 解析 由题干中Y的结构简式可知,碳氧双键和碳碳双键上的碳原子采取sp2杂化,其他碳原子采取sp3杂化,故A错误;由题干中X、Y的结构简式可知,X分子中含有酚羟基,Y分子中不含酚羟基,故能用FeCl3溶液检验Y中是否含有X,B错误;由题干中Z的结构简式可知,1 mol Z中含有5 mol酚羟基和1 mol羧基,故能消耗6 mol NaOH,还有1 mol酚酯基,能够消耗2 mol NaOH,故1 mol Z最多能与8 mol NaOH发生反应,C错误;X与足量氢气发生加成反应,所得产物中有2个手性碳原子,如图所示:,D正确。
11.B 解析 X中含有碳碳双键,1 mol X可以与3 mol Br2发生加成反应;此外酚羟基的邻、对位氢原子可与Br2发生取代反应,则1 mol X与溴水反应最多消耗5 mol Br2,A错误。X中含有碳碳双键、醇羟基、酚羟基等,可以发生氧化、酯化、加聚反应,B正确。Y中不含酚羟基,不能与FeCl3溶液发生显色反应,C错误。1 mol Y最多能与4 mol H2发生加成反应,D错误。
12.D 解析 根据丙的结构简式,可知其分子式为C5H8O2,A项错误;乙生成丁的过程中乙中的共轭双键打开发生1,4-加成,丙中碳碳双键打开发生加成,形成环状结构,该反应属于加成反应,B项错误;乙、丁中均含有碳碳双键、醚键、羰基、酯基,共4种官能团,C项错误;符合条件的甲的同分异构体除去甲还有9种,D项正确。
13.答案 (1)CH3COOH+CH3CH2CH2CH2OHCH3COOCH2CH2CH2CH3+H2O b 使平衡正向移动,提高乙酸丁酯的产率 (2)①C ②除去产品中含有的乙酸、硫酸等杂质,降低乙酸丁酯在水中的溶解度 ③d (3)77.1%
解析 (1)正丁醇和冰醋酸(过量)发生酯化反应生成乙酸丁酯和水,反应的化学方程式为CH3COOH+
CH3CH2CH2CH2OHCH3COOCH2CH2CH2CH3+H2O;为使整个冷凝管中充满水,水应该从b口通入;正丁醇和冰醋酸(过量)反应生成乙酸丁酯和水的酯化反应为可逆反应,水的沸点(100 ℃)低于乙酸丁酯的沸点(126.0 ℃),反应时先将生成的水汽化分离,可以促使平衡正向移动,提高乙酸丁酯的产率。
(2)①由于正丁醇、乙酸、乙酸丁酯能够互溶,所制取的乙酸丁酯中含有正丁醇、乙酸和催化剂硫酸,第一步采用10%碳酸钠溶液洗涤除去乙酸和硫酸等杂质,第二步用水洗除去碳酸钠溶液,第三步用无水硫酸镁干燥除去水,第四步蒸馏,制得较纯净的乙酸丁酯。故排序为C。
②10%碳酸钠溶液可除去乙酸、硫酸等杂质,降低乙酸丁酯在水中的溶解度,减少产物损失。
③由于酯的密度比水小,二者互不相溶,因此水溶液在下层,酯在上层。分液时,要先将下层的水溶液从分液漏斗的下口放出,待下层恰好放完时关闭分液漏斗的活塞,再将上层的乙酸丁酯从上口倒出,所以正确的为d。
(3)12.0 mL 正丁醇的质量为9.6 g ,则12.0 mL 正丁醇理论上生成酯的物质的量n(理论乙酸丁酯)=n(正丁醇)= mol ;n(实际乙酸丁酯)=n(水)==0.10 mol ;乙酸丁酯的产率为×100%≈77.1%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学选择性必修3
专题4分层作业16 羧酸的性质及应用
必备知识基础练
1.[2024河北衡水期中]化学与生活密切相关。下列物质的用途错误的是( )
A.95%酒精常用于杀菌消毒
B.氯仿常用作有机溶剂
C.苯甲酸可用作食品防腐剂
D.丙烯可用于制备聚丙烯塑料
2.在同温同压下,一定量的某有机物与过量Na反应得到V1 L 氢气,另一份等量的有机物与足量的NaHCO3溶液反应得到V2 L二氧化碳,若V1=V2,则该有机物可能是( )
A.
B.HOOC—COOH
C.HOCH2CH2OH
D.CH3COOH
3.己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:
下列说法正确的是( )
A.苯与溴水混合,充分振荡后静置,下层溶液呈橙红色
B.环己醇与乙醇互为同系物
C.环己烷分子中所有碳原子共平面
D.1 mol己二酸与足量NaHCO3溶液反应生成88 g CO2
4.Calanolide A是一种抗HIV药物,其结构简式如图所示。下列关于Calanolide A的说法错误的是( )
A.遇FeCl3溶液显紫色
B.属于芳香族化合物
C.分子中有3个手性碳原子
D.可发生加成、氧化和水解反应
5.A是相对分子质量为28的烃,它的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成乙酸乙酯(CH3COOCH2CH3),合成路线如图所示。
回答下列问题:
(1)写出A的结构简式: 。
(2)写出B→C转化的化学方程式: 。
(3)实验室用如图所示的装置制取乙酸乙酯,他们在试管a中按顺序加入碎瓷片、乙醇、浓硫酸和乙酸,然后加热。
①在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
②试管b中观察到的现象是 。试管a中生成乙酸乙酯的化学方程式为 。b使用饱和Na2CO3溶液的作用是除去乙酸、吸收乙醇、 。
(4)工业上用A和CH3COOH在一定条件下直接反应制得乙酸乙酯。
①反应类型是 (填“加成”或“取代”)反应。
②与实验室制法相比,工业制法的优点是 。
6.某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱进行下述实验。该校学生设计了下图的实验装置(夹持仪器已略去)。
(1)某学生检查装置A的气密性时,先关闭止水夹,从左管向U形管内加水,至左管液面高于右管液面,静置一段时间后,若U形管两侧液面差不发生变化,则气密性良好。你认为该学生的操作正确与否 (填“正确”或“错误”),大理石与乙酸溶液反应的离子方程式为
。
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ,反应的离子方程式为 。
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是 ,改进该装置的方法是 。
(4)在相同温度下,相同物质的量浓度的下列溶液,其pH由大到小排列的顺序为 (填字母)。
a.NaHCO3溶液
b.Na2CO3溶液
c.CH3COONa溶液
d.溶液
关键能力提升练
7.绿原酸亦称“绿吉酸”(结构如图所示),其抗氧化能力强,还具有抗艾滋病毒、抗肿瘤细胞、抗菌、提高中枢兴奋、抗过敏等功能。若等物质的量的绿原酸在一定条件下分别与Na、NaOH溶液、NaHCO3溶液反应,则消耗的Na、NaOH、NaHCO3的物质的量之比为( )
A.6∶4∶1 B.6∶3∶1
C.6∶3∶3 D.6∶7∶3
8.如下三种有机化合物是某些药物中的有效成分,下列关于它们的说法正确的是( )
对羟基桂皮酸
布洛芬
阿司匹林
A.三种有机化合物都是芳香烃
B.向等物质的量的三种有机化合物中加入足量的NaOH溶液,阿司匹林消耗的NaOH的量最多
C.三种有机化合物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种(不考虑立体异构)
D.1 mol 对羟基桂皮酸最多可以与1 mol Br2反应
9.乙酸乙酯的制备实验过程如下:
步骤1:在一支试管中加入3 mL 乙醇,然后边振荡边缓缓加入2 mL 浓硫酸和2 mL乙酸,再加入几片碎瓷片,加热并收集蒸出的乙酸乙酯粗品。
步骤2:向盛有乙酸乙酯粗品的试管中滴加1~2滴KMnO4溶液,振荡,紫红色褪去。
步骤3:向盛有Na2CO3溶液的试管中滴加乙酸乙酯粗品,振荡,有气泡产生。
下列说法正确的是( )
A.步骤1中使用过量的乙醇能提高乙酸的转化率
B.步骤1中使用碎瓷片的目的是作反应的催化剂
C.步骤2中紫红色变浅说明乙酸乙酯粗品含有乙烯
D.步骤3中发生反应的离子方程式为C+2H+H2O+CO2↑
10.[2024河北石家庄期中]五倍子是种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。
下列说法正确的是( )
A.Y分子中所有碳原子杂化方式相同
B.不能用FeCl3溶液检验Y中是否含有X
C.1 mol Z最多能与7 mol NaOH发生反应
D.X与足量氢气发生加成反应,所得产物中有2个手性碳原子
11.利用下图所示的有机物X可生产Y。下列说法正确的是( )
A.1 mol X与溴水反应最多消耗4 mol Br2
B.X可以发生氧化、酯化、加聚反应
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1 mol Y最多能与3 mol H2发生加成反应
12.香子兰酸甲酯(甲)、甲醇、甲基丙烯酸甲酯(丙)、有机物(乙)、有机物(丁)存在下列转化关系,下列说法正确的是( )
A.丙的分子式为C5H10O2
B.乙→丁的反应类型为取代反应
C.乙、丁中的官能团种类均为3种
D.甲的同分异构体中含有苯环且取代基与甲完全相同的有9种
学科素养创新练
13.乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯(CH3COOCH2CH2CH2CH3)的反应装置示意图和有关信息如下:
物质 乙酸 正丁醇 乙酸丁酯
熔点/ ℃ 16.6 -89.5 -73.5
沸点/ ℃ 117.9 117 126.0
1.1 0.80 0.88
(1)乙酸丁酯粗产品的制备。
在干燥的50 mL 圆底烧瓶中,装入沸石,加入12.0 mL 正丁醇和16.0 mL 冰醋酸(过量),再加3~4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。写出制备乙酸丁酯的化学方程式: 。
装置中冷水应从 (填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是 。
(2)乙酸丁酯的精制。
①将乙酸丁酯粗产品用如下的操作进行精制:a.水洗、b.蒸馏、c.用无水MgSO4干燥、d.用10%碳酸钠溶液洗涤。正确的操作步骤是 (填字母)。
A.abcd B.cadb
C.dacb D.cdab
②在乙酸丁酯的精制中,用10%碳酸钠溶液洗涤的主要目的是 。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填字母)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率。
测量分水器内由乙酸与丁醇反应生成水的体积为1.8 mL ,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率约为 。
分层作业16 羧酸的性质及应用
1.A 解析 体积分数为75%的酒精常用于杀菌消毒,故A错误;四氯化碳俗称氯仿,是良好的有机溶剂,故B正确;苯甲酸可用作食品防腐剂,故C正确;丙烯通过聚合反应生成聚丙烯来制备塑料,故D正确。
2.A 解析 一定量的有机物与过量Na反应得到V1 L 氢气,说明分子中含有—OH或—COOH,另一份等量的该有机物与足量的NaHCO3溶液反应得到V2 L 二氧化碳,说明分子中含有—COOH,反应关系式为2—OH~H2,2—COOH~H2,以及—COOH~NaHCO3~CO2,若同温同压下,V1=V2,说明该有机物的分子中含有—OH和—COOH且二者数目相等。
3.D 解析 苯的密度比水小,苯与溴水混合,充分振荡后静置,有机层在上层,应是上层溶液呈橙红色,故A错误;环己醇含有六元碳环,和乙醇结构不相似,分子组成也不相差若干CH2原子团,不互为同系物,故B错误;环己烷分子中的碳原子均为饱和碳原子,与每个碳原子直接相连的4个原子形成四面体结构,因此所有碳原子不可能共平面,故C错误;1 mol己二酸与足量NaHCO3溶液反应生成2 mol CO2,即88 g CO2,故D正确。
4.A 解析 该物质不含酚羟基,遇氯化铁溶液不显紫色,A错误;含有苯环,属于芳香族化合物,B正确;分子中有3个手性碳原子,如图,C正确;分子中含有苯环、碳碳双键和酯基,故能发生加成反应、氧化反应和水解反应,D正确。
5.答案 (1)CH2CH2
(2)2CH3CH2OH+O22CH3CHO+2H2O
(3)①防倒吸 ②液体分为两层,上层为透明油状液体,有香味 CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O 冷凝酯蒸气、减小酯在水中的溶解度(利于分层)
(4)①加成 ②原子利用率高
解析 A的产量通常用来衡量一个国家的石油化工水平,则A为CH2CH2,B为CH3CH2OH,C为CH3CHO,D为CH3COOH。
(1)A为乙烯,结构简式为CH2CH2。
(2)乙醇和O2在催化剂、加热条件下生成乙醛,化学方程式为2CH3CH2OH+O22CH3CHO+2H2O。
(3)①在实验中球形干燥管除起冷凝作用外,另一个重要作用是防倒吸。②试管b中观察到的现象是液体分为两层,上层为乙酸乙酯,则上层为透明油状液体,有香味;试管a中乙醇与乙酸在浓硫酸、加热条件下反应生成乙酸乙酯;b使用饱和Na2CO3溶液的作用除了除去乙酸、吸收乙醇外,还有冷凝酯蒸气、减小酯在水中的溶解度(利于分层)等作用。
(4)①工业上用A和CH3COOH在一定条件下直接反应制得乙酸乙酯,只有一种生成物,该反应属于加成反应;②与实验室制法相比,工业制法的优点是原子利用率高。
6.答案 (1)正确 2CH3COOH+CaCO32CH3COO-+Ca2++H2O+CO2↑ (2)溶液变浑浊 +CO2+H2O+HC (3)乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应生成苯酚 在A和B之间加一个吸收装置,内盛饱和NaHCO3溶液 (4)bdac
解析 (4)酸性:CH3COOH>H2CO3>>HC,故溶液碱性:Na2CO3>>NaHCO3>CH3COONa。
7.A 解析 绿原酸中含有酚羟基、酯基、醇羟基、羧基,具有酚类、酯类、醇类、羧酸类物质的化学性质,钠能与羟基、羧基反应,氢氧化钠能与酚羟基、羧基和酯基反应,碳酸氢钠能与羧基反应。该有机物分子结构中含有5个羟基(2个酚羟基和3个醇羟基)、1个酯基、1个羧基,所以等物质的量的该有机物消耗钠、氢氧化钠、碳酸氢钠的物质的量之比为6∶4∶1,故选A。
8.B 解析 由结构简式可知,三种有机化合物都含有氧原子,属于烃的衍生物,A项错误;1 mol 对羟基桂皮酸消耗2 mol NaOH,1 mol 布洛芬消耗1 mol NaOH,1 mol 阿司匹林消耗3 mol NaOH,则等物质的量的三种有机物中阿司匹林消耗氢氧化钠的量最多,B项正确;阿司匹林结构不对称,苯环上的氢原子被氯原子取代所得一氯代物有4种,C项错误;1 mol 对羟基桂皮酸分子最多可以与3 mol Br2反应,D项错误。
9.A 解析 乙酸与乙醇的酯化反应为可逆反应,提高一种反应物的用量,可以使平衡正向移动,提高另一种反应物的转化率,A正确;碎瓷片的作用是防止暴沸,浓硫酸是催化剂,B错误;步骤2中紫红色变浅也可能是因为含有溶解在乙酸乙酯中的未反应的乙醇,C错误;乙酸为弱酸,离子方程式应为C+2CH3COOHH2O+CO2↑+2CH3COO-,D错误。
10.D 解析 由题干中Y的结构简式可知,碳氧双键和碳碳双键上的碳原子采取sp2杂化,其他碳原子采取sp3杂化,故A错误;由题干中X、Y的结构简式可知,X分子中含有酚羟基,Y分子中不含酚羟基,故能用FeCl3溶液检验Y中是否含有X,B错误;由题干中Z的结构简式可知,1 mol Z中含有5 mol酚羟基和1 mol羧基,故能消耗6 mol NaOH,还有1 mol酚酯基,能够消耗2 mol NaOH,故1 mol Z最多能与8 mol NaOH发生反应,C错误;X与足量氢气发生加成反应,所得产物中有2个手性碳原子,如图所示:,D正确。
11.B 解析 X中含有碳碳双键,1 mol X可以与3 mol Br2发生加成反应;此外酚羟基的邻、对位氢原子可与Br2发生取代反应,则1 mol X与溴水反应最多消耗5 mol Br2,A错误。X中含有碳碳双键、醇羟基、酚羟基等,可以发生氧化、酯化、加聚反应,B正确。Y中不含酚羟基,不能与FeCl3溶液发生显色反应,C错误。1 mol Y最多能与4 mol H2发生加成反应,D错误。
12.D 解析 根据丙的结构简式,可知其分子式为C5H8O2,A项错误;乙生成丁的过程中乙中的共轭双键打开发生1,4-加成,丙中碳碳双键打开发生加成,形成环状结构,该反应属于加成反应,B项错误;乙、丁中均含有碳碳双键、醚键、羰基、酯基,共4种官能团,C项错误;符合条件的甲的同分异构体除去甲还有9种,D项正确。
13.答案 (1)CH3COOH+CH3CH2CH2CH2OHCH3COOCH2CH2CH2CH3+H2O b 使平衡正向移动,提高乙酸丁酯的产率 (2)①C ②除去产品中含有的乙酸、硫酸等杂质,降低乙酸丁酯在水中的溶解度 ③d (3)77.1%
解析 (1)正丁醇和冰醋酸(过量)发生酯化反应生成乙酸丁酯和水,反应的化学方程式为CH3COOH+
CH3CH2CH2CH2OHCH3COOCH2CH2CH2CH3+H2O;为使整个冷凝管中充满水,水应该从b口通入;正丁醇和冰醋酸(过量)反应生成乙酸丁酯和水的酯化反应为可逆反应,水的沸点(100 ℃)低于乙酸丁酯的沸点(126.0 ℃),反应时先将生成的水汽化分离,可以促使平衡正向移动,提高乙酸丁酯的产率。
(2)①由于正丁醇、乙酸、乙酸丁酯能够互溶,所制取的乙酸丁酯中含有正丁醇、乙酸和催化剂硫酸,第一步采用10%碳酸钠溶液洗涤除去乙酸和硫酸等杂质,第二步用水洗除去碳酸钠溶液,第三步用无水硫酸镁干燥除去水,第四步蒸馏,制得较纯净的乙酸丁酯。故排序为C。
②10%碳酸钠溶液可除去乙酸、硫酸等杂质,降低乙酸丁酯在水中的溶解度,减少产物损失。
③由于酯的密度比水小,二者互不相溶,因此水溶液在下层,酯在上层。分液时,要先将下层的水溶液从分液漏斗的下口放出,待下层恰好放完时关闭分液漏斗的活塞,再将上层的乙酸丁酯从上口倒出,所以正确的为d。
(3)12.0 mL 正丁醇的质量为9.6 g ,则12.0 mL 正丁醇理论上生成酯的物质的量n(理论乙酸丁酯)=n(正丁醇)= mol ;n(实际乙酸丁酯)=n(水)==0.10 mol ;乙酸丁酯的产率为×100%≈77.1%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
