专题4 分子空间结构与物质性质 B卷能力提升(含解析)高二化学苏教版(2019)选择性必修二单元测试AB卷
文档属性
| 名称 | 专题4 分子空间结构与物质性质 B卷能力提升(含解析)高二化学苏教版(2019)选择性必修二单元测试AB卷 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-04-30 15:44:49 | ||
图片预览



文档简介
专题4 分子空间结构与物质性质(B卷能力提升)——高二化学苏教版(2019)选择性必修二单元测试AB卷
(时间:75分钟,分值:100分)
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 P-31 S-32 K-39 Cu-64 Zn-65 I-127 Ba-137 Pb-207
单项选择题:本题共16小题,每小题3分,共48分。每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列各组物质中,都是由极性键构成的极性分子的是( )
A.和 B.和
C.和 D.和
2.工业上从硒化亚铜中提取Se的反应之一为。下列与该反应有关的化学用语表述正确的是( )
A.的电子式为
B.的空间结构是三角锥形
C.键角:
D.基态Se原子核外电子有34种空间运动状态
3.下列分子为手性分子的是( )
A. B.
C. D.
4.已知X、Y为前四周期主族元素,基态X原子核外每个能级上电子数相等,基态Y原子最外层电子云轮廓图为球形,内层上s、p能级上电子数之比为1:2,Y的第二电离能与第一电离能之比大于5,X一种单质的单层二维结构如甲图所示,六方晶胞结构如乙图所示,晶胞中最近的两个X原子之间的距离为apm,层间距为bpm,Y原子嵌入X一种单质的层间得到的二维结构图如丙图所示,下列叙述错误的是( )
A.甲、丙二维材料都具有良好的导电性
B.甲、丙结构中X原子都是杂化
C.丙的化学式为
D.乙晶体的密度为
5.一种可用来治疗心脑血管的有机物,其分子结构式如图所示。已知:R、W、X、Y、Z为原子序数依次增大的短周期主族元素,Y和Z同主族。下列说法正确的是( )
A.第一电离能:X>Y>W
B.简单氢化物沸点:X>Z>Y
C.最高价氧化物对应水化物的酸性:W>Z
D.和的中心原子均采取杂化
6.咪唑为五元芳香杂环化合物,且分子中环上原子位于同一平面内,该类化合物在医学上有若重要的用途。如:咪唑()和4-甲基咪唑()都是合成医药中间体的重要原料,下列有关说法正确的是( )
A.咪唑()和4-甲基咪唑()σ键之比为3:2
B.1号N与2号N相比,1号N更容易与形成配位键
C.4-甲基咪唑()中C原子与N原子杂化方式相同
D.4-甲基咪唑()具有碱性,可以与盐酸反应生成相应的盐
7.W、X、Y、Z、M为原子序数依次增大的短周期主族元素,最外层电子数之和为17,X和Z的基态原子均有两个未成对电子,M的某种盐的阴离子由于形成如图的双聚物结构导致溶解度降低。下列说法正确的是( )
A.第一电离能:
B.氢化物的沸点:
C.键角:
D.W和Z形成的常见化合物是极性分子
8.物质结构决定性质。下列有关物质性质的解释错误的是( )
选项 物质性质 解释
A 一氟乙酸的大于一溴乙酸 的电负性比的大,羧基中的羟基的极性更
B 石墨与金刚石硬度差别大 石墨中碳碳键键能小于金刚石中碳碳键键能
C 分子键角: 和中心原子均为杂化且均有一对孤电子对,电负性:,使成键电子对更偏向于,成键电子对间的距离更远,排斥力更小
D 晶体的某些物理性质有各向异性 晶体内部质点排列的有序
A.A B.B C.C D.D
9.下列离子的VSEPR模型与离子的空间立体构型一致的是( )
A. B. C. D.
10.物质的结构决定物质的性质,下列性质差异与结构因素匹配正确的是( )
性质差异 结构因素
A 溶解度(20℃):(29g)大于(9g) 阴离子电荷数
B 酸性: 羟基的极性
C 键角:()大于() 中心原子的杂化方式
D 熔点:低于 晶体类型
A.A B.B C.C D.D
11.短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )
元素 X Y Z W
最高价氧化物的水化物
溶液对应的pH(25℃) 1.00 13.00 1.57 0.70
A.X、W最简单氢化物的键角:X>W
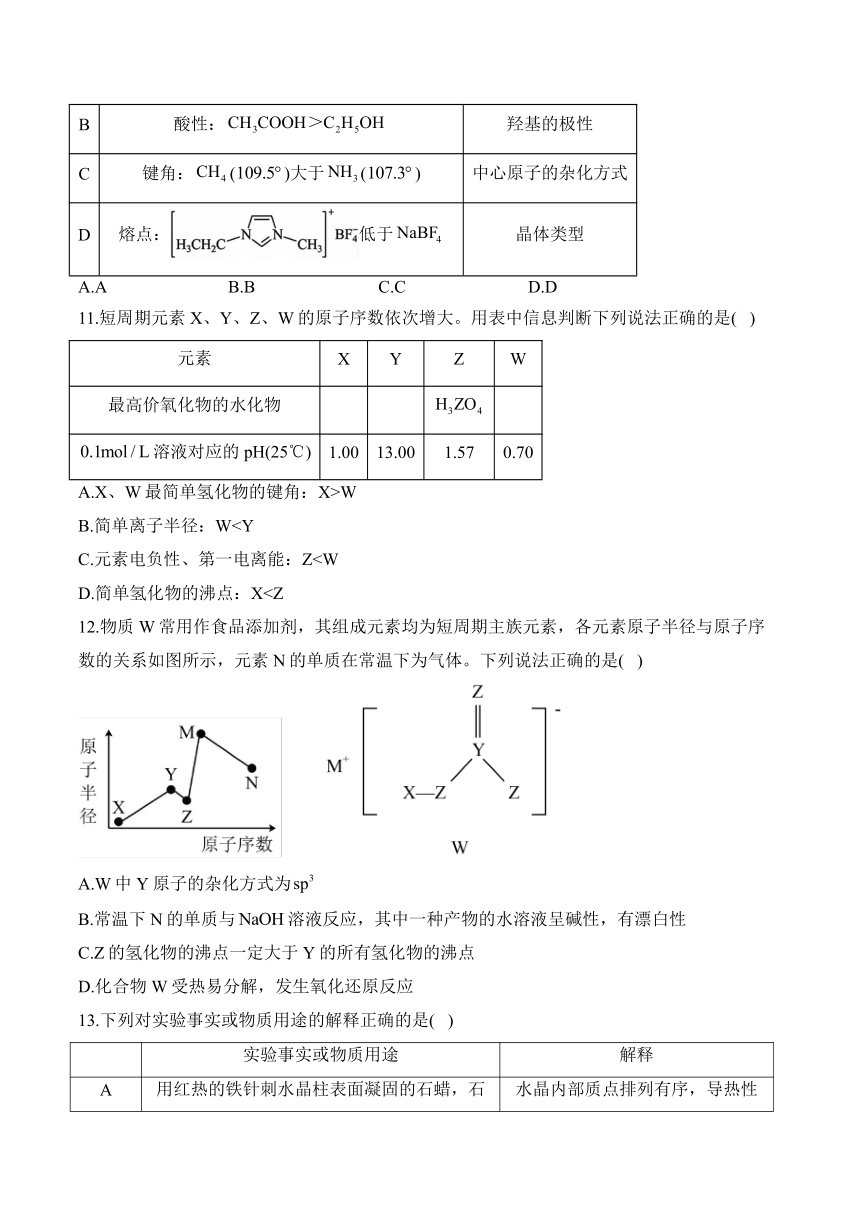
B.简单离子半径:WC.元素电负性、第一电离能:ZD.简单氢化物的沸点:X12.物质W常用作食品添加剂,其组成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,元素N的单质在常温下为气体。下列说法正确的是( )
A.W中Y原子的杂化方式为
B.常温下N的单质与溶液反应,其中一种产物的水溶液呈碱性,有漂白性
C.Z的氢化物的沸点一定大于Y的所有氢化物的沸点
D.化合物W受热易分解,发生氧化还原反应
13.下列对实验事实或物质用途的解释正确的是( )
实验事实或物质用途 解释
A 用红热的铁针刺水晶柱表面凝固的石蜡,石蜡在不同方向熔化的快慢不同 水晶内部质点排列有序,导热性各向异性
B 工业上常用液氨作制冷剂 断裂中H—N需要吸收能量
C 蔗糖易溶于水,难溶于四氯化碳 蔗糖和四氯化碳都是有机物,这违背了“相似相溶”规律
D 紫红色碘的四氯化碳溶液中,加入浓碘化钾水溶液,紫色变浅 碘在水中溶解性比碘在四氯化碳中溶解性好
A.A B.B C.C D.D
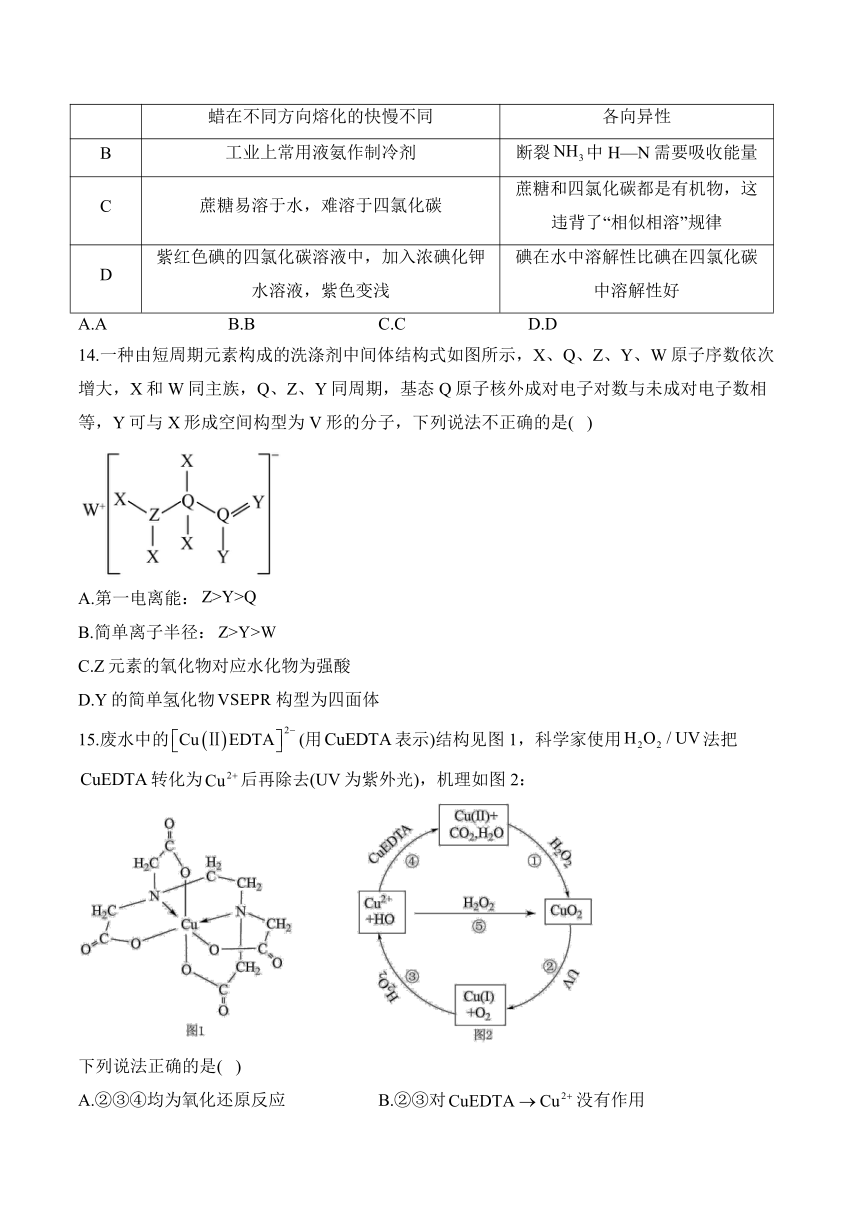
14.一种由短周期元素构成的洗涤剂中间体结构式如图所示,X、Q、Z、Y、W原子序数依次增大,X和W同主族,Q、Z、Y同周期,基态Q原子核外成对电子对数与未成对电子数相等,Y可与X形成空间构型为V形的分子,下列说法不正确的是( )
A.第一电离能:
B.简单离子半径:
C.Z元素的氧化物对应水化物为强酸
D.Y的简单氢化物构型为四面体
15.废水中的(用表示)结构见图1,科学家使用法把转化为后再除去(UV为紫外光),机理如图2:
下列说法正确的是( )
A.②③④均为氧化还原反应 B.②③对没有作用
C.中铜配位数为2 D.中多个五元环使配合物不稳定
16.由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
已知:为浅紫色,为红色,为无色。下列说法错误的是( )
A.溶于水后溶液不是浅紫色而是黄色,是因为水解生成
B.与形成配位键时,S原子提供孤电子对
C.溶液Ⅱ加NaF后溶液由红色变为无色,说明与配位键强度不及与配位键强度
D.焰色试验中可用无锈铁丝替代铂丝,说明铁灼烧时无焰色且不会产生发射光谱
二、填空题:本大题共4小题,17题10分,18题12分,19题14分,20题16分,共52分。
17.钙钛矿是指通式为的一类化合物,最早发现钙钛矿石中的,因此而得名。钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等的功能材料。
(1)基态原子中未成对电子数为___________。
(2)的四卤化物熔点如下表所示,熔点高于其他三种卤化物,自至熔点依次升高,原因是___________。
化合物
熔点 377 -24.12 38.3 155
的立方晶胞如图1所示。
(3)其组成元素的电负性大小顺序是___________。
(4)金属离子与氧离子间的作用力为___________。
A.离子键 B.金属键 C.共价键 D.分子间作用力
(5)晶胞中与距离最近且相等的数目为___________。
A.4 B.8 C.12 D.16
一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子,其晶胞如图2所示。
(6)图1中与具有相同的空间位置的微粒是___________。
A. B. C. D.无
(7)有机碱中,N原子的杂化轨道类型是___________。
(8)若晶胞参数为,则晶体密度为___________(用表示阿伏加德罗常数)。
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。
(9)用离子方程式表示该原理___________、___________。
18.锌及锌合金广泛用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌的流程如下:
已知:是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生相关反应:,
(1)已知(部分结构如图所示)中采用杂化,由此推知:有________种结构。分子中键角为,与中配体键角不同的原因是________________________________________。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅也。”已知:炉甘石的主要成分是,倭铅即指Zn。由此可知,古代炼锌方法类似上述三种方法中的_________(填标号,下同)。
a.半湿法 b.火法 c.全湿法
上述三种方法中,最佳方法是______________。
(3)“氧压酸浸”即在一定浓度稀硫酸中加入锌矿粉,并在加压下通入,除生成外,还能回收非金属单质。写出主要反应的离子方程式:___________。
(4)若将“氧化、调pH”步骤改为直接用过量的NaOH或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响?_________(填“是”或“否”),请说明原因:__________________。
(5)“电解沉积”(以惰性材料为电极)中阳极反应式为___________。航母外壳常镶嵌一些锌块,这种保护航母的电化学方法叫___________。
19.“中国紫”——硅酸铜钡(),其合成原料为、孔雀石和砂子()。回答下列问题:
(1)基态原子核外电子的空间运动状态有_________种;基态原子的价电子排布式_________。
(2)中中C原子的杂化方式为_________,与互为等电子体的分子是_________(写出一种即可)。
(3)孔雀石溶于强酸可生成,与过量氨水可形成配离子,还可与其他微粒形成配离子,如与乙二胺形成配离子的结构如图:
①此配离子内部不含有的化学键类型是_________(填字母)。
A.离子键
B.非极性键
C.配位键
D.氢键
②此配离子中的配位原子为_________,配位数为_________。
③此配离子中三种非金属元素的电负性由大到小依次为_________(用元素符号作答)。
④与相似,也能与乙二胺形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的_________(填“”或“”)。
(4)和C为同主族元素,但它们的氧化物干冰CO2和晶体的熔点差异很大,其原因是_________。
(5)和形成的某种合金的立方体晶胞结构如图所示,设为阿伏加德罗常数的值,该晶体的密度为,则晶胞参数为a=_________(列出计算式)。
20.凉山州是矿产资源“聚宝盆”,下辖的会东、金阳、雷波等县磷矿资源丰富,磷化工产业比较发达。请回答下列问题:
(1)基态磷原子的价电子排布图为:________;其基态原子核外有________种不同能量的电子。
(2)含磷药物磷酸氯喹对治疗新冠肺炎有一定效果,其结构如下图。
磷酸氯喹中所含第二周期元素第一电离能由大到小的顺序为:________,其中碳原子的轨道杂化类型为:________。
(3)卤化磷通常有三卤化磷和五卤化磷。三卤化磷的熔点见下表,试解释、、、熔点逐渐升高的原因是________。
三卤化磷
熔点/℃ -151.5 -93.6 -41.5 61.2
(4)已知晶体中含有等量的和。
①晶体中的化学键有________,其中的空间构型为________。
②晶胞结构如下图,晶胞中含有的P原子的个数为________,已知晶胞边长为apm,阿伏加德罗常数为,则该晶体密度为________(列出计算式即可)。
答案以及解析
1.答案:D
解析:A.和中的C-H键和C-Cl键均为极性键,和分子均为正四面体构型,高度对称,分子中正负电荷的中心重合,均为非极性分子,故A不符合题意;
B.含有N-H极性键,分子空间结构为三角锥形,正负电荷中心不重合,为极性分子;含有C-H极性键,为正四面体构型,高度对称,分子中正负电荷的中心重合,为非极性分子,故B不符合题意;
C.含有C=O极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子;含有C=S极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子,故C不符合题意;
D.含有H-S极性键,正负电荷的中心不重合,是极性分子;HCl含有H-Cl极性键,正负电荷的中心不重合,是极性分子,故D符合题意;答案选D。
2.答案:A
解析:A.中O原子与2个H形成共用电子对,电子式为:,故A正确;
B.中心S原子价层电子对数为4,无孤电子对,空间构型为正四面体形,故B错误;
C.O原子半径小于S,中成键电子对之间的斥力较大,因此键角大于,故C错误;
D.基态Se原子核外电子排布为:,所以基态硒原子核外有18种不同空间运动状态的电子,D项错误;
故选:A。
3.答案:D
解析:A.中,碳原子所连接的2个基团都有一样的,没有手性碳原子,不属于手性分子,故A错误;
B.中两个碳原子均连有两个氢原子,不是手性碳原子,该分子不是手性分子,故B错误;
C.中三个碳原子均连有相同的氢原子,不是手性碳原子,该分子不是手性分子,故C错误;
D.中间的碳原子连有四个不同取代基,该碳原子具有手性,属于手性分子,故D正确;
答案选D。
4.答案:C
解析:X、Y为前四周期主族元素,基态X原子核外每个能级上电子数相等,则X为C元素;基态Y原子最外层电子云轮廓图为球形,内层上s、p能级上电子数之比为1:2,Y的第二电离能与第一电离能之比大于5,则Y为K元素;由晶胞结构可知,甲图为过渡型晶体石墨的单层二维结构、乙图为石墨的六方晶胞结构、丙图为钾原子嵌入石墨的层间得到的二维结构,由丙图可知,钾原子形成的正六边形中,位于顶点和面心的钾原子的个数为6×+1=3、位于面内的碳原子个数为24,则丙的化学式为。
A.石墨和二维材料都为片层晶体,晶体内部含有大量的自由电子,所以石墨和二维材料都具有良好的导电性,故A正确;
B.石墨和二维材料都为片层晶体,晶体中每个碳原子均形成3个σ键,原子的杂化方式都为杂化,故B正确;
C.由分析可知,丙的化学式为,故C错误;
D.由石墨的六方晶胞结构可知,晶胞中位于顶点、面上、棱上、体内的碳原子个数为,晶胞中碳原子之间的距离为由碳原子之间的距离为apm可知,晶胞的参数为,设晶体的密度为,由晶胞的质量公式可得:,解得,故D正确;
故选C。
5.答案:A
解析:A.同周期从左向右第一电离能增大,但是N核外轨道处于半充满状态,因此第一电离能:N>O>C,A正确;
B.X、Y、Z的简单氢化物分别为、、,、有分子间氢键,且水分子之间氢键较多,常温为液体,氨气常温为气体,则沸点:,B错误;
C.非金属性;S>C,因此酸性:,C错误;
D.、的价层电子对数都是3,则其中心原子均采取杂化,D错误;
故选A。
6.答案:D
解析:A.咪唑分子含有9个键,4-甲基咪唑分子含有12个键,故二者含键的个数比为3:4,A错误;
B.4-甲基咪唑()为五元芳香杂环化合物,且分子中环上原子位于同一平面内,则环上的5个原子形成的大键,1号N原子和2号N相比,1号N原子无孤电子对,而2号N原子有孤电子对,则2号N更容易与形成配位键,B错误;
C.4-甲基咪唑()中1号N原子形成3个键,无孤电子对,价层电子对数为3,采取杂化,2号N原子形成2个键,有1个孤电子对,价层电子对数为3,采取杂化,环上的C原子形成3个键,无孤电子对,价层电子对数为3,采取杂化,甲基中的C原子形成4个键,无孤电子对,价层电子对数为4,采取杂化,则C原子与N原子杂化方式不完全相同,C错误;
D.4-甲基咪唑()中2号氮原子上有孤电子对,能与H+反应,具有碱性,可用于盐酸反应生成相应的盐,D正确;故选D。
7.答案:D
解析:W、X、Y、Z、M为短周期主族元素,原子序数依次增大,最外层电子数之和为17,X和Z的基态原子均有两个未成对电子,X为C,Z为O,Y为N;根据结构图示,内含氢键,W为H;最外层电子数之和为17,M最外层电子数为1,M为,据此解答。
Z为O,Y为N,M为,同周期从左到右,元素第一电离能呈增大趋势,第IIA族和第VA族元素第一电离能大于相邻元素,同主族从上到下,元素第一电离能减小,故第一电离能:,A错误;
X为C,Y为N,Z为O,未说明是简单氢化物,无法确定其沸,点关系,B错误;
中C采取杂化,空间结构为平面三角形,键角为,时中N采取杂化,空间结构为正四面体形,键角为,则键角:,C错误;
W和Z形成的常见化合物是,分子空间结构为V形,是极性分子,D正确。
8.答案:B
解析:A.因为电负性大于,电负性越大,吸电子能力越强,导致羧基中羟基的极性越大,越容易电离出氢离子,酸性越强,故一氟乙酸的电离常数大于一溴乙酸,A正确;
B.石墨与金刚石硬度差别大是因为碳原子的排列方式不同,金刚石中碳原子具有空间网状结构,其硬度大,石墨是片层状结构,硬度小,B错误;
C.和中心原子均为染化且均有一对孤电子对,电负性:,使成键电子对更偏向于F,成键电子对间的距离更远,排斥力更小,键角越小,故键角,C正确;
D.因为晶体内部质点排列的有序,故晶体某些物理性质具有各向异性,例如石墨的导电性具有各向异性,D正确;
答案选B。
9.答案:B
解析:
A.写中价层电子对个数且含有一个孤电子对,所以VSEPR模型为四面体结构,实际为三角锥形结构,故A错误;
B.中价层电子对个数且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是正四面体结构,故B正确;
C.中价层电子对个数且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,故C错误;
D.中价层电子对且含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,故D错误;
故选:B。
10.答案:B
解析:A.碳酸氢钠在水中的溶解度比碳酸钠小的原因是碳酸氢钠晶体中间存在氢键,与阴离子电荷数无关,A不正确;
B.乙酸中羟基与羰基相连,乙醇中羟基与乙基相连,羰基的吸电子能力强于乙基,因此乙酸中的羟基极性更强,更易电离,B正确;
C.甲烷和氨气的中心原子的杂化方式均为,其键角差异是:氨气的中心原子N原子上有孤电子对,根据价层电子对互斥理论,孤电子对与σ键的斥力大于σ键之间的斥力,因此氨气的键角略小于109.5°,C不正确;
D.与均为离子化合物,判断离子化合物的熔点高低通常用晶格能,晶格能与离子的电荷、离子的半径和离子的电子层结构有关,离子的电荷越高,半径越小,晶格能越大,熔点越高,与离子电荷相同,但的阳离子半径大于,因此晶格能小,熔点低,D不正确;
故选B。
11.答案:A
解析:0.1mol/L的X最高价氧化物对应水化物溶液的pH=1.00,说明该水化物为一元强酸,因为四种元素为短周期元素,因此X为N元素,同理,Y的最高价氧化物对应水化物为一元强碱,即Y为Na元素,Z的最高价氧化物对应水化物的化学式为,Z为P元素,0.1mol/L的W最高价氧化物对应水化物溶液的pH=0.70,则该水化物为二元强酸,即W为S,据此分析;
A.N的简单氢化物为,S的简单氢化物为,中心原子N有1个孤电子对,中心原子S有2个孤电子对,因此的键角大于,故A正确;
B.根据上述分析,W为S,Y为Na,W、Y简单离子分别为,前者3个电子层,后者2个电子层,因此,故B错误;
C.根据上述分析,Z为P,W为S,同周期从左向右电负性增大,即S的电负性强于P,根据同周期第一电离能规律,,故C错误;
D.X的简单氢化物为,分子间存在氢键,Z的简单氢化物为,分子间没有氢键,因此的沸点高于,故D错误;
答案为A。
12.答案:B
解析:根据题意,W结构中为+1价的离子,再根据原子序数和原子半径的关系,原子半径最大,推出为元素,再根据X的原子半径最小,原子序数最小,又只能形成一个化学键,推出X为H,Y可以形成4个键,原子序数大于H小于,所以Y为C,Z可以形成2个键,原子序数大于C小于,最外层电子为6,故Z为O,元素N的原子序数大于,其单质在常温下为气体,N为,故W为。
A.由图可知,中C原子形成3个σ键,C原子的价电子全部用于成键,无孤电子对,因此C原子的杂化方式为,A错误;
B.N的单质为,常温下与溶液反应生成的水溶液呈碱性,有漂白性,B正确;
C.Z为C,氢化物为烃类物质,其沸点不一定大于Y的所有氢化物的沸点,C错误;
D.中元素化合价均未发生变化,不是氧化还原反应,D错误;
故选A。
13.答案:A
解析:A.水晶属于晶体,晶体的各向异性具体表现在晶体不同方向上的导热性等性质是不同的,A正确;
B.液氨作为制冷剂的原理是基于氨气的物理性质,液氨的沸点为-33.3℃根据热力学原理,当液氨在制冷系统中汽化时,它会吸收周围的热量,从而将温度降低,B错误;
C.蔗糖为极性分子,水为极性分子,四氯化碳为非极性分子,蔗糖易溶于水、难溶于四氯化碳,符合“相似相溶”规律,C错误;
D.紫红色碘的四氯化碳溶液中,加入浓碘化钾水溶液,紫色变浅,碘会和碘化钾反应:,四氯化碳的碘溶液颜色将变淡,D错误;
故选。
14.答案:C
解析:A.由分析可知,Q为C、Z为N、Y为O,根据同一周期从左往右元素第一电离能呈增大趋势,ⅡA、ⅤA反常,故第一电离能N>O>C即,A正确;
B.由分析可知,W为Na、Y为O、Z为N,三者的简单离子具有相同的电子排布,则核电荷数越大半径越小,故简单离子半径即,B正确;
C.由分析可知,Z为N,Z元素的氧化物对应水化物为强酸,而为弱酸,C错误;
D.由分析可知,Y为O,Y的简单氢化物即,中心原子O周围的价层电子对数=2+=4,根据价层电子对互斥理论可知,其构型为四面体,D正确;
故答案为:C。
15.答案:A
解析:A.②③过程存在氧元素和铜元素化合价的变化,④过程中碳元素化合价发生变化,②③④均为氧化还原反应,A正确;
B.根据机理图2,②③过程转化为提供了,可知②③对有作用,B错误;
C.做配体时,N、O原子均可提供孤电子对于铜形成配位键,中铜配位数为6,C错误;
D.具有强大的配位能力,能够与金属离子形成具有多个五元环的螯合物,这些螯合物的稳定性非常高,D错误;
故选A。
16.答案:D
解析:为浅紫色,但溶液Ⅰ却呈黄色,说明发生水解生成了,A正确;
中S和N均有孤电子对,但因电负性S溶液Ⅱ为红色是所致,加NaF后溶液由红色变为无色,说明更易与配位,C正确;
焰色试验中可用无锈铁丝替代铂丝,是因为铁灼烧时焰色不在可见光波长范围内,但一定会产生发射光谱,D错误。
17.答案:(1)2
(2)是离子晶体,其余三种则为分子晶体,故的熔点高于其余三种物质;均为分子晶体,对于结构相似的分子晶体,则其相对分子质量越大,分子间作用力依次越大,熔点越高
(3)O>Ti>Ca
(4)A
(5)C
(6)B
(7)
(8)
(9);
解析:(1)基态Ti原子电子排布式为,未成对电子数为2;
(2)一般不同的晶体类型的熔沸点是原子晶体>离子晶体>分子晶体,是离子晶体,其余三种则为分子晶体,故的熔点高于其余三种物质,均为分子晶体,对于结构相似的分子晶体,则其相对分子质量越大,分子间作用力依次越大,熔点越高;
(3)晶体中含有Ca、Ti、O三种元素,Ca、Ti是同为第四周期的金属元素,Ca在Ti的左边,根据同一周期元素的电负性从左往右依次增大,故Ti>Ca,O为非金属,故其电负性最强,故三者电负性由大到小的顺序是O>Ti>Ca;
(4)金属阳离子和氧负离子之间以离子键结合,故选A;
(5)从图1可知,位于棱心,位于体心,故晶胞中与距离最近且相等的数目为12,故选C。
(6)比较晶胞1和2可知,将图2中周围紧邻的八个晶胞中体心上的离子连接起来,就能变为图1所示晶胞结构,图2中体心上的就变为了八个顶点,即相当于图1中的,故选B;
(7)有机碱中N原子上无孤对电子,形成了4个σ键,故N原子采用杂化;
(8)从图2可知,一个晶胞中含有的数目为1个,在8个顶点,均摊为个,在6个面心,均摊为个,故晶胞的密度为;
(9)从作用原理图3可以推出,这里发生两个离子反应方程式,左边发生,右边发生。
18.答案:(1)1;四氨合锌离子中配体中N原子价层无孤电子对,而游离的分子中N原子价层有1个孤电子对,孤电子对对成键电子对排斥力较强,导致游离的分子中键角小
(2)b;c
(3)
(4)是;加入的过量NaOH或氨水会与反应生成或,“电解沉积”时较活泼的可参与反应,而较稳定,还原较难
(5);牺牲阳极法
解析:(1)中锌离子采用杂化,该配合物呈正四面体结构,类比可推知,的空间结构只有1种(类似二氯甲烷)。
(2)碳酸锌受热分解生成氧化锌,氧化锌与煤炭发生置换反应生成锌,类似火法冶炼锌;全湿法既省略了易产生污染气体的焙烧步骤,又得到了具有工业价值的非金属单质(S),是三者中的最佳方法。
(3)硫化锌在稀硫酸中与氧气反应生成硫酸锌、硫和水,由原子守恒、电荷守恒、得失电子守恒可写出离子方程式。
(5)电解硫酸锌溶液时,阳极上水发生氧化反应生成氧气和;锌与钢铁外壳构成原电池,锌为负极,保护钢铁外壳,这种保护法叫牺牲阳极法。
19.答案:(1)8;
(2);SO3
(3)A;N;4;N>C>H;
(4)是分子晶体,是共价晶体,共价晶体的熔沸点高于分子晶体
(5)
解析:(1)硅元素的原子序数为14,基态原子的电子排布式为,轨道数为8,则原子核外电子的空间运动状态有8种;铜元素的原子序数为29,基态原子的价电子排布式为,故答案为:8;;
(2)碳酸根离子中碳原子的价层电子对数为3,则碳原子的杂化方式为杂化;三氧化硫与碳酸根离子的原子个数都为3、价电子数都为24,互为等电子体,故答案为:;;
(3)①氢键是较强的分子间作用力,不属于化学键,由结构可知,配离子中含有极性键、非极性键和配位键,不含有离子键,故选A;
②由结构可知,配离子中中心离子为铜离子,配体为氮原子,配位数为4,故答案为:N;4;
③元素的非金属越强,电负性越大,配离子中三种非金属元素的非金属性强弱顺序为N>C>H,则电负性的大小顺序为N>C>H,故答案为:N>C>H;
④铜离子的离子半径大于镁离子,与具有孤对电子的氮原子形成头碰头的配位键的重叠程度大,所以乙二胺与铜离子形成的配合物的稳定性较强,故答案为:;
(4)二氧化碳是熔沸点低的分子晶体,二氧化硅是熔沸点高的共价晶体,一般情况下,共价晶体的熔沸点高于分子晶体,所以二氧化碳与二氧化硅的熔点相差很大,故答案为:是分子晶体,是共价晶体,共价晶体的熔沸点高于分子晶体;
(5)由晶胞结构可知,晶胞中位于顶点的钡原子个数为8×=1,位于面上和体心的铜原子个数为8×+1=5,由晶胞的质量公式可得:,解得nm,故答案为:。
20.答案:(1);5
(2)N>O>C;
(3)四种物质均为分子晶体,不含分子间氢键,随着相对相对分子质量的增大,范德华力增大,熔点增大
(4)离子键、共价键;正四面体;2;
解析:(1)基态磷原子核外电子排布式为1s22s22p63s23p3,价电子排布式为3s23p3,因此价电子排布图为;基态磷原子核外有5个能级,因此有核外有5种不同能量的电子;故答案为;5;
(2)根据结构可知,属于第二周期的元素有C、N、O,根据第一电离能规律,三种元素第一电离能由大到小顺序是N>O>C;苯环、双键上碳原子杂化类型为,甲基、亚甲基、次甲基上的碳原子杂化类型为,故答案为N>O>C;;
(3)四种物质均为分子晶体,且不含分子间氢键,因此它们熔点高低与范德华力有关,即逐渐升高的原因是四种物质均为分子晶体,不含分子间氢键,随着相对相对分子质量的增大,范德华力增大,熔点逐渐升高;故答案为四种物质均为分子晶体,不含分子间氢键,随着相对相对分子质量的增大,范德华力增大,熔点逐渐升高。
(时间:75分钟,分值:100分)
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 P-31 S-32 K-39 Cu-64 Zn-65 I-127 Ba-137 Pb-207
单项选择题:本题共16小题,每小题3分,共48分。每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列各组物质中,都是由极性键构成的极性分子的是( )
A.和 B.和
C.和 D.和
2.工业上从硒化亚铜中提取Se的反应之一为。下列与该反应有关的化学用语表述正确的是( )
A.的电子式为
B.的空间结构是三角锥形
C.键角:
D.基态Se原子核外电子有34种空间运动状态
3.下列分子为手性分子的是( )
A. B.
C. D.
4.已知X、Y为前四周期主族元素,基态X原子核外每个能级上电子数相等,基态Y原子最外层电子云轮廓图为球形,内层上s、p能级上电子数之比为1:2,Y的第二电离能与第一电离能之比大于5,X一种单质的单层二维结构如甲图所示,六方晶胞结构如乙图所示,晶胞中最近的两个X原子之间的距离为apm,层间距为bpm,Y原子嵌入X一种单质的层间得到的二维结构图如丙图所示,下列叙述错误的是( )
A.甲、丙二维材料都具有良好的导电性
B.甲、丙结构中X原子都是杂化
C.丙的化学式为
D.乙晶体的密度为
5.一种可用来治疗心脑血管的有机物,其分子结构式如图所示。已知:R、W、X、Y、Z为原子序数依次增大的短周期主族元素,Y和Z同主族。下列说法正确的是( )
A.第一电离能:X>Y>W
B.简单氢化物沸点:X>Z>Y
C.最高价氧化物对应水化物的酸性:W>Z
D.和的中心原子均采取杂化
6.咪唑为五元芳香杂环化合物,且分子中环上原子位于同一平面内,该类化合物在医学上有若重要的用途。如:咪唑()和4-甲基咪唑()都是合成医药中间体的重要原料,下列有关说法正确的是( )
A.咪唑()和4-甲基咪唑()σ键之比为3:2
B.1号N与2号N相比,1号N更容易与形成配位键
C.4-甲基咪唑()中C原子与N原子杂化方式相同
D.4-甲基咪唑()具有碱性,可以与盐酸反应生成相应的盐
7.W、X、Y、Z、M为原子序数依次增大的短周期主族元素,最外层电子数之和为17,X和Z的基态原子均有两个未成对电子,M的某种盐的阴离子由于形成如图的双聚物结构导致溶解度降低。下列说法正确的是( )
A.第一电离能:
B.氢化物的沸点:
C.键角:
D.W和Z形成的常见化合物是极性分子
8.物质结构决定性质。下列有关物质性质的解释错误的是( )
选项 物质性质 解释
A 一氟乙酸的大于一溴乙酸 的电负性比的大,羧基中的羟基的极性更
B 石墨与金刚石硬度差别大 石墨中碳碳键键能小于金刚石中碳碳键键能
C 分子键角: 和中心原子均为杂化且均有一对孤电子对,电负性:,使成键电子对更偏向于,成键电子对间的距离更远,排斥力更小
D 晶体的某些物理性质有各向异性 晶体内部质点排列的有序
A.A B.B C.C D.D
9.下列离子的VSEPR模型与离子的空间立体构型一致的是( )
A. B. C. D.
10.物质的结构决定物质的性质,下列性质差异与结构因素匹配正确的是( )
性质差异 结构因素
A 溶解度(20℃):(29g)大于(9g) 阴离子电荷数
B 酸性: 羟基的极性
C 键角:()大于() 中心原子的杂化方式
D 熔点:低于 晶体类型
A.A B.B C.C D.D
11.短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )
元素 X Y Z W
最高价氧化物的水化物
溶液对应的pH(25℃) 1.00 13.00 1.57 0.70
A.X、W最简单氢化物的键角:X>W
B.简单离子半径:W
A.W中Y原子的杂化方式为
B.常温下N的单质与溶液反应,其中一种产物的水溶液呈碱性,有漂白性
C.Z的氢化物的沸点一定大于Y的所有氢化物的沸点
D.化合物W受热易分解,发生氧化还原反应
13.下列对实验事实或物质用途的解释正确的是( )
实验事实或物质用途 解释
A 用红热的铁针刺水晶柱表面凝固的石蜡,石蜡在不同方向熔化的快慢不同 水晶内部质点排列有序,导热性各向异性
B 工业上常用液氨作制冷剂 断裂中H—N需要吸收能量
C 蔗糖易溶于水,难溶于四氯化碳 蔗糖和四氯化碳都是有机物,这违背了“相似相溶”规律
D 紫红色碘的四氯化碳溶液中,加入浓碘化钾水溶液,紫色变浅 碘在水中溶解性比碘在四氯化碳中溶解性好
A.A B.B C.C D.D
14.一种由短周期元素构成的洗涤剂中间体结构式如图所示,X、Q、Z、Y、W原子序数依次增大,X和W同主族,Q、Z、Y同周期,基态Q原子核外成对电子对数与未成对电子数相等,Y可与X形成空间构型为V形的分子,下列说法不正确的是( )
A.第一电离能:
B.简单离子半径:
C.Z元素的氧化物对应水化物为强酸
D.Y的简单氢化物构型为四面体
15.废水中的(用表示)结构见图1,科学家使用法把转化为后再除去(UV为紫外光),机理如图2:
下列说法正确的是( )
A.②③④均为氧化还原反应 B.②③对没有作用
C.中铜配位数为2 D.中多个五元环使配合物不稳定
16.由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
已知:为浅紫色,为红色,为无色。下列说法错误的是( )
A.溶于水后溶液不是浅紫色而是黄色,是因为水解生成
B.与形成配位键时,S原子提供孤电子对
C.溶液Ⅱ加NaF后溶液由红色变为无色,说明与配位键强度不及与配位键强度
D.焰色试验中可用无锈铁丝替代铂丝,说明铁灼烧时无焰色且不会产生发射光谱
二、填空题:本大题共4小题,17题10分,18题12分,19题14分,20题16分,共52分。
17.钙钛矿是指通式为的一类化合物,最早发现钙钛矿石中的,因此而得名。钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等的功能材料。
(1)基态原子中未成对电子数为___________。
(2)的四卤化物熔点如下表所示,熔点高于其他三种卤化物,自至熔点依次升高,原因是___________。
化合物
熔点 377 -24.12 38.3 155
的立方晶胞如图1所示。
(3)其组成元素的电负性大小顺序是___________。
(4)金属离子与氧离子间的作用力为___________。
A.离子键 B.金属键 C.共价键 D.分子间作用力
(5)晶胞中与距离最近且相等的数目为___________。
A.4 B.8 C.12 D.16
一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子,其晶胞如图2所示。
(6)图1中与具有相同的空间位置的微粒是___________。
A. B. C. D.无
(7)有机碱中,N原子的杂化轨道类型是___________。
(8)若晶胞参数为,则晶体密度为___________(用表示阿伏加德罗常数)。
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了的器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图3所示。
(9)用离子方程式表示该原理___________、___________。
18.锌及锌合金广泛用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌的流程如下:
已知:是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生相关反应:,
(1)已知(部分结构如图所示)中采用杂化,由此推知:有________种结构。分子中键角为,与中配体键角不同的原因是________________________________________。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定毁罐取出……即倭铅也。”已知:炉甘石的主要成分是,倭铅即指Zn。由此可知,古代炼锌方法类似上述三种方法中的_________(填标号,下同)。
a.半湿法 b.火法 c.全湿法
上述三种方法中,最佳方法是______________。
(3)“氧压酸浸”即在一定浓度稀硫酸中加入锌矿粉,并在加压下通入,除生成外,还能回收非金属单质。写出主要反应的离子方程式:___________。
(4)若将“氧化、调pH”步骤改为直接用过量的NaOH或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响?_________(填“是”或“否”),请说明原因:__________________。
(5)“电解沉积”(以惰性材料为电极)中阳极反应式为___________。航母外壳常镶嵌一些锌块,这种保护航母的电化学方法叫___________。
19.“中国紫”——硅酸铜钡(),其合成原料为、孔雀石和砂子()。回答下列问题:
(1)基态原子核外电子的空间运动状态有_________种;基态原子的价电子排布式_________。
(2)中中C原子的杂化方式为_________,与互为等电子体的分子是_________(写出一种即可)。
(3)孔雀石溶于强酸可生成,与过量氨水可形成配离子,还可与其他微粒形成配离子,如与乙二胺形成配离子的结构如图:
①此配离子内部不含有的化学键类型是_________(填字母)。
A.离子键
B.非极性键
C.配位键
D.氢键
②此配离子中的配位原子为_________,配位数为_________。
③此配离子中三种非金属元素的电负性由大到小依次为_________(用元素符号作答)。
④与相似,也能与乙二胺形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的_________(填“”或“”)。
(4)和C为同主族元素,但它们的氧化物干冰CO2和晶体的熔点差异很大,其原因是_________。
(5)和形成的某种合金的立方体晶胞结构如图所示,设为阿伏加德罗常数的值,该晶体的密度为,则晶胞参数为a=_________(列出计算式)。
20.凉山州是矿产资源“聚宝盆”,下辖的会东、金阳、雷波等县磷矿资源丰富,磷化工产业比较发达。请回答下列问题:
(1)基态磷原子的价电子排布图为:________;其基态原子核外有________种不同能量的电子。
(2)含磷药物磷酸氯喹对治疗新冠肺炎有一定效果,其结构如下图。
磷酸氯喹中所含第二周期元素第一电离能由大到小的顺序为:________,其中碳原子的轨道杂化类型为:________。
(3)卤化磷通常有三卤化磷和五卤化磷。三卤化磷的熔点见下表,试解释、、、熔点逐渐升高的原因是________。
三卤化磷
熔点/℃ -151.5 -93.6 -41.5 61.2
(4)已知晶体中含有等量的和。
①晶体中的化学键有________,其中的空间构型为________。
②晶胞结构如下图,晶胞中含有的P原子的个数为________,已知晶胞边长为apm,阿伏加德罗常数为,则该晶体密度为________(列出计算式即可)。
答案以及解析
1.答案:D
解析:A.和中的C-H键和C-Cl键均为极性键,和分子均为正四面体构型,高度对称,分子中正负电荷的中心重合,均为非极性分子,故A不符合题意;
B.含有N-H极性键,分子空间结构为三角锥形,正负电荷中心不重合,为极性分子;含有C-H极性键,为正四面体构型,高度对称,分子中正负电荷的中心重合,为非极性分子,故B不符合题意;
C.含有C=O极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子;含有C=S极性键,空间结构为直线形,正负电荷的中心重合,是非极性分子,故C不符合题意;
D.含有H-S极性键,正负电荷的中心不重合,是极性分子;HCl含有H-Cl极性键,正负电荷的中心不重合,是极性分子,故D符合题意;答案选D。
2.答案:A
解析:A.中O原子与2个H形成共用电子对,电子式为:,故A正确;
B.中心S原子价层电子对数为4,无孤电子对,空间构型为正四面体形,故B错误;
C.O原子半径小于S,中成键电子对之间的斥力较大,因此键角大于,故C错误;
D.基态Se原子核外电子排布为:,所以基态硒原子核外有18种不同空间运动状态的电子,D项错误;
故选:A。
3.答案:D
解析:A.中,碳原子所连接的2个基团都有一样的,没有手性碳原子,不属于手性分子,故A错误;
B.中两个碳原子均连有两个氢原子,不是手性碳原子,该分子不是手性分子,故B错误;
C.中三个碳原子均连有相同的氢原子,不是手性碳原子,该分子不是手性分子,故C错误;
D.中间的碳原子连有四个不同取代基,该碳原子具有手性,属于手性分子,故D正确;
答案选D。
4.答案:C
解析:X、Y为前四周期主族元素,基态X原子核外每个能级上电子数相等,则X为C元素;基态Y原子最外层电子云轮廓图为球形,内层上s、p能级上电子数之比为1:2,Y的第二电离能与第一电离能之比大于5,则Y为K元素;由晶胞结构可知,甲图为过渡型晶体石墨的单层二维结构、乙图为石墨的六方晶胞结构、丙图为钾原子嵌入石墨的层间得到的二维结构,由丙图可知,钾原子形成的正六边形中,位于顶点和面心的钾原子的个数为6×+1=3、位于面内的碳原子个数为24,则丙的化学式为。
A.石墨和二维材料都为片层晶体,晶体内部含有大量的自由电子,所以石墨和二维材料都具有良好的导电性,故A正确;
B.石墨和二维材料都为片层晶体,晶体中每个碳原子均形成3个σ键,原子的杂化方式都为杂化,故B正确;
C.由分析可知,丙的化学式为,故C错误;
D.由石墨的六方晶胞结构可知,晶胞中位于顶点、面上、棱上、体内的碳原子个数为,晶胞中碳原子之间的距离为由碳原子之间的距离为apm可知,晶胞的参数为,设晶体的密度为,由晶胞的质量公式可得:,解得,故D正确;
故选C。
5.答案:A
解析:A.同周期从左向右第一电离能增大,但是N核外轨道处于半充满状态,因此第一电离能:N>O>C,A正确;
B.X、Y、Z的简单氢化物分别为、、,、有分子间氢键,且水分子之间氢键较多,常温为液体,氨气常温为气体,则沸点:,B错误;
C.非金属性;S>C,因此酸性:,C错误;
D.、的价层电子对数都是3,则其中心原子均采取杂化,D错误;
故选A。
6.答案:D
解析:A.咪唑分子含有9个键,4-甲基咪唑分子含有12个键,故二者含键的个数比为3:4,A错误;
B.4-甲基咪唑()为五元芳香杂环化合物,且分子中环上原子位于同一平面内,则环上的5个原子形成的大键,1号N原子和2号N相比,1号N原子无孤电子对,而2号N原子有孤电子对,则2号N更容易与形成配位键,B错误;
C.4-甲基咪唑()中1号N原子形成3个键,无孤电子对,价层电子对数为3,采取杂化,2号N原子形成2个键,有1个孤电子对,价层电子对数为3,采取杂化,环上的C原子形成3个键,无孤电子对,价层电子对数为3,采取杂化,甲基中的C原子形成4个键,无孤电子对,价层电子对数为4,采取杂化,则C原子与N原子杂化方式不完全相同,C错误;
D.4-甲基咪唑()中2号氮原子上有孤电子对,能与H+反应,具有碱性,可用于盐酸反应生成相应的盐,D正确;故选D。
7.答案:D
解析:W、X、Y、Z、M为短周期主族元素,原子序数依次增大,最外层电子数之和为17,X和Z的基态原子均有两个未成对电子,X为C,Z为O,Y为N;根据结构图示,内含氢键,W为H;最外层电子数之和为17,M最外层电子数为1,M为,据此解答。
Z为O,Y为N,M为,同周期从左到右,元素第一电离能呈增大趋势,第IIA族和第VA族元素第一电离能大于相邻元素,同主族从上到下,元素第一电离能减小,故第一电离能:,A错误;
X为C,Y为N,Z为O,未说明是简单氢化物,无法确定其沸,点关系,B错误;
中C采取杂化,空间结构为平面三角形,键角为,时中N采取杂化,空间结构为正四面体形,键角为,则键角:,C错误;
W和Z形成的常见化合物是,分子空间结构为V形,是极性分子,D正确。
8.答案:B
解析:A.因为电负性大于,电负性越大,吸电子能力越强,导致羧基中羟基的极性越大,越容易电离出氢离子,酸性越强,故一氟乙酸的电离常数大于一溴乙酸,A正确;
B.石墨与金刚石硬度差别大是因为碳原子的排列方式不同,金刚石中碳原子具有空间网状结构,其硬度大,石墨是片层状结构,硬度小,B错误;
C.和中心原子均为染化且均有一对孤电子对,电负性:,使成键电子对更偏向于F,成键电子对间的距离更远,排斥力更小,键角越小,故键角,C正确;
D.因为晶体内部质点排列的有序,故晶体某些物理性质具有各向异性,例如石墨的导电性具有各向异性,D正确;
答案选B。
9.答案:B
解析:
A.写中价层电子对个数且含有一个孤电子对,所以VSEPR模型为四面体结构,实际为三角锥形结构,故A错误;
B.中价层电子对个数且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是正四面体结构,故B正确;
C.中价层电子对个数且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,故C错误;
D.中价层电子对且含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,故D错误;
故选:B。
10.答案:B
解析:A.碳酸氢钠在水中的溶解度比碳酸钠小的原因是碳酸氢钠晶体中间存在氢键,与阴离子电荷数无关,A不正确;
B.乙酸中羟基与羰基相连,乙醇中羟基与乙基相连,羰基的吸电子能力强于乙基,因此乙酸中的羟基极性更强,更易电离,B正确;
C.甲烷和氨气的中心原子的杂化方式均为,其键角差异是:氨气的中心原子N原子上有孤电子对,根据价层电子对互斥理论,孤电子对与σ键的斥力大于σ键之间的斥力,因此氨气的键角略小于109.5°,C不正确;
D.与均为离子化合物,判断离子化合物的熔点高低通常用晶格能,晶格能与离子的电荷、离子的半径和离子的电子层结构有关,离子的电荷越高,半径越小,晶格能越大,熔点越高,与离子电荷相同,但的阳离子半径大于,因此晶格能小,熔点低,D不正确;
故选B。
11.答案:A
解析:0.1mol/L的X最高价氧化物对应水化物溶液的pH=1.00,说明该水化物为一元强酸,因为四种元素为短周期元素,因此X为N元素,同理,Y的最高价氧化物对应水化物为一元强碱,即Y为Na元素,Z的最高价氧化物对应水化物的化学式为,Z为P元素,0.1mol/L的W最高价氧化物对应水化物溶液的pH=0.70,则该水化物为二元强酸,即W为S,据此分析;
A.N的简单氢化物为,S的简单氢化物为,中心原子N有1个孤电子对,中心原子S有2个孤电子对,因此的键角大于,故A正确;
B.根据上述分析,W为S,Y为Na,W、Y简单离子分别为,前者3个电子层,后者2个电子层,因此,故B错误;
C.根据上述分析,Z为P,W为S,同周期从左向右电负性增大,即S的电负性强于P,根据同周期第一电离能规律,,故C错误;
D.X的简单氢化物为,分子间存在氢键,Z的简单氢化物为,分子间没有氢键,因此的沸点高于,故D错误;
答案为A。
12.答案:B
解析:根据题意,W结构中为+1价的离子,再根据原子序数和原子半径的关系,原子半径最大,推出为元素,再根据X的原子半径最小,原子序数最小,又只能形成一个化学键,推出X为H,Y可以形成4个键,原子序数大于H小于,所以Y为C,Z可以形成2个键,原子序数大于C小于,最外层电子为6,故Z为O,元素N的原子序数大于,其单质在常温下为气体,N为,故W为。
A.由图可知,中C原子形成3个σ键,C原子的价电子全部用于成键,无孤电子对,因此C原子的杂化方式为,A错误;
B.N的单质为,常温下与溶液反应生成的水溶液呈碱性,有漂白性,B正确;
C.Z为C,氢化物为烃类物质,其沸点不一定大于Y的所有氢化物的沸点,C错误;
D.中元素化合价均未发生变化,不是氧化还原反应,D错误;
故选A。
13.答案:A
解析:A.水晶属于晶体,晶体的各向异性具体表现在晶体不同方向上的导热性等性质是不同的,A正确;
B.液氨作为制冷剂的原理是基于氨气的物理性质,液氨的沸点为-33.3℃根据热力学原理,当液氨在制冷系统中汽化时,它会吸收周围的热量,从而将温度降低,B错误;
C.蔗糖为极性分子,水为极性分子,四氯化碳为非极性分子,蔗糖易溶于水、难溶于四氯化碳,符合“相似相溶”规律,C错误;
D.紫红色碘的四氯化碳溶液中,加入浓碘化钾水溶液,紫色变浅,碘会和碘化钾反应:,四氯化碳的碘溶液颜色将变淡,D错误;
故选。
14.答案:C
解析:A.由分析可知,Q为C、Z为N、Y为O,根据同一周期从左往右元素第一电离能呈增大趋势,ⅡA、ⅤA反常,故第一电离能N>O>C即,A正确;
B.由分析可知,W为Na、Y为O、Z为N,三者的简单离子具有相同的电子排布,则核电荷数越大半径越小,故简单离子半径即,B正确;
C.由分析可知,Z为N,Z元素的氧化物对应水化物为强酸,而为弱酸,C错误;
D.由分析可知,Y为O,Y的简单氢化物即,中心原子O周围的价层电子对数=2+=4,根据价层电子对互斥理论可知,其构型为四面体,D正确;
故答案为:C。
15.答案:A
解析:A.②③过程存在氧元素和铜元素化合价的变化,④过程中碳元素化合价发生变化,②③④均为氧化还原反应,A正确;
B.根据机理图2,②③过程转化为提供了,可知②③对有作用,B错误;
C.做配体时,N、O原子均可提供孤电子对于铜形成配位键,中铜配位数为6,C错误;
D.具有强大的配位能力,能够与金属离子形成具有多个五元环的螯合物,这些螯合物的稳定性非常高,D错误;
故选A。
16.答案:D
解析:为浅紫色,但溶液Ⅰ却呈黄色,说明发生水解生成了,A正确;
中S和N均有孤电子对,但因电负性S
焰色试验中可用无锈铁丝替代铂丝,是因为铁灼烧时焰色不在可见光波长范围内,但一定会产生发射光谱,D错误。
17.答案:(1)2
(2)是离子晶体,其余三种则为分子晶体,故的熔点高于其余三种物质;均为分子晶体,对于结构相似的分子晶体,则其相对分子质量越大,分子间作用力依次越大,熔点越高
(3)O>Ti>Ca
(4)A
(5)C
(6)B
(7)
(8)
(9);
解析:(1)基态Ti原子电子排布式为,未成对电子数为2;
(2)一般不同的晶体类型的熔沸点是原子晶体>离子晶体>分子晶体,是离子晶体,其余三种则为分子晶体,故的熔点高于其余三种物质,均为分子晶体,对于结构相似的分子晶体,则其相对分子质量越大,分子间作用力依次越大,熔点越高;
(3)晶体中含有Ca、Ti、O三种元素,Ca、Ti是同为第四周期的金属元素,Ca在Ti的左边,根据同一周期元素的电负性从左往右依次增大,故Ti>Ca,O为非金属,故其电负性最强,故三者电负性由大到小的顺序是O>Ti>Ca;
(4)金属阳离子和氧负离子之间以离子键结合,故选A;
(5)从图1可知,位于棱心,位于体心,故晶胞中与距离最近且相等的数目为12,故选C。
(6)比较晶胞1和2可知,将图2中周围紧邻的八个晶胞中体心上的离子连接起来,就能变为图1所示晶胞结构,图2中体心上的就变为了八个顶点,即相当于图1中的,故选B;
(7)有机碱中N原子上无孤对电子,形成了4个σ键,故N原子采用杂化;
(8)从图2可知,一个晶胞中含有的数目为1个,在8个顶点,均摊为个,在6个面心,均摊为个,故晶胞的密度为;
(9)从作用原理图3可以推出,这里发生两个离子反应方程式,左边发生,右边发生。
18.答案:(1)1;四氨合锌离子中配体中N原子价层无孤电子对,而游离的分子中N原子价层有1个孤电子对,孤电子对对成键电子对排斥力较强,导致游离的分子中键角小
(2)b;c
(3)
(4)是;加入的过量NaOH或氨水会与反应生成或,“电解沉积”时较活泼的可参与反应,而较稳定,还原较难
(5);牺牲阳极法
解析:(1)中锌离子采用杂化,该配合物呈正四面体结构,类比可推知,的空间结构只有1种(类似二氯甲烷)。
(2)碳酸锌受热分解生成氧化锌,氧化锌与煤炭发生置换反应生成锌,类似火法冶炼锌;全湿法既省略了易产生污染气体的焙烧步骤,又得到了具有工业价值的非金属单质(S),是三者中的最佳方法。
(3)硫化锌在稀硫酸中与氧气反应生成硫酸锌、硫和水,由原子守恒、电荷守恒、得失电子守恒可写出离子方程式。
(5)电解硫酸锌溶液时,阳极上水发生氧化反应生成氧气和;锌与钢铁外壳构成原电池,锌为负极,保护钢铁外壳,这种保护法叫牺牲阳极法。
19.答案:(1)8;
(2);SO3
(3)A;N;4;N>C>H;
(4)是分子晶体,是共价晶体,共价晶体的熔沸点高于分子晶体
(5)
解析:(1)硅元素的原子序数为14,基态原子的电子排布式为,轨道数为8,则原子核外电子的空间运动状态有8种;铜元素的原子序数为29,基态原子的价电子排布式为,故答案为:8;;
(2)碳酸根离子中碳原子的价层电子对数为3,则碳原子的杂化方式为杂化;三氧化硫与碳酸根离子的原子个数都为3、价电子数都为24,互为等电子体,故答案为:;;
(3)①氢键是较强的分子间作用力,不属于化学键,由结构可知,配离子中含有极性键、非极性键和配位键,不含有离子键,故选A;
②由结构可知,配离子中中心离子为铜离子,配体为氮原子,配位数为4,故答案为:N;4;
③元素的非金属越强,电负性越大,配离子中三种非金属元素的非金属性强弱顺序为N>C>H,则电负性的大小顺序为N>C>H,故答案为:N>C>H;
④铜离子的离子半径大于镁离子,与具有孤对电子的氮原子形成头碰头的配位键的重叠程度大,所以乙二胺与铜离子形成的配合物的稳定性较强,故答案为:;
(4)二氧化碳是熔沸点低的分子晶体,二氧化硅是熔沸点高的共价晶体,一般情况下,共价晶体的熔沸点高于分子晶体,所以二氧化碳与二氧化硅的熔点相差很大,故答案为:是分子晶体,是共价晶体,共价晶体的熔沸点高于分子晶体;
(5)由晶胞结构可知,晶胞中位于顶点的钡原子个数为8×=1,位于面上和体心的铜原子个数为8×+1=5,由晶胞的质量公式可得:,解得nm,故答案为:。
20.答案:(1);5
(2)N>O>C;
(3)四种物质均为分子晶体,不含分子间氢键,随着相对相对分子质量的增大,范德华力增大,熔点增大
(4)离子键、共价键;正四面体;2;
解析:(1)基态磷原子核外电子排布式为1s22s22p63s23p3,价电子排布式为3s23p3,因此价电子排布图为;基态磷原子核外有5个能级,因此有核外有5种不同能量的电子;故答案为;5;
(2)根据结构可知,属于第二周期的元素有C、N、O,根据第一电离能规律,三种元素第一电离能由大到小顺序是N>O>C;苯环、双键上碳原子杂化类型为,甲基、亚甲基、次甲基上的碳原子杂化类型为,故答案为N>O>C;;
(3)四种物质均为分子晶体,且不含分子间氢键,因此它们熔点高低与范德华力有关,即逐渐升高的原因是四种物质均为分子晶体,不含分子间氢键,随着相对相对分子质量的增大,范德华力增大,熔点逐渐升高;故答案为四种物质均为分子晶体,不含分子间氢键,随着相对相对分子质量的增大,范德华力增大,熔点逐渐升高。
