高考化学二轮复习题型突破一突破点2工艺流程中的分离提纯与操作分析课件(共42张PPT)
文档属性
| 名称 | 高考化学二轮复习题型突破一突破点2工艺流程中的分离提纯与操作分析课件(共42张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 14:31:38 | ||
图片预览








文档简介
(共42张PPT)
题型突破一 化学工艺流程综合
突破点2 工艺流程中的分离提纯与操作分析
高考真题赏析 明考向
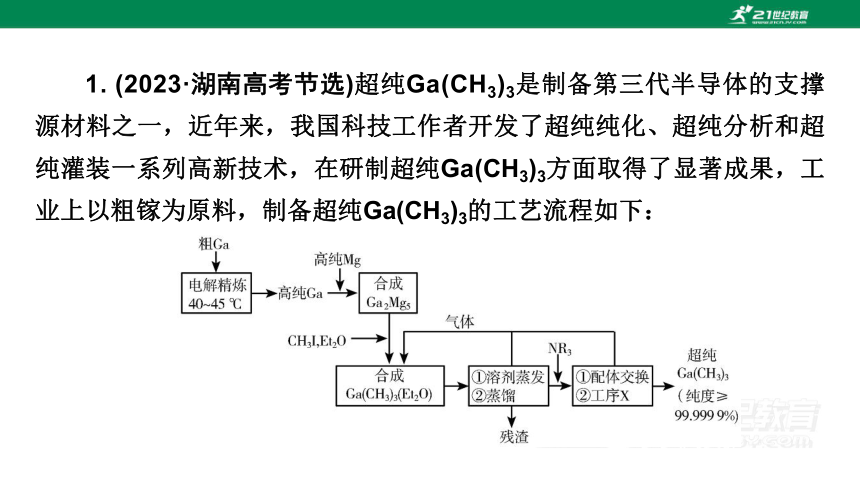
1. (2023·湖南高考节选)超纯Ga(CH3)3是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯Ga(CH3)3方面取得了显著成果,工业上以粗镓为原料,制备超纯Ga(CH3)3的工艺流程如下:
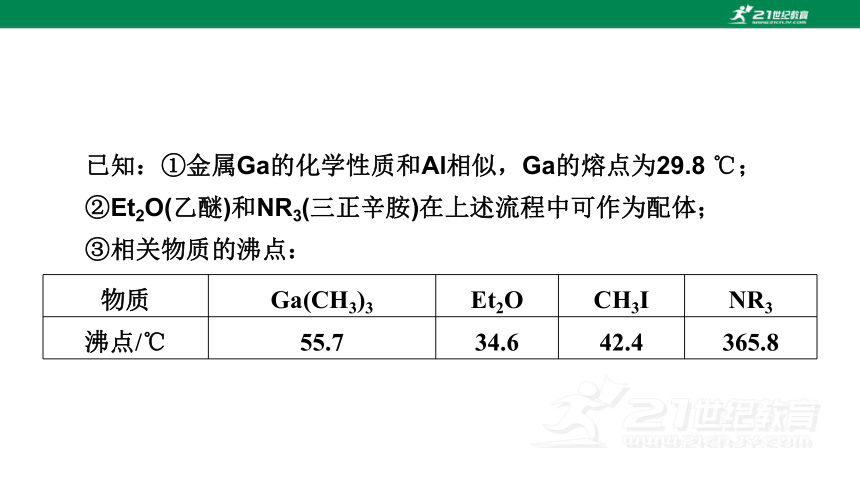
已知:①金属Ga的化学性质和Al相似,Ga的熔点为29.8 ℃;
②Et2O(乙醚)和NR3(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
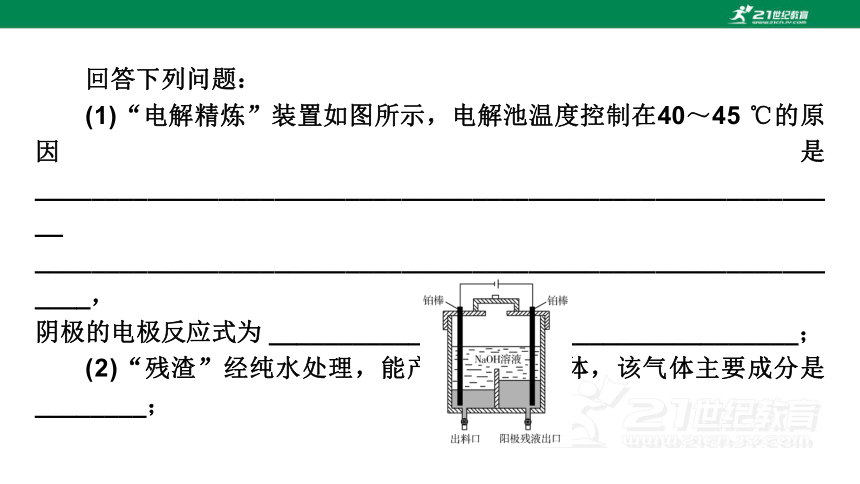
回答下列问题:
(1)“电解精炼”装置如图所示,电解池温度控制在40~45 ℃的原因是 __________________________________________________________
____________________________________________________________,
阴极的电极反应式为 ______________________________________;
(2)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是 ________;
(3)直接分解Ga(CH3)3(Et2O)不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是 ____________________
______________________________________________________________
____________________________________________________________。
(3)直接分解Ga(CH3)3(Et2O)时由于Et2O的沸点较低,与Ga(CH3)3一起蒸出,不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是根据题给相关物质沸点可知,NR3沸点远高于Ga(CH3)3,与Ga(CH3)3易分离。
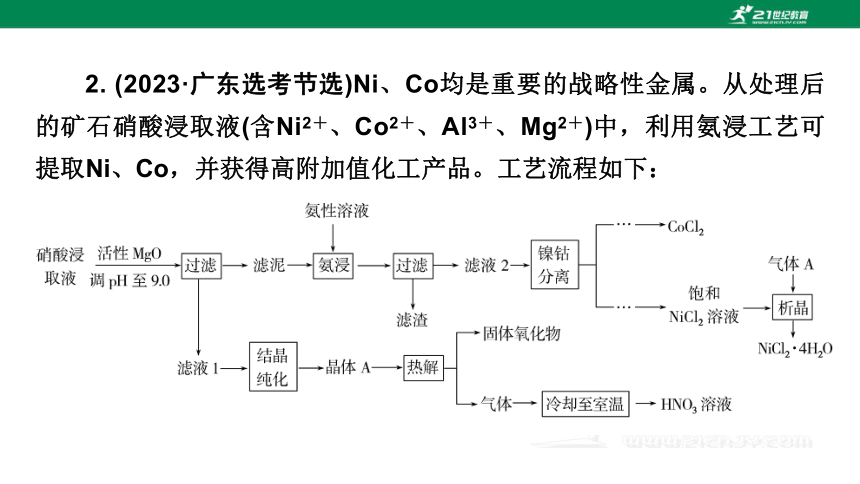
2. (2023·广东选考节选)Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:
已知:氨性溶液由NH3·H2O、(NH4)2SO3和(NH4)2CO3配制。常温下,Ni2+、Co2+、Co3+与NH3形成可溶于水的配离子;lg Kb(NH3·H2O)=-4.7;Co(OH)2易被空气氧化为Co(OH)3;部分氢氧化物的Ksp如下表。
氢氧化物 Co(OH)2 Co(OH)3 Ni(OH)2 Al(OH)3 Mg(OH)2
Ksp 5.9×10-15 1.6×10-44 5.5×10-16 1.3×10-33 5.6×10-12
回答下列问题:
(1)活性MgO可与水反应,化学方程式为 ______________________
__________________________________________________________。
(2)常温下,pH=9.9的氨性溶液中,c(NH3·H2O) ________c(NH)(填“>”“<”或“=”)。
(3)“ 氨浸”时,由Co(OH)3转化为[Co(NH3)6]2+的离子方程式为 __
____________________________________________。
实质是通过配位键生成络合离子而溶解,称为络合溶解
(4)(NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。(NH4)2CO3提高了Ni、Co的浸取速率,其原因是 ______________
_____________________________________________。“析晶”过程中通入的酸性气体A为 ________。
(5)“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用HNO3和 ________(填化学式)。
规律方法整合 建模型
? 物质分离与提纯的7种常用方法
? 常用的结晶方法
1.从溶液中获取不带结晶水的晶体。如NaCl、K2SO4等,用蒸发结晶。
2.从溶液中获取带结晶水的晶体。如CuSO4·5H2O、FeSO4·7H2O等,用蒸发浓缩、冷却结晶、过滤。
3.从混合液中获取溶解度受温度影响较小的溶质。如从含少量KNO3的NaCl溶液中获取NaCl晶体,用蒸发结晶、趁热过滤。
4.从混合液中获取溶解度受温度影响较大的溶质。如从含少量KCl的KNO3溶液中获取KNO3晶体,用蒸发浓缩、冷却结晶、过滤。
5.重结晶指析出的晶体经过溶解后再次从溶液中结晶析出的过程,是一种利用物质的溶解性不同而进行分离、提纯的方法。如苯甲酸的分离提纯。
【思维模型】 金属离子的萃取与反萃取
(1)溶剂萃取简称萃取——利用溶质在两种不相溶的液体之间的溶解度或者分配差异,达到分离和富集的目的。经过反复多次萃取,可将大部分化合物提取出来。
(2)反萃取和洗脱——与萃取过程相反,用一定的酸、碱或盐溶液把金属离子从有机相中再次返回到水相中的过程。
强基培优精练 提能力
1. (2024·河北邯郸二模)铝镍合金粉经活化处理制得的雷尼镍触媒是一种高活性催化剂,主要应用于催化加氢、有机合成等生产过程。经反复使用后,其活性逐渐降低,失活后变成废镍催化剂,该废镍催化剂的原料组成见下表:
名称 有机物 Ni Al Fe Cu SiO2
质量分数/% 13.5 40.2 36.3 2.7 1.3 6
工业上对该催化剂进行处理并回收Al和Ni,工艺流程如下,请回答下列问题:
(1)焙烧的目的是 __________________________________________。
(2)请任写一条“滤渣1”在工业上的用途: ____________________
___________________________________________________________。
(3)调pH之前先加入H2O2的目的是 ________________________。“滤液3”与过量CO2发生的离子方程式为__________________________
__________________________________________。
(4)“一系列操作”是 _________________________________。
(5)“滤渣3”中含有两种金属元素,向“滤渣3”中加入过量 _____
(填试剂名称),过滤,可以分离两种元素。
【解析】 废镍触媒焙烧后加入硫酸酸溶过滤除去滤渣1为SiO2,滤液1加入双氧水、碳酸镍调节pH后过滤,滤液2一系列操作后得到硫酸镍晶体;一系列操作应该为蒸发浓缩、冷却结晶、过滤;滤渣2加入NaOH碱溶后过滤得到滤渣3主要为氢氧化铁和氢氧化铜的混合物,滤液3通入过量二氧化碳反应得到的沉淀固体A为氢氧化铝。(1)将废镍触媒焙烧,主要是将有机物转化成CO2除掉,同时将难溶于酸的Cu转化成CuO。(2)经硫酸酸浸后,得到的滤渣1是SiO2。(3)金属元素溶于硫酸存在于滤液1中,其中铁元素可能有二价,用H2O2氧化后,用NiCO3调节pH,使铁元素、铝元素和铜元素均转化为氢氧化物沉淀,经碱溶过滤将
2. (2024·湖南邵阳二模节选)铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
已知:(NH4)2SO4在350 ℃分解生成NH3和H2SO4。回答下列问题:
(1)用95 ℃热水浸泡的目的是 __________________________。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式是 ____________________________________________________________
________________________________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3 mol·L-1),除钙率为99%时应控制溶液中F-浓度至少是 ______mol·L-1
[Ksp(CaF2)=4.0×10-11]。
(4)从NiSO4溶液中获得NiSO4·6H2O晶体的操作依次是 ___________
_________,过滤,洗涤,干燥。
【答案】 (1)促进Fe3+水解,使Fe3+转化成沉淀除去
(2)4FeO+6H2SO4+O2===2Fe2(SO4)3+6H2O
(3)2.0×10-3
(4)加热浓缩溶液至有晶膜出现(蒸发浓缩),冷却结晶
【解析】 在600 ℃焙烧时,(NH4)2SO4分解产生H2SO4,H2SO4与NiO、FeO、CaO反应生成NiSO4、Fe2(SO4)3(未隔绝空气,亚铁被氧化)、CaSO4,SiO2不与硫酸反应,接着进入浸泡环节,除铁元素,使铁转化为沉淀除去,SiO2不溶,故浸渣中还含有SiO2,经过此步骤,所得浸取液中含有CaSO4(微溶物,上一步未完全除去)、NiSO4、H2SO4,接着进入除钙步骤,CaSO4转化为难溶的CaF2被除去,之后溶液中主要含有NiSO4、H2SO4、硫酸钠,萃取实现分离,有机相经过几步处理最终得NiSO4。(1)浸泡目的是除铁元素,故用95℃热水浸泡的目的是促进Fe3+水解,使Fe3+转化成沉淀除去。(2)矿渣中部分FeO焙烧时与H2SO4反应
考前押题 练预测
1. (2024·河北张家口三模节选)五氧化二钒主要用作合金添加剂,含钒钢具有强度高,韧性大,耐磨性好等优良特性。工业上常用炼钢残渣(主要含V2O3及少量铁粉、Fe2O3、SiO2、Al2O3等杂质)为原料制取V2O5的一种工艺流程如图所示:
已知:NH4VO3难溶于水,Ksp(NH4VO3)=1.6×10-3。
回答下列问题:
(1)“焙烧”时通入大量空气的作用是 ________________________
________________________________________。
(2)“碱浸”所得滤渣的主要成分是 ________。
(3)写出“沉硅、 铝”反应的离子方程式: _________________、 ___________________。
2. (2024·河北保定市名校联考三模)稀土元素铈及其化合物在生产生活中有重要用途,如汽车尾气用稀土/钯三效催化剂处理,不仅可以降低催化剂的成本,还可以提高催化效能。以氟碳铈矿(主要成分为CeCO3F)为原料制备CeO2的一种工艺流程如图:
已知:①滤渣1的主要成分是难溶于水的Ce(BF4)3,滤渣2的主要成分是KBF4;Ksp(KBF4)=10-a、Ksp[Ce(BF4)3]=10-b(a、b均大于0)。
②当前工艺条件下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于1×10-5 mol·L-1)时的pH如下表:
金属阳离子 Fe3+ Ce3+
开始沉淀时的pH 1.3 7.7
完全沉淀时的pH 3.1 9.2
回答下列问题:
(1)写出一条提高焙烧效率的方法: _______________________。
(2)加入盐酸和H3BO3进行浸取时有污染环境的气体产生,该气体为 ________(填化学式);操作1和操作2的名称为 ________。
(3)调节滤液1的pH的范围为 ______________;滤渣3的主要成分为 ________(填化学式)。
(4)某研究小组利用硫化锌锂电池,在酸性
环境下电解Ce2O3制Ce(SO4)2的装置如右图所示。
阴极的电极反应式为 _______________,随着电
解反应的进行,为使电解液成分稳定,应不断补
充 __________________(填化学式)。
【答案】 (1)矿石粉碎、搅拌等
(2)Cl2 过滤 (3)3.1~7.7 Fe(OH)3
(4)2H++2e-===H2↑ H2SO4
【解析】 氟碳铈矿焙烧后加入盐酸、硼酸酸浸,生成Ce(BF4)3沉淀成为滤渣1,滤渣1加入氯化钾溶液得到KBF4沉淀成为滤渣2,滤液1中含有铁离子、Ce3+,调节pH将铁离子转化为沉淀得到滤渣3,滤液2含Ce3+,滤液2加入碳酸氢铵得到Ce2(CO3)3,煅烧过程中被空气中氧气氧化为CeO2。(1)矿石粉碎、搅拌等都会加快反应速率,提高焙烧效率。(2)四价Ce具有氧化性,加入盐酸和H3BO3进行浸取时,会将氯离
子氧化为有毒的氯气,产生有污染环境的气体,该气体为Cl2;操作1和操作2均为分离固液的操作,名称为过滤。(3)调节滤液1的pH使得铁离子沉淀被分离,而Ce3+不产生沉淀,结合表中数据可知,范围为3.1~7.7;滤渣3的主要成分为生成氢氧化铁Fe(OH)3。(4)在酸性环境下电解Ce2O3制Ce(SO4)2,则阴极氢离子放电发生还原反应生成氢气,电极反应式为2H++2e-===H2↑,阳极Ce2O3失去电子发生氧化反应生成Ce(SO4)2,电极反应式为Ce2O3-2e-+6H+===2Ce4++3H2O;则总反应为Ce2O3+8H+===2Ce4++3H2O+H2↑,随着电解反应的进行,为使电解液成分稳定,应不断补充H2SO4。
题型突破一 化学工艺流程综合
突破点2 工艺流程中的分离提纯与操作分析
高考真题赏析 明考向
1. (2023·湖南高考节选)超纯Ga(CH3)3是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯Ga(CH3)3方面取得了显著成果,工业上以粗镓为原料,制备超纯Ga(CH3)3的工艺流程如下:
已知:①金属Ga的化学性质和Al相似,Ga的熔点为29.8 ℃;
②Et2O(乙醚)和NR3(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
物质 Ga(CH3)3 Et2O CH3I NR3
沸点/℃ 55.7 34.6 42.4 365.8
回答下列问题:
(1)“电解精炼”装置如图所示,电解池温度控制在40~45 ℃的原因是 __________________________________________________________
____________________________________________________________,
阴极的电极反应式为 ______________________________________;
(2)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是 ________;
(3)直接分解Ga(CH3)3(Et2O)不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是 ____________________
______________________________________________________________
____________________________________________________________。
(3)直接分解Ga(CH3)3(Et2O)时由于Et2O的沸点较低,与Ga(CH3)3一起蒸出,不能制备超纯Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯Ga(CH3)3的理由是根据题给相关物质沸点可知,NR3沸点远高于Ga(CH3)3,与Ga(CH3)3易分离。
2. (2023·广东选考节选)Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:
已知:氨性溶液由NH3·H2O、(NH4)2SO3和(NH4)2CO3配制。常温下,Ni2+、Co2+、Co3+与NH3形成可溶于水的配离子;lg Kb(NH3·H2O)=-4.7;Co(OH)2易被空气氧化为Co(OH)3;部分氢氧化物的Ksp如下表。
氢氧化物 Co(OH)2 Co(OH)3 Ni(OH)2 Al(OH)3 Mg(OH)2
Ksp 5.9×10-15 1.6×10-44 5.5×10-16 1.3×10-33 5.6×10-12
回答下列问题:
(1)活性MgO可与水反应,化学方程式为 ______________________
__________________________________________________________。
(2)常温下,pH=9.9的氨性溶液中,c(NH3·H2O) ________c(NH)(填“>”“<”或“=”)。
(3)“ 氨浸”时,由Co(OH)3转化为[Co(NH3)6]2+的离子方程式为 __
____________________________________________。
实质是通过配位键生成络合离子而溶解,称为络合溶解
(4)(NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。(NH4)2CO3提高了Ni、Co的浸取速率,其原因是 ______________
_____________________________________________。“析晶”过程中通入的酸性气体A为 ________。
(5)“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用HNO3和 ________(填化学式)。
规律方法整合 建模型
? 物质分离与提纯的7种常用方法
? 常用的结晶方法
1.从溶液中获取不带结晶水的晶体。如NaCl、K2SO4等,用蒸发结晶。
2.从溶液中获取带结晶水的晶体。如CuSO4·5H2O、FeSO4·7H2O等,用蒸发浓缩、冷却结晶、过滤。
3.从混合液中获取溶解度受温度影响较小的溶质。如从含少量KNO3的NaCl溶液中获取NaCl晶体,用蒸发结晶、趁热过滤。
4.从混合液中获取溶解度受温度影响较大的溶质。如从含少量KCl的KNO3溶液中获取KNO3晶体,用蒸发浓缩、冷却结晶、过滤。
5.重结晶指析出的晶体经过溶解后再次从溶液中结晶析出的过程,是一种利用物质的溶解性不同而进行分离、提纯的方法。如苯甲酸的分离提纯。
【思维模型】 金属离子的萃取与反萃取
(1)溶剂萃取简称萃取——利用溶质在两种不相溶的液体之间的溶解度或者分配差异,达到分离和富集的目的。经过反复多次萃取,可将大部分化合物提取出来。
(2)反萃取和洗脱——与萃取过程相反,用一定的酸、碱或盐溶液把金属离子从有机相中再次返回到水相中的过程。
强基培优精练 提能力
1. (2024·河北邯郸二模)铝镍合金粉经活化处理制得的雷尼镍触媒是一种高活性催化剂,主要应用于催化加氢、有机合成等生产过程。经反复使用后,其活性逐渐降低,失活后变成废镍催化剂,该废镍催化剂的原料组成见下表:
名称 有机物 Ni Al Fe Cu SiO2
质量分数/% 13.5 40.2 36.3 2.7 1.3 6
工业上对该催化剂进行处理并回收Al和Ni,工艺流程如下,请回答下列问题:
(1)焙烧的目的是 __________________________________________。
(2)请任写一条“滤渣1”在工业上的用途: ____________________
___________________________________________________________。
(3)调pH之前先加入H2O2的目的是 ________________________。“滤液3”与过量CO2发生的离子方程式为__________________________
__________________________________________。
(4)“一系列操作”是 _________________________________。
(5)“滤渣3”中含有两种金属元素,向“滤渣3”中加入过量 _____
(填试剂名称),过滤,可以分离两种元素。
【解析】 废镍触媒焙烧后加入硫酸酸溶过滤除去滤渣1为SiO2,滤液1加入双氧水、碳酸镍调节pH后过滤,滤液2一系列操作后得到硫酸镍晶体;一系列操作应该为蒸发浓缩、冷却结晶、过滤;滤渣2加入NaOH碱溶后过滤得到滤渣3主要为氢氧化铁和氢氧化铜的混合物,滤液3通入过量二氧化碳反应得到的沉淀固体A为氢氧化铝。(1)将废镍触媒焙烧,主要是将有机物转化成CO2除掉,同时将难溶于酸的Cu转化成CuO。(2)经硫酸酸浸后,得到的滤渣1是SiO2。(3)金属元素溶于硫酸存在于滤液1中,其中铁元素可能有二价,用H2O2氧化后,用NiCO3调节pH,使铁元素、铝元素和铜元素均转化为氢氧化物沉淀,经碱溶过滤将
2. (2024·湖南邵阳二模节选)铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:
已知:(NH4)2SO4在350 ℃分解生成NH3和H2SO4。回答下列问题:
(1)用95 ℃热水浸泡的目的是 __________________________。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式是 ____________________________________________________________
________________________________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3 mol·L-1),除钙率为99%时应控制溶液中F-浓度至少是 ______mol·L-1
[Ksp(CaF2)=4.0×10-11]。
(4)从NiSO4溶液中获得NiSO4·6H2O晶体的操作依次是 ___________
_________,过滤,洗涤,干燥。
【答案】 (1)促进Fe3+水解,使Fe3+转化成沉淀除去
(2)4FeO+6H2SO4+O2===2Fe2(SO4)3+6H2O
(3)2.0×10-3
(4)加热浓缩溶液至有晶膜出现(蒸发浓缩),冷却结晶
【解析】 在600 ℃焙烧时,(NH4)2SO4分解产生H2SO4,H2SO4与NiO、FeO、CaO反应生成NiSO4、Fe2(SO4)3(未隔绝空气,亚铁被氧化)、CaSO4,SiO2不与硫酸反应,接着进入浸泡环节,除铁元素,使铁转化为沉淀除去,SiO2不溶,故浸渣中还含有SiO2,经过此步骤,所得浸取液中含有CaSO4(微溶物,上一步未完全除去)、NiSO4、H2SO4,接着进入除钙步骤,CaSO4转化为难溶的CaF2被除去,之后溶液中主要含有NiSO4、H2SO4、硫酸钠,萃取实现分离,有机相经过几步处理最终得NiSO4。(1)浸泡目的是除铁元素,故用95℃热水浸泡的目的是促进Fe3+水解,使Fe3+转化成沉淀除去。(2)矿渣中部分FeO焙烧时与H2SO4反应
考前押题 练预测
1. (2024·河北张家口三模节选)五氧化二钒主要用作合金添加剂,含钒钢具有强度高,韧性大,耐磨性好等优良特性。工业上常用炼钢残渣(主要含V2O3及少量铁粉、Fe2O3、SiO2、Al2O3等杂质)为原料制取V2O5的一种工艺流程如图所示:
已知:NH4VO3难溶于水,Ksp(NH4VO3)=1.6×10-3。
回答下列问题:
(1)“焙烧”时通入大量空气的作用是 ________________________
________________________________________。
(2)“碱浸”所得滤渣的主要成分是 ________。
(3)写出“沉硅、 铝”反应的离子方程式: _________________、 ___________________。
2. (2024·河北保定市名校联考三模)稀土元素铈及其化合物在生产生活中有重要用途,如汽车尾气用稀土/钯三效催化剂处理,不仅可以降低催化剂的成本,还可以提高催化效能。以氟碳铈矿(主要成分为CeCO3F)为原料制备CeO2的一种工艺流程如图:
已知:①滤渣1的主要成分是难溶于水的Ce(BF4)3,滤渣2的主要成分是KBF4;Ksp(KBF4)=10-a、Ksp[Ce(BF4)3]=10-b(a、b均大于0)。
②当前工艺条件下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于1×10-5 mol·L-1)时的pH如下表:
金属阳离子 Fe3+ Ce3+
开始沉淀时的pH 1.3 7.7
完全沉淀时的pH 3.1 9.2
回答下列问题:
(1)写出一条提高焙烧效率的方法: _______________________。
(2)加入盐酸和H3BO3进行浸取时有污染环境的气体产生,该气体为 ________(填化学式);操作1和操作2的名称为 ________。
(3)调节滤液1的pH的范围为 ______________;滤渣3的主要成分为 ________(填化学式)。
(4)某研究小组利用硫化锌锂电池,在酸性
环境下电解Ce2O3制Ce(SO4)2的装置如右图所示。
阴极的电极反应式为 _______________,随着电
解反应的进行,为使电解液成分稳定,应不断补
充 __________________(填化学式)。
【答案】 (1)矿石粉碎、搅拌等
(2)Cl2 过滤 (3)3.1~7.7 Fe(OH)3
(4)2H++2e-===H2↑ H2SO4
【解析】 氟碳铈矿焙烧后加入盐酸、硼酸酸浸,生成Ce(BF4)3沉淀成为滤渣1,滤渣1加入氯化钾溶液得到KBF4沉淀成为滤渣2,滤液1中含有铁离子、Ce3+,调节pH将铁离子转化为沉淀得到滤渣3,滤液2含Ce3+,滤液2加入碳酸氢铵得到Ce2(CO3)3,煅烧过程中被空气中氧气氧化为CeO2。(1)矿石粉碎、搅拌等都会加快反应速率,提高焙烧效率。(2)四价Ce具有氧化性,加入盐酸和H3BO3进行浸取时,会将氯离
子氧化为有毒的氯气,产生有污染环境的气体,该气体为Cl2;操作1和操作2均为分离固液的操作,名称为过滤。(3)调节滤液1的pH使得铁离子沉淀被分离,而Ce3+不产生沉淀,结合表中数据可知,范围为3.1~7.7;滤渣3的主要成分为生成氢氧化铁Fe(OH)3。(4)在酸性环境下电解Ce2O3制Ce(SO4)2,则阴极氢离子放电发生还原反应生成氢气,电极反应式为2H++2e-===H2↑,阳极Ce2O3失去电子发生氧化反应生成Ce(SO4)2,电极反应式为Ce2O3-2e-+6H+===2Ce4++3H2O;则总反应为Ce2O3+8H+===2Ce4++3H2O+H2↑,随着电解反应的进行,为使电解液成分稳定,应不断补充H2SO4。
同课章节目录
