高考化学二轮复习题型突破二突破点4实验方案的设计与评价课件(共47张PPT)
文档属性
| 名称 | 高考化学二轮复习题型突破二突破点4实验方案的设计与评价课件(共47张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 14:35:54 | ||
图片预览











文档简介
(共47张PPT)
题型突破二 化学实验综合
突破点4 实验方案的设计与评价
高考真题赏析 明考向
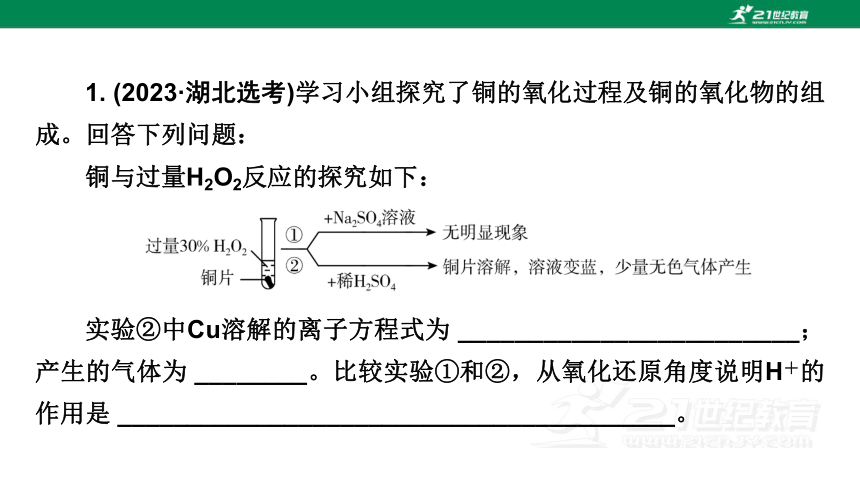
1. (2023·湖北选考)学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
铜与过量H2O2反应的探究如下:
实验②中Cu溶解的离子方程式为 ________________________;产生的气体为 ________。比较实验①和②,从氧化还原角度说明H+的作用是 ________________________________________。
【答案】 Cu+H2O2+2H+===Cu2++2H2O O2 既不是氧化剂,也不是还原剂
【解析】 根据实验现象,铜片溶解,溶液变蓝,可知在酸性条件下铜和过氧化氢发生反应,生成硫酸铜,离子方程式为Cu+H2O2+2H+===Cu2++2H2O;硫酸铜可以催化过氧化氢分解生成氧气,则产生的气体为O2;在铜和过氧化氢的反应过程中,氢元素的化合价没有发生变化,故从氧化还原角度说明H+的作用是:既不是氧化剂,也不是还原剂。
2. (2023·北京选考)资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I-??I(红棕色);I2和I氧化性几乎相同。
将等体积的KI溶液加入到m mol铜粉和n mol I2(n>m)的固体混合物中,振荡。
实验记录如下:
c(KI) 实验现象
实验Ⅰ 0.01 mol·L-1 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 mol·L-1 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 mol·L-1 I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
(1)初始阶段,Cu被氧化的反应速率:实验Ⅰ ________(填“>”“<”或“=”)实验Ⅱ。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是 ________________________________________。
ⅱ.查阅资料,2Cu2++4I-===2CuI↓+I2,[Cu(NH3)2]+(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化: _________
________________________________________。
(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是 ___________________________________。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,________________________(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 _______________________________。
(4)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如右图所示,a、b分别是 _________________________
___________________。
(5)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因: ______________________________________________
____________________________________________________________。
[Cu(NH3)4]2+,方程式为[CuI2]-+2NH3·H2O===[Cu(NH3)2]++2H2O+
2I-、4[Cu(NH3)2]++O2+8NH3·H2O===4[Cu(NH3)4]2++4OH-+6H2O。(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是2Cu+I2===2CuI或2Cu+KI3===2CuI+KI;2Cu+I2===2CuI反应为可逆反应,加入浓KI溶液,I2浓度减小,CuI转化为Cu和I2,故产生白色沉淀溶解,出现红色固体的过程或I浓度小未能氧化全部的铜,或生成的CuI覆盖在Cu表面。(4)要验证I2能将Cu氧化为Cu2+,需设计原电池负极材料为Cu,b为含n mol I2的4 mol·L-1的KI溶液。(5)含n mol I2的4 mol L-1的KI溶液,铜与碘反应的体系在原电池
装置中,I2将Cu氧化为Cu2+;而在实验Ⅰ、实验Ⅱ和实验Ⅲ中Cu以Cu+形式存在,这是由于在实验Ⅰ、实验Ⅱ、实验Ⅲ中Cu+可以进一步与I-结合生成CuI沉淀或[CuI2]-,Cu+浓度减小使得Cu2+氧化性增强,发生反应2Cu2++4I-===2CuI↓+I2和2Cu2++6I-===2[CuI2]-+I2。
规律方法整合 建模型
? 变量控制型实验
1.控制变量法:物质变化往往受到多个因素的影响,在研究化学反应与外界因素之间的关系时,对影响物质变化规律的因素或条件加以人为控制,使其他几个因素不变,集中研究其中一个因素的变化所产生的影响,有利于在研究过程中,迅速寻找到物质变化的规律。
2.解答流程
? 物质性质探究
1.探究性实验以其创新、灵活的特点成为每年高考的热点题型,试题将元素化合物知识与化学实验知识巧妙地融合在一起,增加了题目的新颖度和难度,能充分考查学生的发散思维能力和分析问题的能力。实验往往通过对物质化学性质的实验探究、反应产物成分的实验探究、化学反应原理的实验探究,揭示反应原理、解释产生某些现象的原因等。
2.性质实验探究的主要角度有
(1)物质氧化性强弱、还原性强弱的判断。如探究Fe3+的氧化性强于I2时,可利用FeCl3与KI淀粉溶液反应,通过溶液是否变蓝色来说明Fe3+的氧化性大于I2。
同周期、同主族元素性质的递变规律一般通过设计元素金属性、非金属性的强弱实验来完成,如通过Mg、Al与同浓度盐酸反应产生H2的快慢来说明Mg的活泼性强于Al。
(2)电解质强弱的判断。如探究一元酸HA是弱酸的方法是常温下配制NaA的溶液,测pH,若pH>7,则说明HA为弱酸。
(3)物质酸性强弱的判断。如探究碳酸和硅酸的酸性强弱,可利用相对强的酸制备相对弱的酸的反应原理,将CO2气体通入Na2SiO3溶液,看是否有白色沉淀生成来判断。
(4)钢铁发生电化学腐蚀的规律探究。可以通过控制所含的杂质是否与空气接触、所接触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等角度设计实验,找出规律。
【思维模型】 猜想型实验题的思维流程
强基培优精练 提能力
1. (2024·广东湛江市二模)Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色Fe(OH)2,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、 ____________、 ___________。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是 _____________________
__________________________________________。
(3)甲同学按如图a所示操作制备Fe(OH)2(溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因: _________________________
_______________________________________。
(4)乙同学经查阅资料后设计了如图b所示的装置(溶液均用煮沸过的蒸馏水配制),能较长时间观察到白色Fe(OH)2。
①该反应的原理为 ___________________________________
(用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2
的原因: _______________________________________________
_________________________。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
c(NaHCO3)/
(mol·L-1)
c(FeSO4)/(mol·L-1) 1.0 1.5 2.0
1.0 现象 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速
稳定时间 3.5 min 9 min 24 min
c(NaHCO3)/
(mol·L-1)
c(FeSO4)/(mol·L-1) 1.0 1.5 2.0
1.5 现象 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速
稳定时间 13 min 15 min 22 min
c(NaHCO3)/
(mol·L-1)
c(FeSO4)/(mol·L-1) 1.0 1.5 2.0
2.0 现象 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 常温下无现象,加热后产生白色沉淀
稳定时间 3 min 8 min 30 min
①由以上实验可得到的规律是 ________________________________
____________________________________________。
②NaHCO3溶液的浓度为1.5 mol·L-1时,FeSO4溶液的最佳浓度为 ________(填“1.0”“1.5”或“2.0”)mol·L-1。
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为 _______________
_______________________________________________(任写一条)。
【解析】 Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,为能较长时间观察到白色沉淀,需隔绝空气或通过调节NaHCO3溶液和FeSO4溶液的浓度来延长Fe(OH)2存在的时间。(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、一定规格的容量瓶、胶头滴管。(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,这是由于Fe(OH)2不稳定,具有强的还原性,容易被进入到溶液中的氧气氧化变为红褐色Fe(OH)3,用化学方程式表示为:4Fe(OH)2+O2+2H2O===4Fe(OH)3。(3)Fe(OH)2固体变色的原因是
Fe(OH)2逐渐被空气中的氧气氧化为Fe(OH)3,物质的颜色由白色迅速变为灰绿色,最后变为红褐色。(4)①该反应过程中NaHCO3溶液和FeSO4溶液反应生成Fe(OH)2,同时反应产生CO2气体,反应的离子方程式为Fe2++2HCO===Fe(OH)2↓+2CO2↑;②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因是:在液面上覆盖了一层苯,苯在液面上可以隔绝空气,避免空气进入到溶液中,从而防止Fe(OH)2氧化变质。(5)①由以上实验可得到的规律是:NaHCO3的浓度越大,Fe(OH)2的稳定时间越长;②NaHCO3溶液的浓度为1.5 mol·L-1时,FeSO4溶液的浓度为1.5 mol·L-1时,Fe(OH)2的稳定时间最长,故FeSO4溶液的最佳浓度为1.5 mol·L-1。(6)延长Fe(OH)2沉淀的稳定时间还可以采取的措施为:向配制好的FeSO4溶液中加入铁屑,进一步防止FeSO4被氧化。
2. (2024·福建莆田二模)久置的硝酸银溶液,试剂瓶底部有黑色固体A,瓶口和瓶壁上有黑色固体B。
已知:①硝酸银见光或受热会分解,分解产物相同。
②氧化银为棕黑色粉末,难溶于水,可溶于氨水和稀硝酸,见光或200 ℃左右分解生成氧气。
③AgOH不稳定,极易分解生成Ag2O
和H2O。
某兴趣小组开展以下探究活动。
Ⅰ.探究硝酸银固体受热分解的产物
利用下列装置(夹持仪器略去)进行实验。
实验现象:a中有银白色金属光泽的固体生成,a、b中出现红棕色气体,导管口d处逸出的气体可使带火星的木条复燃。
(1)仪器e名称为 ___________,试管b的主要作用是 ___________。
(2)试管a中反应的化学方程式为 ____________________________。
Ⅱ.探究A、B的成分
【提出猜想】甲、乙同学猜想固体中含有Ag、Ag2O中的一种或两种。
(3)从化学变化角度,甲、乙同学猜想固体中可能含有Ag2O的依据是 _________________________________________________________。
【进行实验】甲、乙分别对固体A、B按以下步骤进行实验。
ⅰ.取少量固体于试管中;
ⅱ.加入过量氨水,振荡;
ⅲ.……
【形成结论】甲得出固体A为Ag和Ag2O的混合物,乙得出固体B为Ag。
(4)①甲同学步骤ⅱ观察到的现象为 ______________________,相应的化学方程式为 ___________________________________。
②乙同学步骤ⅲ加入的试剂为 ________________(填名称)。
【反思与应用】
(5)固体A与固体B成分不同的可能原因是 _______________________
____________________________________________________________。
(6)实验室保存硝酸银溶液采取的措施为 _______________________
______________________________________________(写出两条)。
(3)溶液中AgNO3水解生成AgOH,AgOH分解生成Ag2O
(4)固体部分溶解 Ag2O+4NH3·H2O===2[Ag(NH3)2]OH+3H2O 稀硝酸
(5)硝酸银溶液中,硝酸银转化为银和氧化银的过程同时存在。瓶口和瓶壁见光较多,硝酸银和氧化银分解成银;瓶底见光较少,同时有银和氧化银生成
(6)加入适量稀硝酸、棕色的细口瓶、低温避光处
成Ag2O,所以甲、乙同学猜想固体中可能含有Ag2O。(4)①氧化银难溶于水,可溶于氨水。甲同学步骤ⅱ加入过量氨水,得出固体A为Ag和Ag2O的混合物,可知步骤ⅱ的现象为固体部分溶解;Ag2O溶于氨水生成氢氧化二氨合银,相应的化学方程式为Ag2O+4NH3·H2O===2[Ag(NH3)2]
OH+3H2O;②银可溶于稀硝酸,不溶于氨水,乙得出固体B为Ag的结论,可知,乙同学步骤ⅲ加入的试剂为稀硝酸。(5)硝酸银溶液中,硝酸银转化为银和氧化银的过程同时存在。瓶口和瓶壁见光较多,硝酸银和氧化银分解成银;瓶底见光较少,同时有银和氧化银生成,所以固体A与固体B成分不同。(6)硝酸银可以水解,加稀硝酸可以抑制硝酸银水解,硝酸银见光易分解,所以实验室保存硝酸银溶液采取的措施为加入适量稀硝酸、棕色的细口瓶、低温避光处。
考前押题 练预测
(河北保定市名校协作体三模)某兴趣小组设计实验验证铜与浓硝酸、稀硝酸的反应,装置如图所示(夹持装置未画出):
实验一:验证铜与浓硝酸的反应
按图示连接好装置, ________后,
装入药品,关闭K2、K3,打开K1,一
段时间后,再关闭K1,打开K2,加入足
量的浓HNO3。
实验二:验证铜与稀硝酸的反应
待装置B中反应完全后……
回答下列有关问题:
(1)实验一中的横线上应填入的内容是 ________________;装置B中装浓硝酸的仪器名称是 ____________。
(2)实验一中“关闭K2、K3,打开K1”的目的是 _________________
__________________________________________。
(3)装置B中发生反应的离子方程式为 __________________________
________________________________________________。
(4)实验二的后续操作顺序为 ________________(填标号),打开止水夹后装置C的具支试管中的现象为 ______________________________。
a.打开止水夹 b.打开K1
c.打开K3,加入蒸馏水 d.关闭K1
e.插入铜丝
(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色。小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同,浓度小时呈蓝色,浓度大时呈绿色。
猜想2:NO2溶解在硝酸铜溶液中,导致溶液颜色不同。
继续实验,打开K1,一段时间后,装置B中溶液变为蓝色,说明 ___________可能成立,请设计实验验证另一猜想的可能性: _________
____________________________________________________________。
【解析】 研究铜与浓、稀HNO3反应的差异,先利用二氧化碳将装置中的空气排出,防止Cu与稀硝酸反应生成的NO被氧化,装置B中滴加浓硝酸时Cu与浓硝酸反应生成二氧化氮,在C中验证铜和稀硝酸的反应,最后尾气处理,以此来解答。(1)装置连接后首先需要做的是检验装置的气密性;装置B中装浓硝酸的仪器名称是分液漏斗。(2)由于装置中含有空气,会干扰NO检验,所以实验一中“关闭K2、K3,打开K1”的目的是排尽装置内的空气,防止Cu与稀硝酸反应生成的NO被氧化。(3)装置B中浓硝酸和铜反应生成硝酸铜、二氧化氮和水,发生反应的离子方程式为Cu+2NO-3+4H+===Cu2++2NO2↑+2H2O。(4)实验二
是验证铜与稀硝酸的反应,因此首先把生成的二氧化氮转化为硝酸,所以后续操作顺序为待装置B中反应完全后打开K1、打开K3,加入蒸馏水、插入铜丝、关闭K1、打开止水夹,即bceda,打开止水夹后氧气把NO氧化为二氧化氮,则装置C的具支试管中的现象为液面上方出现红棕色气体。(5)继续实验,打开K1,一段时间后,装置B中溶液变为蓝色,由于A装置中二氧化碳把二氧化氮带出,因此说明猜想2可能成立,要验证猜想1的可能性,实验方案为取装置B中的溶液适量于试管中,加入适量蒸馏水稀释,若溶液变为蓝色,说明猜想1成立。
题型突破二 化学实验综合
突破点4 实验方案的设计与评价
高考真题赏析 明考向
1. (2023·湖北选考)学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
铜与过量H2O2反应的探究如下:
实验②中Cu溶解的离子方程式为 ________________________;产生的气体为 ________。比较实验①和②,从氧化还原角度说明H+的作用是 ________________________________________。
【答案】 Cu+H2O2+2H+===Cu2++2H2O O2 既不是氧化剂,也不是还原剂
【解析】 根据实验现象,铜片溶解,溶液变蓝,可知在酸性条件下铜和过氧化氢发生反应,生成硫酸铜,离子方程式为Cu+H2O2+2H+===Cu2++2H2O;硫酸铜可以催化过氧化氢分解生成氧气,则产生的气体为O2;在铜和过氧化氢的反应过程中,氢元素的化合价没有发生变化,故从氧化还原角度说明H+的作用是:既不是氧化剂,也不是还原剂。
2. (2023·北京选考)资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I-??I(红棕色);I2和I氧化性几乎相同。
将等体积的KI溶液加入到m mol铜粉和n mol I2(n>m)的固体混合物中,振荡。
实验记录如下:
c(KI) 实验现象
实验Ⅰ 0.01 mol·L-1 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ 0.1 mol·L-1 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ 4 mol·L-1 I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
(1)初始阶段,Cu被氧化的反应速率:实验Ⅰ ________(填“>”“<”或“=”)实验Ⅱ。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是 ________________________________________。
ⅱ.查阅资料,2Cu2++4I-===2CuI↓+I2,[Cu(NH3)2]+(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化: _________
________________________________________。
(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是 ___________________________________。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,________________________(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 _______________________________。
(4)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如右图所示,a、b分别是 _________________________
___________________。
(5)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因: ______________________________________________
____________________________________________________________。
[Cu(NH3)4]2+,方程式为[CuI2]-+2NH3·H2O===[Cu(NH3)2]++2H2O+
2I-、4[Cu(NH3)2]++O2+8NH3·H2O===4[Cu(NH3)4]2++4OH-+6H2O。(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是2Cu+I2===2CuI或2Cu+KI3===2CuI+KI;2Cu+I2===2CuI反应为可逆反应,加入浓KI溶液,I2浓度减小,CuI转化为Cu和I2,故产生白色沉淀溶解,出现红色固体的过程或I浓度小未能氧化全部的铜,或生成的CuI覆盖在Cu表面。(4)要验证I2能将Cu氧化为Cu2+,需设计原电池负极材料为Cu,b为含n mol I2的4 mol·L-1的KI溶液。(5)含n mol I2的4 mol L-1的KI溶液,铜与碘反应的体系在原电池
装置中,I2将Cu氧化为Cu2+;而在实验Ⅰ、实验Ⅱ和实验Ⅲ中Cu以Cu+形式存在,这是由于在实验Ⅰ、实验Ⅱ、实验Ⅲ中Cu+可以进一步与I-结合生成CuI沉淀或[CuI2]-,Cu+浓度减小使得Cu2+氧化性增强,发生反应2Cu2++4I-===2CuI↓+I2和2Cu2++6I-===2[CuI2]-+I2。
规律方法整合 建模型
? 变量控制型实验
1.控制变量法:物质变化往往受到多个因素的影响,在研究化学反应与外界因素之间的关系时,对影响物质变化规律的因素或条件加以人为控制,使其他几个因素不变,集中研究其中一个因素的变化所产生的影响,有利于在研究过程中,迅速寻找到物质变化的规律。
2.解答流程
? 物质性质探究
1.探究性实验以其创新、灵活的特点成为每年高考的热点题型,试题将元素化合物知识与化学实验知识巧妙地融合在一起,增加了题目的新颖度和难度,能充分考查学生的发散思维能力和分析问题的能力。实验往往通过对物质化学性质的实验探究、反应产物成分的实验探究、化学反应原理的实验探究,揭示反应原理、解释产生某些现象的原因等。
2.性质实验探究的主要角度有
(1)物质氧化性强弱、还原性强弱的判断。如探究Fe3+的氧化性强于I2时,可利用FeCl3与KI淀粉溶液反应,通过溶液是否变蓝色来说明Fe3+的氧化性大于I2。
同周期、同主族元素性质的递变规律一般通过设计元素金属性、非金属性的强弱实验来完成,如通过Mg、Al与同浓度盐酸反应产生H2的快慢来说明Mg的活泼性强于Al。
(2)电解质强弱的判断。如探究一元酸HA是弱酸的方法是常温下配制NaA的溶液,测pH,若pH>7,则说明HA为弱酸。
(3)物质酸性强弱的判断。如探究碳酸和硅酸的酸性强弱,可利用相对强的酸制备相对弱的酸的反应原理,将CO2气体通入Na2SiO3溶液,看是否有白色沉淀生成来判断。
(4)钢铁发生电化学腐蚀的规律探究。可以通过控制所含的杂质是否与空气接触、所接触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等角度设计实验,找出规律。
【思维模型】 猜想型实验题的思维流程
强基培优精练 提能力
1. (2024·广东湛江市二模)Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,使学生误认为氢氧化亚铁的颜色是灰绿色。为能较长时间观察到白色Fe(OH)2,某实验小组做了如下探究实验。
(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、 ____________、 ___________。
(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,其原因可能是 _____________________
__________________________________________。
(3)甲同学按如图a所示操作制备Fe(OH)2(溶液均用煮沸过的蒸馏水配制)。挤入少量NaOH溶液后,立即出现白色沉淀,但很快变成浅绿色,一会儿后变为灰绿色,最终变为红褐色。请分析固体变色的原因: _________________________
_______________________________________。
(4)乙同学经查阅资料后设计了如图b所示的装置(溶液均用煮沸过的蒸馏水配制),能较长时间观察到白色Fe(OH)2。
①该反应的原理为 ___________________________________
(用离子方程式表示)。
②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2
的原因: _______________________________________________
_________________________。
(5)实验试剂最佳浓度探究:
采用不同浓度的试剂进行实验,记录如下。
c(NaHCO3)/
(mol·L-1)
c(FeSO4)/(mol·L-1) 1.0 1.5 2.0
1.0 现象 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速
稳定时间 3.5 min 9 min 24 min
c(NaHCO3)/
(mol·L-1)
c(FeSO4)/(mol·L-1) 1.0 1.5 2.0
1.5 现象 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率较快 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率迅速
稳定时间 13 min 15 min 22 min
c(NaHCO3)/
(mol·L-1)
c(FeSO4)/(mol·L-1) 1.0 1.5 2.0
2.0 现象 产生白色沉淀和气泡,沉淀逐渐变暗,气泡增多 产生白色沉淀和气泡,沉淀逐渐变暗,气泡产生速率加快 常温下无现象,加热后产生白色沉淀
稳定时间 3 min 8 min 30 min
①由以上实验可得到的规律是 ________________________________
____________________________________________。
②NaHCO3溶液的浓度为1.5 mol·L-1时,FeSO4溶液的最佳浓度为 ________(填“1.0”“1.5”或“2.0”)mol·L-1。
(6)实验创新:
延长Fe(OH)2沉淀的稳定时间还可以采取的措施为 _______________
_______________________________________________(任写一条)。
【解析】 Fe(OH)2具有较强的还原性,新制的白色Fe(OH)2会逐渐转变为灰绿色,为能较长时间观察到白色沉淀,需隔绝空气或通过调节NaHCO3溶液和FeSO4溶液的浓度来延长Fe(OH)2存在的时间。(1)配制实验所需一定物质的量浓度的溶液备用,配制溶液时所用仪器有托盘天平、烧杯、量筒、玻璃棒、一定规格的容量瓶、胶头滴管。(2)实验时发现即使是用煮沸过的蒸馏水配制实验所用的溶液,新生成的Fe(OH)2也仅能存在几分钟,这是由于Fe(OH)2不稳定,具有强的还原性,容易被进入到溶液中的氧气氧化变为红褐色Fe(OH)3,用化学方程式表示为:4Fe(OH)2+O2+2H2O===4Fe(OH)3。(3)Fe(OH)2固体变色的原因是
Fe(OH)2逐渐被空气中的氧气氧化为Fe(OH)3,物质的颜色由白色迅速变为灰绿色,最后变为红褐色。(4)①该反应过程中NaHCO3溶液和FeSO4溶液反应生成Fe(OH)2,同时反应产生CO2气体,反应的离子方程式为Fe2++2HCO===Fe(OH)2↓+2CO2↑;②结合原理和装置特点分析能较长时间观察到白色Fe(OH)2的原因是:在液面上覆盖了一层苯,苯在液面上可以隔绝空气,避免空气进入到溶液中,从而防止Fe(OH)2氧化变质。(5)①由以上实验可得到的规律是:NaHCO3的浓度越大,Fe(OH)2的稳定时间越长;②NaHCO3溶液的浓度为1.5 mol·L-1时,FeSO4溶液的浓度为1.5 mol·L-1时,Fe(OH)2的稳定时间最长,故FeSO4溶液的最佳浓度为1.5 mol·L-1。(6)延长Fe(OH)2沉淀的稳定时间还可以采取的措施为:向配制好的FeSO4溶液中加入铁屑,进一步防止FeSO4被氧化。
2. (2024·福建莆田二模)久置的硝酸银溶液,试剂瓶底部有黑色固体A,瓶口和瓶壁上有黑色固体B。
已知:①硝酸银见光或受热会分解,分解产物相同。
②氧化银为棕黑色粉末,难溶于水,可溶于氨水和稀硝酸,见光或200 ℃左右分解生成氧气。
③AgOH不稳定,极易分解生成Ag2O
和H2O。
某兴趣小组开展以下探究活动。
Ⅰ.探究硝酸银固体受热分解的产物
利用下列装置(夹持仪器略去)进行实验。
实验现象:a中有银白色金属光泽的固体生成,a、b中出现红棕色气体,导管口d处逸出的气体可使带火星的木条复燃。
(1)仪器e名称为 ___________,试管b的主要作用是 ___________。
(2)试管a中反应的化学方程式为 ____________________________。
Ⅱ.探究A、B的成分
【提出猜想】甲、乙同学猜想固体中含有Ag、Ag2O中的一种或两种。
(3)从化学变化角度,甲、乙同学猜想固体中可能含有Ag2O的依据是 _________________________________________________________。
【进行实验】甲、乙分别对固体A、B按以下步骤进行实验。
ⅰ.取少量固体于试管中;
ⅱ.加入过量氨水,振荡;
ⅲ.……
【形成结论】甲得出固体A为Ag和Ag2O的混合物,乙得出固体B为Ag。
(4)①甲同学步骤ⅱ观察到的现象为 ______________________,相应的化学方程式为 ___________________________________。
②乙同学步骤ⅲ加入的试剂为 ________________(填名称)。
【反思与应用】
(5)固体A与固体B成分不同的可能原因是 _______________________
____________________________________________________________。
(6)实验室保存硝酸银溶液采取的措施为 _______________________
______________________________________________(写出两条)。
(3)溶液中AgNO3水解生成AgOH,AgOH分解生成Ag2O
(4)固体部分溶解 Ag2O+4NH3·H2O===2[Ag(NH3)2]OH+3H2O 稀硝酸
(5)硝酸银溶液中,硝酸银转化为银和氧化银的过程同时存在。瓶口和瓶壁见光较多,硝酸银和氧化银分解成银;瓶底见光较少,同时有银和氧化银生成
(6)加入适量稀硝酸、棕色的细口瓶、低温避光处
成Ag2O,所以甲、乙同学猜想固体中可能含有Ag2O。(4)①氧化银难溶于水,可溶于氨水。甲同学步骤ⅱ加入过量氨水,得出固体A为Ag和Ag2O的混合物,可知步骤ⅱ的现象为固体部分溶解;Ag2O溶于氨水生成氢氧化二氨合银,相应的化学方程式为Ag2O+4NH3·H2O===2[Ag(NH3)2]
OH+3H2O;②银可溶于稀硝酸,不溶于氨水,乙得出固体B为Ag的结论,可知,乙同学步骤ⅲ加入的试剂为稀硝酸。(5)硝酸银溶液中,硝酸银转化为银和氧化银的过程同时存在。瓶口和瓶壁见光较多,硝酸银和氧化银分解成银;瓶底见光较少,同时有银和氧化银生成,所以固体A与固体B成分不同。(6)硝酸银可以水解,加稀硝酸可以抑制硝酸银水解,硝酸银见光易分解,所以实验室保存硝酸银溶液采取的措施为加入适量稀硝酸、棕色的细口瓶、低温避光处。
考前押题 练预测
(河北保定市名校协作体三模)某兴趣小组设计实验验证铜与浓硝酸、稀硝酸的反应,装置如图所示(夹持装置未画出):
实验一:验证铜与浓硝酸的反应
按图示连接好装置, ________后,
装入药品,关闭K2、K3,打开K1,一
段时间后,再关闭K1,打开K2,加入足
量的浓HNO3。
实验二:验证铜与稀硝酸的反应
待装置B中反应完全后……
回答下列有关问题:
(1)实验一中的横线上应填入的内容是 ________________;装置B中装浓硝酸的仪器名称是 ____________。
(2)实验一中“关闭K2、K3,打开K1”的目的是 _________________
__________________________________________。
(3)装置B中发生反应的离子方程式为 __________________________
________________________________________________。
(4)实验二的后续操作顺序为 ________________(填标号),打开止水夹后装置C的具支试管中的现象为 ______________________________。
a.打开止水夹 b.打开K1
c.打开K3,加入蒸馏水 d.关闭K1
e.插入铜丝
(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色。小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同,浓度小时呈蓝色,浓度大时呈绿色。
猜想2:NO2溶解在硝酸铜溶液中,导致溶液颜色不同。
继续实验,打开K1,一段时间后,装置B中溶液变为蓝色,说明 ___________可能成立,请设计实验验证另一猜想的可能性: _________
____________________________________________________________。
【解析】 研究铜与浓、稀HNO3反应的差异,先利用二氧化碳将装置中的空气排出,防止Cu与稀硝酸反应生成的NO被氧化,装置B中滴加浓硝酸时Cu与浓硝酸反应生成二氧化氮,在C中验证铜和稀硝酸的反应,最后尾气处理,以此来解答。(1)装置连接后首先需要做的是检验装置的气密性;装置B中装浓硝酸的仪器名称是分液漏斗。(2)由于装置中含有空气,会干扰NO检验,所以实验一中“关闭K2、K3,打开K1”的目的是排尽装置内的空气,防止Cu与稀硝酸反应生成的NO被氧化。(3)装置B中浓硝酸和铜反应生成硝酸铜、二氧化氮和水,发生反应的离子方程式为Cu+2NO-3+4H+===Cu2++2NO2↑+2H2O。(4)实验二
是验证铜与稀硝酸的反应,因此首先把生成的二氧化氮转化为硝酸,所以后续操作顺序为待装置B中反应完全后打开K1、打开K3,加入蒸馏水、插入铜丝、关闭K1、打开止水夹,即bceda,打开止水夹后氧气把NO氧化为二氧化氮,则装置C的具支试管中的现象为液面上方出现红棕色气体。(5)继续实验,打开K1,一段时间后,装置B中溶液变为蓝色,由于A装置中二氧化碳把二氧化氮带出,因此说明猜想2可能成立,要验证猜想1的可能性,实验方案为取装置B中的溶液适量于试管中,加入适量蒸馏水稀释,若溶液变为蓝色,说明猜想1成立。
同课章节目录
