高考化学二轮复习题型突破二突破点3综合实验中的定量分析与计算课件(共38张PPT)
文档属性
| 名称 | 高考化学二轮复习题型突破二突破点3综合实验中的定量分析与计算课件(共38张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 14:36:43 | ||
图片预览











文档简介
(共38张PPT)
题型突破二 化学实验综合
突破点3 综合实验中的定量分析与计算
高考真题赏析 明考向
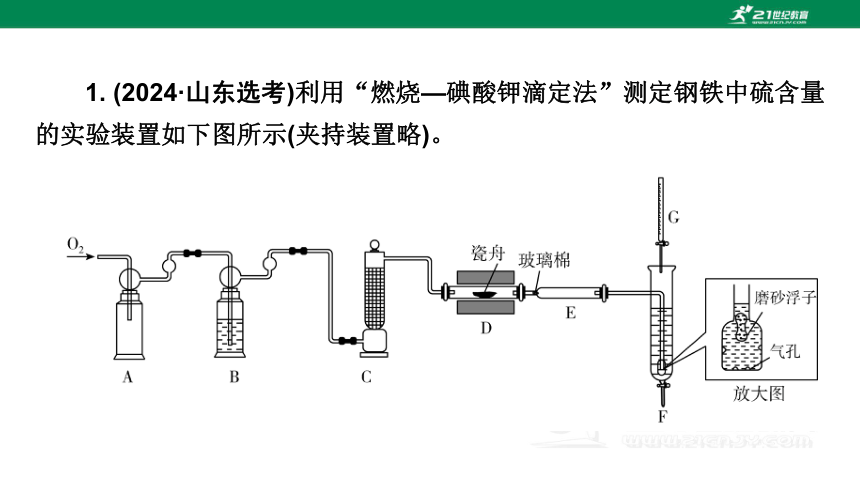
1. (2024·山东选考)利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持装置略)。
实验过程如下:
①加样,将a mg样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装c(KIO3)∶c(KI)略小于1∶5的KIO3碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量KIO3碱性标准溶液,发生反应:KIO3+5KI+6HCl===3I2+6KCl+3H2O,使溶液显浅蓝色。
②燃烧:按一定流速通入O2,一段时间后,加热并使样品燃烧。
③滴定:当F内溶液浅蓝色消退时(发生反应:SO2+I2+2H2O===H2SO4+2HI),立即用KIO3碱性标准溶液滴定至浅蓝色复现。随SO2不断进入F,滴定过程中溶液颜色“消退—变蓝”不断变换,直至终点。
回答下列问题:
(1)取20.00 mL 0.100 0 mol·L-1 KIO3的碱性溶液和一定量的KI固体,配制1 000 mL KIO3碱性标准溶液,下列仪器必须用到的是 _______
(填标号)。
A.玻璃棒
B.1 000 mL锥形瓶
C.500 mL容量瓶
D.胶头滴管
(2)装置B和C的作用是充分干燥O2,B中的试剂为 ____________。装置F中通气管末端多孔玻璃泡内置一密度小于水的磨砂浮子(见放大图),目的是 ________________________。
(3)该滴定实验达终点的现象是 _____________________________;滴定消耗KIO3碱性标准溶液V mL,样品中硫的质量分数是 __________
_______(用代数式表示)。
【解析】 由题中信息可知,利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验中,将氧气经干燥、净化后通入管式炉中将钢铁中硫氧化为SO2,然后将生成的SO2导入碘液中吸收,通过消耗KIO3碱性标准溶液的体积来测定钢铁中硫的含量。(1)取20.00 mL 0.100 0 mol·L-1 KIO3的碱性溶液和一定量的KI固体,配制1 000 mL KIO3碱性标准溶液(稀释了50倍后KIO3的浓度为0.002 0 mol·L-1),需要用碱式滴定管或移液管量取20.00 mL 0.100 0 mol·L-1 KIO3的碱性溶液,需要用一定精确度的天平称量一定质量的KI固体,需要在烧杯中溶解KI固体,溶解时要用到玻璃棒搅拌,需要用1 000 mL容量瓶配制标准溶液,需要用胶头滴
管定容,因此,下列仪器必须用到的是AD。(2)装置B和C的作用是充分干燥O2,浓硫酸具有吸水性,常用于干燥某些气体,因此B中的试剂为浓硫酸。装置F中通气管末端多孔玻璃泡内置一密度小于水的磨砂浮子,其目的是防止倒吸,因为磨砂浮子的密度小于水,若球泡内水面上升,磨砂浮子也随之上升,磨砂浮子可以作为一个磨砂玻璃塞将导气管的出气口堵塞上,从而防止倒吸。(3)该滴定实验是利用过量的1滴或半滴标准溶液来指示滴定终点的,因此,该滴定实验达终点的现象是当加入最后半滴KIO3碱性标准溶液后,溶液由无色突变为蓝色且30 s内不变色;由S元素守恒及SO2+I2+2H2O===H2SO4+2HI、KIO3+5KI+6HCl
2. (2023·河北选考)配合物Na3[Co(NO2)6](M=404 g·mol-1)在分析化学中用于K+的鉴定,其制备步骤如下:
①向三颈烧瓶中加入15.0 g NaNO2和15.0 mL热蒸馏水,搅拌溶解。
②磁力搅拌下加入5.0 g Co(NO3)2·6H2O,从仪器a加入50%醋酸7.0 mL。冷却至室温后,再从仪器b缓慢滴入30%双氧水8.0 mL。待反应结束,滤去固体。
③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
【答案】 80.0
规律方法整合 建模型
? 定量实验数据的测定方法
1.沉淀法:先将欲测定离子转化为沉淀,然后称量沉淀(经洗涤、干燥)的质量,再通过原子守恒进行计算。
2.气体法:(1)测定气体的体积:把待测定元素转化为气体,通过排液量气装置测定气体体积,转化为标准状况下体积并进行计算。
(2)测定气体的质量:一种是测定反应装置反应或分解释放出气体前后的质量差;另一种是根据气体性质选择恰当的吸收剂,计算吸收剂吸收前后的质量差,即为气体的质量。
3.滴定法:通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算。
4.热重法:分析热重曲线(物质质量与温度关系曲线),通过计算验证就可以知道样品热分解的产物的组成及其发生的分解反应等信息。
? 常见定量实验的数据计算
强基培优精练 提能力
2. (2024·河北邯郸二模节选)[Co(NH3)6]Cl3[三氯化六氨合钴(Ⅲ)]易溶于热水,难溶于冷水及乙醇,常用于制备钴的高效催化剂。某化学兴趣小组测定产品[Co(NH3)6]Cl3中氨和氯的含量。已知:[Co(NH3)6]Cl3在热的强碱溶液中发生反应:[Co(NH3)6]Cl3+3NaOH===Co(OH)3↓+6NH3↑+3NaCl;
Ksp(AgCl白色)=1.0×10-10,Ksp(Ag2CrO4)=2.0×10-12(砖红色)。
(1)氨的测定:准确称取m g [Co(NH3)6]Cl3样品放入三颈烧瓶,向其中加入过量的NaOH溶液,用20.00 mL 0.5 mol·L-1盐酸吸收生成的气体,再用NaOH标准溶液滴定剩余盐酸,吸收装置如右图所示:
用0.100 0 mol·L-1 NaOH标准溶液滴定盐酸至终点,消耗NaOH标准溶液20.00 mL。
①滴定过程中选用 ________作为指示剂。
②样品中氨的物质的量为 ________mol。
③反应结束后,通入氮气的作用是 ____________________________
_____________________________________。
(2)氯的测定:将反应后三颈烧瓶中的混合物过滤,滤液用硝酸调节pH至中性,选用K2CrO4作为指示剂,用AgNO3标准溶液滴定。
①滤液用硝酸调整pH至中性的原因是:若pH过小, ____________
_________________________________;若pH过大, ________________
________________________________。
②滴定终点时,指示剂的物质的量浓度不能大于 _______mol·L-1。
考前押题 练预测
(2024·河北石家庄三模)纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,产品中碳酸氢钠含量的测定步骤如下:
称取a g产品加水溶解,滴加指示剂M,用c0 mol·L-1盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸V1 mL;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积V2 mL。
已知:相关物质的溶解度如下
温度/℃
物质 10 20 30 40 50 60 70
NaCl 35.8 36.0 36.3 36.6 37.0 37.3 37.8
NH4HCO3 15.8 21.0 27.0 — — — —
NaHCO3 8.15 9.6 11.1 12.7 14.5 16.4 —
NH4Cl 33.3 37.2 41.4 45.8 50.4 55.2 60.2
说明:“—”表示该物质在相应温度下已开始分解。
(1)碳酸氢钠含量的测定用到的玻璃仪器除胶头滴管外还需要下列仪器中的 __________________________(填仪器名称)。
(2)指示剂M为 ____________;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为 ____________________________________________;选择指示剂N时,滴定终点溶液颜色变化为 ____________________。
(3)产品中碳酸氢钠的质量分数为 ________________________(用含字母的代数式表示)。
【解析】 (1)利用中和滴定的方法测定产品中碳酸氢钠含量,中和滴定时用到的玻璃仪器除胶头滴管外还需要用到酸式滴定管和锥形瓶。(2)测定产品中碳酸氢钠含量时,先向溶液中滴入酚酞溶液做指示剂,将溶液中的碳酸钠转化为碳酸氢钠,滴定终点的实验现象为溶液由浅红色变为无色;然后再向溶液中滴入甲基橙溶液做指示剂,将溶液中的碳酸氢钠转化为碳酸,滴定终点的实验现象为溶液由黄色变为橙色;滴定过程中,为防止盐酸浓度局部过高,使得二氧化碳逸出导致滴定误差,滴定时盐酸需要逐滴加入并不断振荡。(3)滴定过程中,酚酞溶液做指示剂
题型突破二 化学实验综合
突破点3 综合实验中的定量分析与计算
高考真题赏析 明考向
1. (2024·山东选考)利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持装置略)。
实验过程如下:
①加样,将a mg样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管G内预装c(KIO3)∶c(KI)略小于1∶5的KIO3碱性标准溶液,吸收管F内盛有盐酸酸化的淀粉水溶液。向F内滴入适量KIO3碱性标准溶液,发生反应:KIO3+5KI+6HCl===3I2+6KCl+3H2O,使溶液显浅蓝色。
②燃烧:按一定流速通入O2,一段时间后,加热并使样品燃烧。
③滴定:当F内溶液浅蓝色消退时(发生反应:SO2+I2+2H2O===H2SO4+2HI),立即用KIO3碱性标准溶液滴定至浅蓝色复现。随SO2不断进入F,滴定过程中溶液颜色“消退—变蓝”不断变换,直至终点。
回答下列问题:
(1)取20.00 mL 0.100 0 mol·L-1 KIO3的碱性溶液和一定量的KI固体,配制1 000 mL KIO3碱性标准溶液,下列仪器必须用到的是 _______
(填标号)。
A.玻璃棒
B.1 000 mL锥形瓶
C.500 mL容量瓶
D.胶头滴管
(2)装置B和C的作用是充分干燥O2,B中的试剂为 ____________。装置F中通气管末端多孔玻璃泡内置一密度小于水的磨砂浮子(见放大图),目的是 ________________________。
(3)该滴定实验达终点的现象是 _____________________________;滴定消耗KIO3碱性标准溶液V mL,样品中硫的质量分数是 __________
_______(用代数式表示)。
【解析】 由题中信息可知,利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验中,将氧气经干燥、净化后通入管式炉中将钢铁中硫氧化为SO2,然后将生成的SO2导入碘液中吸收,通过消耗KIO3碱性标准溶液的体积来测定钢铁中硫的含量。(1)取20.00 mL 0.100 0 mol·L-1 KIO3的碱性溶液和一定量的KI固体,配制1 000 mL KIO3碱性标准溶液(稀释了50倍后KIO3的浓度为0.002 0 mol·L-1),需要用碱式滴定管或移液管量取20.00 mL 0.100 0 mol·L-1 KIO3的碱性溶液,需要用一定精确度的天平称量一定质量的KI固体,需要在烧杯中溶解KI固体,溶解时要用到玻璃棒搅拌,需要用1 000 mL容量瓶配制标准溶液,需要用胶头滴
管定容,因此,下列仪器必须用到的是AD。(2)装置B和C的作用是充分干燥O2,浓硫酸具有吸水性,常用于干燥某些气体,因此B中的试剂为浓硫酸。装置F中通气管末端多孔玻璃泡内置一密度小于水的磨砂浮子,其目的是防止倒吸,因为磨砂浮子的密度小于水,若球泡内水面上升,磨砂浮子也随之上升,磨砂浮子可以作为一个磨砂玻璃塞将导气管的出气口堵塞上,从而防止倒吸。(3)该滴定实验是利用过量的1滴或半滴标准溶液来指示滴定终点的,因此,该滴定实验达终点的现象是当加入最后半滴KIO3碱性标准溶液后,溶液由无色突变为蓝色且30 s内不变色;由S元素守恒及SO2+I2+2H2O===H2SO4+2HI、KIO3+5KI+6HCl
2. (2023·河北选考)配合物Na3[Co(NO2)6](M=404 g·mol-1)在分析化学中用于K+的鉴定,其制备步骤如下:
①向三颈烧瓶中加入15.0 g NaNO2和15.0 mL热蒸馏水,搅拌溶解。
②磁力搅拌下加入5.0 g Co(NO3)2·6H2O,从仪器a加入50%醋酸7.0 mL。冷却至室温后,再从仪器b缓慢滴入30%双氧水8.0 mL。待反应结束,滤去固体。
③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
【答案】 80.0
规律方法整合 建模型
? 定量实验数据的测定方法
1.沉淀法:先将欲测定离子转化为沉淀,然后称量沉淀(经洗涤、干燥)的质量,再通过原子守恒进行计算。
2.气体法:(1)测定气体的体积:把待测定元素转化为气体,通过排液量气装置测定气体体积,转化为标准状况下体积并进行计算。
(2)测定气体的质量:一种是测定反应装置反应或分解释放出气体前后的质量差;另一种是根据气体性质选择恰当的吸收剂,计算吸收剂吸收前后的质量差,即为气体的质量。
3.滴定法:通过酸碱中和滴定、沉淀滴定和氧化还原滴定等获得相应数据后再进行相关计算。
4.热重法:分析热重曲线(物质质量与温度关系曲线),通过计算验证就可以知道样品热分解的产物的组成及其发生的分解反应等信息。
? 常见定量实验的数据计算
强基培优精练 提能力
2. (2024·河北邯郸二模节选)[Co(NH3)6]Cl3[三氯化六氨合钴(Ⅲ)]易溶于热水,难溶于冷水及乙醇,常用于制备钴的高效催化剂。某化学兴趣小组测定产品[Co(NH3)6]Cl3中氨和氯的含量。已知:[Co(NH3)6]Cl3在热的强碱溶液中发生反应:[Co(NH3)6]Cl3+3NaOH===Co(OH)3↓+6NH3↑+3NaCl;
Ksp(AgCl白色)=1.0×10-10,Ksp(Ag2CrO4)=2.0×10-12(砖红色)。
(1)氨的测定:准确称取m g [Co(NH3)6]Cl3样品放入三颈烧瓶,向其中加入过量的NaOH溶液,用20.00 mL 0.5 mol·L-1盐酸吸收生成的气体,再用NaOH标准溶液滴定剩余盐酸,吸收装置如右图所示:
用0.100 0 mol·L-1 NaOH标准溶液滴定盐酸至终点,消耗NaOH标准溶液20.00 mL。
①滴定过程中选用 ________作为指示剂。
②样品中氨的物质的量为 ________mol。
③反应结束后,通入氮气的作用是 ____________________________
_____________________________________。
(2)氯的测定:将反应后三颈烧瓶中的混合物过滤,滤液用硝酸调节pH至中性,选用K2CrO4作为指示剂,用AgNO3标准溶液滴定。
①滤液用硝酸调整pH至中性的原因是:若pH过小, ____________
_________________________________;若pH过大, ________________
________________________________。
②滴定终点时,指示剂的物质的量浓度不能大于 _______mol·L-1。
考前押题 练预测
(2024·河北石家庄三模)纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,产品中碳酸氢钠含量的测定步骤如下:
称取a g产品加水溶解,滴加指示剂M,用c0 mol·L-1盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸V1 mL;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积V2 mL。
已知:相关物质的溶解度如下
温度/℃
物质 10 20 30 40 50 60 70
NaCl 35.8 36.0 36.3 36.6 37.0 37.3 37.8
NH4HCO3 15.8 21.0 27.0 — — — —
NaHCO3 8.15 9.6 11.1 12.7 14.5 16.4 —
NH4Cl 33.3 37.2 41.4 45.8 50.4 55.2 60.2
说明:“—”表示该物质在相应温度下已开始分解。
(1)碳酸氢钠含量的测定用到的玻璃仪器除胶头滴管外还需要下列仪器中的 __________________________(填仪器名称)。
(2)指示剂M为 ____________;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为 ____________________________________________;选择指示剂N时,滴定终点溶液颜色变化为 ____________________。
(3)产品中碳酸氢钠的质量分数为 ________________________(用含字母的代数式表示)。
【解析】 (1)利用中和滴定的方法测定产品中碳酸氢钠含量,中和滴定时用到的玻璃仪器除胶头滴管外还需要用到酸式滴定管和锥形瓶。(2)测定产品中碳酸氢钠含量时,先向溶液中滴入酚酞溶液做指示剂,将溶液中的碳酸钠转化为碳酸氢钠,滴定终点的实验现象为溶液由浅红色变为无色;然后再向溶液中滴入甲基橙溶液做指示剂,将溶液中的碳酸氢钠转化为碳酸,滴定终点的实验现象为溶液由黄色变为橙色;滴定过程中,为防止盐酸浓度局部过高,使得二氧化碳逸出导致滴定误差,滴定时盐酸需要逐滴加入并不断振荡。(3)滴定过程中,酚酞溶液做指示剂
同课章节目录
