第6练 离子方程式的书写与正误判断 课时作业(含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第6练 离子方程式的书写与正误判断 课时作业(含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 531.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 01:08:59 | ||
图片预览




文档简介
第6练 离子方程式的书写与正误判断
一、 单项选择题
1. 下列所述实验事实或所对应的离子方程式不正确的是( )
选项 实验事实 离子方程式
A 过量H2S通入FeCl3溶液中产生黑褐色沉淀 3H2S+2Fe3+===2FeS↓+S↓+6H+
B 过量的NaOH与NH4Al(SO4)2反应未生成沉淀 NH+Al3++5OH-===AlO+2H2O+NH3·H2O
C 等物质的量NaHSO4与Ba(OH)2溶液反应产生白色沉淀 H++SO+Ba2++OH-===H2O+BaSO4↓
D 苯酚钠溶液中通入CO2,溶液变浑浊 C6H5O-+H2O+CO2―→C6H5OH+HCO
2. 下列实验对应的离子方程式不正确的是( )
A. 将碳酸氢钙溶液与过量的澄清石灰水混合:HCO+Ca2++OH-===CaCO3↓+H2O
B. 将少量SO2通入NaClO溶液:SO2+H2O+2ClO-===SO+2HClO
C. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH+SO+H2O
D. 向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O===[Ag(NH3)2]++2H2O
3. 下列离子方程式,能正确解释沉淀产生原因的是( )
A. 向FeCl3溶液中加入氨水,产生红褐色沉淀:Fe3++3OH-===Fe(OH)3↓
B. 向甲醛中加入足量新制Cu(OH)2悬浊液,加热,产生砖红色沉淀:HCHO+4Cu(OH)2+2OH-CO+2Cu2O↓+6H2O
C. 向饱和Na2CO3溶液中通入CO2,产生白色沉淀:Na++CO+CO2+H2O===NaHCO3↓
D. 向Ba(NO3)2溶液中通入SO2,产生白色沉淀:Ba2++SO2+H2O===BaSO3↓+2H+
4. 下列反应的离子方程式正确的是( )
A. 向硫化钠溶液中通入足量二氧化硫:2S2-+5SO2+2H2O===3S↓+4HSO
B. 向Mg(HCO3)2溶液中加入足量烧碱溶液:2OH-+Mg2++2HCO===MgCO3↓+CO+2H2O
C. 向次氯酸钙溶液中通入过量二氧化碳:CO2+H2O+Ca2++2ClO-===CaCO3↓+2HClO
D. 向Fe(NO3)3溶液中通入少量SO2:2Fe3++SO2+2H2O===2Fe2++4H++SO
5. (2025·南师附中高三下月考)对于下列实验,描述其反应的离子方程式错误的是( )
A. 用惰性电极电解硫酸铜溶液:2Cu2++2H2O2Cu+4H++O2↑
B. 向苯酚钠溶液中滴加稀盐酸:
C. 将K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
D. 向氢氧化钙溶液中滴加少量碳酸氢钙溶液:Ca2++OH-+HCO===CaCO3↓+H2O
6. 宏观辨识与微观探析是化学学科核心素养之一,下列反应的离子方程式书写错误的是( )
A. 漂白粉溶液吸收CO2后产生白色沉淀:Ca2++CO2+H2O===CaCO3↓+2H+
B. 氯气通入氢氧化钠溶液制“84”消毒液:Cl2+2OH-===Cl-+ClO-+H2O
C. 过氧化钠溶于水制氧气:2Na2O2+2H2O===4Na++4OH-+O2↑
D. 用氯化铁溶液蚀刻覆铜板:2Fe3++Cu===2Fe2++Cu2+
7. (2024·南京外国语二模)下列离子方程式书写不正确的是( )
A. 锌和稀硫酸反应:Zn+2H+===Zn2++H2↑
B. 稀盐酸与“铁红”反应:Fe2O3+6H+===2Fe3++3H2O
C. 石灰石与稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
D. 铜片插入到硝酸银溶液中:Cu+Ag+===Cu2++Ag
二、 非选择题
8. (1)电解锰渣主要含MnO2、PbSO4、Fe2(SO4)3、SiO2。利用电解锰回收铅的工艺如图所示:
“还原酸浸”时,Fe2(SO4)3氧化PbS生成S的离子方程式为___________________________________________。
(2)五氧化二钒主要用作合金添加剂,含钒钢具有强度高,韧性大,耐磨性好等优良特性。工业上常用炼钢残渣(主要含V2O3及少量铁粉、Fe2O3、SiO2、Al2O3等杂质)为原料制取V2O5的一种工艺流程如图所示:
写出“沉硅、铝”反应的离子方程式:____________________________、_____________。
(3)以钕铁硼油泥废料(主要物相为RE2O3、Fe2O3)为原料,回收有价金属的工艺流程如图所示。
已知:用RE表示稀土元素。
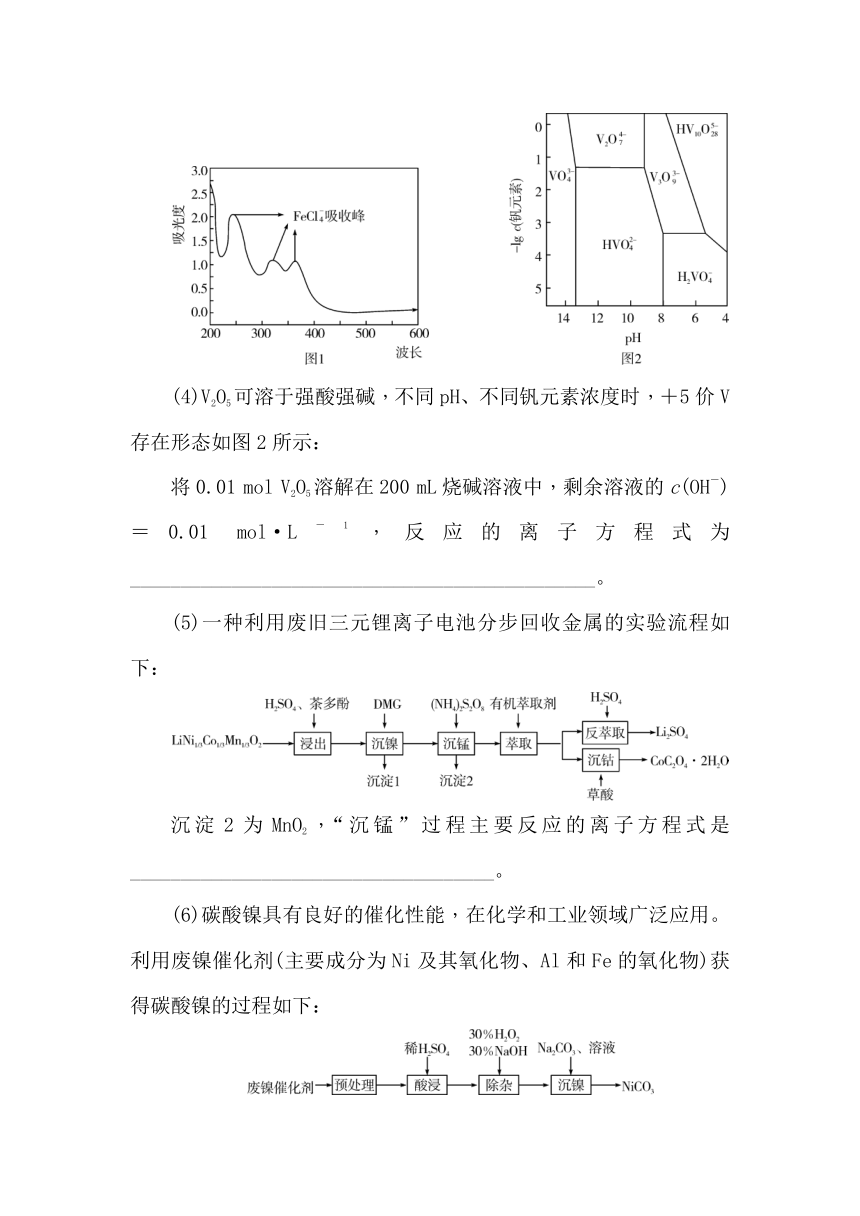
浸取后,对浸取液进行紫外可见光光度测试,结果如图1所示。写出Fe2O3与盐酸反应的离子方程式:______________________________________。
(4)V2O5可溶于强酸强碱,不同pH、不同钒元素浓度时,+5价V存在形态如图2所示:
将0.01 mol V2O5溶解在200 mL烧碱溶液中,剩余溶液的c(OH-)=0.01 mol·L-1,反应的离子方程式为______________________________________________。
(5)一种利用废旧三元锂离子电池分步回收金属的实验流程如下:
沉淀2为MnO2,“沉锰”过程主要反应的离子方程式是____________________________________。
(6)碳酸镍具有良好的催化性能,在化学和工业领域广泛应用。利用废镍催化剂(主要成分为Ni及其氧化物、Al和Fe的氧化物)获得碳酸镍的过程如下:
已知溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
物质 Fe(OH)3 Al(OH)3 Ni(OH)2 Fe(OH)2
开始沉淀pH 2.2 3.7 7.2 7.5
完全沉淀pH 3.2 4.7 8.7 9.0
“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH,适当升温,反应2 h。该过程还可用NaClO替代H2O2,调节pH为3.5,其反应的离子方程式为____________________________________________。
(7)As(V)在不同pH条件下的物种分布分数如图所示。
向中性含砷(V)废水中加入适量石灰水,使As(V)完全转化为Ca3(AsO4)2沉淀。写出该反应的离子方程式:______________________________________________。
(8)工业上用磷铁渣(主要含FeP、Fe2P,以及少量Fe2O3、SiO2等杂质)制备FePO4(磷酸铁)。
已知:FePO4难溶于水,能溶于无机强酸。
“浸取”时Fe2P发生反应的离子方程式为______________________________________________。
(9)工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_________________。
(10)以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
已知:①酸性条件下,MnO2的氧化性强于Fe3+;②“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有_______________________。
第6练 离子方程式的书写与正误判断
1. A 解析:过量H2S通入FeCl3溶液中产生淡黄色沉淀,没有黑色沉淀生成,离子方程式为H2S+2Fe3+===2Fe2++S↓+2H+,A不正确;过量的NaOH与NH4Al(SO4)2反应,NH转化为NH3·H2O,Al3+转化为[Al(OH)4]-,未生成沉淀,离子方程式为NH+Al3++5OH-===AlO+2H2O+NH3·H2O,B正确;等物质的量NaHSO4与Ba(OH)2溶液反应,生成BaSO4白色沉淀、NaOH和水,离子方程式为H++SO+Ba2++OH-===H2O+BaSO4↓,C正确;苯酚钠溶液中通入CO2,不管CO2通入量如何,溶液都变浑浊,且都生成NaHCO3,离子方程式为C6H5O-+H2O+CO2―→C6H5OH+HCO,D正确。故选A。
2. B 解析:根据少定多变的原则可知,将碳酸氢钙溶液与过量的澄清石灰水混合的离子方程式为:HCO+Ca2++OH-===CaCO3↓+H2O,A正确;由于HClO具有强氧化性,可以把亚硫酸根氧化为硫酸根离子,离子方程式为:SO2+H2O+3ClO-===SO+2HClO+Cl-,B错误;用过量氨水吸收工业尾气中的SO2生成亚硫酸铵,离子方程式为:2NH3·H2O+SO2===2NH+SO+H2O,C正确;向氨水中滴入少量硝酸银溶液生成二氨合银离子,离子方程式为:Ag++2NH3·H2O===[Ag(NH3)2]++2H2O,D正确。故选B。
3. B 解析:向FeCl3溶液中加入氨水,产生红褐色沉淀,一水合氨是弱电解质,不能拆写成离子:Fe3++3NH3·H2O===Fe(OH)3↓+3NH,A错误;向甲醛中加入足量新制Cu(OH)2悬浊液,加热,产生砖红色沉淀,甲醛被氧化生成碳酸根:HCHO+4Cu(OH)2+2OH-CO+2Cu2O↓+6H2O,B正确;向饱和Na2CO3溶液中通入CO2,产生白色沉淀:2Na++CO+CO2+H2O===2NaHCO3↓,C错误;向Ba(NO3)2溶液中通入SO2,发生氧化还原反应,产生白色沉淀硫酸钡:3Ba2++2NO+3SO2+2H2O===3BaSO4↓+4H++2NO↑,D错误。故选B。
4. A 解析:硫化钠溶液中通入足量二氧化硫发生反应:2S2-+5SO2+2H2O===3S↓+4HSO,A项正确;向Mg(HCO3)2溶液中加入足量烧碱溶液,生成氢氧化镁沉淀,离子方程式为4OH-+Mg2++2HCO===Mg(OH)2↓+2CO+2H2O,B项错误;向次氯酸钙溶液中通入过量二氧化碳,生成碳酸氢钙,离子方程式为CO2+H2O+ClO-===HCO+HClO,C项错误;向Fe(NO3)3溶液中通入少量SO2会有硝酸生成,硝酸的氧化性强于Fe3+,二氧化硫先和硝酸反应,离子方程式为2NO+3SO2+2H2O===2NO↑+3SO+4H+,D项错误。故选A。
5. B 解析:用惰性电极电解硫酸铜溶液,阳极发生的反应为水失电子生成氧气,阴极发生的反应为铜离子得电子生成铜单质,因此电解反应的总方程式为:2Cu2++2H2O2Cu+O2↑+4H+,故A正确;向苯酚钠溶液中滴加稀盐酸的反应为: O-+H+―→OH,故B错误;二价铁的检验是加入K3[Fe(CN)6]溶液后产生蓝色沉淀,反应为:K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓,故C正确;碳酸氢钙溶液加入是少量,因此以碳酸氢钙配平可得,反应为:Ca2++OH-+HCO===CaCO3↓+H2O,故D正确。故选B。
6. A 解析:漂白粉溶液吸收CO2后产生碳酸钙沉淀和次氯酸,反应的离子方程式是Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO,故A错误;氯气通入氢氧化钠溶液反应的离子方程式:Cl2+2OH-===Cl-+ClO-+H2O,故B正确;过氧化钠溶于水制氧气离子方程式为:2Na2O2+2H2O===4Na++4OH-+O2↑,故C正确;氯化铁和铜反应生成氯化亚铁和氯化铜,离子方程式为2Fe3++Cu===2Fe2++Cu2+,故D正确。故选A。
7. D 解析:Zn与稀硫酸反应生成硫酸锌和氢气,硫酸和硫酸锌都溶于水,所以离子方程式正确,故A不选;“铁红”主要成分为Fe2O3,Fe2O3与稀盐酸反应后生成溶于水的氯化铁,离子方程式正确,故B不选;石灰石的主要成分是CaCO3,和盐酸反应生成溶于水的氯化钙,同时生成水和二氧化碳,对应离子方程式正确,故C不选;铜能置换硝酸银溶液中的银,铜转化为Cu2+,对应离子方程式为:Cu+2Ag+===Cu2++2Ag,书写的离子方程式电荷不守恒,故D选。故选D。
8. (1)2Fe3++PbS+SO===2Fe2++PbSO4+S
(2)SiO+2HCO===H2SiO3↓+2CO、AlO+HCO+H2O===Al(OH)3↓+CO
(3)Fe2O3+8Cl-+6H+===2FeCl+3H2O
(4)V2O5+4OH-===V2O+2H2O
(5)Mn2++S2O+2H2O===2SO+MnO2↓+4H+
(6)ClO-+2Fe2++5H2O===Cl-+2Fe(OH)3+4H+
(7)H2AsO+HAsO+3Ca2++3OH-===Ca3(AsO4)2↓+3H2O
(8)3Fe2P+29H++11NO===6Fe3++11NO↑+3H3PO4+10H2O
(9)Mn2++2HCO===MnCO+CO2↑+H2O
(10)2[AgCl2]-+Fe===Fe2++2Ag+4Cl-、2Fe3++Fe===3Fe2+
解析:(1)由已知条件,Fe2(SO4)3氧化PbS为S及流程框图中加入H2SO4溶液可得SO+2F3++P ===+PbSO4+2F2+,PbS中S由-2价升高为0价,化合价升2;Fe3+中Fe元素由+3价降为+2价,化合价降1,最小公倍数为2;根据氧化还原反应原理及质量守恒配平得反应2Fe3++PbS+SO===2Fe2++PbSO4+S。
(2)炼钢残渣加入碳酸钠、空气焙烧,空气中氧气具有氧化性,将V2O3氧化为NaVO3,二氧化硅转化为硅酸钠、氧化铝转化为含铝钠盐,焙烧后加入氢氧化钠碱浸,氧化铁不反应成为滤渣,“沉硅、铝”中加入碳酸氢铵和硅酸钠反应生成硅酸沉淀:SiO+2HCO===H2SiO3↓+2CO,和偏铝酸根离子生成氢氧化铝沉淀:AlO+HCO+H2O===Al(OH)3↓+CO。
(3)由图可知,Fe2O3与盐酸反应生成了FeCl,离子方程式为:Fe2O3+8Cl-+6H+===2FeCl+3H2O。
(4)由钒原子个数守恒可知,五氧化二钒与氢氧化钠溶液反应所得溶液中钒元素的浓度为=0.1 mol·L-1,则溶液中钒元素浓度-lg c=1,由溶液中氢氧根离子浓度为0.01 mol·L-1,溶液pH为12,由图可知,-lg c为1和pH为12时,+5价钒元素的存在形式为V2O,则五氧化二钒与氢氧化钠溶液反应的离子方程式为V2O5+4OH-===V2O+2H2O。
(5)沉淀2为MnO2,是因为(NH4)2S2O8将Mn2+氧化为MnO2,离子方程式为:Mn2++S2O+2H2O===2SO+MnO2↓+4H+。
(6)用NaClO替代H2O2,调节pH为3.5,则Fe3+转化为Fe(OH)3,反应的离子方程式为ClO-+2Fe2++5H2O===Cl-+2Fe(OH)3+4H+。
(7)根据图像知,中性废水中As(V)以H2AsO、HAsO的形式存在,且各占50%,则加入石灰水后生成Ca3(AsO4)2沉淀的反应方程式为:H2AsO+HAsO+3Ca2++3OH-===Ca3(AsO4)2↓+3H2O。
(8)由分析可知,加入稀硝酸和硫酸在90 ℃条件下浸取的目的是将铁元素和磷元素转化为铁离子和磷酸,则Fe2P与混酸反应生成铁离子、磷酸、一氧化氮和水,反应的离子方程式为3Fe2P+29H++11NO===6Fe3++11NO↑+3H3PO4+10H2O。
(9)Mn2+的溶液中加入NH4HCO3溶液后,生成碳酸锰沉淀和二氧化碳,反应为:
Mn2++2HCO===MnCO+CO2↑+H2O。
(10)铁粉可将[AgCl2]-还原为单质银,过量的铁粉还可以与铁离子发生反应,因此离子方程式为2[AgCl2]-+Fe===Fe2++2Ag+4Cl-、2Fe3++Fe===3Fe2+。
一、 单项选择题
1. 下列所述实验事实或所对应的离子方程式不正确的是( )
选项 实验事实 离子方程式
A 过量H2S通入FeCl3溶液中产生黑褐色沉淀 3H2S+2Fe3+===2FeS↓+S↓+6H+
B 过量的NaOH与NH4Al(SO4)2反应未生成沉淀 NH+Al3++5OH-===AlO+2H2O+NH3·H2O
C 等物质的量NaHSO4与Ba(OH)2溶液反应产生白色沉淀 H++SO+Ba2++OH-===H2O+BaSO4↓
D 苯酚钠溶液中通入CO2,溶液变浑浊 C6H5O-+H2O+CO2―→C6H5OH+HCO
2. 下列实验对应的离子方程式不正确的是( )
A. 将碳酸氢钙溶液与过量的澄清石灰水混合:HCO+Ca2++OH-===CaCO3↓+H2O
B. 将少量SO2通入NaClO溶液:SO2+H2O+2ClO-===SO+2HClO
C. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH+SO+H2O
D. 向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O===[Ag(NH3)2]++2H2O
3. 下列离子方程式,能正确解释沉淀产生原因的是( )
A. 向FeCl3溶液中加入氨水,产生红褐色沉淀:Fe3++3OH-===Fe(OH)3↓
B. 向甲醛中加入足量新制Cu(OH)2悬浊液,加热,产生砖红色沉淀:HCHO+4Cu(OH)2+2OH-CO+2Cu2O↓+6H2O
C. 向饱和Na2CO3溶液中通入CO2,产生白色沉淀:Na++CO+CO2+H2O===NaHCO3↓
D. 向Ba(NO3)2溶液中通入SO2,产生白色沉淀:Ba2++SO2+H2O===BaSO3↓+2H+
4. 下列反应的离子方程式正确的是( )
A. 向硫化钠溶液中通入足量二氧化硫:2S2-+5SO2+2H2O===3S↓+4HSO
B. 向Mg(HCO3)2溶液中加入足量烧碱溶液:2OH-+Mg2++2HCO===MgCO3↓+CO+2H2O
C. 向次氯酸钙溶液中通入过量二氧化碳:CO2+H2O+Ca2++2ClO-===CaCO3↓+2HClO
D. 向Fe(NO3)3溶液中通入少量SO2:2Fe3++SO2+2H2O===2Fe2++4H++SO
5. (2025·南师附中高三下月考)对于下列实验,描述其反应的离子方程式错误的是( )
A. 用惰性电极电解硫酸铜溶液:2Cu2++2H2O2Cu+4H++O2↑
B. 向苯酚钠溶液中滴加稀盐酸:
C. 将K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓
D. 向氢氧化钙溶液中滴加少量碳酸氢钙溶液:Ca2++OH-+HCO===CaCO3↓+H2O
6. 宏观辨识与微观探析是化学学科核心素养之一,下列反应的离子方程式书写错误的是( )
A. 漂白粉溶液吸收CO2后产生白色沉淀:Ca2++CO2+H2O===CaCO3↓+2H+
B. 氯气通入氢氧化钠溶液制“84”消毒液:Cl2+2OH-===Cl-+ClO-+H2O
C. 过氧化钠溶于水制氧气:2Na2O2+2H2O===4Na++4OH-+O2↑
D. 用氯化铁溶液蚀刻覆铜板:2Fe3++Cu===2Fe2++Cu2+
7. (2024·南京外国语二模)下列离子方程式书写不正确的是( )
A. 锌和稀硫酸反应:Zn+2H+===Zn2++H2↑
B. 稀盐酸与“铁红”反应:Fe2O3+6H+===2Fe3++3H2O
C. 石灰石与稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
D. 铜片插入到硝酸银溶液中:Cu+Ag+===Cu2++Ag
二、 非选择题
8. (1)电解锰渣主要含MnO2、PbSO4、Fe2(SO4)3、SiO2。利用电解锰回收铅的工艺如图所示:
“还原酸浸”时,Fe2(SO4)3氧化PbS生成S的离子方程式为___________________________________________。
(2)五氧化二钒主要用作合金添加剂,含钒钢具有强度高,韧性大,耐磨性好等优良特性。工业上常用炼钢残渣(主要含V2O3及少量铁粉、Fe2O3、SiO2、Al2O3等杂质)为原料制取V2O5的一种工艺流程如图所示:
写出“沉硅、铝”反应的离子方程式:____________________________、_____________。
(3)以钕铁硼油泥废料(主要物相为RE2O3、Fe2O3)为原料,回收有价金属的工艺流程如图所示。
已知:用RE表示稀土元素。
浸取后,对浸取液进行紫外可见光光度测试,结果如图1所示。写出Fe2O3与盐酸反应的离子方程式:______________________________________。
(4)V2O5可溶于强酸强碱,不同pH、不同钒元素浓度时,+5价V存在形态如图2所示:
将0.01 mol V2O5溶解在200 mL烧碱溶液中,剩余溶液的c(OH-)=0.01 mol·L-1,反应的离子方程式为______________________________________________。
(5)一种利用废旧三元锂离子电池分步回收金属的实验流程如下:
沉淀2为MnO2,“沉锰”过程主要反应的离子方程式是____________________________________。
(6)碳酸镍具有良好的催化性能,在化学和工业领域广泛应用。利用废镍催化剂(主要成分为Ni及其氧化物、Al和Fe的氧化物)获得碳酸镍的过程如下:
已知溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
物质 Fe(OH)3 Al(OH)3 Ni(OH)2 Fe(OH)2
开始沉淀pH 2.2 3.7 7.2 7.5
完全沉淀pH 3.2 4.7 8.7 9.0
“除杂”时,先加入30% H2O2溶液,再用30% NaOH溶液调pH,适当升温,反应2 h。该过程还可用NaClO替代H2O2,调节pH为3.5,其反应的离子方程式为____________________________________________。
(7)As(V)在不同pH条件下的物种分布分数如图所示。
向中性含砷(V)废水中加入适量石灰水,使As(V)完全转化为Ca3(AsO4)2沉淀。写出该反应的离子方程式:______________________________________________。
(8)工业上用磷铁渣(主要含FeP、Fe2P,以及少量Fe2O3、SiO2等杂质)制备FePO4(磷酸铁)。
已知:FePO4难溶于水,能溶于无机强酸。
“浸取”时Fe2P发生反应的离子方程式为______________________________________________。
(9)工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_________________。
(10)以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
已知:①酸性条件下,MnO2的氧化性强于Fe3+;②“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有_______________________。
第6练 离子方程式的书写与正误判断
1. A 解析:过量H2S通入FeCl3溶液中产生淡黄色沉淀,没有黑色沉淀生成,离子方程式为H2S+2Fe3+===2Fe2++S↓+2H+,A不正确;过量的NaOH与NH4Al(SO4)2反应,NH转化为NH3·H2O,Al3+转化为[Al(OH)4]-,未生成沉淀,离子方程式为NH+Al3++5OH-===AlO+2H2O+NH3·H2O,B正确;等物质的量NaHSO4与Ba(OH)2溶液反应,生成BaSO4白色沉淀、NaOH和水,离子方程式为H++SO+Ba2++OH-===H2O+BaSO4↓,C正确;苯酚钠溶液中通入CO2,不管CO2通入量如何,溶液都变浑浊,且都生成NaHCO3,离子方程式为C6H5O-+H2O+CO2―→C6H5OH+HCO,D正确。故选A。
2. B 解析:根据少定多变的原则可知,将碳酸氢钙溶液与过量的澄清石灰水混合的离子方程式为:HCO+Ca2++OH-===CaCO3↓+H2O,A正确;由于HClO具有强氧化性,可以把亚硫酸根氧化为硫酸根离子,离子方程式为:SO2+H2O+3ClO-===SO+2HClO+Cl-,B错误;用过量氨水吸收工业尾气中的SO2生成亚硫酸铵,离子方程式为:2NH3·H2O+SO2===2NH+SO+H2O,C正确;向氨水中滴入少量硝酸银溶液生成二氨合银离子,离子方程式为:Ag++2NH3·H2O===[Ag(NH3)2]++2H2O,D正确。故选B。
3. B 解析:向FeCl3溶液中加入氨水,产生红褐色沉淀,一水合氨是弱电解质,不能拆写成离子:Fe3++3NH3·H2O===Fe(OH)3↓+3NH,A错误;向甲醛中加入足量新制Cu(OH)2悬浊液,加热,产生砖红色沉淀,甲醛被氧化生成碳酸根:HCHO+4Cu(OH)2+2OH-CO+2Cu2O↓+6H2O,B正确;向饱和Na2CO3溶液中通入CO2,产生白色沉淀:2Na++CO+CO2+H2O===2NaHCO3↓,C错误;向Ba(NO3)2溶液中通入SO2,发生氧化还原反应,产生白色沉淀硫酸钡:3Ba2++2NO+3SO2+2H2O===3BaSO4↓+4H++2NO↑,D错误。故选B。
4. A 解析:硫化钠溶液中通入足量二氧化硫发生反应:2S2-+5SO2+2H2O===3S↓+4HSO,A项正确;向Mg(HCO3)2溶液中加入足量烧碱溶液,生成氢氧化镁沉淀,离子方程式为4OH-+Mg2++2HCO===Mg(OH)2↓+2CO+2H2O,B项错误;向次氯酸钙溶液中通入过量二氧化碳,生成碳酸氢钙,离子方程式为CO2+H2O+ClO-===HCO+HClO,C项错误;向Fe(NO3)3溶液中通入少量SO2会有硝酸生成,硝酸的氧化性强于Fe3+,二氧化硫先和硝酸反应,离子方程式为2NO+3SO2+2H2O===2NO↑+3SO+4H+,D项错误。故选A。
5. B 解析:用惰性电极电解硫酸铜溶液,阳极发生的反应为水失电子生成氧气,阴极发生的反应为铜离子得电子生成铜单质,因此电解反应的总方程式为:2Cu2++2H2O2Cu+O2↑+4H+,故A正确;向苯酚钠溶液中滴加稀盐酸的反应为: O-+H+―→OH,故B错误;二价铁的检验是加入K3[Fe(CN)6]溶液后产生蓝色沉淀,反应为:K++Fe2++[Fe(CN)6]3-===KFe[Fe(CN)6]↓,故C正确;碳酸氢钙溶液加入是少量,因此以碳酸氢钙配平可得,反应为:Ca2++OH-+HCO===CaCO3↓+H2O,故D正确。故选B。
6. A 解析:漂白粉溶液吸收CO2后产生碳酸钙沉淀和次氯酸,反应的离子方程式是Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO,故A错误;氯气通入氢氧化钠溶液反应的离子方程式:Cl2+2OH-===Cl-+ClO-+H2O,故B正确;过氧化钠溶于水制氧气离子方程式为:2Na2O2+2H2O===4Na++4OH-+O2↑,故C正确;氯化铁和铜反应生成氯化亚铁和氯化铜,离子方程式为2Fe3++Cu===2Fe2++Cu2+,故D正确。故选A。
7. D 解析:Zn与稀硫酸反应生成硫酸锌和氢气,硫酸和硫酸锌都溶于水,所以离子方程式正确,故A不选;“铁红”主要成分为Fe2O3,Fe2O3与稀盐酸反应后生成溶于水的氯化铁,离子方程式正确,故B不选;石灰石的主要成分是CaCO3,和盐酸反应生成溶于水的氯化钙,同时生成水和二氧化碳,对应离子方程式正确,故C不选;铜能置换硝酸银溶液中的银,铜转化为Cu2+,对应离子方程式为:Cu+2Ag+===Cu2++2Ag,书写的离子方程式电荷不守恒,故D选。故选D。
8. (1)2Fe3++PbS+SO===2Fe2++PbSO4+S
(2)SiO+2HCO===H2SiO3↓+2CO、AlO+HCO+H2O===Al(OH)3↓+CO
(3)Fe2O3+8Cl-+6H+===2FeCl+3H2O
(4)V2O5+4OH-===V2O+2H2O
(5)Mn2++S2O+2H2O===2SO+MnO2↓+4H+
(6)ClO-+2Fe2++5H2O===Cl-+2Fe(OH)3+4H+
(7)H2AsO+HAsO+3Ca2++3OH-===Ca3(AsO4)2↓+3H2O
(8)3Fe2P+29H++11NO===6Fe3++11NO↑+3H3PO4+10H2O
(9)Mn2++2HCO===MnCO+CO2↑+H2O
(10)2[AgCl2]-+Fe===Fe2++2Ag+4Cl-、2Fe3++Fe===3Fe2+
解析:(1)由已知条件,Fe2(SO4)3氧化PbS为S及流程框图中加入H2SO4溶液可得SO+2F3++P ===+PbSO4+2F2+,PbS中S由-2价升高为0价,化合价升2;Fe3+中Fe元素由+3价降为+2价,化合价降1,最小公倍数为2;根据氧化还原反应原理及质量守恒配平得反应2Fe3++PbS+SO===2Fe2++PbSO4+S。
(2)炼钢残渣加入碳酸钠、空气焙烧,空气中氧气具有氧化性,将V2O3氧化为NaVO3,二氧化硅转化为硅酸钠、氧化铝转化为含铝钠盐,焙烧后加入氢氧化钠碱浸,氧化铁不反应成为滤渣,“沉硅、铝”中加入碳酸氢铵和硅酸钠反应生成硅酸沉淀:SiO+2HCO===H2SiO3↓+2CO,和偏铝酸根离子生成氢氧化铝沉淀:AlO+HCO+H2O===Al(OH)3↓+CO。
(3)由图可知,Fe2O3与盐酸反应生成了FeCl,离子方程式为:Fe2O3+8Cl-+6H+===2FeCl+3H2O。
(4)由钒原子个数守恒可知,五氧化二钒与氢氧化钠溶液反应所得溶液中钒元素的浓度为=0.1 mol·L-1,则溶液中钒元素浓度-lg c=1,由溶液中氢氧根离子浓度为0.01 mol·L-1,溶液pH为12,由图可知,-lg c为1和pH为12时,+5价钒元素的存在形式为V2O,则五氧化二钒与氢氧化钠溶液反应的离子方程式为V2O5+4OH-===V2O+2H2O。
(5)沉淀2为MnO2,是因为(NH4)2S2O8将Mn2+氧化为MnO2,离子方程式为:Mn2++S2O+2H2O===2SO+MnO2↓+4H+。
(6)用NaClO替代H2O2,调节pH为3.5,则Fe3+转化为Fe(OH)3,反应的离子方程式为ClO-+2Fe2++5H2O===Cl-+2Fe(OH)3+4H+。
(7)根据图像知,中性废水中As(V)以H2AsO、HAsO的形式存在,且各占50%,则加入石灰水后生成Ca3(AsO4)2沉淀的反应方程式为:H2AsO+HAsO+3Ca2++3OH-===Ca3(AsO4)2↓+3H2O。
(8)由分析可知,加入稀硝酸和硫酸在90 ℃条件下浸取的目的是将铁元素和磷元素转化为铁离子和磷酸,则Fe2P与混酸反应生成铁离子、磷酸、一氧化氮和水,反应的离子方程式为3Fe2P+29H++11NO===6Fe3++11NO↑+3H3PO4+10H2O。
(9)Mn2+的溶液中加入NH4HCO3溶液后,生成碳酸锰沉淀和二氧化碳,反应为:
Mn2++2HCO===MnCO+CO2↑+H2O。
(10)铁粉可将[AgCl2]-还原为单质银,过量的铁粉还可以与铁离子发生反应,因此离子方程式为2[AgCl2]-+Fe===Fe2++2Ag+4Cl-、2Fe3++Fe===3Fe2+。
同课章节目录
