第2练 物质的量 课时作业(含答案)2026届高三化学一轮总复习
文档属性
| 名称 | 第2练 物质的量 课时作业(含答案)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 699.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 01:17:04 | ||
图片预览



文档简介
第2练 物质的量
一、 单项选择题
1. (2025·东台中学高三月考)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol·L-1 HCl溶液中,HCl分子的数目为NA
B. 1.8 g重水(D2O)中所含质子数为NA
C. 足量的浓盐酸与8.7 g MnO2反应,转移电子的数目为0.4NA
D. 180 g葡萄糖中,C原子的数目为6NA
2. (2024·常州中学高三下月考)常温常压下,0.5 mol铝、0.5 mol铁分别与足量稀硫酸完全反应,生成氢气的体积分别为V1和V2(NA为阿伏加德罗常数的值)。下列说法正确的是( )
A. V2=11.2 L
B. V1∶V2=3∶2
C. 铝、铁消耗硫酸的物质的量相等
D. 反应生成的硫酸铝水解形成Al(OH)3胶体,胶体粒子数目为0.5NA
3. 人体血液中葡萄糖(C6H12O6)浓度的正常参考值是3.9~6.1 mmol·L-1(1 mmol·L-1=1×10-3 mol·L-1)。下列说法正确的是( )
A. 葡萄糖的摩尔质量为180
B. 标准状况下,11.2 L葡萄糖中含有的分子数约为0.5×6.02×1023
C. 1 mol·L-1葡萄糖水溶液中含有的碳原子数约为6×6.02×1023
D. 若某人血液中葡萄糖检查结果为360 mg·L-1,可诊断为低血糖
4. 下列有关溶液配制的叙述正确的是( )
A. 配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B. 用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管
C. 量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液
D. 称取0.158 g KMnO4固体,放入100 mL容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液
5. 溶液配制过程中,下列操作将导致溶液浓度偏小的是( )
A. 定容时俯视容量瓶刻度线
B. 容量瓶未干燥处理
C. 定容加水时超过刻度线后,立即吸出多余的水
D. 将溶液从烧杯转移到容量瓶中后洗涤烧杯,并将洗涤液转移至容量瓶中
二、 非选择题
6. 请补充完整配制100 mL 0.080 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液的实验步骤:用精度为千分之一的电子天平准确称取固体(NH4)2Fe(SO4)2__________ g,将(NH4)2Fe(SO4)2固体转移至100 mL烧杯中,加入少量1 mol·L-1 H2SO4溶液和适量蒸馏水溶解,____________________________________________。轻轻摇动容量瓶,使溶液混匀。__________________________________________________________________________________________,盖好瓶塞,反复上下颠倒,摇匀。将配制好的溶液倒入试剂瓶中,并贴好标签(H—1,N—14,O—16,S—32,Fe—56)。
7. (1)(2024·盐城五校联考)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,同时生成NO。要将16.2 g淀粉完全水解后的淀粉水解液全部转化为草酸,理论上消耗2 mol·L-1 HNO3溶液的体积为__________(H—1,C—12,O—16)。
(2)(2024·南通高三下二调)硫化法:As(Ⅲ)能与硫化剂(能提供S2-)反应生成雌黄(As2S3)沉淀。HCHO能在硫酸盐还原菌的作用下将SO还原为H2S,同时生成HCO。
沉淀1 mol As(Ⅲ)理论上需消耗HCHO的物质的量为__________ mol。
(3)(2024·连云港高三上质量调研)水体中的Cr2O、HCrO、CrO是高毒性的重金属离子,可用Cr(Ⅵ)表示。处理含Cr(Ⅵ)废水的方法有沉淀法、还原法等。
纳米铁粉还原法:纳米铁粉可将水体中Cr(Ⅵ)还原为Cr3+,再通过调节溶液pH,可使Cr3+转化为Cr(OH)3沉淀而被除去。
在氮气气氛保护下,向一定量的FeCl2溶液中逐滴加入一定量的NaBH4溶液,可制得纳米铁粉,反应的离子方程式为2BH+Fe2++6H2O===Fe↓+2B(OH)3+7H2↑,已知电负性 χ(H)> χ(B),每生成1 mol纳米铁粉,被Fe2+氧化的NaBH4的物质的量为__________。
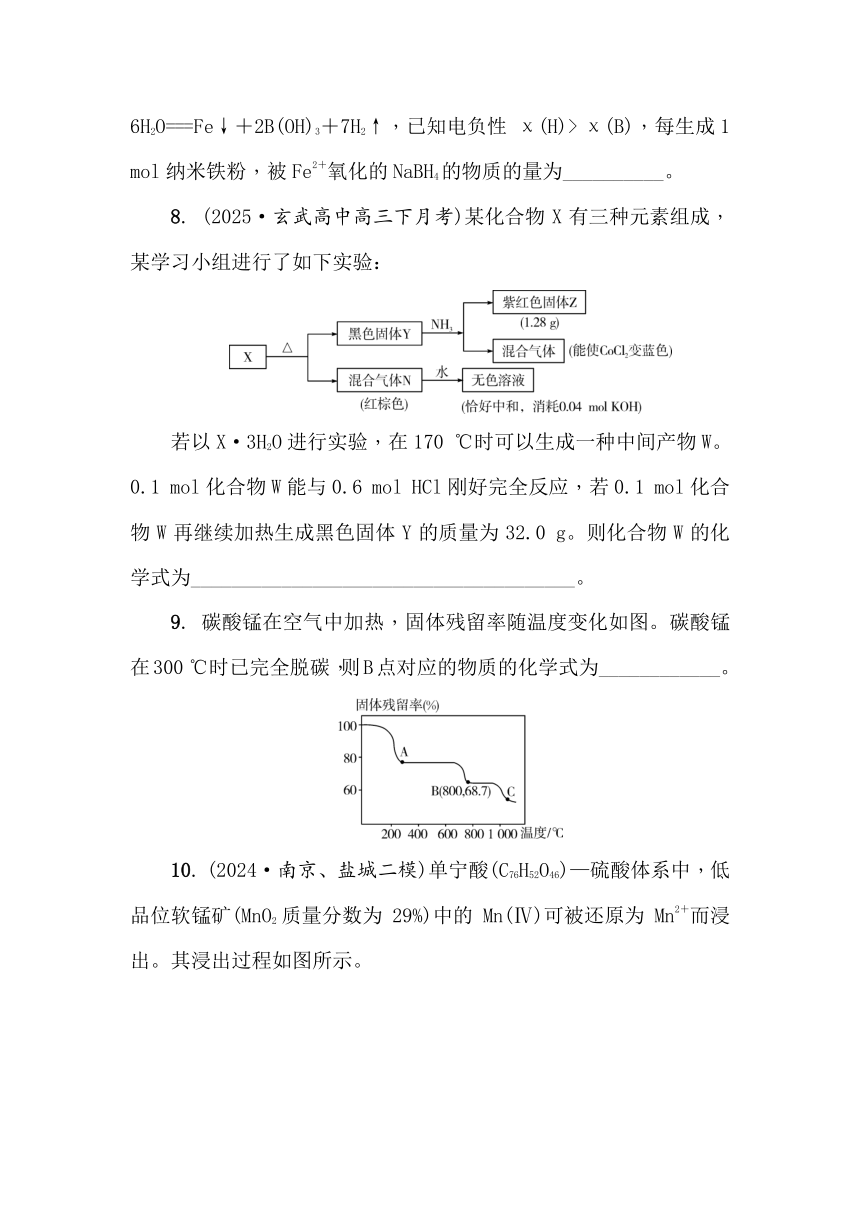
8. (2025·玄武高中高三下月考)某化合物X有三种元素组成,某学习小组进行了如下实验:
若以X·3H2O进行实验,在170 ℃时可以生成一种中间产物W。0.1 mol化合物W能与0.6 mol HCl刚好完全反应,若0.1 mol化合物W再继续加热生成黑色固体Y的质量为32.0 g。则化合物W的化学式为______________________________________。
9. 碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300 ℃时已完全脱碳,则B点对应的物质的化学式为____________。
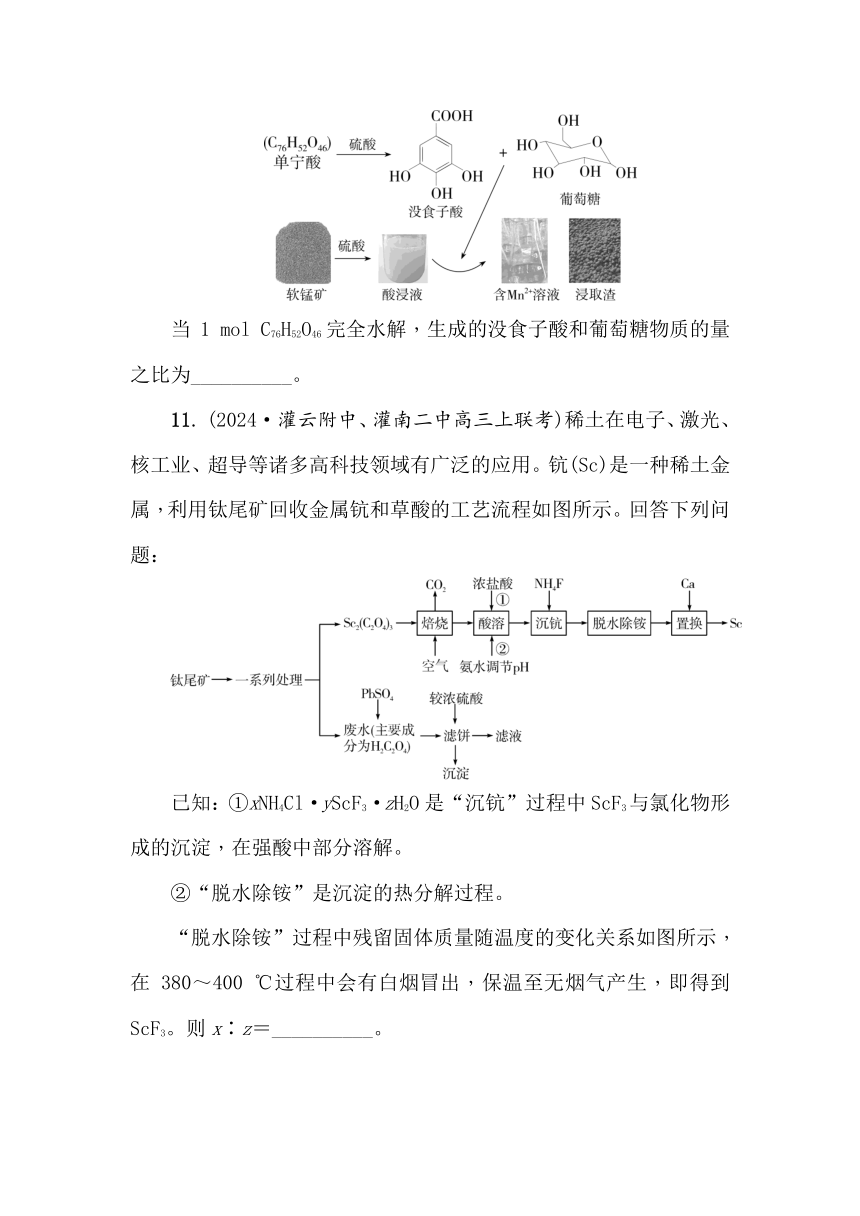
10. (2024·南京、盐城二模)单宁酸(C76H52O46)—硫酸体系中,低品位软锰矿(MnO2质量分数为29%)中的Mn(Ⅳ)可被还原为Mn2+而浸出。其浸出过程如图所示。
当1 mol C76H52O46完全水解,生成的没食子酸和葡萄糖物质的量之比为__________。
11. (2024·灌云附中、灌南二中高三上联考)稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题:
已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的沉淀,在强酸中部分溶解。
②“脱水除铵”是沉淀的热分解过程。
“脱水除铵”过程中残留固体质量随温度的变化关系如图所示,在380~400 ℃过程中会有白烟冒出,保温至无烟气产生,即得到ScF3。则x∶z=__________。
12. 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1。
若要除尽1 m3上述浸出液中的Fe2+和Mn2+,需加入__________ g KMnO4。
13. (2025·淮海中学高三下月考)近日,中国科学技术大学某课题组以Pd掺杂的Co3O4原子层为原型,在温和条件下,通过CO2光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钴的氧化物的重要原料,二水合草酸钴(CoC2O4·2H2O)(M=183 g·mol-1)在空气中受热时固体质量随温度变化的曲线如图所示。
写出B点对应的物质的化学式:________,CD段发生反应的化学方程式为_______________________________。
14. 向AgCl固体中加入5 mol·L-1氨水[溶质以NH3(aq)计],发生反应:AgCl(s)+2NH3(aq)===[Ag(NH3)2]+(aq)+Cl-(aq) K=2.5×10-3。再加入水合肼(N2H4·H2O)还原[Ag(NH3)2]Cl,制得单质银,同时产生N2和NH3两种气体。
(1)溶解0.1 mol AgCl(s),至少需加入氨水的体积为__________(忽略溶液体积的变化)。
(2)水合肼还原[Ag(NH3)2]Cl的化学方程式为______________________________________________________。
15. (2024·通州中学高三月考)工业上可以在酸性介质中用H2O2氧化浸出黄铜矿。40 ℃、pH<1、H2O2过量的条件下用H2O2、H2SO4混合液浸出黄铜矿。
(1)CuFeS2反应后转化为Cu2+、Fe3+、SO。将1 mol CuFeS2完全转化,理论上所需H2O2的物质的量为__________。
(2)浸出过程中发现,H2O2的反应实际用量远大于理论用量,原因是__________________________。
(3)若浸出过程中,溶液中含有少量Na2SO4,则会析出黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀。写出Fe3+转化为黄钠铁矾沉淀的离子方程式:________________________________________________。
16. (2024·溧阳中学高三下月考)利用PbSO4可制得PbO2。PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2。现将1 mol PbO2加热分解得到O2,向“剩余固体”中加入足量的浓盐酸得到Cl2。生成的O2和Cl2的物质的量相等。计算“剩余固体”中Pb、O原子个数比(写出计算过程)。
17. 碱式硫酸铝[(1-x)Al2(SO4)3·xAl(OH)3]溶液用于烟气脱硫,其x值的大小影响碱式硫酸铝溶液的脱硫效率。通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
步骤1:取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.330 0 g。
步骤2:取碱式硫酸铝溶液2.50 mL,稀释至25.00 mL,加入0.100 0 mol·L-1 EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.080 00 mol·L-1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
第2练 物质的量
1. D 解析:HCl是强酸,在溶液中全部以H+和Cl-的形成存在,故1 mol·L-1 HCl溶液中,HCl分子的数目0,A错误;1.8 g重水(D2O)中所含质子数为×10×NA mol-1=0.9NA,B错误;根据反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,故足量的浓盐酸与8.7 g MnO2即=0.1 mol反应,转移电子的数目为0.2NA,C错误;180 g葡萄糖中,C原子的数目为×6×NA mol-1=6NA,D正确。故选D。
2. B 解析:由2Al+3H2SO4===Al2(SO4)3+3H2↑可知,0.5 mol铝完全反应消耗0.75 mol硫酸,生成0.75 mol H2;由Fe+H2SO4===FeSO4+H2↑可知,0.5 mol铁完全反应消耗0.5 mol硫酸,生成0.5 mol H2。常温常压下,气体摩尔体积不是22.4 mol·L-1,则0.5 mol H2的体积V2不是11.2 L,A错误;由阿伏加德罗定律可知,同温同压下,气体体积之比等于其物质的量之比,即V1∶V2=0.75 mol∶0.5 mol=3∶2,B正确;由分析可知,铝、铁消耗的硫酸的物质的量不相等,C错误;Al(OH)3胶体粒子是由若干分子聚集在一起的集合体,故粒子数目无法计算,D错误。故选B。
3. D 解析:葡萄糖的相对分子质量为180,则葡萄糖的摩尔质量为180 g·mol-1,A错误;标准状况下葡萄糖不呈气态,不能用22.4 L·mol-1计算11.2 L葡萄糖物质的量,B错误;溶液的体积未知,不能计算1 mol·L-1葡萄糖水溶液中所含碳原子物质的量,从而不能计算含有的碳原子数,C错误;若某人血液中葡萄糖检查结果为360 mg·L-1,则葡萄糖物质的量浓度为=0.002 mol·L-1=2 mmol·L-1<3.9 mmol·L-1,故可诊断为低血糖,D正确。故选D。
4. B 解析:n(NaOH)=m/M=4.0 g÷40 g·mol-1=0.1 mol。NaOH在溶解时会放出大量热,因此需要冷却至室温后再转移到250 mL容量瓶中,并且洗涤烧杯和玻璃棒2~3次,将洗涤液也转移到容量瓶中,A错误;用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,溶解时用到烧杯、玻璃棒,转移到容量瓶中,再用胶头滴管定容,B正确;浓硫酸稀释时需要将浓硫酸沿烧杯内壁缓慢倒入蒸馏水中,并用玻璃棒不断搅拌,C错误;容量瓶不能作为溶解容器,应在烧杯中进行溶解,D错误。故选B。
5. C 解析:定容时俯视容量瓶刻度线会使溶液的体积偏小,导致所配溶液浓度偏大,故不符合题意;容量瓶未干燥处理不会影响溶质的物质的量和溶液的体积,对所配溶液浓度无影响,故不符合题意;定容加水时超过刻度线后,立即吸出多余的水会使溶质的物质的量偏小,导致所配溶液浓度偏小,故符合题意;将溶液从烧杯转移到容量瓶中后洗涤烧杯,并转移洗涤液不会使溶质的物质的量偏小,故不符合题意。故选C。
6. 2.272 冷却至室温,将烧杯中的溶液沿玻璃棒注入100 mL容量瓶,用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,并将洗涤液都注入容量瓶 将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加至溶液的凹液面与刻度线相切
解析:配制溶液一般需要计算、称量、溶解、冷却转移、定容摇匀、装瓶;配制100 mL 0.080 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液,需m[(NH4)2Fe(SO4)2]=0.1 L×0.080 0 mol·L-1×284 g·mol-1=2.272 g。
7. (1)0.3 L (2)3 (3)0.5
解析:(1)(C6H10O5)n~nC6H12O6,C6H12O6~6HNO3,可得关系式:(C6H10O5)n~6nHNO3,16.2 g淀粉需要0.6 mol HNO3,HNO3溶液体积==0.3 L。
(2)根据题意知HCHO能在硫酸盐还原菌的作用下将SO还原为H2S,同时生成HCO,故2HCHO~H2S,根据As2S3的组成,生成As2S3时,2 mol As(Ⅲ)对应3 mol S2-,那么沉淀1 mol As(Ⅲ)需要 mol S2-,而1 mol H2S提供1 mol S2-,故需要 mol H2S,根据H2S与HCHO对应关系,可知需消耗 mol×2=3 mol HCHO。
(3)由电负性可知,四氢合硼酸钠中氢元素为-1价、硼元素为+3价,则制备纳米铁粉的反应中四氢合硼酸钠为反应的还原剂,亚铁离子和水是氧化剂,由得失电子数目守恒可知,每生成1 mol纳米铁粉时,被亚铁离子氧化的四氢合硼酸根离子的物质的量为=0.5 mol。
8. Cu4(OH)6(NO3)2或Cu(NO3)2·3Cu(OH)2
解析:0.1 mol W能消耗0.6 mol HCl,所以W化学式中含有6个OH-;又因为0.1 mol W分解得到Y(CuO)质量32.0 g即0.4 mol,所以W的化学式中含有4个Cu2+,所以W的化学式为Cu4(OH)6(NO3)2。
9. Mn2O3
解析:设MnCO3物质的量为1 mol,m(MnCO3)=1 mol×115 g·mol-1=115 g,其中n(Mn)=1 mol,m(Mn)=55 g,800 ℃,剩余固体的质量为115 g×68.7%=79 g,其中m(O)=79 g-55 g=24 g,n(O)=24 g÷16 g·mol-1=1.5 mol,n(Mn)∶n(O)=2∶3,则B点对应的物质的化学式为Mn2O3。
10. 10∶1
解析:设1 mol C76H52O46完全水解,生成的没食子酸x mol、葡萄糖y mol,根据C守恒①7x+6y=76,没食子酸、葡萄糖比单宁酸分子中多的氧、氢原子都由水提供,则=,解得x=10,带入①得y=1,生成的没食子酸和葡萄糖物质的量之比为10∶1。
11. 1∶2
解析:已知②“脱水除铵”是复盐沉淀xNH4Cl·yScF3·zH2O的热分解过程,结合图中曲线及数据,200~300 ℃固体质量损失2.16 g是其中的水分,物质的量为0.12 mol,380~400 ℃过程中会有白烟冒出,固体质量损失3.2 g是其中的NH4Cl,物质的量为0.06 mol,则x∶z=1∶2。
12. 7.9
解析:浸出液中c(Fe2+)=5.04 mg·L-1=5.04 g·m-3、c(Mn2+)=1.65 mg·L-1=1.65 g·m-3,1 m3上述浸出液中,Fe2+的物质的量为=0.09 mol,Mn2+的物质的量=0.03 mol,3Fe2++MnO+7H2O===3Fe(OH)3+MnO2↓+5H+、2MnO+3Mn2++2H2O===5MnO2↓+4H+,可知需要高锰酸钾的物质的量为0.09 mol×+0.03 mol×=0.05 mol,需要高锰酸钾的质量为0.05 mol×158 g·mol-1=7.9 g。
13. CoO 6CoO+O22Co3O4
解析:18.3 g CoC2O4·2H2O的物质的量为0.1 mol,当CoC2O4·2H2O失0.2 mol结晶水时,固体减少的质量为3.6 g,此时如果再失去了碳元素,0.2 mol碳,则固体共减少6 g,B点固体质量实际减少了10.8 g,则还有失去4.8 g的氧,恰好为0.3 mol,说明剩余固体为CoO,从C到D的过程中,根据Co元素守恒,如果转化为Co3O4,Co3O4的质量为×(59×3+4×16)×0.1=8.03 g,恰好与D点固体质量相同,所以D为Co3O4,CD段发生反应的化学方程式为:6CoO+O22Co3O4。
14. (1)0.44 L (2)N2H4·H2O+4[Ag(NH3)2]Cl===4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O
解析:(1)0.1 mol AgCl(s)完全溶解生成的[Ag(NH3)2]+和Cl-的物质的量均为0.1 mol,同时消耗0.2 mol NH3,设加入氨水的体积为V L,平衡时[Ag(NH3)2]+和Cl-的物质的量浓度均为 mol·L-1,NH3的物质的量浓度为 mol·L-1,K==2.5×10-3,则V=0.44。
(2)N2H4·H2O还原[Ag(NH3)2]Cl生成Ag、N2、NH3,根据得失电子守恒可知,N2H4·H2O与[Ag(NH3)2]Cl的化学计量数之比为1∶4,化学方程式为N2H4·H2O+4[Ag(NH3)2]Cl===4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O。
15. (1)8.5 mol
(2)过氧化氢不稳定容易分解
(3)Na++3Fe3++2SO+6H2O===NaFe3(SO4)2(OH)6↓+6H+
解析:(1)CuFeS2和H2O2、H2SO4混合液反应后转化为Cu2+、Fe3+、SO,反应中铜元素化合价由+1升为+2、硫元素由-2升为+6,、过氧化氢中氧元素化合价由-1降为-2,根据电荷守恒可知,2CuFeS2+17H2O2+2H+===2Cu2++2Fe3++4SO+18H2O,故将1 mol CuFeS2完全转化,理论上所需H2O2的物质的量为8.5 mol。
(2)浸出过程中发现,H2O2的反应实际用量远大于理论用量,原因是过氧化氢不稳定容易分解,导致其用量增加;
(3)浸出过程中,溶液中含有少量Na2SO4,Na2SO4、铁离子、水会生成并析出黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀,Fe3+转化为黄钠铁矾沉淀的离子方程式:Na++3Fe3++2SO+6H2O===NaFe3(SO4)2(OH)6↓+6H+。
16. 3∶4(过程见解析)
解析:PbO2受热分解固体混合物,再与HCl反应,+4价Pb还原为+2价,Cl-氧化为Cl2,为PbCl2溶液,1 mol PbO2转化为PbCl2,电子转移:1 mol×(4-2)=2 mol,设产生O2 x mol,则Cl2 x mol,根据电子守恒:4x+2x=2 mol,x=,所以1 mol PbO2分解产生O2: mol,则固体混合物中n(O)=2 mol- mol×2= mol,而n(Pb)不变,为1 mol,n(Pb)∶n(O)=1∶=3∶4。
17. 0.41(过程见解析)
解析:25.00 mL溶液中n(SO)=n(BaSO4)==0.01 mol,根据滴定过程可知,2.50 mL碱式硫酸铝溶液中Al3+的物质的量为n(Al3+)=n(EDTA)-n(Cu2+)=0.1 mol·L-1×25×10-3 L-0.08 mol·L-1×20×10-3 L=9×10-4 mol,25.00 mL碱式硫酸铝溶液中n(Al3+)=9×10-3 mol,根据元素守恒有=eq \f(n(SO),n(Al3+))==,解得x=0.41。
一、 单项选择题
1. (2025·东台中学高三月考)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol·L-1 HCl溶液中,HCl分子的数目为NA
B. 1.8 g重水(D2O)中所含质子数为NA
C. 足量的浓盐酸与8.7 g MnO2反应,转移电子的数目为0.4NA
D. 180 g葡萄糖中,C原子的数目为6NA
2. (2024·常州中学高三下月考)常温常压下,0.5 mol铝、0.5 mol铁分别与足量稀硫酸完全反应,生成氢气的体积分别为V1和V2(NA为阿伏加德罗常数的值)。下列说法正确的是( )
A. V2=11.2 L
B. V1∶V2=3∶2
C. 铝、铁消耗硫酸的物质的量相等
D. 反应生成的硫酸铝水解形成Al(OH)3胶体,胶体粒子数目为0.5NA
3. 人体血液中葡萄糖(C6H12O6)浓度的正常参考值是3.9~6.1 mmol·L-1(1 mmol·L-1=1×10-3 mol·L-1)。下列说法正确的是( )
A. 葡萄糖的摩尔质量为180
B. 标准状况下,11.2 L葡萄糖中含有的分子数约为0.5×6.02×1023
C. 1 mol·L-1葡萄糖水溶液中含有的碳原子数约为6×6.02×1023
D. 若某人血液中葡萄糖检查结果为360 mg·L-1,可诊断为低血糖
4. 下列有关溶液配制的叙述正确的是( )
A. 配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B. 用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管
C. 量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液
D. 称取0.158 g KMnO4固体,放入100 mL容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液
5. 溶液配制过程中,下列操作将导致溶液浓度偏小的是( )
A. 定容时俯视容量瓶刻度线
B. 容量瓶未干燥处理
C. 定容加水时超过刻度线后,立即吸出多余的水
D. 将溶液从烧杯转移到容量瓶中后洗涤烧杯,并将洗涤液转移至容量瓶中
二、 非选择题
6. 请补充完整配制100 mL 0.080 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液的实验步骤:用精度为千分之一的电子天平准确称取固体(NH4)2Fe(SO4)2__________ g,将(NH4)2Fe(SO4)2固体转移至100 mL烧杯中,加入少量1 mol·L-1 H2SO4溶液和适量蒸馏水溶解,____________________________________________。轻轻摇动容量瓶,使溶液混匀。__________________________________________________________________________________________,盖好瓶塞,反复上下颠倒,摇匀。将配制好的溶液倒入试剂瓶中,并贴好标签(H—1,N—14,O—16,S—32,Fe—56)。
7. (1)(2024·盐城五校联考)在浓硫酸催化作用下,用硝酸氧化葡萄糖可制取草酸,同时生成NO。要将16.2 g淀粉完全水解后的淀粉水解液全部转化为草酸,理论上消耗2 mol·L-1 HNO3溶液的体积为__________(H—1,C—12,O—16)。
(2)(2024·南通高三下二调)硫化法:As(Ⅲ)能与硫化剂(能提供S2-)反应生成雌黄(As2S3)沉淀。HCHO能在硫酸盐还原菌的作用下将SO还原为H2S,同时生成HCO。
沉淀1 mol As(Ⅲ)理论上需消耗HCHO的物质的量为__________ mol。
(3)(2024·连云港高三上质量调研)水体中的Cr2O、HCrO、CrO是高毒性的重金属离子,可用Cr(Ⅵ)表示。处理含Cr(Ⅵ)废水的方法有沉淀法、还原法等。
纳米铁粉还原法:纳米铁粉可将水体中Cr(Ⅵ)还原为Cr3+,再通过调节溶液pH,可使Cr3+转化为Cr(OH)3沉淀而被除去。
在氮气气氛保护下,向一定量的FeCl2溶液中逐滴加入一定量的NaBH4溶液,可制得纳米铁粉,反应的离子方程式为2BH+Fe2++6H2O===Fe↓+2B(OH)3+7H2↑,已知电负性 χ(H)> χ(B),每生成1 mol纳米铁粉,被Fe2+氧化的NaBH4的物质的量为__________。
8. (2025·玄武高中高三下月考)某化合物X有三种元素组成,某学习小组进行了如下实验:
若以X·3H2O进行实验,在170 ℃时可以生成一种中间产物W。0.1 mol化合物W能与0.6 mol HCl刚好完全反应,若0.1 mol化合物W再继续加热生成黑色固体Y的质量为32.0 g。则化合物W的化学式为______________________________________。
9. 碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300 ℃时已完全脱碳,则B点对应的物质的化学式为____________。
10. (2024·南京、盐城二模)单宁酸(C76H52O46)—硫酸体系中,低品位软锰矿(MnO2质量分数为29%)中的Mn(Ⅳ)可被还原为Mn2+而浸出。其浸出过程如图所示。
当1 mol C76H52O46完全水解,生成的没食子酸和葡萄糖物质的量之比为__________。
11. (2024·灌云附中、灌南二中高三上联考)稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图所示。回答下列问题:
已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的沉淀,在强酸中部分溶解。
②“脱水除铵”是沉淀的热分解过程。
“脱水除铵”过程中残留固体质量随温度的变化关系如图所示,在380~400 ℃过程中会有白烟冒出,保温至无烟气产生,即得到ScF3。则x∶z=__________。
12. 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1。
若要除尽1 m3上述浸出液中的Fe2+和Mn2+,需加入__________ g KMnO4。
13. (2025·淮海中学高三下月考)近日,中国科学技术大学某课题组以Pd掺杂的Co3O4原子层为原型,在温和条件下,通过CO2光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钴的氧化物的重要原料,二水合草酸钴(CoC2O4·2H2O)(M=183 g·mol-1)在空气中受热时固体质量随温度变化的曲线如图所示。
写出B点对应的物质的化学式:________,CD段发生反应的化学方程式为_______________________________。
14. 向AgCl固体中加入5 mol·L-1氨水[溶质以NH3(aq)计],发生反应:AgCl(s)+2NH3(aq)===[Ag(NH3)2]+(aq)+Cl-(aq) K=2.5×10-3。再加入水合肼(N2H4·H2O)还原[Ag(NH3)2]Cl,制得单质银,同时产生N2和NH3两种气体。
(1)溶解0.1 mol AgCl(s),至少需加入氨水的体积为__________(忽略溶液体积的变化)。
(2)水合肼还原[Ag(NH3)2]Cl的化学方程式为______________________________________________________。
15. (2024·通州中学高三月考)工业上可以在酸性介质中用H2O2氧化浸出黄铜矿。40 ℃、pH<1、H2O2过量的条件下用H2O2、H2SO4混合液浸出黄铜矿。
(1)CuFeS2反应后转化为Cu2+、Fe3+、SO。将1 mol CuFeS2完全转化,理论上所需H2O2的物质的量为__________。
(2)浸出过程中发现,H2O2的反应实际用量远大于理论用量,原因是__________________________。
(3)若浸出过程中,溶液中含有少量Na2SO4,则会析出黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀。写出Fe3+转化为黄钠铁矾沉淀的离子方程式:________________________________________________。
16. (2024·溧阳中学高三下月考)利用PbSO4可制得PbO2。PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2。现将1 mol PbO2加热分解得到O2,向“剩余固体”中加入足量的浓盐酸得到Cl2。生成的O2和Cl2的物质的量相等。计算“剩余固体”中Pb、O原子个数比(写出计算过程)。
17. 碱式硫酸铝[(1-x)Al2(SO4)3·xAl(OH)3]溶液用于烟气脱硫,其x值的大小影响碱式硫酸铝溶液的脱硫效率。通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
步骤1:取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.330 0 g。
步骤2:取碱式硫酸铝溶液2.50 mL,稀释至25.00 mL,加入0.100 0 mol·L-1 EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.080 00 mol·L-1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
第2练 物质的量
1. D 解析:HCl是强酸,在溶液中全部以H+和Cl-的形成存在,故1 mol·L-1 HCl溶液中,HCl分子的数目0,A错误;1.8 g重水(D2O)中所含质子数为×10×NA mol-1=0.9NA,B错误;根据反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,故足量的浓盐酸与8.7 g MnO2即=0.1 mol反应,转移电子的数目为0.2NA,C错误;180 g葡萄糖中,C原子的数目为×6×NA mol-1=6NA,D正确。故选D。
2. B 解析:由2Al+3H2SO4===Al2(SO4)3+3H2↑可知,0.5 mol铝完全反应消耗0.75 mol硫酸,生成0.75 mol H2;由Fe+H2SO4===FeSO4+H2↑可知,0.5 mol铁完全反应消耗0.5 mol硫酸,生成0.5 mol H2。常温常压下,气体摩尔体积不是22.4 mol·L-1,则0.5 mol H2的体积V2不是11.2 L,A错误;由阿伏加德罗定律可知,同温同压下,气体体积之比等于其物质的量之比,即V1∶V2=0.75 mol∶0.5 mol=3∶2,B正确;由分析可知,铝、铁消耗的硫酸的物质的量不相等,C错误;Al(OH)3胶体粒子是由若干分子聚集在一起的集合体,故粒子数目无法计算,D错误。故选B。
3. D 解析:葡萄糖的相对分子质量为180,则葡萄糖的摩尔质量为180 g·mol-1,A错误;标准状况下葡萄糖不呈气态,不能用22.4 L·mol-1计算11.2 L葡萄糖物质的量,B错误;溶液的体积未知,不能计算1 mol·L-1葡萄糖水溶液中所含碳原子物质的量,从而不能计算含有的碳原子数,C错误;若某人血液中葡萄糖检查结果为360 mg·L-1,则葡萄糖物质的量浓度为=0.002 mol·L-1=2 mmol·L-1<3.9 mmol·L-1,故可诊断为低血糖,D正确。故选D。
4. B 解析:n(NaOH)=m/M=4.0 g÷40 g·mol-1=0.1 mol。NaOH在溶解时会放出大量热,因此需要冷却至室温后再转移到250 mL容量瓶中,并且洗涤烧杯和玻璃棒2~3次,将洗涤液也转移到容量瓶中,A错误;用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,溶解时用到烧杯、玻璃棒,转移到容量瓶中,再用胶头滴管定容,B正确;浓硫酸稀释时需要将浓硫酸沿烧杯内壁缓慢倒入蒸馏水中,并用玻璃棒不断搅拌,C错误;容量瓶不能作为溶解容器,应在烧杯中进行溶解,D错误。故选B。
5. C 解析:定容时俯视容量瓶刻度线会使溶液的体积偏小,导致所配溶液浓度偏大,故不符合题意;容量瓶未干燥处理不会影响溶质的物质的量和溶液的体积,对所配溶液浓度无影响,故不符合题意;定容加水时超过刻度线后,立即吸出多余的水会使溶质的物质的量偏小,导致所配溶液浓度偏小,故符合题意;将溶液从烧杯转移到容量瓶中后洗涤烧杯,并转移洗涤液不会使溶质的物质的量偏小,故不符合题意。故选C。
6. 2.272 冷却至室温,将烧杯中的溶液沿玻璃棒注入100 mL容量瓶,用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,并将洗涤液都注入容量瓶 将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加至溶液的凹液面与刻度线相切
解析:配制溶液一般需要计算、称量、溶解、冷却转移、定容摇匀、装瓶;配制100 mL 0.080 0 mol·L-1 (NH4)2Fe(SO4)2标准溶液,需m[(NH4)2Fe(SO4)2]=0.1 L×0.080 0 mol·L-1×284 g·mol-1=2.272 g。
7. (1)0.3 L (2)3 (3)0.5
解析:(1)(C6H10O5)n~nC6H12O6,C6H12O6~6HNO3,可得关系式:(C6H10O5)n~6nHNO3,16.2 g淀粉需要0.6 mol HNO3,HNO3溶液体积==0.3 L。
(2)根据题意知HCHO能在硫酸盐还原菌的作用下将SO还原为H2S,同时生成HCO,故2HCHO~H2S,根据As2S3的组成,生成As2S3时,2 mol As(Ⅲ)对应3 mol S2-,那么沉淀1 mol As(Ⅲ)需要 mol S2-,而1 mol H2S提供1 mol S2-,故需要 mol H2S,根据H2S与HCHO对应关系,可知需消耗 mol×2=3 mol HCHO。
(3)由电负性可知,四氢合硼酸钠中氢元素为-1价、硼元素为+3价,则制备纳米铁粉的反应中四氢合硼酸钠为反应的还原剂,亚铁离子和水是氧化剂,由得失电子数目守恒可知,每生成1 mol纳米铁粉时,被亚铁离子氧化的四氢合硼酸根离子的物质的量为=0.5 mol。
8. Cu4(OH)6(NO3)2或Cu(NO3)2·3Cu(OH)2
解析:0.1 mol W能消耗0.6 mol HCl,所以W化学式中含有6个OH-;又因为0.1 mol W分解得到Y(CuO)质量32.0 g即0.4 mol,所以W的化学式中含有4个Cu2+,所以W的化学式为Cu4(OH)6(NO3)2。
9. Mn2O3
解析:设MnCO3物质的量为1 mol,m(MnCO3)=1 mol×115 g·mol-1=115 g,其中n(Mn)=1 mol,m(Mn)=55 g,800 ℃,剩余固体的质量为115 g×68.7%=79 g,其中m(O)=79 g-55 g=24 g,n(O)=24 g÷16 g·mol-1=1.5 mol,n(Mn)∶n(O)=2∶3,则B点对应的物质的化学式为Mn2O3。
10. 10∶1
解析:设1 mol C76H52O46完全水解,生成的没食子酸x mol、葡萄糖y mol,根据C守恒①7x+6y=76,没食子酸、葡萄糖比单宁酸分子中多的氧、氢原子都由水提供,则=,解得x=10,带入①得y=1,生成的没食子酸和葡萄糖物质的量之比为10∶1。
11. 1∶2
解析:已知②“脱水除铵”是复盐沉淀xNH4Cl·yScF3·zH2O的热分解过程,结合图中曲线及数据,200~300 ℃固体质量损失2.16 g是其中的水分,物质的量为0.12 mol,380~400 ℃过程中会有白烟冒出,固体质量损失3.2 g是其中的NH4Cl,物质的量为0.06 mol,则x∶z=1∶2。
12. 7.9
解析:浸出液中c(Fe2+)=5.04 mg·L-1=5.04 g·m-3、c(Mn2+)=1.65 mg·L-1=1.65 g·m-3,1 m3上述浸出液中,Fe2+的物质的量为=0.09 mol,Mn2+的物质的量=0.03 mol,3Fe2++MnO+7H2O===3Fe(OH)3+MnO2↓+5H+、2MnO+3Mn2++2H2O===5MnO2↓+4H+,可知需要高锰酸钾的物质的量为0.09 mol×+0.03 mol×=0.05 mol,需要高锰酸钾的质量为0.05 mol×158 g·mol-1=7.9 g。
13. CoO 6CoO+O22Co3O4
解析:18.3 g CoC2O4·2H2O的物质的量为0.1 mol,当CoC2O4·2H2O失0.2 mol结晶水时,固体减少的质量为3.6 g,此时如果再失去了碳元素,0.2 mol碳,则固体共减少6 g,B点固体质量实际减少了10.8 g,则还有失去4.8 g的氧,恰好为0.3 mol,说明剩余固体为CoO,从C到D的过程中,根据Co元素守恒,如果转化为Co3O4,Co3O4的质量为×(59×3+4×16)×0.1=8.03 g,恰好与D点固体质量相同,所以D为Co3O4,CD段发生反应的化学方程式为:6CoO+O22Co3O4。
14. (1)0.44 L (2)N2H4·H2O+4[Ag(NH3)2]Cl===4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O
解析:(1)0.1 mol AgCl(s)完全溶解生成的[Ag(NH3)2]+和Cl-的物质的量均为0.1 mol,同时消耗0.2 mol NH3,设加入氨水的体积为V L,平衡时[Ag(NH3)2]+和Cl-的物质的量浓度均为 mol·L-1,NH3的物质的量浓度为 mol·L-1,K==2.5×10-3,则V=0.44。
(2)N2H4·H2O还原[Ag(NH3)2]Cl生成Ag、N2、NH3,根据得失电子守恒可知,N2H4·H2O与[Ag(NH3)2]Cl的化学计量数之比为1∶4,化学方程式为N2H4·H2O+4[Ag(NH3)2]Cl===4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O。
15. (1)8.5 mol
(2)过氧化氢不稳定容易分解
(3)Na++3Fe3++2SO+6H2O===NaFe3(SO4)2(OH)6↓+6H+
解析:(1)CuFeS2和H2O2、H2SO4混合液反应后转化为Cu2+、Fe3+、SO,反应中铜元素化合价由+1升为+2、硫元素由-2升为+6,、过氧化氢中氧元素化合价由-1降为-2,根据电荷守恒可知,2CuFeS2+17H2O2+2H+===2Cu2++2Fe3++4SO+18H2O,故将1 mol CuFeS2完全转化,理论上所需H2O2的物质的量为8.5 mol。
(2)浸出过程中发现,H2O2的反应实际用量远大于理论用量,原因是过氧化氢不稳定容易分解,导致其用量增加;
(3)浸出过程中,溶液中含有少量Na2SO4,Na2SO4、铁离子、水会生成并析出黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀,Fe3+转化为黄钠铁矾沉淀的离子方程式:Na++3Fe3++2SO+6H2O===NaFe3(SO4)2(OH)6↓+6H+。
16. 3∶4(过程见解析)
解析:PbO2受热分解固体混合物,再与HCl反应,+4价Pb还原为+2价,Cl-氧化为Cl2,为PbCl2溶液,1 mol PbO2转化为PbCl2,电子转移:1 mol×(4-2)=2 mol,设产生O2 x mol,则Cl2 x mol,根据电子守恒:4x+2x=2 mol,x=,所以1 mol PbO2分解产生O2: mol,则固体混合物中n(O)=2 mol- mol×2= mol,而n(Pb)不变,为1 mol,n(Pb)∶n(O)=1∶=3∶4。
17. 0.41(过程见解析)
解析:25.00 mL溶液中n(SO)=n(BaSO4)==0.01 mol,根据滴定过程可知,2.50 mL碱式硫酸铝溶液中Al3+的物质的量为n(Al3+)=n(EDTA)-n(Cu2+)=0.1 mol·L-1×25×10-3 L-0.08 mol·L-1×20×10-3 L=9×10-4 mol,25.00 mL碱式硫酸铝溶液中n(Al3+)=9×10-3 mol,根据元素守恒有=eq \f(n(SO),n(Al3+))==,解得x=0.41。
同课章节目录
