苏教版高二化学选修三《物质性质与结构》专题三《晶体结构》教学课件 (共31张PPT)
文档属性
| 名称 | 苏教版高二化学选修三《物质性质与结构》专题三《晶体结构》教学课件 (共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 72.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-03 15:04:33 | ||
图片预览






文档简介
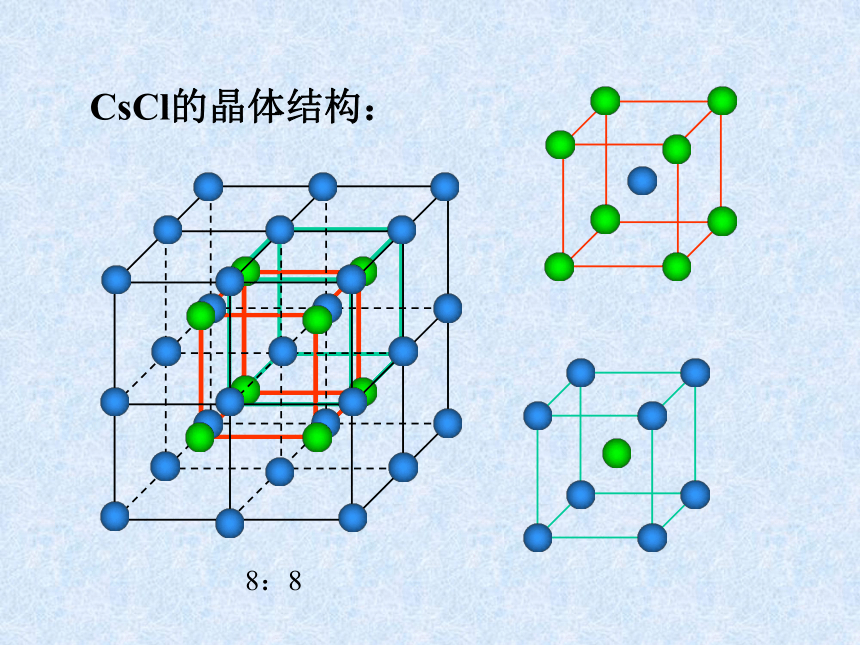
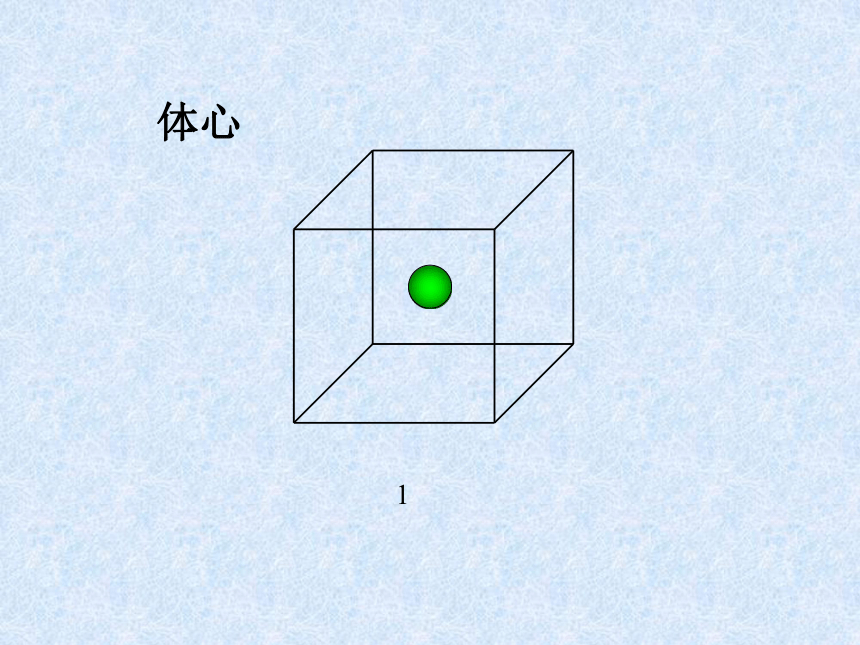
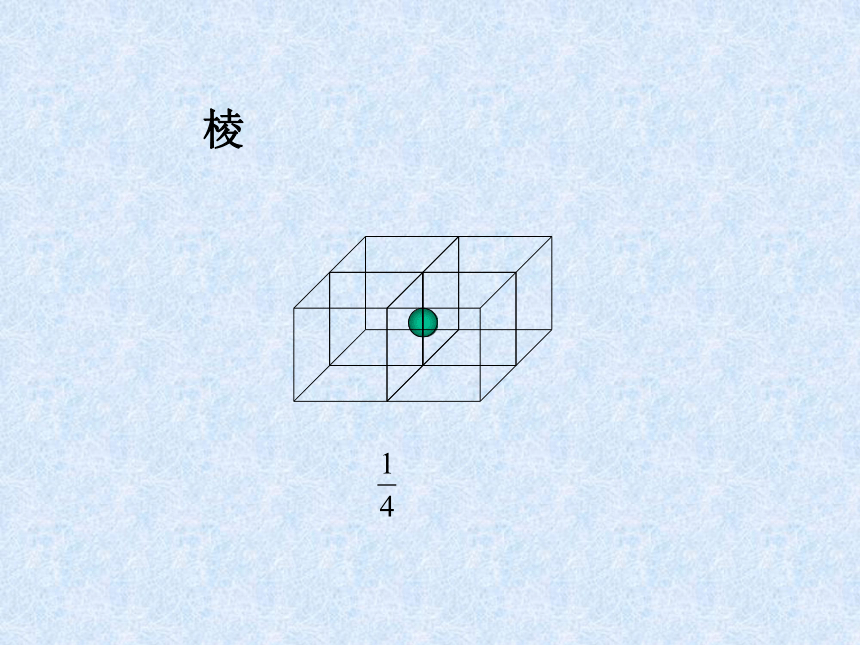
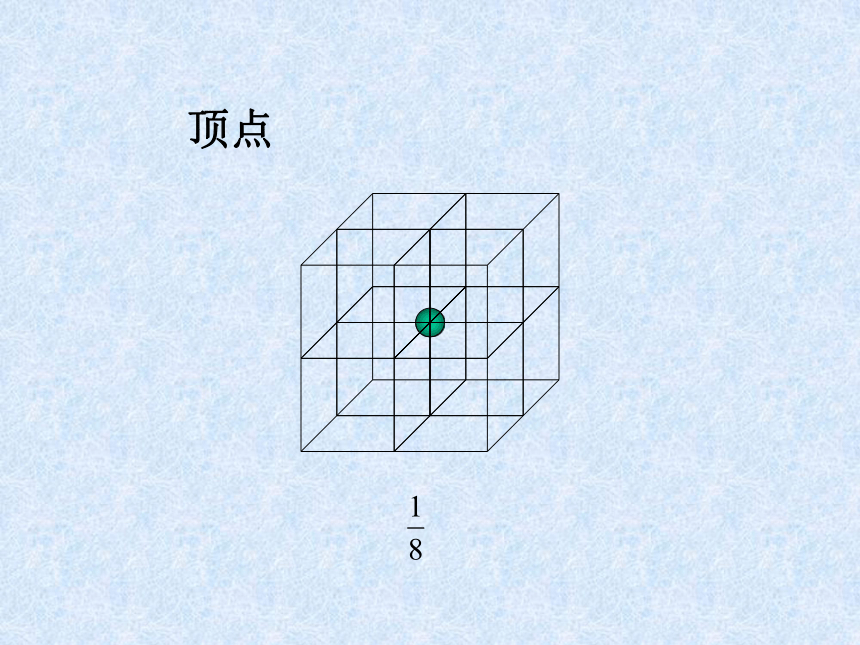
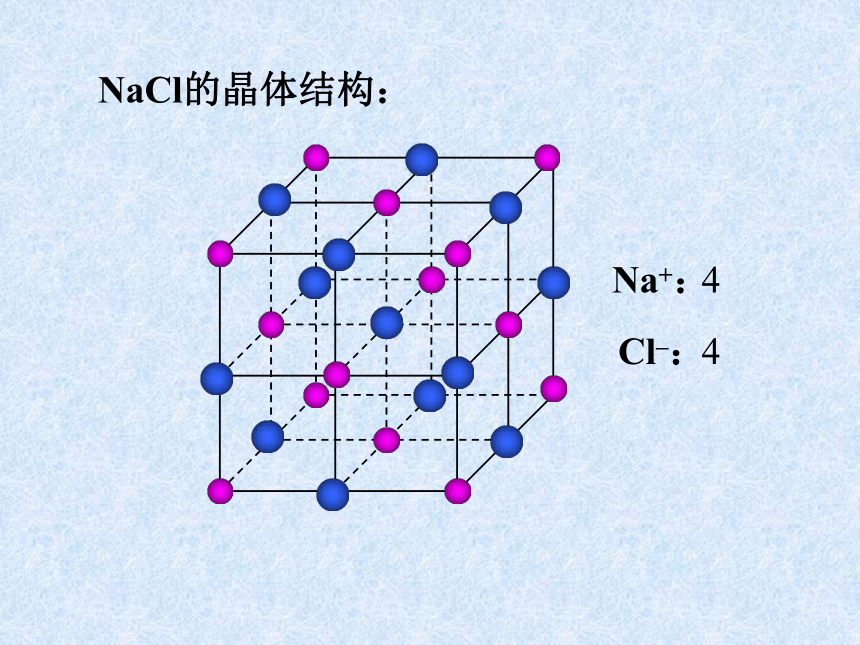
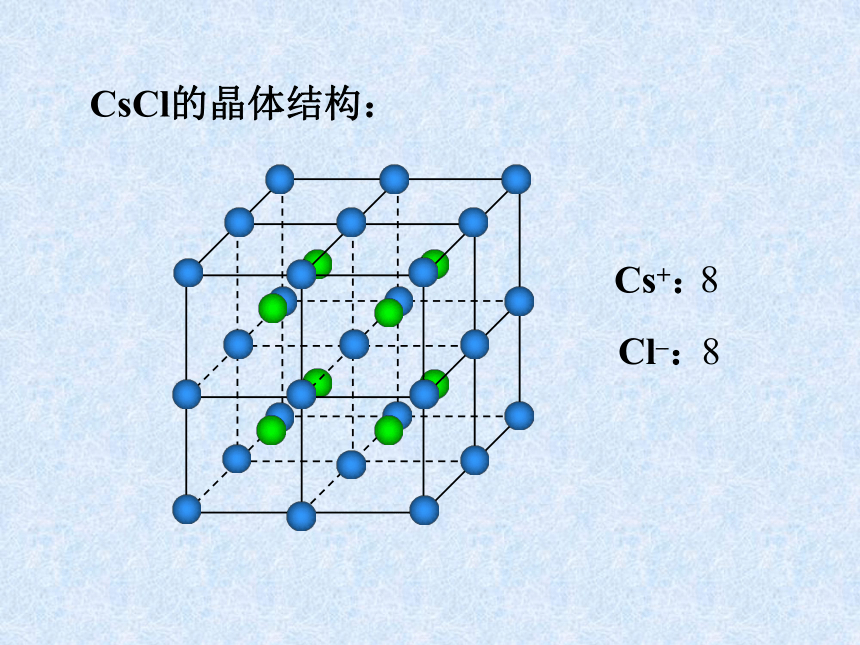
课件31张PPT。离子晶体、分子晶体和原子晶体 离子晶体、分子晶体和原子晶体食盐晶体雪花金刚石一、离子晶体1、定义:离子间通过离子键结合而形成的晶体叫做离子晶体。以离子键结合的化合物就是离子化合物。如:NaCl CsCl MgF2 Na2O Na2O2 BaSO4等离子化合物中只含有离子键吗?2、晶体举例:NaCl的晶体结构:6:6CsCl的晶体结构:8:8体心1面心棱顶点NaCl的晶体结构:Na+:Cl–:44小结:晶胞中实际质点数每个晶胞中,各“质点”对晶胞的贡献分别是:
面心点为1/2,体心点为1 、棱上的点为1/4、角上的点为1/8 。
由NaCl晶体结构图可推知晶体结构中Cl-=(12/4+1)=4个;Na+=(8/8+6/2)=4个,即每个这样的结构单元中相当于有4个NaCl。 CsCl的晶体结构:Cs+:Cl–:883、离子晶体的物理特性:硬度较高,密度较大,难于压缩,脆,
难于挥发,有较高的熔沸点破坏化学键,消耗能量。离子半径越小,所带电荷越多,离子键越强,熔沸点越高。二、分子晶体1、分子间作用力?、定义:分子间存在的作用力,又叫范德华力。分子间力要比化学键弱得多,
通常每摩约几个至数十个千焦。?、影响分子间作用力的因素:分子的极性;分子量;分子的形状。?、分子间作用力的大小对物质的熔沸点的影响:对组成、结构相似的物质来说,分子间作用力
越大,熔沸点越高。2、分子晶体?、定义:分子间以分子间作用力互相结合的晶体
叫做分子晶体。如:卤素,稀有气体,氧气,CO,CO2,NH3,
卤化氢等都形成分子晶体。?、分子晶体的物理特性:较低的熔沸点,较小的硬度。范德华力共价键干冰的晶体结构示意图比较H2O,H2S,H2Se,H2Te熔沸点的高低 沸点
H2O :100?C
H2S :–61?C
H2Se:–41?C
H2Te:–2?C氢键氢键的形成氢键共价键三、原子晶体1、定义:相邻原子间以共价键相结合而形成空间
网状结构的晶体,叫原子晶体。2、原子晶体举例:金刚石,SiO2,SiC,晶体硅。109o28′金刚石的晶体结构示意图共价键180o109o28′Sio二氧化硅的晶体结构示意图共价键原子晶体的物理特性: 熔沸点高,硬度大,不导电。
共价键强弱比较:
共价键键长越短,键能越大,键越强。
离子晶体、原子晶体、分子晶体空间结构的比较 实例 硬度 熔沸点
微粒间作
用 组成微粒分子晶体原子晶体 离子 晶体阴、阳离子
原子
分子
离子键
共价键分子间作
用力(氢键)较高
高
较低
较大
大
较小
干冰
金刚石NaCl
几种晶体的组成、作用力及物理性质不同晶体类型熔沸点高低的判断:离子晶体:离子半径越小,所带电荷越多,离子键越强,
熔沸点越高。NaCl与MgCl2NaClSiC > Si分子晶体:结构相似的分子,分子量越大,分子间作用力
越大,熔沸点越高。F2,Cl2,Br2,I2F2 < Cl2 < Br2 < I2练习:比较晶体熔沸点的高低1、金刚石、氯化钠、干冰
2、金刚石、晶体硅、碳化硅
3、CH4、C2H6、C3H8
4、正戊烷、异戊烷、新戊烷
5、NaCl、CsCl三、金刚石过程最小的碳环有几个碳原子?石墨图石墨图石墨晶体中每一层为
正六边形的平面网状
结构,则每个正六边形
占有多少个碳原子?多
少个C-C键?石墨碳环结构二氧化碳
面心点为1/2,体心点为1 、棱上的点为1/4、角上的点为1/8 。
由NaCl晶体结构图可推知晶体结构中Cl-=(12/4+1)=4个;Na+=(8/8+6/2)=4个,即每个这样的结构单元中相当于有4个NaCl。 CsCl的晶体结构:Cs+:Cl–:883、离子晶体的物理特性:硬度较高,密度较大,难于压缩,脆,
难于挥发,有较高的熔沸点破坏化学键,消耗能量。离子半径越小,所带电荷越多,离子键越强,熔沸点越高。二、分子晶体1、分子间作用力?、定义:分子间存在的作用力,又叫范德华力。分子间力要比化学键弱得多,
通常每摩约几个至数十个千焦。?、影响分子间作用力的因素:分子的极性;分子量;分子的形状。?、分子间作用力的大小对物质的熔沸点的影响:对组成、结构相似的物质来说,分子间作用力
越大,熔沸点越高。2、分子晶体?、定义:分子间以分子间作用力互相结合的晶体
叫做分子晶体。如:卤素,稀有气体,氧气,CO,CO2,NH3,
卤化氢等都形成分子晶体。?、分子晶体的物理特性:较低的熔沸点,较小的硬度。范德华力共价键干冰的晶体结构示意图比较H2O,H2S,H2Se,H2Te熔沸点的高低 沸点
H2O :100?C
H2S :–61?C
H2Se:–41?C
H2Te:–2?C氢键氢键的形成氢键共价键三、原子晶体1、定义:相邻原子间以共价键相结合而形成空间
网状结构的晶体,叫原子晶体。2、原子晶体举例:金刚石,SiO2,SiC,晶体硅。109o28′金刚石的晶体结构示意图共价键180o109o28′Sio二氧化硅的晶体结构示意图共价键原子晶体的物理特性: 熔沸点高,硬度大,不导电。
共价键强弱比较:
共价键键长越短,键能越大,键越强。
离子晶体、原子晶体、分子晶体空间结构的比较 实例 硬度 熔沸点
微粒间作
用 组成微粒分子晶体原子晶体 离子 晶体阴、阳离子
原子
分子
离子键
共价键分子间作
用力(氢键)较高
高
较低
较大
大
较小
干冰
金刚石NaCl
几种晶体的组成、作用力及物理性质不同晶体类型熔沸点高低的判断:离子晶体:离子半径越小,所带电荷越多,离子键越强,
熔沸点越高。NaCl与MgCl2NaCl
越大,熔沸点越高。F2,Cl2,Br2,I2F2 < Cl2 < Br2 < I2练习:比较晶体熔沸点的高低1、金刚石、氯化钠、干冰
2、金刚石、晶体硅、碳化硅
3、CH4、C2H6、C3H8
4、正戊烷、异戊烷、新戊烷
5、NaCl、CsCl三、金刚石过程最小的碳环有几个碳原子?石墨图石墨图石墨晶体中每一层为
正六边形的平面网状
结构,则每个正六边形
占有多少个碳原子?多
少个C-C键?石墨碳环结构二氧化碳
