1.3.1烷烃及其性质(教学课件)(共33张PPT)_高中化学鲁科版(2019)选择性必修三_
文档属性
| 名称 | 1.3.1烷烃及其性质(教学课件)(共33张PPT)_高中化学鲁科版(2019)选择性必修三_ |  | |
| 格式 | pptx | ||
| 文件大小 | 789.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 00:29:31 | ||
图片预览









文档简介
(共33张PPT)
有机化合物的结构与性质 烃
第一章
1.3烃
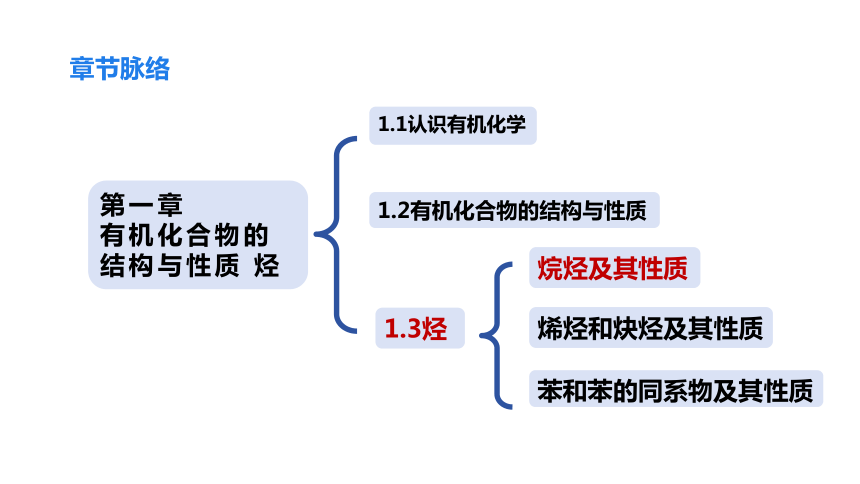
章节脉络
第一章
有机化合物的结构与性质 烃
1.2有机化合物的结构与性质
1.1认识有机化学
烯烃和炔烃及其性质
苯和苯的同系物及其性质
烷烃及其性质
1.3烃
烷烃及其性质
1. 宏观辨识与微观探析
通过观察甲烷、乙烷等气态烷烃与液态烷烃的状态差异,理解碳链长度对熔沸点的影响规律。认识烷烃与结合分子组成、反应与产物之间的宏观关联。
2. 证据推理与模型认知
运用结构决定性质的理念,预测不同碳链长度烷烃的化学稳定性,并通过实验验证。
3. 科学态度与社会责任
了解有机化学在社会发展中的应用,认识其推动科技进步与改善生活的重要价值,树立正确的科学价值观和社会责任感。
核心素养目标
重点:
1. 理解烷烃的稳定性,掌握燃烧反应的通式及产物。
2.掌握甲烷与卤素的取代反应条件、产物特征及反应分步进行的特点。
难点:
1. 理解自由基取代反应的链引发、链增长、链终止三个阶段,并能结合反应条件解释实验现象。
2.处理含多支链或较长碳链的烷烃时,避免重复或遗漏,掌握对称性分析方法。
学习重难点
课前导入
烃是一类重要的化工原料,生活中许多物品如塑料水杯、汽车轮胎等都是以各种各样的烃为主要原料制得的。那么,烃为什么会有如此重要的作用呢?这些重要的作用与它们的哪些性质有关呢?
塑料水杯
汽车轮胎
烷烃的结构
PART 01
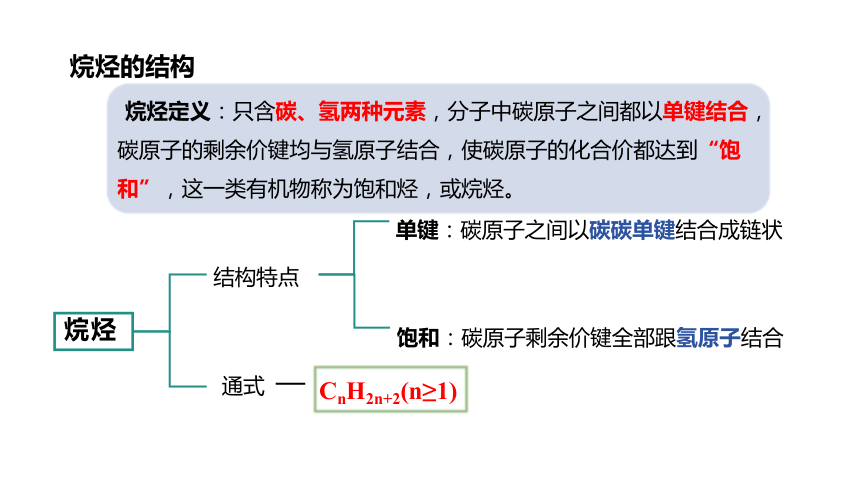
烷烃的结构
CnH2n+2(n≥1)
烷烃
结构特点
通式
单键:碳原子之间以碳碳单键结合成链状
饱和:碳原子剩余价键全部跟氢原子结合
烷烃定义:只含碳、氢两种元素,分子中碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”,这一类有机物称为饱和烃,或烷烃。
烷烃的性质
PART 02
烷烃的性质
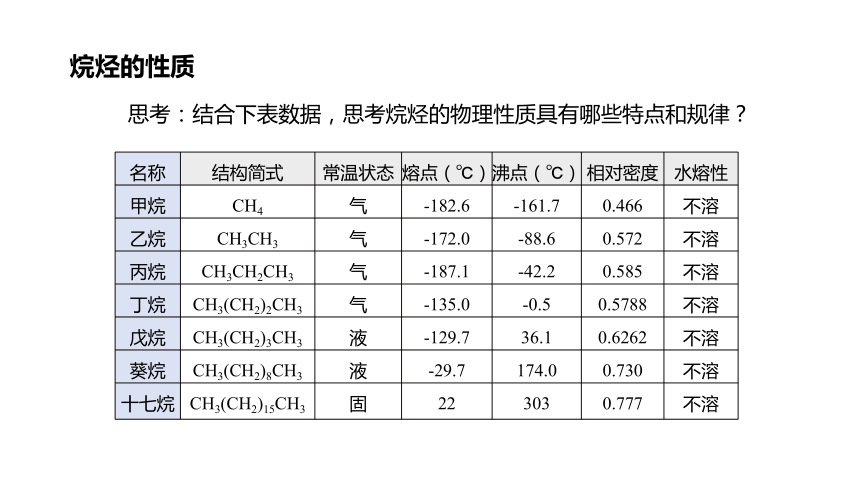
名称 结构简式 常温状态 熔点(℃) 沸点(℃) 相对密度 水熔性
甲烷 CH4 气 -182.6 -161.7 0.466 不溶
乙烷 CH3CH3 气 -172.0 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -187.1 -42.2 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -135.0 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -129.7 36.1 0.6262 不溶
葵烷 CH3(CH2)8CH3 液 -29.7 174.0 0.730 不溶
十七烷 CH3(CH2)15CH3 固 22 303 0.777 不溶
思考:结合下表数据,思考烷烃的物理性质具有哪些特点和规律?
烷烃的性质
①均难溶于水,易溶于有机溶剂。
②随着碳原子数的增多,熔、沸点逐渐增高;密度逐渐增大(比水小)。
③状态:气态(n≤4) → 液态 → 固态(n≥17)
④对于同种烃,若碳原子数相同时,支链越多,熔沸点越低
烷烃的物理性质
最简单的烷烃:甲烷
甲烷的物理性质:
无色无味的气体,难溶于水,密度小于空气(0.717g L-1)
烷烃的性质
烷烃的物理性质
(1)分子中全是碳碳单键的烃一定是烷烃。 ( )
(2)C2H6、C3H8、C4H10的熔沸点依次升高。 ( )
×
√
环烷烃中碳原子也全是碳碳单键。
烷烃随着碳原子数的增多熔沸点升高。
烷烃的化学性质
1.稳定性
因为烷烃分子中碳氢键和碳碳单键的键能较高,所以常温下烷烃很不活泼,与强酸、强碱、强氧化剂和还原剂都不反应。
2.与卤素单质的反应
在光照条件下,烷烃与Cl2、Br2等卤素单质的气体发生取代反应。
(1)乙烷在光照下与氯气发生取代反应生成一氯代物的化学方程式为
____________________________ 。
CH3CH3+Cl2 CH3CH2Cl+HCl
光
烷烃的性质
烷烃的性质
反应条件 光照
反应物 烷烃和气态卤素单质(烷烃与卤素单质的水溶液不反应)
化学键变化 断键:C—H键和X—X键
成键:C—X键和H—X键
取代特点 分子中的氢原子被卤素原子逐步取代,往往是各步反应同时发生
产物 特点 种类 多种卤代烷烃的混合物,HX的物质的量最多
产物 的量 ①根据碳元素守恒,烷烃的物质的量等于所有卤代烷烃的物质的量之和
②根据取代反应的特点,有机物中卤素的物质的量等于HX的物质的量等于反应了的X2的物质的量,即反应了的n(X2)=n(一卤代物)+2n(二卤代物)+3n(三卤代物)+……=n(HX)
烷烃的取代反应
烷烃的性质
关于取代反应和置换反应的判断的简单方法
(1)看参与反应的物质类别
点拨
若物质类别是无机物,一定是置换反应,若物质类别均是有机物,则一定不是置换反应。
(2)看产物中是否有单质生成
若产物中有单质生成,一定不是取代反应。
(2)分子中碳链较长的烷烃与氯气反应时,不同碳氢键断裂可以得到不同的取代产物,如丙烷与氯气在光照条件下发生取代反应的产物是 (1-氯丙烷)、 (2-氯丙烷)。
丁烷如果和氯气发生取代反应生成一氯代物,会有多少种
四种。CH2(Cl)CH2CH2CH3,CH3CH(Cl)CH2CH3,C(Cl)(CH3)3,CH(CH3)2CH2Cl
烷烃的性质
自由基反应
链引发:
链增长:
…
链终止:
烷烃的性质
当生成的氯甲烷与氯自由基反应时,可进一步生成二氯甲烷、三氯甲烷和四氯化碳。
自由基反应
一氯甲烷(气体)
二氯甲烷(液体)
CH4+Cl2 CH3Cl+HCl
光
CH3Cl+Cl2 CH2Cl2+HCl
光
烷烃的性质
三氯甲烷、氯仿(液体)
四氯甲烷、四氯化碳(液体)
CH2Cl2+Cl2 CHCl3+HCl
光
CHCl3+Cl2 CCl4+HCl
光
烷烃的性质
3.与氧气的反应
烷烃的燃烧通式为
____________________________ ____。
CnH2n+2+ O2 nCO2+(n+1)H2O
点燃
烷烃的燃烧是十分重要的反应,烷烃燃烧时能放出大量的热,这使烷烃成为重要的能源之一。
烷烃的性质
烃的燃烧规律
CxHy +(x+ ) O2 xCO2 + H2O
y
2
y
4
点燃
(1)烃的燃烧通式:
(2)烃燃烧的三个规律
①等质量的烃完全燃烧
烷烃的性质
②等物质的量的烃完全燃烧
烷烃的性质
a.烃分子中 的数值越大,则耗氧量越大。
b.烃分子中x的数值越大,完全燃烧生成的CO2越多。
c.烃分子中y的数值越大,完全燃烧生成的H2O的物质的量越多。
③最简式相同的烃燃烧
a.最简式相同的烃,C、H的质量分数相同。
b.等质量的最简式相同的烃完全燃烧时,耗氧量相同、产生的CO2、H2O的质量、物质的量均相同。
烷烃的性质
(3)燃烧规律的应用
①若反应前后温度保持在100 ℃以上,则烃完全燃烧前后的体积变化为
CxHy +(x+ ) O2 xCO2 + H2O
y
2
y
4
点燃
1
x+ x
-1
ΔV
故反应前后气体体积的变化ΔV仅与氢原子数y有关。
烷烃的性质
(2)若反应前后温度低于100 ℃,此时气体体积一定是减少的,减少的气体体积为ΔV=1+ ,也与氢原子数有关。
y
4
①水的状态是液态还是气态,从条件上看温度是在100℃以下还是以上。
②气态烃完全燃烧前后,体积变化值也只与烃中的氢原子个数有关,根据体积差值可以求出氢原子的个数或氢原子的平均个数。
③要注意检验氧气是否足量。
利用烃类燃烧的通式进行计算时注意:
烷烃的性质
思考讨论
等物质的量的甲烷、乙烷、丙烷完全燃烧消耗氧气的物质的量之比为多少
由烃类燃烧的通式 可知,等物质的量的烃完全燃烧时耗氧量的大小取决于x+
的数值大小,从而可得其比值为 4:7:10。
CxHy +(x+ ) O2 xCO2 + H2O
y
2
y
4
点燃
y
4
课堂小结
与氧气的反应
烷烃的性质
稳定性
烷烃的结构
烷烃的化学性质
烷烃的物理性质
与卤素单质的反应
烃的燃烧规律
随堂训练
1.下列关于烷烃的叙述中正确的是( )。
A.燃烧产物只有二氧化碳和水
B.烷烃分子中碳原子不可能在同一平面上
C.在烷烃分子中,所有的化学键都为单键
D.任何烷烃分子中碳、氢原子个数之比都是相同的
C
随堂训练
2.下列关于烷烃性质的叙述中,不正确的是( )。
A.烷烃同系物的熔、沸点随分子内碳原子数的增加而逐渐升高,常温下的状态由气态到液态,再到固态
B.烷烃同系物的密度随分子内碳原子数的增多而逐渐增大,从比水轻到比水重
C.烷烃与卤素单质在光照下能发生取代反应
D.烷烃同系物都不能使溴水、酸性KMnO4溶液因反应而褪色
B
随堂训练
3.物质的量相同的下列烃,完全燃烧,耗氧量最多的是( )
A.C2H6 B.C4H6
C.C5H10 D.C7H8
D
随堂训练
4.已知液化气的主要成分是丙烷,下列有关丙烷的叙述
不正确的是( )
A.是直链烃,但分子中碳原子不在一条直线上
B.在光照条件下能够与氯气发生取代反应
C.丙烷的球棍模型图为
D.1 mol丙烷完全燃烧消耗5 mol O2
C
随堂训练
5.下列说法正确的是( )
A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B.分子组成符合CnH2n+2的烃一定是烷烃
C.正戊烷分子中所有的碳原子均在同一条直线上
D.碳、氢原子个数比为1∶3的烷烃有两种
B
随堂训练
6.从石油分馏得到的固体石蜡(主要成分为烷烃),用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过( )
A.加成反应 B.取代反应
C.聚合反应 D.催化裂化反应
B
谢谢观看
有机化合物的结构与性质 烃
第一章
1.3烃
章节脉络
第一章
有机化合物的结构与性质 烃
1.2有机化合物的结构与性质
1.1认识有机化学
烯烃和炔烃及其性质
苯和苯的同系物及其性质
烷烃及其性质
1.3烃
烷烃及其性质
1. 宏观辨识与微观探析
通过观察甲烷、乙烷等气态烷烃与液态烷烃的状态差异,理解碳链长度对熔沸点的影响规律。认识烷烃与结合分子组成、反应与产物之间的宏观关联。
2. 证据推理与模型认知
运用结构决定性质的理念,预测不同碳链长度烷烃的化学稳定性,并通过实验验证。
3. 科学态度与社会责任
了解有机化学在社会发展中的应用,认识其推动科技进步与改善生活的重要价值,树立正确的科学价值观和社会责任感。
核心素养目标
重点:
1. 理解烷烃的稳定性,掌握燃烧反应的通式及产物。
2.掌握甲烷与卤素的取代反应条件、产物特征及反应分步进行的特点。
难点:
1. 理解自由基取代反应的链引发、链增长、链终止三个阶段,并能结合反应条件解释实验现象。
2.处理含多支链或较长碳链的烷烃时,避免重复或遗漏,掌握对称性分析方法。
学习重难点
课前导入
烃是一类重要的化工原料,生活中许多物品如塑料水杯、汽车轮胎等都是以各种各样的烃为主要原料制得的。那么,烃为什么会有如此重要的作用呢?这些重要的作用与它们的哪些性质有关呢?
塑料水杯
汽车轮胎
烷烃的结构
PART 01
烷烃的结构
CnH2n+2(n≥1)
烷烃
结构特点
通式
单键:碳原子之间以碳碳单键结合成链状
饱和:碳原子剩余价键全部跟氢原子结合
烷烃定义:只含碳、氢两种元素,分子中碳原子之间都以单键结合,碳原子的剩余价键均与氢原子结合,使碳原子的化合价都达到“饱和”,这一类有机物称为饱和烃,或烷烃。
烷烃的性质
PART 02
烷烃的性质
名称 结构简式 常温状态 熔点(℃) 沸点(℃) 相对密度 水熔性
甲烷 CH4 气 -182.6 -161.7 0.466 不溶
乙烷 CH3CH3 气 -172.0 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -187.1 -42.2 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -135.0 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -129.7 36.1 0.6262 不溶
葵烷 CH3(CH2)8CH3 液 -29.7 174.0 0.730 不溶
十七烷 CH3(CH2)15CH3 固 22 303 0.777 不溶
思考:结合下表数据,思考烷烃的物理性质具有哪些特点和规律?
烷烃的性质
①均难溶于水,易溶于有机溶剂。
②随着碳原子数的增多,熔、沸点逐渐增高;密度逐渐增大(比水小)。
③状态:气态(n≤4) → 液态 → 固态(n≥17)
④对于同种烃,若碳原子数相同时,支链越多,熔沸点越低
烷烃的物理性质
最简单的烷烃:甲烷
甲烷的物理性质:
无色无味的气体,难溶于水,密度小于空气(0.717g L-1)
烷烃的性质
烷烃的物理性质
(1)分子中全是碳碳单键的烃一定是烷烃。 ( )
(2)C2H6、C3H8、C4H10的熔沸点依次升高。 ( )
×
√
环烷烃中碳原子也全是碳碳单键。
烷烃随着碳原子数的增多熔沸点升高。
烷烃的化学性质
1.稳定性
因为烷烃分子中碳氢键和碳碳单键的键能较高,所以常温下烷烃很不活泼,与强酸、强碱、强氧化剂和还原剂都不反应。
2.与卤素单质的反应
在光照条件下,烷烃与Cl2、Br2等卤素单质的气体发生取代反应。
(1)乙烷在光照下与氯气发生取代反应生成一氯代物的化学方程式为
____________________________ 。
CH3CH3+Cl2 CH3CH2Cl+HCl
光
烷烃的性质
烷烃的性质
反应条件 光照
反应物 烷烃和气态卤素单质(烷烃与卤素单质的水溶液不反应)
化学键变化 断键:C—H键和X—X键
成键:C—X键和H—X键
取代特点 分子中的氢原子被卤素原子逐步取代,往往是各步反应同时发生
产物 特点 种类 多种卤代烷烃的混合物,HX的物质的量最多
产物 的量 ①根据碳元素守恒,烷烃的物质的量等于所有卤代烷烃的物质的量之和
②根据取代反应的特点,有机物中卤素的物质的量等于HX的物质的量等于反应了的X2的物质的量,即反应了的n(X2)=n(一卤代物)+2n(二卤代物)+3n(三卤代物)+……=n(HX)
烷烃的取代反应
烷烃的性质
关于取代反应和置换反应的判断的简单方法
(1)看参与反应的物质类别
点拨
若物质类别是无机物,一定是置换反应,若物质类别均是有机物,则一定不是置换反应。
(2)看产物中是否有单质生成
若产物中有单质生成,一定不是取代反应。
(2)分子中碳链较长的烷烃与氯气反应时,不同碳氢键断裂可以得到不同的取代产物,如丙烷与氯气在光照条件下发生取代反应的产物是 (1-氯丙烷)、 (2-氯丙烷)。
丁烷如果和氯气发生取代反应生成一氯代物,会有多少种
四种。CH2(Cl)CH2CH2CH3,CH3CH(Cl)CH2CH3,C(Cl)(CH3)3,CH(CH3)2CH2Cl
烷烃的性质
自由基反应
链引发:
链增长:
…
链终止:
烷烃的性质
当生成的氯甲烷与氯自由基反应时,可进一步生成二氯甲烷、三氯甲烷和四氯化碳。
自由基反应
一氯甲烷(气体)
二氯甲烷(液体)
CH4+Cl2 CH3Cl+HCl
光
CH3Cl+Cl2 CH2Cl2+HCl
光
烷烃的性质
三氯甲烷、氯仿(液体)
四氯甲烷、四氯化碳(液体)
CH2Cl2+Cl2 CHCl3+HCl
光
CHCl3+Cl2 CCl4+HCl
光
烷烃的性质
3.与氧气的反应
烷烃的燃烧通式为
____________________________ ____。
CnH2n+2+ O2 nCO2+(n+1)H2O
点燃
烷烃的燃烧是十分重要的反应,烷烃燃烧时能放出大量的热,这使烷烃成为重要的能源之一。
烷烃的性质
烃的燃烧规律
CxHy +(x+ ) O2 xCO2 + H2O
y
2
y
4
点燃
(1)烃的燃烧通式:
(2)烃燃烧的三个规律
①等质量的烃完全燃烧
烷烃的性质
②等物质的量的烃完全燃烧
烷烃的性质
a.烃分子中 的数值越大,则耗氧量越大。
b.烃分子中x的数值越大,完全燃烧生成的CO2越多。
c.烃分子中y的数值越大,完全燃烧生成的H2O的物质的量越多。
③最简式相同的烃燃烧
a.最简式相同的烃,C、H的质量分数相同。
b.等质量的最简式相同的烃完全燃烧时,耗氧量相同、产生的CO2、H2O的质量、物质的量均相同。
烷烃的性质
(3)燃烧规律的应用
①若反应前后温度保持在100 ℃以上,则烃完全燃烧前后的体积变化为
CxHy +(x+ ) O2 xCO2 + H2O
y
2
y
4
点燃
1
x+ x
-1
ΔV
故反应前后气体体积的变化ΔV仅与氢原子数y有关。
烷烃的性质
(2)若反应前后温度低于100 ℃,此时气体体积一定是减少的,减少的气体体积为ΔV=1+ ,也与氢原子数有关。
y
4
①水的状态是液态还是气态,从条件上看温度是在100℃以下还是以上。
②气态烃完全燃烧前后,体积变化值也只与烃中的氢原子个数有关,根据体积差值可以求出氢原子的个数或氢原子的平均个数。
③要注意检验氧气是否足量。
利用烃类燃烧的通式进行计算时注意:
烷烃的性质
思考讨论
等物质的量的甲烷、乙烷、丙烷完全燃烧消耗氧气的物质的量之比为多少
由烃类燃烧的通式 可知,等物质的量的烃完全燃烧时耗氧量的大小取决于x+
的数值大小,从而可得其比值为 4:7:10。
CxHy +(x+ ) O2 xCO2 + H2O
y
2
y
4
点燃
y
4
课堂小结
与氧气的反应
烷烃的性质
稳定性
烷烃的结构
烷烃的化学性质
烷烃的物理性质
与卤素单质的反应
烃的燃烧规律
随堂训练
1.下列关于烷烃的叙述中正确的是( )。
A.燃烧产物只有二氧化碳和水
B.烷烃分子中碳原子不可能在同一平面上
C.在烷烃分子中,所有的化学键都为单键
D.任何烷烃分子中碳、氢原子个数之比都是相同的
C
随堂训练
2.下列关于烷烃性质的叙述中,不正确的是( )。
A.烷烃同系物的熔、沸点随分子内碳原子数的增加而逐渐升高,常温下的状态由气态到液态,再到固态
B.烷烃同系物的密度随分子内碳原子数的增多而逐渐增大,从比水轻到比水重
C.烷烃与卤素单质在光照下能发生取代反应
D.烷烃同系物都不能使溴水、酸性KMnO4溶液因反应而褪色
B
随堂训练
3.物质的量相同的下列烃,完全燃烧,耗氧量最多的是( )
A.C2H6 B.C4H6
C.C5H10 D.C7H8
D
随堂训练
4.已知液化气的主要成分是丙烷,下列有关丙烷的叙述
不正确的是( )
A.是直链烃,但分子中碳原子不在一条直线上
B.在光照条件下能够与氯气发生取代反应
C.丙烷的球棍模型图为
D.1 mol丙烷完全燃烧消耗5 mol O2
C
随堂训练
5.下列说法正确的是( )
A.碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B.分子组成符合CnH2n+2的烃一定是烷烃
C.正戊烷分子中所有的碳原子均在同一条直线上
D.碳、氢原子个数比为1∶3的烷烃有两种
B
随堂训练
6.从石油分馏得到的固体石蜡(主要成分为烷烃),用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过( )
A.加成反应 B.取代反应
C.聚合反应 D.催化裂化反应
B
谢谢观看
