(15)2.4分子间作用力 (含解析)高二化学鲁科版(2019)选择性必修二同步课时作业
文档属性
| 名称 | (15)2.4分子间作用力 (含解析)高二化学鲁科版(2019)选择性必修二同步课时作业 |  | |
| 格式 | docx | ||
| 文件大小 | 717.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 01:18:12 | ||
图片预览


文档简介
(15)2.4分子间作用力——高二化学鲁科版(2019)选择性必修二同步课时作业
1.下列各分子既含有杂化的原子又能与形成氢键的是( )
A. B. C. D.
2.下列说法正确的是( )
A.氯化铵固体受热分解和干冰升华均只需克服分子间作用力
B.中所含化学键的类型相同
C.HCl气体溶于水和NaOH熔化破坏的化学键类型相同
D.的熔、沸点逐渐降低
3.下列说法正确的是( )
A.氢键是一种共价键
B.表面活性剂的疏水基团有较强的极性
C.σ键的电子云图形是轴对称的,π键的电子云图形是镜面对称的
D.可燃冰中甲烷分子和水分子间形成了氢键
4.碘晶体升华时,下列所述内容发生改变的是( )
A.分子内共价键 B.分子间的作用力
C.碘分子的大小 D.分子内共价键的键长
5.下列现象与氢键无关的是( )
A.乙醇可以和水以任意比互溶 B.冰的密度比液态水的密度小
C.水分子在较高温度下也很稳定 D.的沸点比的沸点高
6.下列关于物质结构与性质的说法中正确的是( )
A.同温同压下在水中的溶解度大于
B.和的中心原子均采用杂化
C.氢键()中三原子共线时作用力最强
D.的VSEPR模型与其空间结构均为三角锥形
7.五种短周期主族元素的原子半径依次增大,其中基态X原子未成对电子数目最多,Y和W同主族,基态Q原子填充3个能级,有1个未成对电子,基态Z原子电子填充了3个原子轨道,Z周期表中的位置与Y相邻。下列说法正确的是( )
A.X与W形成的化合物属于分子晶体
B.Q的氢化物的水溶液存在3种氢键
C.化合物含有配位键
D.X的氢化物沸点一定高于Y的氢化物沸点
8.为短周期主族元素,原子序数依次增大。W的某种原子核内无中子,为同周期相邻元素,Z2是氧化性最强的单质,W的核外电子数与R的价层电子数相等,下列有关说法正确的是( )
A.第一电离能:
B.不稳定易分解的主要原因是分子间氢键较弱
C.Y和R反应生成的化合物中只含有离子键
D.和均为极性分子
9.下列说法正确的是( )
A.分子形状呈平面三角形,是极性分子
B.冰中存在共价键和氢键两种化学键
C.基态原子的核外电子全部填充在6个轨道中的元素有3种
D.的沸点比CO低主要是由于两者范德华力不同
10.下列化学用语表达正确的是( )
A.用电子云轮廓图表示键的形成示意图:
B.的空间结构模型:
C.邻羟基苯甲醛分子内氢键:
D.基态原子的价层电子轨道表示式:
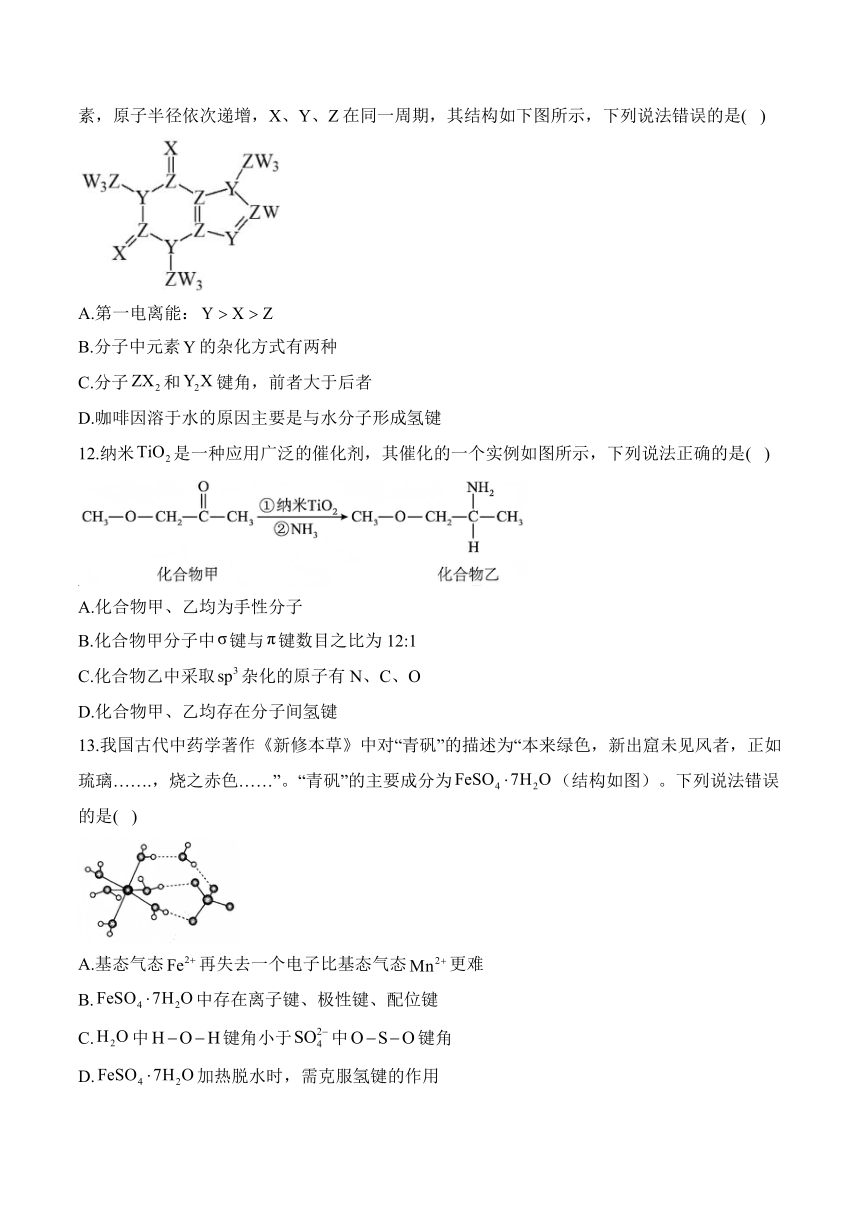
11.茶叶中含有少量的咖啡因,它是一种简单有机物,其组成元素W、X、Y、Z为短周期元素,原子半径依次递增,X、Y、Z在同一周期,其结构如下图所示,下列说法错误的是( )
A.第一电离能:
B.分子中元素的杂化方式有两种
C.分子和键角,前者大于后者
D.咖啡因溶于水的原因主要是与水分子形成氢键
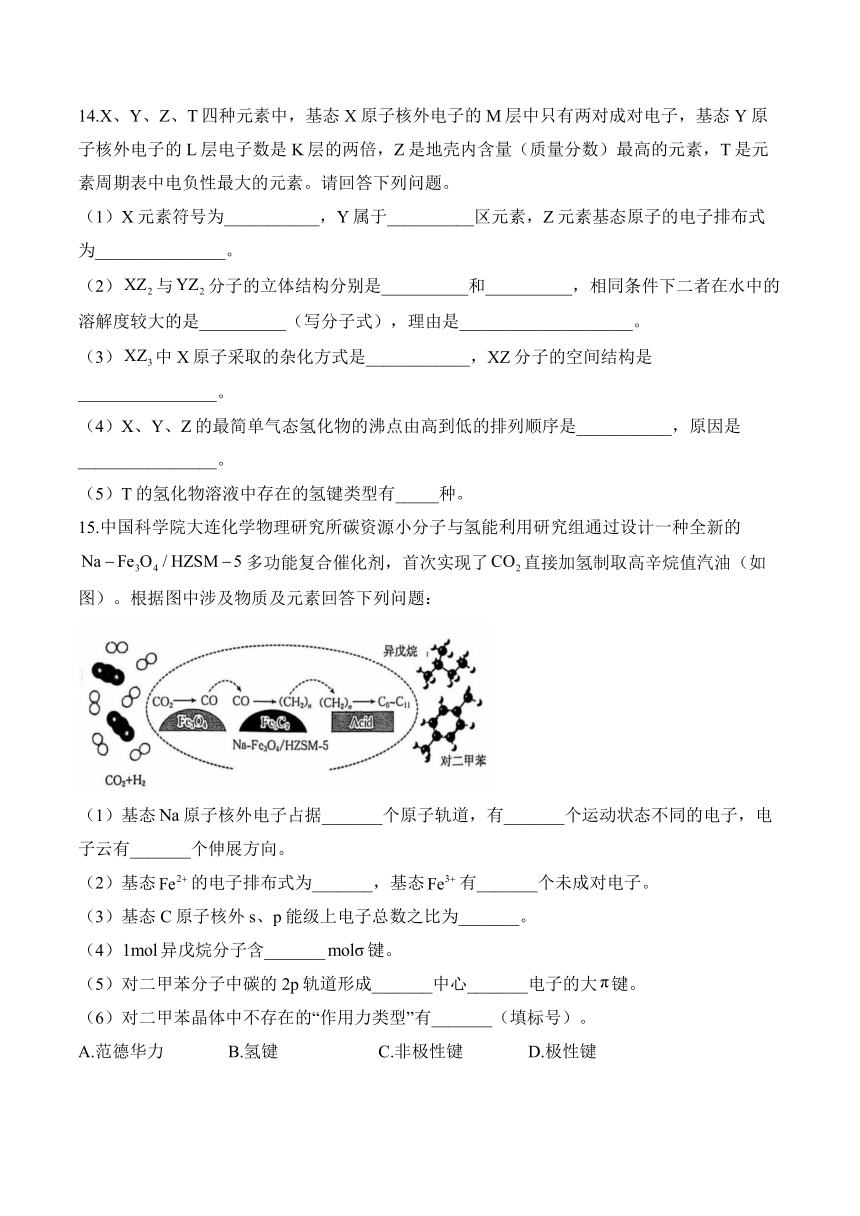
12.纳米是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )
A.化合物甲、乙均为手性分子
B.化合物甲分子中键与键数目之比为12:1
C.化合物乙中采取杂化的原子有N、C、O
D.化合物甲、乙均存在分子间氢键
13.我国古代中药学著作《新修本草》中对“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃…….,烧之赤色……”。“青矾”的主要成分为(结构如图)。下列说法错误的是( )
A.基态气态再失去一个电子比基态气态更难
B.中存在离子键、极性键、配位键
C.中键角小于中键角
D.加热脱水时,需克服氢键的作用
14.X、Y、Z、T四种元素中,基态X原子核外电子的M层中只有两对成对电子,基态Y原子核外电子的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,T是元素周期表中电负性最大的元素。请回答下列问题。
(1)X元素符号为___________,Y属于__________区元素,Z元素基态原子的电子排布式为_______________。
(2)与分子的立体结构分别是__________和__________,相同条件下二者在水中的溶解度较大的是__________(写分子式),理由是____________________。
(3)中X原子采取的杂化方式是____________,XZ分子的空间结构是________________。
(4)X、Y、Z的最简单气态氢化物的沸点由高到低的排列顺序是___________,原因是________________。
(5)T的氢化物溶液中存在的氢键类型有_____种。
15.中国科学院大连化学物理研究所碳资源小分子与氢能利用研究组通过设计一种全新的多功能复合催化剂,首次实现了直接加氢制取高辛烷值汽油(如图)。根据图中涉及物质及元素回答下列问题:
(1)基态原子核外电子占据_______个原子轨道,有_______个运动状态不同的电子,电子云有_______个伸展方向。
(2)基态的电子排布式为_______,基态有_______个未成对电子。
(3)基态C原子核外s、p能级上电子总数之比为_______。
(4)异戊烷分子含_______键。
(5)对二甲苯分子中碳的2p轨道形成_______中心_______电子的大键。
(6)对二甲苯晶体中不存在的“作用力类型”有_______(填标号)。
A.范德华力 B.氢键 C.非极性键 D.极性键
答案以及解析
1.答案:C
解析:A.中两个碳原子价层电子对数为4都采用杂化,且和不能形成分子间氢键,故A错误;
B.中两个碳原子价层电子对数为3采用杂化,但不能和形成分子间氢键,故B错误;
C.的—COOH中碳原子价层电子对数为3采用杂化,且能和形成分子间氢键,故C正确;
D.中C、N原子价层电子对数为4都采用杂化,故D错误;
故选:C。
2.答案:D
解析:A.氯化铵受热时氯化铵分解生成氨气和氯化氢,属于化学变化,化学键破坏,干冰升华是物理变化,只需克服分子间作用力,A错误;
B.NaF中含有离子键,中含有共价键,所含化学键类型不相同,B错误;
C.HCl气体溶于水共价键断键,NaOH熔化破坏的是离子键,化学键类型不相同,C错误;
D.形成的均是分子晶体,相对分子质量依次减小,分子间作用力逐渐减小,则熔沸点逐渐降低,D正确。
答案选D。
3.答案:C
解析:A.氢键是一种特殊的分子间作用力,不属于共价键,A错误;
B.表面活性剂的疏水基团极性较低,亲水基极性较高,B错误;
C.σ键的电子云图形是轴对称的,π键的电子云图形是镜面对称的,C正确;
D.可燃冰()中甲烷分子和水分子间形成了范德华力,D错误。
故选C。
4.答案:B
解析:干冰是固态的二氧化碳,属于分子晶体,分子间存在分子间作用力,不存在氢键,分子汽化时破坏分子间作用力,而分子内原子间共价键没有被破坏,所以分子的性质不发生改变,故B正确。
5.答案:C
解析:A.因乙醇、水分子之间能形成氢键,所以乙醇可以和水以任意比互溶,A项不符合题意;
B.冰中存在氢键,使其与相同质量的水相比,体积变大,则冰的密度比液态水的密度小,B项不符合题意;
C.水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,C项符合题意;
D.HF易形成分子间氢键,而HCl不能形成氢键,HF的沸点比HCl高,D项不符合题意;
故选C。
6.答案:C
解析:A.分子中O价层电子对数为,采取杂化,有一对孤电子对,分子呈V性,该分子为极性分子。根据相似相溶原理可知,同温同压下在水中的溶解度比大,A错误;
B.分子中B价层电子对数为,B采取杂化。分子中P价层电子对数为,P采用杂化,B错误;
C.氢键(X—H…Y)中三原子在一条直线上时,原子轨道达到最大重叠,作用力最强,C正确;
D.中S价层电子对数为,S采取,的VSEPR模型为四面体形,有1对孤电子对,空间结构为三角锥形,D错误;
故答案为:C。
7.答案:C
解析:A.根据上述分析,X与W形成的化合物为,属于共价晶体,A错误;
B.的氢化物为,水溶液存在的氢键有:,,,,共4种,B错误;
C.化合物是,结构式为:,是配位键,C正确;
D.X为碳元素,形成的氢化物有各种烃,故X的氢化物沸点不一定高于Y的氢化物沸点,D错误;
故选C。
8.答案:D
解析:A.第一电离能:,N的轨道处于半满,A错误;
B.为,不稳定易分解的主要原因是分子内化学键不稳定,B错误;
C.Y和R反应生成的化合物有,含有离子键和共价键,C错误;
D.和WZ为和HF,均为极性分子,D正确;答案选D。
9.答案:D
解析:A选项:中B原子价层电子对数日不含孤电子对,故分子为半面正三角形,正负电荷中心重合,为非极性分子,故A错误;
B选项:氢键属于分子间作用力,不属于化学键,故B错误;
C选项:基态子的核外电子填充在6个轨道中的元素其核外电子排布式为或,为Na、Mg,有2种元素,故C错误;
D选项:与CO都属于分子晶体,分子晶体沸点与分子间作用力有关,所以沸点比CO低主要是由于两者范德华力不同,故D正确;故选D。
10.答案:A
解析:A.两个氢原子形成1个键,由于H原子只有一个电子,处于1s轨道,两个氢原子轨道重叠,成为共用电子对,形成共价键,,故A正确;
B.的中心原子有3个键,孤电子对数为1,价层电子对数为4,空间结构模型为三角锥形,故B错误;
C.邻羟基苯甲醛分子内氢键:,故C错误;
D.价层电子轨道表示式,故D错误;
答案选A。
11.答案:C
解析:W、X、Y、Z为短周期元素,原子半径依次递增,同周期元素原子半径从左到右逐渐减小,X、Y、Z在同一周期,则X、Y、Z原子序数依次减小,Z形成4个共价键,可知Z为C;Y形成3个共价键,X形成2个共价键,则Y、X分别是N和O;W只能形成1个共价键,且原子序数小于C,则W为H;
A.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,第一电离能:,A正确;
B.分子中形成单键的N原子为杂化,形成双键的N原子为杂化,故分子中元素N的杂化方式有两种,B正确;
C.分子和分别为,两者均为直线形构型,则键角相等,C错误;
D.咖啡因分子O、N电负性较大,可以和水分子形成氢键,其溶于水的原因主要是与水分子形成氢键,D正确;
故选C。
12.答案:C
解析:A.手性碳原子必须含饱和碳原子,且饱和碳原子上要连有4个不同的原子或原子团,化合物甲中没有连有4个不同的原子或原子团的饱和碳原子,不可能是手性分子,故A错误;
B.单键都是键,双键中含有1个键与键,所以化合物甲分子中键与键数目之比为13:1,故B错误;
C.化合物乙中碳原子均是饱和碳原子,由于O原子的接了两条共价键的单键,故其成键电子对数为2,此时孤电子对数为2,因此其价层电子对数为4,N原子的接了三条共价键的单键,故其成键电子对数为3,此时孤电子对数为1,因此其价层电子对数为4,N、C、O均是杂化,故C正确;
D.化合物甲不存在分子间氢键,化合物乙中含有氨基可以形成分子间氢键,故D错误;
故选C。
13.答案:A
解析:基态气态的价电子排布式为,易失去一个电子变为半充满的稳定结构,基态气态的价电子排布式为,为半充满的稳定结构,难以再失去一个电子,A错误;中与之间存在离子键,与水分子之间存在配位键,中S原子与O原子之间存在极性共价键,B正确;的中心原子O和的中心原子S均为杂化,但中的O原子上有2个孤电子对,故中键角小于中键角,C正确;由题图可知水分子与水分子之间、水分子与硫酸根离子之间均存在氢键,所以加热脱水时,需克服氢键的作用,D正确。
14.答案:(1)S;p;
(2)角形直线形;是极性分子,极性溶质易溶于极性溶剂,而是非极性分子
(3)平面三角形
(4)组成和结构相似的分子,相对分子质量越大,范德华力越大,沸点越高,由于分子间存在氢键,故的沸点最高 (5)4
解析:基态X原子核外电子的M层中只有两对成对电子,则其核外电子排布式为,则X为S;基态Y原子核外的L层电子数是K层的两倍,则Y为C;Z是地壳内含量(质量分数)最高的元素,则Z为O;T是元素周期表中电负性最大的元素,则T为F。
15.答案:(1)6;11;4 (2);5
(3) (4)16 (5)6;6 (6)B
解析:(1)基态原子的电子排布式为,电子占据6个轨道;每个电子运动状态不同,故钠原子有11个运动状态不同的电子;电子云伸展方向相同且只有1个,故基态钠原子有4个电子云伸展方向;
(2)铁是26号元素基态铁原子核外电子排布式为,基态的外电子排布式为,基态核外电子排布式为,有5个未成对电子;
(3)基态C原子核外电子排布式为,s、p能级上电子总数之比为2:1;
(4)异成烷分子式为,异成烷分子含12个极性键、4个非极性键,故异成烷分子含16个键;
(5))毗咯中C、N原子均采取杂化,未参与杂化的p轨道垂直于分子平面形成大键,由于C、N均形成3个键,则每个C原子提供1个电子,N原子提供2个电子形成大键;
(6)对二甲苯晶体是分子晶体,分子间存在范德华力,不存在氢键,分子内存在极性键和非极性键。
1.下列各分子既含有杂化的原子又能与形成氢键的是( )
A. B. C. D.
2.下列说法正确的是( )
A.氯化铵固体受热分解和干冰升华均只需克服分子间作用力
B.中所含化学键的类型相同
C.HCl气体溶于水和NaOH熔化破坏的化学键类型相同
D.的熔、沸点逐渐降低
3.下列说法正确的是( )
A.氢键是一种共价键
B.表面活性剂的疏水基团有较强的极性
C.σ键的电子云图形是轴对称的,π键的电子云图形是镜面对称的
D.可燃冰中甲烷分子和水分子间形成了氢键
4.碘晶体升华时,下列所述内容发生改变的是( )
A.分子内共价键 B.分子间的作用力
C.碘分子的大小 D.分子内共价键的键长
5.下列现象与氢键无关的是( )
A.乙醇可以和水以任意比互溶 B.冰的密度比液态水的密度小
C.水分子在较高温度下也很稳定 D.的沸点比的沸点高
6.下列关于物质结构与性质的说法中正确的是( )
A.同温同压下在水中的溶解度大于
B.和的中心原子均采用杂化
C.氢键()中三原子共线时作用力最强
D.的VSEPR模型与其空间结构均为三角锥形
7.五种短周期主族元素的原子半径依次增大,其中基态X原子未成对电子数目最多,Y和W同主族,基态Q原子填充3个能级,有1个未成对电子,基态Z原子电子填充了3个原子轨道,Z周期表中的位置与Y相邻。下列说法正确的是( )
A.X与W形成的化合物属于分子晶体
B.Q的氢化物的水溶液存在3种氢键
C.化合物含有配位键
D.X的氢化物沸点一定高于Y的氢化物沸点
8.为短周期主族元素,原子序数依次增大。W的某种原子核内无中子,为同周期相邻元素,Z2是氧化性最强的单质,W的核外电子数与R的价层电子数相等,下列有关说法正确的是( )
A.第一电离能:
B.不稳定易分解的主要原因是分子间氢键较弱
C.Y和R反应生成的化合物中只含有离子键
D.和均为极性分子
9.下列说法正确的是( )
A.分子形状呈平面三角形,是极性分子
B.冰中存在共价键和氢键两种化学键
C.基态原子的核外电子全部填充在6个轨道中的元素有3种
D.的沸点比CO低主要是由于两者范德华力不同
10.下列化学用语表达正确的是( )
A.用电子云轮廓图表示键的形成示意图:
B.的空间结构模型:
C.邻羟基苯甲醛分子内氢键:
D.基态原子的价层电子轨道表示式:
11.茶叶中含有少量的咖啡因,它是一种简单有机物,其组成元素W、X、Y、Z为短周期元素,原子半径依次递增,X、Y、Z在同一周期,其结构如下图所示,下列说法错误的是( )
A.第一电离能:
B.分子中元素的杂化方式有两种
C.分子和键角,前者大于后者
D.咖啡因溶于水的原因主要是与水分子形成氢键
12.纳米是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )
A.化合物甲、乙均为手性分子
B.化合物甲分子中键与键数目之比为12:1
C.化合物乙中采取杂化的原子有N、C、O
D.化合物甲、乙均存在分子间氢键
13.我国古代中药学著作《新修本草》中对“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃…….,烧之赤色……”。“青矾”的主要成分为(结构如图)。下列说法错误的是( )
A.基态气态再失去一个电子比基态气态更难
B.中存在离子键、极性键、配位键
C.中键角小于中键角
D.加热脱水时,需克服氢键的作用
14.X、Y、Z、T四种元素中,基态X原子核外电子的M层中只有两对成对电子,基态Y原子核外电子的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,T是元素周期表中电负性最大的元素。请回答下列问题。
(1)X元素符号为___________,Y属于__________区元素,Z元素基态原子的电子排布式为_______________。
(2)与分子的立体结构分别是__________和__________,相同条件下二者在水中的溶解度较大的是__________(写分子式),理由是____________________。
(3)中X原子采取的杂化方式是____________,XZ分子的空间结构是________________。
(4)X、Y、Z的最简单气态氢化物的沸点由高到低的排列顺序是___________,原因是________________。
(5)T的氢化物溶液中存在的氢键类型有_____种。
15.中国科学院大连化学物理研究所碳资源小分子与氢能利用研究组通过设计一种全新的多功能复合催化剂,首次实现了直接加氢制取高辛烷值汽油(如图)。根据图中涉及物质及元素回答下列问题:
(1)基态原子核外电子占据_______个原子轨道,有_______个运动状态不同的电子,电子云有_______个伸展方向。
(2)基态的电子排布式为_______,基态有_______个未成对电子。
(3)基态C原子核外s、p能级上电子总数之比为_______。
(4)异戊烷分子含_______键。
(5)对二甲苯分子中碳的2p轨道形成_______中心_______电子的大键。
(6)对二甲苯晶体中不存在的“作用力类型”有_______(填标号)。
A.范德华力 B.氢键 C.非极性键 D.极性键
答案以及解析
1.答案:C
解析:A.中两个碳原子价层电子对数为4都采用杂化,且和不能形成分子间氢键,故A错误;
B.中两个碳原子价层电子对数为3采用杂化,但不能和形成分子间氢键,故B错误;
C.的—COOH中碳原子价层电子对数为3采用杂化,且能和形成分子间氢键,故C正确;
D.中C、N原子价层电子对数为4都采用杂化,故D错误;
故选:C。
2.答案:D
解析:A.氯化铵受热时氯化铵分解生成氨气和氯化氢,属于化学变化,化学键破坏,干冰升华是物理变化,只需克服分子间作用力,A错误;
B.NaF中含有离子键,中含有共价键,所含化学键类型不相同,B错误;
C.HCl气体溶于水共价键断键,NaOH熔化破坏的是离子键,化学键类型不相同,C错误;
D.形成的均是分子晶体,相对分子质量依次减小,分子间作用力逐渐减小,则熔沸点逐渐降低,D正确。
答案选D。
3.答案:C
解析:A.氢键是一种特殊的分子间作用力,不属于共价键,A错误;
B.表面活性剂的疏水基团极性较低,亲水基极性较高,B错误;
C.σ键的电子云图形是轴对称的,π键的电子云图形是镜面对称的,C正确;
D.可燃冰()中甲烷分子和水分子间形成了范德华力,D错误。
故选C。
4.答案:B
解析:干冰是固态的二氧化碳,属于分子晶体,分子间存在分子间作用力,不存在氢键,分子汽化时破坏分子间作用力,而分子内原子间共价键没有被破坏,所以分子的性质不发生改变,故B正确。
5.答案:C
解析:A.因乙醇、水分子之间能形成氢键,所以乙醇可以和水以任意比互溶,A项不符合题意;
B.冰中存在氢键,使其与相同质量的水相比,体积变大,则冰的密度比液态水的密度小,B项不符合题意;
C.水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,C项符合题意;
D.HF易形成分子间氢键,而HCl不能形成氢键,HF的沸点比HCl高,D项不符合题意;
故选C。
6.答案:C
解析:A.分子中O价层电子对数为,采取杂化,有一对孤电子对,分子呈V性,该分子为极性分子。根据相似相溶原理可知,同温同压下在水中的溶解度比大,A错误;
B.分子中B价层电子对数为,B采取杂化。分子中P价层电子对数为,P采用杂化,B错误;
C.氢键(X—H…Y)中三原子在一条直线上时,原子轨道达到最大重叠,作用力最强,C正确;
D.中S价层电子对数为,S采取,的VSEPR模型为四面体形,有1对孤电子对,空间结构为三角锥形,D错误;
故答案为:C。
7.答案:C
解析:A.根据上述分析,X与W形成的化合物为,属于共价晶体,A错误;
B.的氢化物为,水溶液存在的氢键有:,,,,共4种,B错误;
C.化合物是,结构式为:,是配位键,C正确;
D.X为碳元素,形成的氢化物有各种烃,故X的氢化物沸点不一定高于Y的氢化物沸点,D错误;
故选C。
8.答案:D
解析:A.第一电离能:,N的轨道处于半满,A错误;
B.为,不稳定易分解的主要原因是分子内化学键不稳定,B错误;
C.Y和R反应生成的化合物有,含有离子键和共价键,C错误;
D.和WZ为和HF,均为极性分子,D正确;答案选D。
9.答案:D
解析:A选项:中B原子价层电子对数日不含孤电子对,故分子为半面正三角形,正负电荷中心重合,为非极性分子,故A错误;
B选项:氢键属于分子间作用力,不属于化学键,故B错误;
C选项:基态子的核外电子填充在6个轨道中的元素其核外电子排布式为或,为Na、Mg,有2种元素,故C错误;
D选项:与CO都属于分子晶体,分子晶体沸点与分子间作用力有关,所以沸点比CO低主要是由于两者范德华力不同,故D正确;故选D。
10.答案:A
解析:A.两个氢原子形成1个键,由于H原子只有一个电子,处于1s轨道,两个氢原子轨道重叠,成为共用电子对,形成共价键,,故A正确;
B.的中心原子有3个键,孤电子对数为1,价层电子对数为4,空间结构模型为三角锥形,故B错误;
C.邻羟基苯甲醛分子内氢键:,故C错误;
D.价层电子轨道表示式,故D错误;
答案选A。
11.答案:C
解析:W、X、Y、Z为短周期元素,原子半径依次递增,同周期元素原子半径从左到右逐渐减小,X、Y、Z在同一周期,则X、Y、Z原子序数依次减小,Z形成4个共价键,可知Z为C;Y形成3个共价键,X形成2个共价键,则Y、X分别是N和O;W只能形成1个共价键,且原子序数小于C,则W为H;
A.同一周期随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大于同周期相邻元素,第一电离能:,A正确;
B.分子中形成单键的N原子为杂化,形成双键的N原子为杂化,故分子中元素N的杂化方式有两种,B正确;
C.分子和分别为,两者均为直线形构型,则键角相等,C错误;
D.咖啡因分子O、N电负性较大,可以和水分子形成氢键,其溶于水的原因主要是与水分子形成氢键,D正确;
故选C。
12.答案:C
解析:A.手性碳原子必须含饱和碳原子,且饱和碳原子上要连有4个不同的原子或原子团,化合物甲中没有连有4个不同的原子或原子团的饱和碳原子,不可能是手性分子,故A错误;
B.单键都是键,双键中含有1个键与键,所以化合物甲分子中键与键数目之比为13:1,故B错误;
C.化合物乙中碳原子均是饱和碳原子,由于O原子的接了两条共价键的单键,故其成键电子对数为2,此时孤电子对数为2,因此其价层电子对数为4,N原子的接了三条共价键的单键,故其成键电子对数为3,此时孤电子对数为1,因此其价层电子对数为4,N、C、O均是杂化,故C正确;
D.化合物甲不存在分子间氢键,化合物乙中含有氨基可以形成分子间氢键,故D错误;
故选C。
13.答案:A
解析:基态气态的价电子排布式为,易失去一个电子变为半充满的稳定结构,基态气态的价电子排布式为,为半充满的稳定结构,难以再失去一个电子,A错误;中与之间存在离子键,与水分子之间存在配位键,中S原子与O原子之间存在极性共价键,B正确;的中心原子O和的中心原子S均为杂化,但中的O原子上有2个孤电子对,故中键角小于中键角,C正确;由题图可知水分子与水分子之间、水分子与硫酸根离子之间均存在氢键,所以加热脱水时,需克服氢键的作用,D正确。
14.答案:(1)S;p;
(2)角形直线形;是极性分子,极性溶质易溶于极性溶剂,而是非极性分子
(3)平面三角形
(4)组成和结构相似的分子,相对分子质量越大,范德华力越大,沸点越高,由于分子间存在氢键,故的沸点最高 (5)4
解析:基态X原子核外电子的M层中只有两对成对电子,则其核外电子排布式为,则X为S;基态Y原子核外的L层电子数是K层的两倍,则Y为C;Z是地壳内含量(质量分数)最高的元素,则Z为O;T是元素周期表中电负性最大的元素,则T为F。
15.答案:(1)6;11;4 (2);5
(3) (4)16 (5)6;6 (6)B
解析:(1)基态原子的电子排布式为,电子占据6个轨道;每个电子运动状态不同,故钠原子有11个运动状态不同的电子;电子云伸展方向相同且只有1个,故基态钠原子有4个电子云伸展方向;
(2)铁是26号元素基态铁原子核外电子排布式为,基态的外电子排布式为,基态核外电子排布式为,有5个未成对电子;
(3)基态C原子核外电子排布式为,s、p能级上电子总数之比为2:1;
(4)异成烷分子式为,异成烷分子含12个极性键、4个非极性键,故异成烷分子含16个键;
(5))毗咯中C、N原子均采取杂化,未参与杂化的p轨道垂直于分子平面形成大键,由于C、N均形成3个键,则每个C原子提供1个电子,N原子提供2个电子形成大键;
(6)对二甲苯晶体是分子晶体,分子间存在范德华力,不存在氢键,分子内存在极性键和非极性键。
