5.3.2 实验室制取二氧化碳 优质课件 (共32张PPT 内嵌视频)初中科粤版(2024)九年级上册
文档属性
| 名称 | 5.3.2 实验室制取二氧化碳 优质课件 (共32张PPT 内嵌视频)初中科粤版(2024)九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 65.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 10:50:26 | ||
图片预览











文档简介
(共32张PPT)
5.3.2 二氧化碳的性质
核心素养目标
一、化学观念
理解实验室制取二氧化碳的反应原理,形成 “物质在一定条件下可以相互转化” 的观念;认识实验室制取气体的一般思路和方法,构建 “科学选择试剂和装置进行物质制备” 的化学观念。
二、科学思维
通过对比不同试剂制取二氧化碳的效果,培养分析、比较、归纳的思维能力。
三、科学态度与责任
严谨对待实验操作,培养认真、负责的科学态度;认识到化学实验对化学研究的重要性,增强对化学学科的责任感。
学习重难点
重点:
1. 实验室制取二氧化碳的反应原理、装置设计和操作步骤
2. 理解实验室制取气体的装置选择依据
难点:
1. 合理设计并组装实验室制取二氧化碳的装置
2. 理解实验室制取气体的一般思路并能迁移应用
新课导入
“同学们,未来我们可能要在火星上建立人类基地,但是火星上没有可供呼吸的氧气,却有大量的二氧化碳。假设我们已经掌握了将二氧化碳转化为氧气的技术,那第一步就是要先制取二氧化碳。在实验室里,我们怎样才能制取到纯净的二氧化碳呢?今天,我们就化身小小科学家,来研究实验室制取二氧化碳的方法。”
01 实验室怎样制取二氧化碳
试剂的选择
选择制取气体时药品的一般原则:较易反应、反应速度适中、生成的气体纯净、易于收集、操作简便、原料廉价易得等。
呼吸作用
碳燃烧
蜡烛燃烧
所得CO2气体不纯,且难以收集。
试剂的选择
实验室常用稀盐酸与块状大理石或石灰石(主要成分是碳酸钙)在常温下反应来制取二氧化碳。
CaCO3 + 2HCl===CaCl2 + CO2↑ + H2O
这个反应实际上包含了连续发生的两个反应:
CaCO3 + 2HCl===CaCl2 +H2CO3
H2CO3=== CO2↑ + H2O
试剂的选择
碳酸钠、稀硫酸也是实验室中常见的试剂,可以用碳酸钠和稀盐酸或者是碳酸钙和稀硫酸反应来制取二氧化碳吗?实验室还有粉末状的碳酸钙试剂,用它来制取二氧化碳,效果会怎么样呢?
tips: 含碳酸根离子(CO32-)的化合物都能与稀盐酸(HCl)或稀硫酸 (H2SO4)等在常温下反应生成CO2气体。
碳酸钠
稀盐酸
稀硫酸
观察活动——认识实验室制备二氧化碳应选用的试剂
观察活动——认识实验室制备二氧化碳应选用的试剂
实验试剂选择 反应速率
碳酸钙(块状) 稀硫酸
稀盐酸
碳酸钠(块状) 稀硫酸
稀盐酸
碳酸钙(粉末) 稀硫酸
稀盐酸
大量气泡,反应速率适中,易于控制
大量气泡,反应的速率过快,不易控制
大量气泡,反应速率太快,不易控制
少量气泡,反应一会儿就停止
大量气泡,反应速率比块状的更快,不易控制
少量气泡,反应一会儿就停止
思考讨论
1. 为什么不用碳酸钠粉末或碳酸钙粉末和酸反应制取二氧化碳?
反应速率太快,不易收集
2. 能不能用浓盐酸代替稀盐酸?
不能,浓盐酸具有挥发性,会挥发出HCl气体,使制得的CO2不纯
3. 为什么不用稀硫酸和大理石反应制取二氧化碳?
稀硫酸和大理石反应生成微溶于水的硫酸钙,覆盖在大理石表面,阻止反应进行。
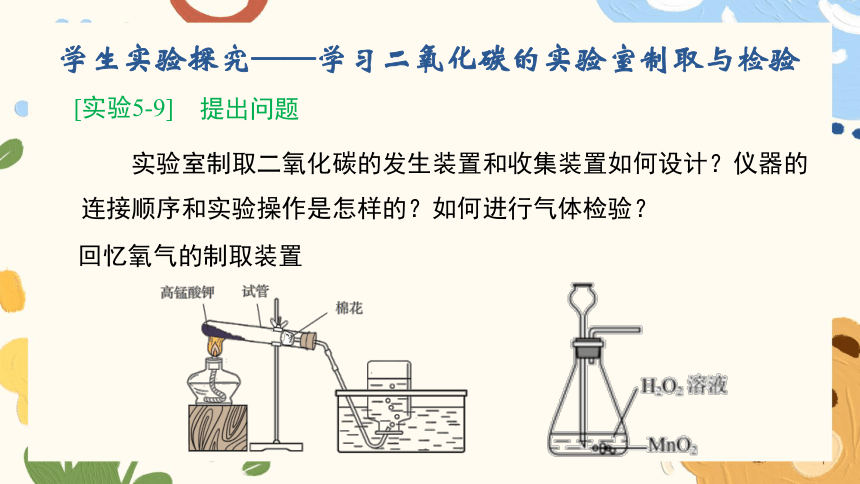
学生实验探究——学习二氧化碳的实验室制取与检验
[实验5-9]
提出问题
实验室制取二氧化碳的发生装置和收集装置如何设计?仪器的连接顺序和实验操作是怎样的?如何进行气体检验?
回忆氧气的制取装置
学生实验探究——学习二氧化碳的实验室制取与检验
设计装置
选择依据
选择依据
实验室制取气体的装置
发生装置
收集装置
反应物的状态
反应条件
气体的密度
气体的溶解度
实验室制取二氧化碳的药品是固体和液体,反应条件是常温,发生装置选择固液常温型;二氧化碳的密度比空气大,能溶于水且和水反应,因此收集方法选择向上排空气法。
注:比较某气体的相对分子质量与空气的平均相对分子质量(29),即可判断该气体与空气密度的相对大小。
学生实验探究——学习二氧化碳的实验室制取与检验
选择与组装仪器(发生装置:固液常温型、收集装置:向上排空气法)
√
√
√
×
×
×
×
×
√
×
√
√
×
√
√
学生实验探究——学习二氧化碳的实验室制取与检验
你能画出不同的装置方案图吗?
方案一
方案二
方案三
方案四
学生实验探究——学习二氧化碳的实验室制取与检验
进行实验
选用最简单的仪器,组装成制取二氧化碳气体的装置,制取并检验该气体。
①检查装置
气密性
②加入试剂
③收集气体
④进行验满
⑤检验气体
装 置
优点
缺点
学生实验探究——学习二氧化碳的实验室制取与检验
反思评价
各装置有什么优缺点呢?
便于随时添加药品
可以控制反应速率
可以控制反应的发生和停止
装置简单
无法补充药品
无法控制反应
速率,容易造
成气体泄漏。
不能实现
随开随用,
随关随停。
结构相对复杂,辅助仪器较多。
学生实验探究——学习二氧化碳的实验室制取与检验
撰写实验报告
二氧化碳的制取
实验目的: .
实验原理: .
实验用品: .
实验装置图:
学习二氧化碳的实验室制取与检验
CaCO3+2HCl ===CaCl2↓+H2O+CO2↑
试管、玻璃弯管、乳胶管、单孔胶塞、铁架台、集气瓶、毛玻璃片、石灰石、稀盐酸、澄清石灰水、火柴等。
学生实验探究——学习二氧化碳的实验室制取与检验
实验内容与步骤 现象
1.检查装置气密性:将导管伸入水中,手握试管,观察水中导管口的现象。
2.加入试剂:打开胶塞,按操作要求在试管中加入适量___________,倒入6mL_________, 迅速盖好胶塞。
3.收集气体:将试管固定在________上,用________法收集气体。
4.进行验满:用_____________靠近集气瓶口,检验气体是否集满。
5.检验气体:往集气瓶中滴加适量澄清石灰水。
导管口有气泡冒出
块状大理石
稀盐酸
倒入稀盐酸后大理石表面有气泡冒出
铁架台
向上排气
燃着的木条
燃着的木条熄灭,说明二氧化碳已集满
澄清石灰水变浑浊
学生实验探究——学习二氧化碳的实验室制取与检验
气体 制取原理 反应物的状态 反应条件 气体的密度和空气的比较 是否溶于水及和水反应 收集方法
二氧化碳
氧气
稀盐酸与大理石(石灰石)反应
固体和液体
常温
比空气大
能溶于水且与水反应
向上排空气法
加热高锰酸钾
固体
加热
比空气大
不易溶于水且不与水反应
向上排空气法、排水法
分解过氧化氢溶液
固体和液体
常温
二氧化锰
实验反思
实验室制取二氧化碳的发生装置和收集装置与制取氧气的有何不同?
思考讨论
1. 若制得的CO2气体中混有HCl气体,该如何除去?若想得到干燥的CO2,该如何除去水蒸气?
将气体通入盛有饱和碳酸氢钠溶液的洗气瓶。
球形干燥管
将气体通入干燥装置。
U形干燥管
浓硫酸洗气装置
实验室制取气体的方法
(1)选择合适的试剂
要求保证安全、操作方便、反应速率适中,并兼顾环保、经济性。
(2)选择实验装置
气体发生装置
反应物的状态
反应条件
固体与固体反应
固体与液体反应
液体与液体反应
加热
不加热
实验室制取气体的方法
常见的气体发生装置
实验室制取气体的方法
(2)选择实验装置
气体收集装置
气体的密度
气体的溶解性
密度比空气大——向上排空气法
不易溶于水,不与水反应——排水法
密度比空气小——向下排空气法
实验室制取气体的方法
常见的气体收集装置
实验室制取气体的方法
(3)组装、拆卸仪器,加入试剂顺序
①按照先下后上、先左后右的顺序组装仪器,并检查装置气密性。拆卸仪器的顺序一般与组装相反。
②加入试剂时,先加固体试剂,后加液体试剂,最后点燃酒精灯(若需要加热)。使用排水法收集气体时,为防止水倒吸,实验结束时需要先将导气管从水中移出,再停止加热。
(4)验证制得的气体就是所要制取的气体。
总结归纳
随堂练习
1. 下列方法中最适用于实验室制取二氧化碳的是( )
A. 碳在空气中充分燃烧
B. 稀盐酸和碳酸钙粉末反应
C. 常温下稀盐酸与石灰石反应
D. 高温煅烧石灰石
C
随堂练习
2. 下列关于CO2的实验室制取及检验的说法不正确的是( )
A. 制CO2的药品 B. 发生装置
C. 收集方法 D. 检验CO2
A
3. 某同学在实验室制取二氧化碳的装置如图所示。下列关于实验用品的使用或相关操作正确的是( )
A. 锥形瓶内长颈漏斗下端的位置
B. 药品的选择
C. 锥形瓶内导管口的位置
D. 导管口开始有气泡冒出时,立即收集气体
随堂练习
B
4. 兴趣小组在实验室制取的发生装置中连接压强传感器,如图1,测得实验过程中试管内气体压强变化情况如图2。下列说法不正确的是( )
A. ab段长颈漏斗中液面逐渐上升
B. bc段反应物固体与液体脱离接触
C. c点的对应操作是打开弹簧夹
D. 该发生装置可以控制反应速率,得到平稳的气流
随堂练习
D
感谢您的观看
“THANK YOU”
5.3.2 二氧化碳的性质
核心素养目标
一、化学观念
理解实验室制取二氧化碳的反应原理,形成 “物质在一定条件下可以相互转化” 的观念;认识实验室制取气体的一般思路和方法,构建 “科学选择试剂和装置进行物质制备” 的化学观念。
二、科学思维
通过对比不同试剂制取二氧化碳的效果,培养分析、比较、归纳的思维能力。
三、科学态度与责任
严谨对待实验操作,培养认真、负责的科学态度;认识到化学实验对化学研究的重要性,增强对化学学科的责任感。
学习重难点
重点:
1. 实验室制取二氧化碳的反应原理、装置设计和操作步骤
2. 理解实验室制取气体的装置选择依据
难点:
1. 合理设计并组装实验室制取二氧化碳的装置
2. 理解实验室制取气体的一般思路并能迁移应用
新课导入
“同学们,未来我们可能要在火星上建立人类基地,但是火星上没有可供呼吸的氧气,却有大量的二氧化碳。假设我们已经掌握了将二氧化碳转化为氧气的技术,那第一步就是要先制取二氧化碳。在实验室里,我们怎样才能制取到纯净的二氧化碳呢?今天,我们就化身小小科学家,来研究实验室制取二氧化碳的方法。”
01 实验室怎样制取二氧化碳
试剂的选择
选择制取气体时药品的一般原则:较易反应、反应速度适中、生成的气体纯净、易于收集、操作简便、原料廉价易得等。
呼吸作用
碳燃烧
蜡烛燃烧
所得CO2气体不纯,且难以收集。
试剂的选择
实验室常用稀盐酸与块状大理石或石灰石(主要成分是碳酸钙)在常温下反应来制取二氧化碳。
CaCO3 + 2HCl===CaCl2 + CO2↑ + H2O
这个反应实际上包含了连续发生的两个反应:
CaCO3 + 2HCl===CaCl2 +H2CO3
H2CO3=== CO2↑ + H2O
试剂的选择
碳酸钠、稀硫酸也是实验室中常见的试剂,可以用碳酸钠和稀盐酸或者是碳酸钙和稀硫酸反应来制取二氧化碳吗?实验室还有粉末状的碳酸钙试剂,用它来制取二氧化碳,效果会怎么样呢?
tips: 含碳酸根离子(CO32-)的化合物都能与稀盐酸(HCl)或稀硫酸 (H2SO4)等在常温下反应生成CO2气体。
碳酸钠
稀盐酸
稀硫酸
观察活动——认识实验室制备二氧化碳应选用的试剂
观察活动——认识实验室制备二氧化碳应选用的试剂
实验试剂选择 反应速率
碳酸钙(块状) 稀硫酸
稀盐酸
碳酸钠(块状) 稀硫酸
稀盐酸
碳酸钙(粉末) 稀硫酸
稀盐酸
大量气泡,反应速率适中,易于控制
大量气泡,反应的速率过快,不易控制
大量气泡,反应速率太快,不易控制
少量气泡,反应一会儿就停止
大量气泡,反应速率比块状的更快,不易控制
少量气泡,反应一会儿就停止
思考讨论
1. 为什么不用碳酸钠粉末或碳酸钙粉末和酸反应制取二氧化碳?
反应速率太快,不易收集
2. 能不能用浓盐酸代替稀盐酸?
不能,浓盐酸具有挥发性,会挥发出HCl气体,使制得的CO2不纯
3. 为什么不用稀硫酸和大理石反应制取二氧化碳?
稀硫酸和大理石反应生成微溶于水的硫酸钙,覆盖在大理石表面,阻止反应进行。
学生实验探究——学习二氧化碳的实验室制取与检验
[实验5-9]
提出问题
实验室制取二氧化碳的发生装置和收集装置如何设计?仪器的连接顺序和实验操作是怎样的?如何进行气体检验?
回忆氧气的制取装置
学生实验探究——学习二氧化碳的实验室制取与检验
设计装置
选择依据
选择依据
实验室制取气体的装置
发生装置
收集装置
反应物的状态
反应条件
气体的密度
气体的溶解度
实验室制取二氧化碳的药品是固体和液体,反应条件是常温,发生装置选择固液常温型;二氧化碳的密度比空气大,能溶于水且和水反应,因此收集方法选择向上排空气法。
注:比较某气体的相对分子质量与空气的平均相对分子质量(29),即可判断该气体与空气密度的相对大小。
学生实验探究——学习二氧化碳的实验室制取与检验
选择与组装仪器(发生装置:固液常温型、收集装置:向上排空气法)
√
√
√
×
×
×
×
×
√
×
√
√
×
√
√
学生实验探究——学习二氧化碳的实验室制取与检验
你能画出不同的装置方案图吗?
方案一
方案二
方案三
方案四
学生实验探究——学习二氧化碳的实验室制取与检验
进行实验
选用最简单的仪器,组装成制取二氧化碳气体的装置,制取并检验该气体。
①检查装置
气密性
②加入试剂
③收集气体
④进行验满
⑤检验气体
装 置
优点
缺点
学生实验探究——学习二氧化碳的实验室制取与检验
反思评价
各装置有什么优缺点呢?
便于随时添加药品
可以控制反应速率
可以控制反应的发生和停止
装置简单
无法补充药品
无法控制反应
速率,容易造
成气体泄漏。
不能实现
随开随用,
随关随停。
结构相对复杂,辅助仪器较多。
学生实验探究——学习二氧化碳的实验室制取与检验
撰写实验报告
二氧化碳的制取
实验目的: .
实验原理: .
实验用品: .
实验装置图:
学习二氧化碳的实验室制取与检验
CaCO3+2HCl ===CaCl2↓+H2O+CO2↑
试管、玻璃弯管、乳胶管、单孔胶塞、铁架台、集气瓶、毛玻璃片、石灰石、稀盐酸、澄清石灰水、火柴等。
学生实验探究——学习二氧化碳的实验室制取与检验
实验内容与步骤 现象
1.检查装置气密性:将导管伸入水中,手握试管,观察水中导管口的现象。
2.加入试剂:打开胶塞,按操作要求在试管中加入适量___________,倒入6mL_________, 迅速盖好胶塞。
3.收集气体:将试管固定在________上,用________法收集气体。
4.进行验满:用_____________靠近集气瓶口,检验气体是否集满。
5.检验气体:往集气瓶中滴加适量澄清石灰水。
导管口有气泡冒出
块状大理石
稀盐酸
倒入稀盐酸后大理石表面有气泡冒出
铁架台
向上排气
燃着的木条
燃着的木条熄灭,说明二氧化碳已集满
澄清石灰水变浑浊
学生实验探究——学习二氧化碳的实验室制取与检验
气体 制取原理 反应物的状态 反应条件 气体的密度和空气的比较 是否溶于水及和水反应 收集方法
二氧化碳
氧气
稀盐酸与大理石(石灰石)反应
固体和液体
常温
比空气大
能溶于水且与水反应
向上排空气法
加热高锰酸钾
固体
加热
比空气大
不易溶于水且不与水反应
向上排空气法、排水法
分解过氧化氢溶液
固体和液体
常温
二氧化锰
实验反思
实验室制取二氧化碳的发生装置和收集装置与制取氧气的有何不同?
思考讨论
1. 若制得的CO2气体中混有HCl气体,该如何除去?若想得到干燥的CO2,该如何除去水蒸气?
将气体通入盛有饱和碳酸氢钠溶液的洗气瓶。
球形干燥管
将气体通入干燥装置。
U形干燥管
浓硫酸洗气装置
实验室制取气体的方法
(1)选择合适的试剂
要求保证安全、操作方便、反应速率适中,并兼顾环保、经济性。
(2)选择实验装置
气体发生装置
反应物的状态
反应条件
固体与固体反应
固体与液体反应
液体与液体反应
加热
不加热
实验室制取气体的方法
常见的气体发生装置
实验室制取气体的方法
(2)选择实验装置
气体收集装置
气体的密度
气体的溶解性
密度比空气大——向上排空气法
不易溶于水,不与水反应——排水法
密度比空气小——向下排空气法
实验室制取气体的方法
常见的气体收集装置
实验室制取气体的方法
(3)组装、拆卸仪器,加入试剂顺序
①按照先下后上、先左后右的顺序组装仪器,并检查装置气密性。拆卸仪器的顺序一般与组装相反。
②加入试剂时,先加固体试剂,后加液体试剂,最后点燃酒精灯(若需要加热)。使用排水法收集气体时,为防止水倒吸,实验结束时需要先将导气管从水中移出,再停止加热。
(4)验证制得的气体就是所要制取的气体。
总结归纳
随堂练习
1. 下列方法中最适用于实验室制取二氧化碳的是( )
A. 碳在空气中充分燃烧
B. 稀盐酸和碳酸钙粉末反应
C. 常温下稀盐酸与石灰石反应
D. 高温煅烧石灰石
C
随堂练习
2. 下列关于CO2的实验室制取及检验的说法不正确的是( )
A. 制CO2的药品 B. 发生装置
C. 收集方法 D. 检验CO2
A
3. 某同学在实验室制取二氧化碳的装置如图所示。下列关于实验用品的使用或相关操作正确的是( )
A. 锥形瓶内长颈漏斗下端的位置
B. 药品的选择
C. 锥形瓶内导管口的位置
D. 导管口开始有气泡冒出时,立即收集气体
随堂练习
B
4. 兴趣小组在实验室制取的发生装置中连接压强传感器,如图1,测得实验过程中试管内气体压强变化情况如图2。下列说法不正确的是( )
A. ab段长颈漏斗中液面逐渐上升
B. bc段反应物固体与液体脱离接触
C. c点的对应操作是打开弹簧夹
D. 该发生装置可以控制反应速率,得到平稳的气流
随堂练习
D
感谢您的观看
“THANK YOU”
同课章节目录
