(20)3.2.4几种简单的晶体结构模型__高二化学鲁科版(2019)选择性必修二同步课时作业(含解析)
文档属性
| 名称 | (20)3.2.4几种简单的晶体结构模型__高二化学鲁科版(2019)选择性必修二同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 15:54:59 | ||
图片预览

文档简介
(20)3.2.4几种简单的晶体结构模型——高二化学鲁科版(2019)选择性必修二同步课时作业
1.下列晶体的熔点最低的是( )
A. B.生铁 C.晶体硅 D.蔗糖
2.“可燃冰”的主要成分是甲烷与水分子的结晶水合物。其晶体类型是( )
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
3.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
A.、、 B.,、
C.、、 D.,、
4.几种单质的沸点如图所示。下列推断正确的是( )
A.D可能为共价晶体,H可能为分子晶体
B.G可能为离子晶体
C.F一定是金属晶体
D.B一定是离子晶体
5.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,金刚石晶胞结构如图所示。下列有关冰晶胞的说法正确的是( )
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞中平均含有4个水分子
C.水分子间的氢键无方向性和饱和性
D.实验测得冰中氢键的作用力为,而冰的熔化热为,这说明冰融化成水,氢键部分被破坏
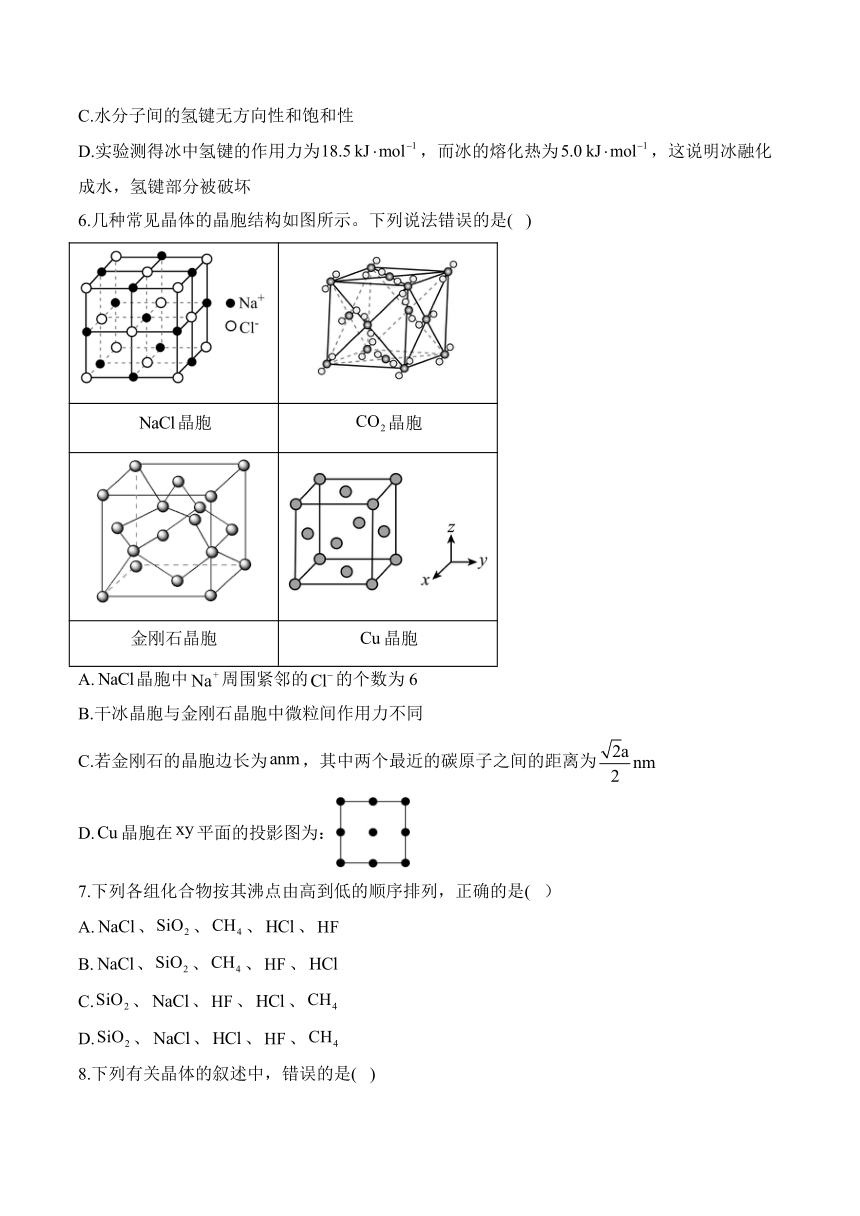
6.几种常见晶体的晶胞结构如图所示。下列说法错误的是( )
晶胞 晶胞
金刚石晶胞 晶胞
A.晶胞中周围紧邻的的个数为6
B.干冰晶胞与金刚石晶胞中微粒间作用力不同
C.若金刚石的晶胞边长为,其中两个最近的碳原子之间的距离为
D.晶胞在平面的投影图为:
7.下列各组化合物按其沸点由高到低的顺序排列,正确的是( )
A.、、、、
B.、、、、
C.、、、、
D.、、、、
8.下列有关晶体的叙述中,错误的是( )
A.干冰晶体中,每个周围紧邻12个
B.氯化钠晶体中,每个周围紧邻且距离相等的共有6个
C.氯化铯晶体中,每个周围紧邻8个
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环有6个碳原子
9.工业上制备四氢硼钠的原理为。上述反应中的物质没有涉及的晶体类型是( )
A.金属晶体 B.共价晶体 C.分子晶体 D.离子晶体
10.下列物质的有关叙述正确的是( )
A.它们的物理性质相同 B.它们充分燃烧后的产物相同
C.石墨能导电故属于金属晶体 D.分子中仅含键
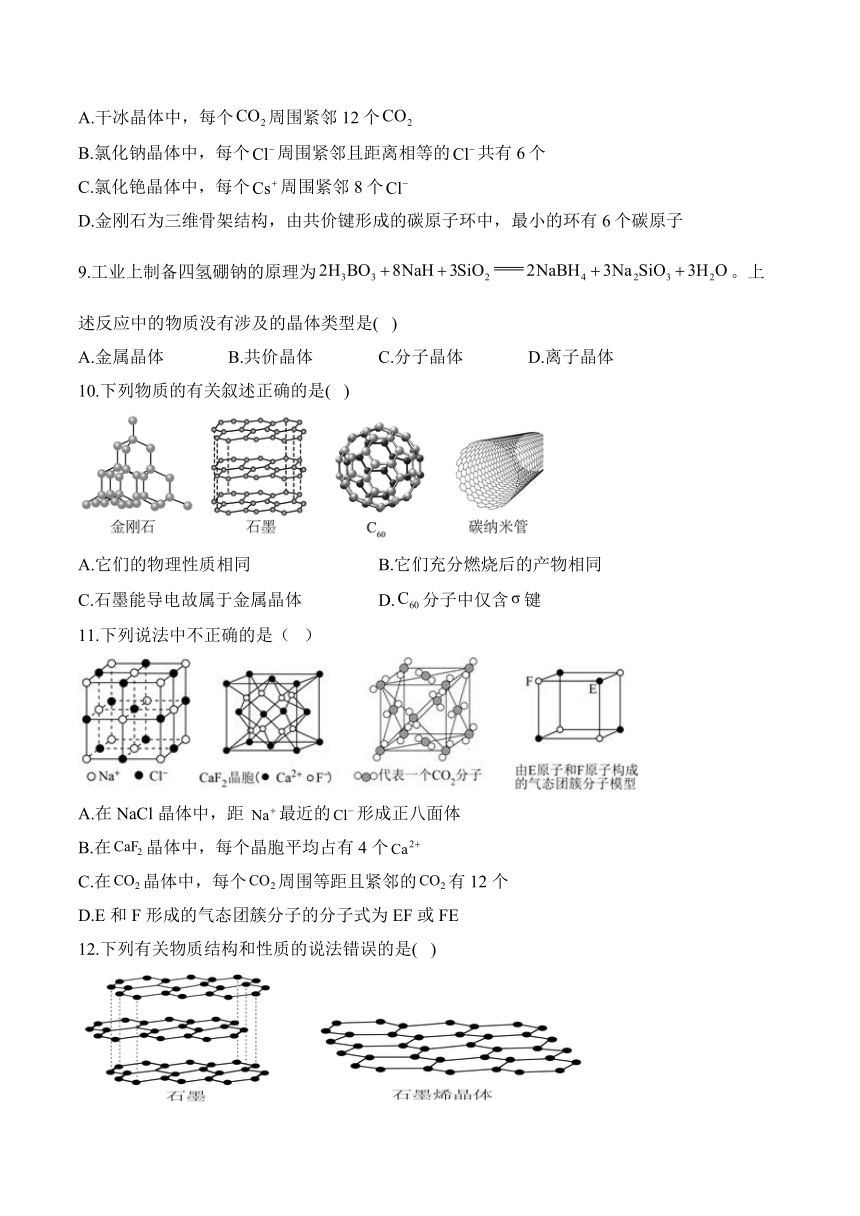
11.下列说法中不正确的是( )
A.在 NaCl 晶体中,距 最近的形成正八面体
B.在晶体中,每个晶胞平均占有 4 个
C.在晶体中,每个周围等距且紧邻的有 12 个
D.E 和 F 形成的气态团簇分子的分子式为 EF 或 FE
12.下列有关物质结构和性质的说法错误的是( )
A.由于碱金属中的半径最小,金属键最强,的熔点最高
B.冰属于分子晶体,且含有氢键,故具有“分子密堆积”特征
C.和均是价层电子对数为4的极性分子,且分子的键角较小
D.从石墨晶体中剥离出石墨烯(结构如图),需破坏分子间作用力
13.在20世纪90年代末,科学家发现碳有新的单质形态存在。后来人们又相继得到了等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是( )
A.金刚石和石墨的熔点肯定比高
B.熔点:
C.球碳分子、管状碳分子和洋葱状碳分子都不能与发生反应
D.金刚石以非分子形式的粒子存在,属于共价晶体;管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质互为同素异形体
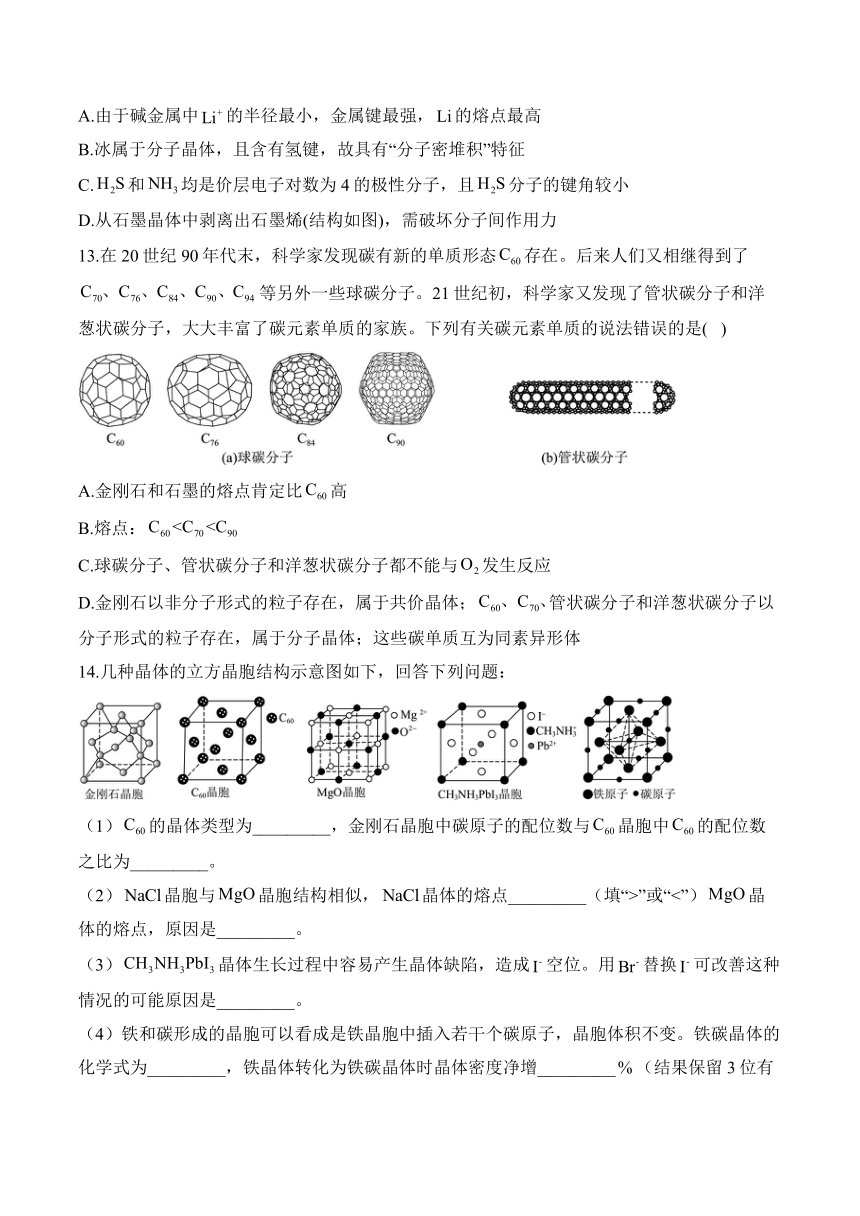
14.几种晶体的立方晶胞结构示意图如下,回答下列问题:
(1)的晶体类型为_________,金刚石晶胞中碳原子的配位数与晶胞中的配位数之比为_________。
(2)晶胞与晶胞结构相似,晶体的熔点_________(填“>”或“<”)晶体的熔点,原因是_________。
(3)晶体生长过程中容易产生晶体缺陷,造成空位。用替换可改善这种情况的可能原因是_________。
(4)铁和碳形成的晶胞可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为_________,铁晶体转化为铁碳晶体时晶体密度净增_________(结果保留3位有效数字)。
15.锡在公元前约2100年就已经被人类发现,锡有2种主要的同素异形体:白锡和灰锡。
(1)基态锡原子的价电子排布式为________。
(2)粗锡的冶炼反应为:。元素电负性从大到小的顺序为________。
(3)白锡与热碱溶液反应生成羟基配合物,此配合物中的配位原子为________,配位数为________。
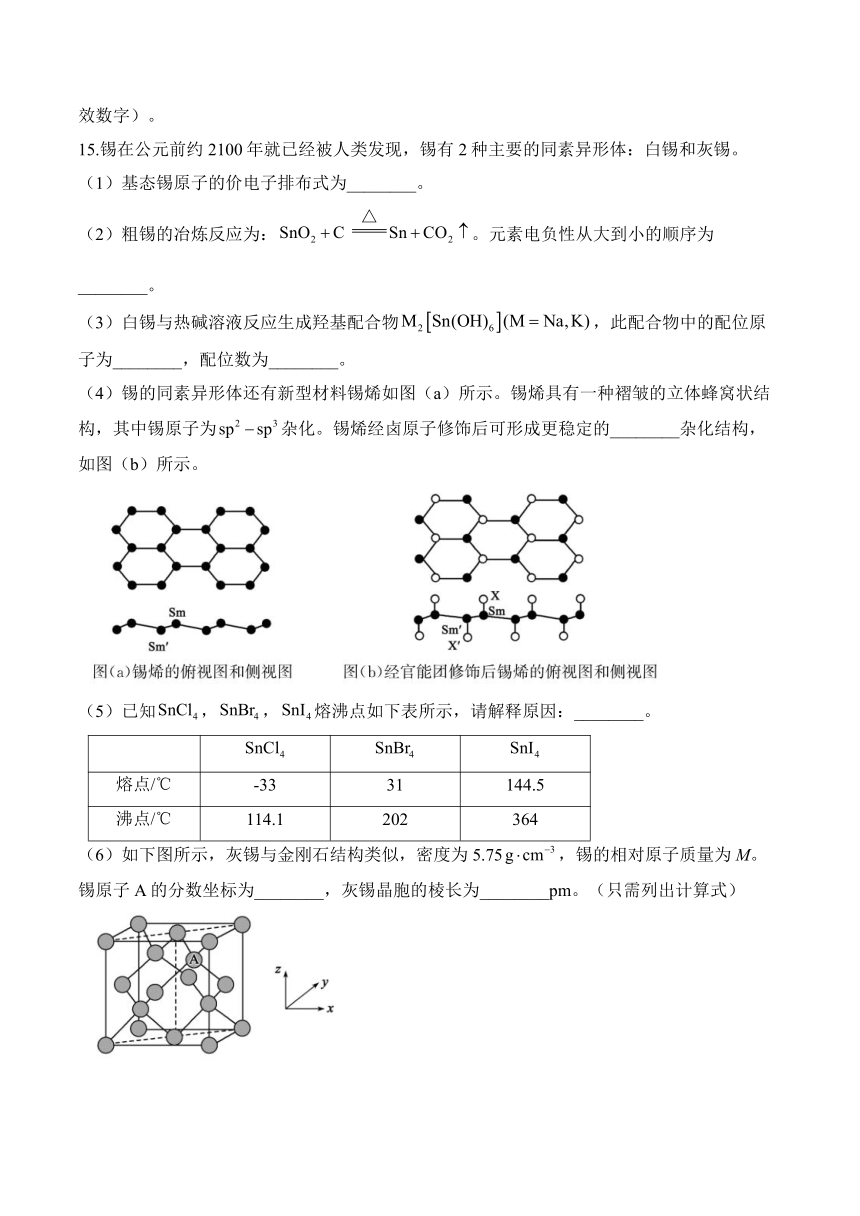
(4)锡的同素异形体还有新型材料锡烯如图(a)所示。锡烯具有一种褶皱的立体蜂窝状结构,其中锡原子为杂化。锡烯经卤原子修饰后可形成更稳定的________杂化结构,如图(b)所示。
(5)已知,,熔沸点如下表所示,请解释原因:________。
熔点/℃ -33 31 144.5
沸点/℃ 114.1 202 364
(6)如下图所示,灰锡与金刚石结构类似,密度为5.75,锡的相对原子质量为M。锡原子A的分数坐标为________,灰锡晶胞的棱长为________pm。(只需列出计算式)
答案以及解析
1.答案:D
解析:蔗糖为分子晶体,晶体硅为共价晶体,氧化镁为离子晶体,生铁为铁合金,属于金属晶体,则蔗糖熔点最低;故选D。
2.答案:B
解析:甲烷属于气态氢化物,其分子之间依靠分子间作用力结合形成分子晶体,B正确。
3.答案:B
解析:不是化合物,A错误;、、均为化合物且都是分子晶体,B正确;是共价晶体,C错误;、是离子晶体,D错误。
4.答案:A
解析:共价晶体的熔、沸点较高,分子晶体的熔、沸点较低,由图可知,D的沸点很高,H的沸点较低,所以D可能为共价晶体,H可能为分子晶体,A正确;单质中不可能含有离子键,所以B、G不可能是离子晶体,B、D错误;金属晶体的熔、沸点有的很高,有的较低,而分子晶体熔、沸点普遍较低,由图可知,F的沸点较低,则F不一定是金属晶体,可能是分子晶体,C错误。
5.答案:D
解析:冰晶胞内水分子间以氢键结合,A错误;冰晶胞中水分子的空间排列方式与金刚石晶胞类似,由金刚石晶胞结构图可知,每个金刚石晶胞中含有的C原子个数,故每个冰晶胞平均含有的水分子数也为8,B错误;水分子间的氢键具有方向性和饱和性,C错误;冰中氢键的作用能为,而冰的熔化热为,说明冰熔化为液态水时只是破坏了一部分氢键,液态水中仍存在氢键,D正确。
6.答案:C
解析:A.由晶胞结构可知,NaCl晶胞中以体心为例,周围紧邻的位于面心,个数为6,故A项正确;
B.干冰晶胞中分子之间存在范德华力,金刚石晶胞中碳原子间的作用为共价键,其作用力不同,故B项正确;
C.若金刚石的晶胞边长为acm,其中两个最近的碳原子之间的距离为晶胞体对角线长度的,即acm,故C项错误;
D.由晶胞结构可知,Cu晶胞在xy平面的投影图为:,故本题选C。
7.答案:C
解析:一般来说,共价晶体的沸点高于离子晶体,离子晶体高于分子晶体。分子晶体若有分子间氢键,则沸点较高,若无氢键,则相对分子质量越大,沸点越高。
是共价晶体,沸点最高,NaCl是离子晶体,沸点次之,HF、HCl、都是分子晶体,沸点较低,且常温下均为气体,HF分子间有氢键,沸点高于HCl和,HCl的相对分子质量大于,所以其沸点高于,所以、NaCl、HF、HCl、沸点由高到低的顺序为、NaCl、HF、HCl、,故选C。
8.答案:B
解析:A.干冰晶体中,位于顶点的二氧化碳与位于面心的二氧化碳的距离最近,则每个二氧化碳周围紧邻12个二氧化碳,故A正确;
B.氯化钠晶体中,位于顶点的氯离子与位于面心的氯离子的距离最近,则每个氯离子周围紧且邻距离相等的氯离子共有12个,故B错误;
C.氯化铯晶体中,位于体心的铯离子与位于顶点的氯离子的距离最近,则每个铯离子周围紧邻8个氯离子,故C正确;
D.金刚石为共价晶体,晶体的空间结构为三维骨架结构,由共价键形成的碳原子环中,最小的环有6个碳原子,故D正确;
故选B。
9.答案:A
解析:题述反应的物质中为离子晶体,为共价晶体,与为分子晶体,所以涉及的晶体类型中没有金属晶体,故答案选A。
10.答案:B
解析:A.同素异形体的物理性质不相同,A错误;
B.组成元素都为碳元素,充分燃烧的产物都为,B正确;
C.石墨能导电,但石墨属于混合晶体,C错误;
D.分子中含键和键,D错误;
答案选B。
11.答案:D
解析:A.由图知,在NaCl晶体中,距最近的有6个、6个形成正八面体,A正确;
B.在晶体中,位于顶点和面心,每个晶胞平均占有数目为,B正确;
C.由图知,在晶体中,每个周围等距且紧邻的有12个,C正确;
D.该气态团簇分子的分子含有4个E和4个F原子,则该态团簇分子的分子式为或,D错误;
答案选D。
12.答案:B
解析:A.碱金属中的电子层数最少,的半径最小,金属键最强,所以碱金属中的熔点最高,A正确;
B.分子间作用力只是范德华力的分子晶体具有“分子密堆积”特征,冰属于分子晶体,但水分子之间的主要作用力是氢键(当然也存在范德华力),不具有“分子密堆积”特征,B错误;
C.和均是价层电子对数为4的极性分子,和分别含有2对、1对孤电子对,孤电子对数越多,孤电子对对成键电子对的排斥力越大,键角越小,故分子的键角较小,C正确;
D.石墨晶体是层状结构,层与层之间通过分子间作用力维系,所以从石墨中剥离石墨烯,需要破坏分子间作用力,D正确;
13.答案:C
解析:A.金刚石属于共价晶体,石墨属于混合型晶体,属于分子晶体,因此金刚石和石墨的熔点肯定比高,A正确;
B.分子晶体的相对分子质量越大,熔点越高,因此熔点:,B正确;
C.球碳分子、管状碳分子和洋葱状碳分子都能在中燃烧生成,C错误;
D.金刚石属于共价晶体;管状碳分子和洋葱状碳分子分子晶体,这些碳单质互为同素异形体,D正确;
故选C。
14.答案:(1)分子晶体;1:3
(2)<;镁离子半径小于钠离子,所带电荷数大于钠离子,氧离子半径小于氯离子,所带电荷数大于氯离子,故MgO晶体中离子键强与NaCl晶体
(3)半径小于,使阴离子和阳离子间的距离变小、作用力增强
(4)FeC;21.4
解析:(1)的晶体类型为:分子晶体;金刚石晶胞中碳原子的配位数4,晶胞中的配位数为12,故金刚石晶胞中碳原子的配位数与晶胞中的配位数之比为1:3;
(2)镁离子半径小于钠离子,所带电荷数大于钠离子,氧离子半径小于氯离子,所带电荷数大于氯离子,故MgO晶体中离子键强与NaCl晶体,晶体的熔点<晶体的熔点;
(3)半径小于,使阴离子和阳离子间的距离变小、作用力增强,可以改善晶体生长过程中产生晶体缺陷;
(4)Fe原子位于顶点和面心,个数为:,C原子位于棱上和内部,个数为:,故晶体的化学式为FeC;密度增加是由于碳原子增加,一个晶胞中含铁原子4个,C原子4个,密度增加的百分比为:。
15.答案:(1)
(2)
(3)O;6
(4)
(5)都是分子晶体,相对分子质量大,范德华力大,熔沸点高
(6);
解析:(1)是第五周期第IVA元素,原子最外层有4个电子,故基态原子的价电子排布式是;
(2)在该反应中涉及到的元素有Sn、C、,素的金属性越强,吸引电子能力就越弱,元素的电负性就越小。一般情况下金属元素的电负性小于非金属元素的电负性。同一周期主族元素,原子序数越大,元素的电负性就越大。所以Sn、C、三种元素的电负性从大到小的顺序为:;
(3)在该化合物中,中心原子是,配位体是,配位原子是O,配位数是6;
(4)锡烯具有一种褶皱的立体蜂窝状结构,其中原子为杂化。当锡烯经卤原子修饰后可形成更稳定的杂化的是图(b)结构;
(5),,都是由分子通过分子间作用力构成的分子晶体。它们的结构相似。物质的相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化、气化消耗的能量就越高,物质的熔沸点就越高,所以物质的熔沸点:物质熔沸点高低顺序为;
(6)根据A在晶胞的位置可知A点坐标为:,在该晶胞中含有原子数目是,由于的相对原子质量为M,假设晶胞的棱长为,其密度为,故。
1.下列晶体的熔点最低的是( )
A. B.生铁 C.晶体硅 D.蔗糖
2.“可燃冰”的主要成分是甲烷与水分子的结晶水合物。其晶体类型是( )
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
3.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
A.、、 B.,、
C.、、 D.,、
4.几种单质的沸点如图所示。下列推断正确的是( )
A.D可能为共价晶体,H可能为分子晶体
B.G可能为离子晶体
C.F一定是金属晶体
D.B一定是离子晶体
5.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,金刚石晶胞结构如图所示。下列有关冰晶胞的说法正确的是( )
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞中平均含有4个水分子
C.水分子间的氢键无方向性和饱和性
D.实验测得冰中氢键的作用力为,而冰的熔化热为,这说明冰融化成水,氢键部分被破坏
6.几种常见晶体的晶胞结构如图所示。下列说法错误的是( )
晶胞 晶胞
金刚石晶胞 晶胞
A.晶胞中周围紧邻的的个数为6
B.干冰晶胞与金刚石晶胞中微粒间作用力不同
C.若金刚石的晶胞边长为,其中两个最近的碳原子之间的距离为
D.晶胞在平面的投影图为:
7.下列各组化合物按其沸点由高到低的顺序排列,正确的是( )
A.、、、、
B.、、、、
C.、、、、
D.、、、、
8.下列有关晶体的叙述中,错误的是( )
A.干冰晶体中,每个周围紧邻12个
B.氯化钠晶体中,每个周围紧邻且距离相等的共有6个
C.氯化铯晶体中,每个周围紧邻8个
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环有6个碳原子
9.工业上制备四氢硼钠的原理为。上述反应中的物质没有涉及的晶体类型是( )
A.金属晶体 B.共价晶体 C.分子晶体 D.离子晶体
10.下列物质的有关叙述正确的是( )
A.它们的物理性质相同 B.它们充分燃烧后的产物相同
C.石墨能导电故属于金属晶体 D.分子中仅含键
11.下列说法中不正确的是( )
A.在 NaCl 晶体中,距 最近的形成正八面体
B.在晶体中,每个晶胞平均占有 4 个
C.在晶体中,每个周围等距且紧邻的有 12 个
D.E 和 F 形成的气态团簇分子的分子式为 EF 或 FE
12.下列有关物质结构和性质的说法错误的是( )
A.由于碱金属中的半径最小,金属键最强,的熔点最高
B.冰属于分子晶体,且含有氢键,故具有“分子密堆积”特征
C.和均是价层电子对数为4的极性分子,且分子的键角较小
D.从石墨晶体中剥离出石墨烯(结构如图),需破坏分子间作用力
13.在20世纪90年代末,科学家发现碳有新的单质形态存在。后来人们又相继得到了等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是( )
A.金刚石和石墨的熔点肯定比高
B.熔点:
C.球碳分子、管状碳分子和洋葱状碳分子都不能与发生反应
D.金刚石以非分子形式的粒子存在,属于共价晶体;管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质互为同素异形体
14.几种晶体的立方晶胞结构示意图如下,回答下列问题:
(1)的晶体类型为_________,金刚石晶胞中碳原子的配位数与晶胞中的配位数之比为_________。
(2)晶胞与晶胞结构相似,晶体的熔点_________(填“>”或“<”)晶体的熔点,原因是_________。
(3)晶体生长过程中容易产生晶体缺陷,造成空位。用替换可改善这种情况的可能原因是_________。
(4)铁和碳形成的晶胞可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为_________,铁晶体转化为铁碳晶体时晶体密度净增_________(结果保留3位有效数字)。
15.锡在公元前约2100年就已经被人类发现,锡有2种主要的同素异形体:白锡和灰锡。
(1)基态锡原子的价电子排布式为________。
(2)粗锡的冶炼反应为:。元素电负性从大到小的顺序为________。
(3)白锡与热碱溶液反应生成羟基配合物,此配合物中的配位原子为________,配位数为________。
(4)锡的同素异形体还有新型材料锡烯如图(a)所示。锡烯具有一种褶皱的立体蜂窝状结构,其中锡原子为杂化。锡烯经卤原子修饰后可形成更稳定的________杂化结构,如图(b)所示。
(5)已知,,熔沸点如下表所示,请解释原因:________。
熔点/℃ -33 31 144.5
沸点/℃ 114.1 202 364
(6)如下图所示,灰锡与金刚石结构类似,密度为5.75,锡的相对原子质量为M。锡原子A的分数坐标为________,灰锡晶胞的棱长为________pm。(只需列出计算式)
答案以及解析
1.答案:D
解析:蔗糖为分子晶体,晶体硅为共价晶体,氧化镁为离子晶体,生铁为铁合金,属于金属晶体,则蔗糖熔点最低;故选D。
2.答案:B
解析:甲烷属于气态氢化物,其分子之间依靠分子间作用力结合形成分子晶体,B正确。
3.答案:B
解析:不是化合物,A错误;、、均为化合物且都是分子晶体,B正确;是共价晶体,C错误;、是离子晶体,D错误。
4.答案:A
解析:共价晶体的熔、沸点较高,分子晶体的熔、沸点较低,由图可知,D的沸点很高,H的沸点较低,所以D可能为共价晶体,H可能为分子晶体,A正确;单质中不可能含有离子键,所以B、G不可能是离子晶体,B、D错误;金属晶体的熔、沸点有的很高,有的较低,而分子晶体熔、沸点普遍较低,由图可知,F的沸点较低,则F不一定是金属晶体,可能是分子晶体,C错误。
5.答案:D
解析:冰晶胞内水分子间以氢键结合,A错误;冰晶胞中水分子的空间排列方式与金刚石晶胞类似,由金刚石晶胞结构图可知,每个金刚石晶胞中含有的C原子个数,故每个冰晶胞平均含有的水分子数也为8,B错误;水分子间的氢键具有方向性和饱和性,C错误;冰中氢键的作用能为,而冰的熔化热为,说明冰熔化为液态水时只是破坏了一部分氢键,液态水中仍存在氢键,D正确。
6.答案:C
解析:A.由晶胞结构可知,NaCl晶胞中以体心为例,周围紧邻的位于面心,个数为6,故A项正确;
B.干冰晶胞中分子之间存在范德华力,金刚石晶胞中碳原子间的作用为共价键,其作用力不同,故B项正确;
C.若金刚石的晶胞边长为acm,其中两个最近的碳原子之间的距离为晶胞体对角线长度的,即acm,故C项错误;
D.由晶胞结构可知,Cu晶胞在xy平面的投影图为:,故本题选C。
7.答案:C
解析:一般来说,共价晶体的沸点高于离子晶体,离子晶体高于分子晶体。分子晶体若有分子间氢键,则沸点较高,若无氢键,则相对分子质量越大,沸点越高。
是共价晶体,沸点最高,NaCl是离子晶体,沸点次之,HF、HCl、都是分子晶体,沸点较低,且常温下均为气体,HF分子间有氢键,沸点高于HCl和,HCl的相对分子质量大于,所以其沸点高于,所以、NaCl、HF、HCl、沸点由高到低的顺序为、NaCl、HF、HCl、,故选C。
8.答案:B
解析:A.干冰晶体中,位于顶点的二氧化碳与位于面心的二氧化碳的距离最近,则每个二氧化碳周围紧邻12个二氧化碳,故A正确;
B.氯化钠晶体中,位于顶点的氯离子与位于面心的氯离子的距离最近,则每个氯离子周围紧且邻距离相等的氯离子共有12个,故B错误;
C.氯化铯晶体中,位于体心的铯离子与位于顶点的氯离子的距离最近,则每个铯离子周围紧邻8个氯离子,故C正确;
D.金刚石为共价晶体,晶体的空间结构为三维骨架结构,由共价键形成的碳原子环中,最小的环有6个碳原子,故D正确;
故选B。
9.答案:A
解析:题述反应的物质中为离子晶体,为共价晶体,与为分子晶体,所以涉及的晶体类型中没有金属晶体,故答案选A。
10.答案:B
解析:A.同素异形体的物理性质不相同,A错误;
B.组成元素都为碳元素,充分燃烧的产物都为,B正确;
C.石墨能导电,但石墨属于混合晶体,C错误;
D.分子中含键和键,D错误;
答案选B。
11.答案:D
解析:A.由图知,在NaCl晶体中,距最近的有6个、6个形成正八面体,A正确;
B.在晶体中,位于顶点和面心,每个晶胞平均占有数目为,B正确;
C.由图知,在晶体中,每个周围等距且紧邻的有12个,C正确;
D.该气态团簇分子的分子含有4个E和4个F原子,则该态团簇分子的分子式为或,D错误;
答案选D。
12.答案:B
解析:A.碱金属中的电子层数最少,的半径最小,金属键最强,所以碱金属中的熔点最高,A正确;
B.分子间作用力只是范德华力的分子晶体具有“分子密堆积”特征,冰属于分子晶体,但水分子之间的主要作用力是氢键(当然也存在范德华力),不具有“分子密堆积”特征,B错误;
C.和均是价层电子对数为4的极性分子,和分别含有2对、1对孤电子对,孤电子对数越多,孤电子对对成键电子对的排斥力越大,键角越小,故分子的键角较小,C正确;
D.石墨晶体是层状结构,层与层之间通过分子间作用力维系,所以从石墨中剥离石墨烯,需要破坏分子间作用力,D正确;
13.答案:C
解析:A.金刚石属于共价晶体,石墨属于混合型晶体,属于分子晶体,因此金刚石和石墨的熔点肯定比高,A正确;
B.分子晶体的相对分子质量越大,熔点越高,因此熔点:,B正确;
C.球碳分子、管状碳分子和洋葱状碳分子都能在中燃烧生成,C错误;
D.金刚石属于共价晶体;管状碳分子和洋葱状碳分子分子晶体,这些碳单质互为同素异形体,D正确;
故选C。
14.答案:(1)分子晶体;1:3
(2)<;镁离子半径小于钠离子,所带电荷数大于钠离子,氧离子半径小于氯离子,所带电荷数大于氯离子,故MgO晶体中离子键强与NaCl晶体
(3)半径小于,使阴离子和阳离子间的距离变小、作用力增强
(4)FeC;21.4
解析:(1)的晶体类型为:分子晶体;金刚石晶胞中碳原子的配位数4,晶胞中的配位数为12,故金刚石晶胞中碳原子的配位数与晶胞中的配位数之比为1:3;
(2)镁离子半径小于钠离子,所带电荷数大于钠离子,氧离子半径小于氯离子,所带电荷数大于氯离子,故MgO晶体中离子键强与NaCl晶体,晶体的熔点<晶体的熔点;
(3)半径小于,使阴离子和阳离子间的距离变小、作用力增强,可以改善晶体生长过程中产生晶体缺陷;
(4)Fe原子位于顶点和面心,个数为:,C原子位于棱上和内部,个数为:,故晶体的化学式为FeC;密度增加是由于碳原子增加,一个晶胞中含铁原子4个,C原子4个,密度增加的百分比为:。
15.答案:(1)
(2)
(3)O;6
(4)
(5)都是分子晶体,相对分子质量大,范德华力大,熔沸点高
(6);
解析:(1)是第五周期第IVA元素,原子最外层有4个电子,故基态原子的价电子排布式是;
(2)在该反应中涉及到的元素有Sn、C、,素的金属性越强,吸引电子能力就越弱,元素的电负性就越小。一般情况下金属元素的电负性小于非金属元素的电负性。同一周期主族元素,原子序数越大,元素的电负性就越大。所以Sn、C、三种元素的电负性从大到小的顺序为:;
(3)在该化合物中,中心原子是,配位体是,配位原子是O,配位数是6;
(4)锡烯具有一种褶皱的立体蜂窝状结构,其中原子为杂化。当锡烯经卤原子修饰后可形成更稳定的杂化的是图(b)结构;
(5),,都是由分子通过分子间作用力构成的分子晶体。它们的结构相似。物质的相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化、气化消耗的能量就越高,物质的熔沸点就越高,所以物质的熔沸点:物质熔沸点高低顺序为;
(6)根据A在晶胞的位置可知A点坐标为:,在该晶胞中含有原子数目是,由于的相对原子质量为M,假设晶胞的棱长为,其密度为,故。
