(21)3.3液晶、纳米材料与超分子__高二化学鲁科版(2019)选择性必修二同步课时作业(含解析)
文档属性
| 名称 | (21)3.3液晶、纳米材料与超分子__高二化学鲁科版(2019)选择性必修二同步课时作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 725.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 16:13:01 | ||
图片预览




文档简介
(21)3.3液晶、纳米材料与超分子——高二化学鲁科版(2019)选择性必修二同步课时作业
1.下列关于液晶的说法中,正确的是( )。
A.液晶是液体和晶体的混合物
B.液晶是一种晶体
C.液晶分子在特定方向排列比较整齐,但不稳定
D.所有物质在一定条件下都能成为液晶
2.目前热门的机器人材料液晶弹性体是一种智能材料,在外界刺激下,其相态或分子结构会产生变化,进而改变液晶基元的排列顺序,从而导致材料本身发生宏观形变,当撤去外界刺激后,液晶弹性体可以恢复到原来的形状。下列说法错误的是( )
A.该液晶同时具有各向异性和弹性
B.这种液晶弹性体机器人可以采用热、光、电、磁等进行驱动
C.该液晶弹性体具有形状记忆功能
D.液晶是介于液态和固态之间的物质状态,而固体是晶体
3.1925年贝尔德在英国首次成功装配世界第一台电视机,短短几十年时间,电视机经历了从黑白到彩色,从手动到遥控,从平板电视机到液晶电视机的发展历程。下列关于液晶的叙述中,错误的是( )
A.液晶是物质的一种聚集状态
B.液晶具有流动性
C.液晶和液态是物质的同一种聚集状态
D.液晶具有各向异性
4.关于超分子,说法错误的是( )
A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.冠醚识别钾离子反映了超分子的“自组装”的特征
C.冠醚识别碱金属离子反映了超分子的“分子识别”的特征
D.利用超分子的分子识别特征,可以用“杯酚”和甲苯、氯仿等分离和
5.下列说法不正确的是( )
A.激光、焰火都与电子跃迁释放能量有关
B.可燃冰中甲烷与水分子间存在氢键
C.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别”
D.晶体的自范性是晶体在微观空间呈周期性有序排列的宏观表象
6.下列关于配合物和超分子的说法正确的是( )
A.冠醚有不同大小的空穴,可识别直径不同的碱金属离子
B.在中,给出孤电子对,提供空轨道
C.利用“杯酚”可分离和是因为超分子具有“自组装”的特征
D.中存在的化学键有离子键、配位键、极性键和氢键
7.下列有关化学概念或性质的判断正确的是( )
A.石英玻璃和水晶的X射线衍射图谱不同
B.冠醚与通过共价键连接得到超分子
C.相同条件下,乙烯和乙烷断裂1 mol C—H键吸收的能量相等
D.胸腺嘧啶核苷酸等多种核苷酸脱水缩合形成RNA的反应是缩聚反应
8.冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与形成的螯合离子的结构如图所示。下列说法错误的是( )
A.该螯合离子所形成的物质是离子晶体,晶体中存在离子键、极性键、非极性键。
B.该螯合离子有4种一氯代物,中心离子的配位数为6
C.该螯合离子有分子识别和自组装的功能
D.该螯合离子中C原子杂化方式有2种,6个O原子与可能在同一平面上
9.有前景的下一代储能铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下:
下列说法错误的是( )
A.化合物Ⅱ中阴、阳离子的空间构型均为正四面体
B.化合物Ⅱ中C、N原子的杂化轨道类型相同
C.化合物Ⅲ中O、F、S电负性顺序:F>O>S
D.化合物I、Ⅱ、Ⅲ均熔点低、难挥发
10.下列说法正确的是( )
A.金刚石莫氏硬度很大,经得起锤击,可用于切割玻璃
B.等离子体中含有带电粒子且能自由移动,可用于化学合成和材料表面改性
C.超分子具有分子识别特性,用冠醚(冠)可识别所有的碱金属离子
D.液晶属于晶态物质,具有晶体的各向异性,广泛应用于手机、电脑等显示器
11.冠醚与碱金属离子()可形成如图所示超分子。
下列有关叙述错误的是( )
A.图示杂化方式为的原子有两种
B.图示冠醚空腔中适配的碱金属离子从左往右顺序为:
C.向溶液中加入冠谜(冠)可加快其与乙烯的反应
D.图示超分子中的碳原子均在同一平面
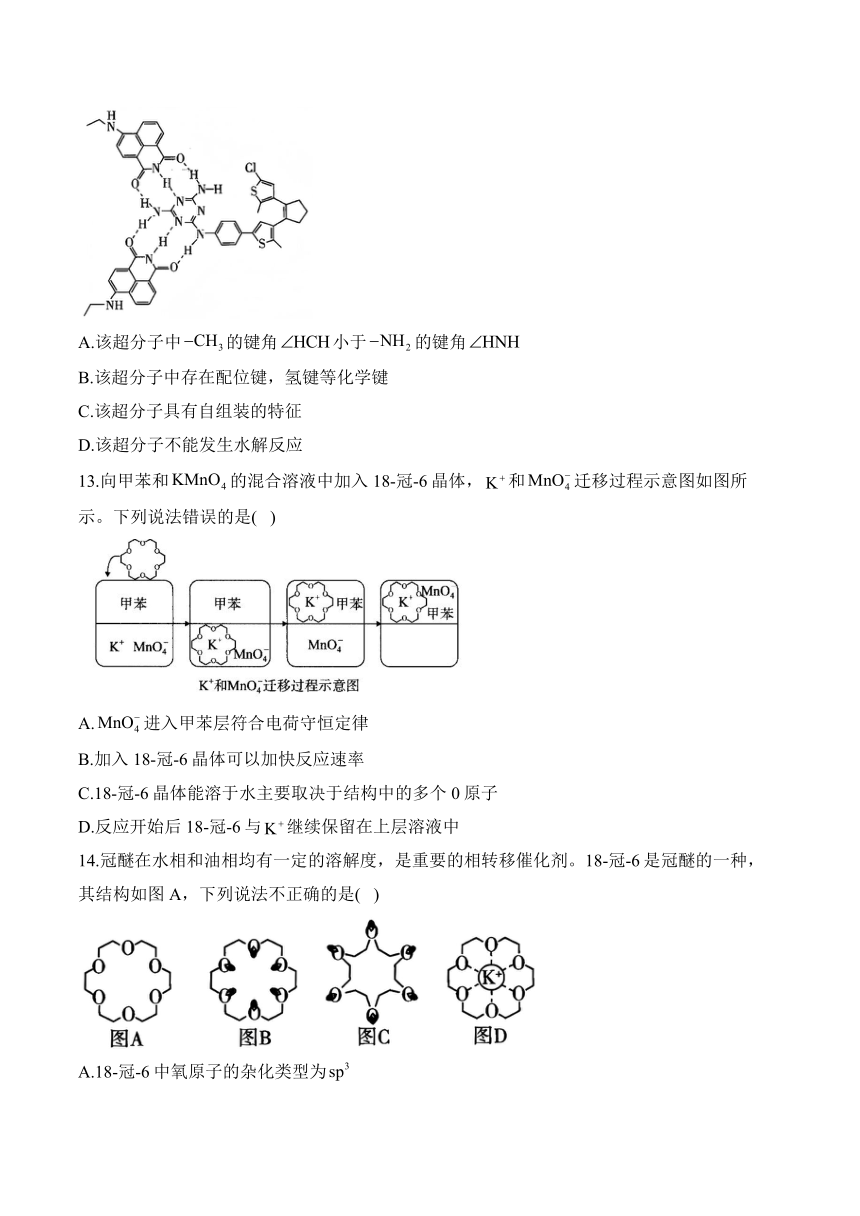
12.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。某种超分子的结构如图所示。下列有关说法正确的是( )
A.该超分子中的键角小于的键角
B.该超分子中存在配位键,氢键等化学键
C.该超分子具有自组装的特征
D.该超分子不能发生水解反应
13.向甲苯和的混合溶液中加入18-冠-6晶体,和迁移过程示意图如图所示。下列说法错误的是( )
A.进入甲苯层符合电荷守恒定律
B.加入18-冠-6晶体可以加快反应速率
C.18-冠-6晶体能溶于水主要取决于结构中的多个0原子
D.反应开始后18-冠-6与继续保留在上层溶液中
14.冠醚在水相和油相均有一定的溶解度,是重要的相转移催化剂。18-冠-6是冠醚的一种,其结构如图A,下列说法不正确的是( )
A.18-冠-6中氧原子的杂化类型为
B.表示18-冠-6在油相中结构的是图B而不是图C
C.图D中与18-冠-6的空腔大小相近,且与氧原子之间通过弱相互作用形成稳定的超分子结构,体现超分子的分子识别功能
D.若18-冠-6的部分氢原子被氟原子取代,与形成的超分子稳定性将增强
15.请回答下列问题:
(1)下列各组物质中,互为同系物的有________,互为同分异构体的有________。(填序号)
①和
②白磷与红磷
③和
④对二甲苯和乙苯
⑤和
⑥和
⑦2,2-二用基丁烷与戊烷
⑧金刚石、石墨、
⑨和
(2)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。A的结构简式为________。1个A分子中最多有________个原子可以处于同一平面。
(3)冠醚是一系列重要的有机物质,可以与碱金属离子形成超分子,从而进行“分子识别”,如(21-冠-7)。
①冠醚通过________(填标号)与碱金属离子结合,体现了超分子“分子识别”的特征。
A.离子键
B.配位键
C.范德华力
D.氢键
②冠醚环的大小与金属离子匹配,其中21-冠-7空腔直径为,则与之匹配的碱金属离子为________。
A.直径:204pm B.直径:276pm
C.直径:304pm D.直径:334pm
(4)金属钛被誉为“未来金属”,工业上电解熔融制备钛,使用无法制备。已知和的熔沸点数据如下表所示,试解释的熔沸点高于的原因:________。
物质
熔点/℃ -25.0 1840
沸点/℃ 136.4 2900
(5)一种的四方晶胞(晶胞棱边夹角均为)如上图所示,上述晶胞沿z轴方向的投影图为________(填标号)。
A. B. C. D.
答案以及解析
1.答案:C
解析:液晶是在一定温度范围内既具有液体的可流动性,又表现出类似晶体的各向异性的一类物质,不是液体与晶体的混合物,它既不同于非晶体又不同于晶体,故A、B错误;在特定条件如外加电场作用下,液晶分子排列整齐,一旦移去电场又恢复原状,所以液晶分子不稳定,故C正确;并不是所有物质都具有液晶态,故D错误。
2.答案:D
解析:由题意可知,该液晶同时具有各向异性和弹性,A正确;在外界刺激下,其相态或分子结构会产生变化,故B正确;撤去外界刺激后,液晶弹性体可以恢复到原来的形状,则该液晶弹性体具有形状记忆功能,C正确;液晶是介于液态和晶态之间的物质状态,不是介于液态和固态之间的状态,D错误。
3.答案:C
解析:A.液晶是介于液态和晶态之间的一种特殊的聚集状态,A正确;
B.液晶是液态晶体的简称,具有液体的流动性,,B正确;
C.液晶是介于液态和晶态之间的一种特殊的聚集状态,C错误;
D.液晶是液态晶体的简称,具有晶体的各向异性,D正确;
故选:C。
4.答案:B
解析:A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体,超分子这种聚集体,有的是有限的,有的是无限伸展的,故A正确;
B.冠醚识别钾离子反映了超分子的“分子识别”的特征,故B错误;
C.冠醚是一种超分子,可以识别碱金属离子,反映了超分子的“分子识别”的特征,故C正确;
D.“杯酚”和甲苯、氯仿都是超分子,可以利用超分子的分子识别特征,对和进行分离,故D正确。
综上所述,答案为B。
5.答案:B
解析:A.电子在基态和激发态之间的跃迁会引起能量的变化,并以光的形式体现,所以激光、焰火都与原子核外电子跃迁释放能量有关,故A正确;B.碳的电负性较小,甲烷分子与水分子间不能形成氢键,只存在分子间作用力,故B错误;C.冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子,从而能对碱金属离子进行“分子识别”,故C正确;D.晶体的自范性是指:在适宜的条件下,晶体能够自发地呈现封闭的规则和凸面体外形的性质,晶体的自范性是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象,故D正确;故选:B。
6.答案:A
解析:A.冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子,故A正确;
B.在中,给出孤电子对,提供空轨道,故B错误;
C.“杯酚”与不能形成超分子,“杯酚”能与和形成超分子,反映出超分子具有“分子识别”的特征,故C错误;
D.氢键是分子间作用力,不是化学键,故D错误;故选A。
7.答案:A
解析:石英玻璃是非晶体,水晶是晶体,在X射线衍射实验中,二者的图谱不同,A正确;冠醚与通过非共价键结合形成超分子,B错误;乙烯中的C—H键为键,乙烷中的C—H键为键,两种C—H键的键长不同,键能不同,C错误;RNA分子中的含氮碱基没有胸腺嘧啶,D错误。
8.答案:D
解析:A.螯合阳离子和阴离子结合形成离子晶体,阴阳离子间存在离子键,阳离子中存在C—H极性键和C—C非极性键,A项正确;
B.螯合离子上下对称、左右对称,只有如图4种等效氢,,的配位数为6,如图中“→”所示,B项正确;
C.分子识别和自组装是超分子的两大特征,C项正确;
D.螯合离子中,除苯环外,碳原子、氧原子均为杂化,不可能在同一平面上,D项错误;
故选D。
9.答案:A
解析:A.由图可知Ⅱ中阳离子中心N原子分别与3个甲基和1个氢原子相连,即价层电子对数为4对,没有孤电子对,因此阳离子的空间构型为四面体,并非正四面体,的中心原子Al的价层电子对数为:,没有孤电子对,因此空间构型为正四面体,故A错误;
B.化合物Ⅱ中C、N原子均是连接的四根单键,即价层电子对数为4对,因此杂化轨道类型均是杂化,故B正确;
C.同周期主族元素从左往右电负性逐渐增大,同主族从上往下电负性逐渐减小,因此O、F、S电负性由大到小的顺序为:,故C正确;
D.离子化合物中,离子半径越大,离子所带电荷数越小,则离子键越弱,离子键越弱则熔沸点越低,离子液体所含的离子键半径大,离子键弱,因此熔点低,而由于离子液体是由有机阳离子和无机阴离子组成,形成稳定的离子键,与传统有机溶剂相比,离子液体中的阳离子和阴离子的结合更加牢固,难以分离,从而保持了低挥发性的特点,故D正确;故答案选A。
10.答案:B
解析:A.金刚石的莫氏硬度很大,锤击易碎因此经不起锤击,可用于切割玻璃,A错误;
B. 等离子体,是由部分电子被剥夺后的原子及原子团被电离后产生的正负离子组成的离子化气体状物质。因此等离子体中含有带电粒子且能自由移动,可用于化学合成和材料表面改性,B正确;
C.超分子具有分子识别特性,用冠醚(冠)只能识别半径大小合适的碱金属离子,C错误;
D.液晶是介于液态和晶态之间的物质,既具有流动性、又有各向异性,不属于晶态物质,D错误;
故选B。
11.答案:D
解析:A.图示中C均形成4个单键,即形成4个键,无孤电子对,O均形成2个单键,即形成2个键,含2对孤电子对,二者的杂化轨道数均为4,杂化类型均为杂化,A正确;
B.电离层数逐渐增多,离子半径逐渐增大,与图示对应,B正确;
C.由图可知,冠醚(18-冠-6)与形成超分子,使存在于其空腔内,进而增大在有机溶剂中的溶解度,加快与乙烯的反应,C正确;
D.超分子中存在杂化的饱和碳原子,存在空间立体结构,碳原子不可能在同一平面,D错误;
答案选D。
12.答案:C
解析:的碳原子为杂化,无孤电子对,的氮原子为杂化,有1个孤电子对,孤电子对与成键电子对之间的排斥力>成键电子对之间的排斥力,的键角大于的键角,A错误;该超分子中无配位键,氢键是较强的分子间作用力,不是化学键,B错误;超分子具有自组装的特征,C正确;该超分子中含有酰胺键,碳氯键,能发生水解反应,D错误。
13.答案:D
解析:由题图可知,18-冠-6晶体对有识别作用,18-冠-6与进入甲苯层后,由于静电作用,也会进入上层溶液,促进和甲苯接触反应,加快反应速率,A、B说法正确;18-冠-6晶体既可溶于水,也可溶于甲苯,18-冠-6晶体可溶于水是因为其结构中的多个O原子可与形成分子间氢键,C说法正确;甲苯和发生氧化还原反应后,被还原为,上层溶液中的负电荷减少,迫使18-冠-6与回到下层溶液并将新的迁移至上层溶液中,D说法错误。
14.答案:D
解析:18-冠-6分子中氧原子都形成2个共价键且都存在2个孤电子对,故都采用杂化,A项正确;烃基亲油,O原子亲水,则能表示18-冠-6在油相中结构的是图B,B项正确;冠醚只能与空腔大小相接近的离子形成稳定结构,体现出超分子的分子识别特征,C项正确;F原子电负性比0原子大,吸引电子能力比0原子强,导致O原子电荷密度减小,配位能力降低,与形成的超分子稳定性将减弱,D项错误。
15.答案:(1)⑦⑨;①④
(2);10
(3)①B;②D
(4)为离子晶体,为分子晶体,分子间作用力弱于化学键
(5)B
解析:(1)质子数相同中子数不同的核素互为同位素,同素异形体是由同种元素组成的不同单质,红磷和白磷是组成元素相同、结构不同、性质不同的两种单质,互为同素异形体;结构相似、通式相同、相差个原子团,互为同系物,分子式相同而结构不同的物质互为同分异构体,二溴甲烷是四面体结构,只有一种结构;①和互为同分异构体;②白磷与红磷互为同素异形体;③和互为同位素;④对二甲苯和乙苯互为同分异构体;⑤和是同种物质;⑥和是苯酚和苯甲醇,属于不同类别的物质;⑦2,2-二甲基丁烷与戊烷互为同系物:⑧金刚石、石墨、是同素异形体;⑨和是烷烃,互为同系物:互为同系物的有⑦⑨,互为同分异构体的有①④;
(2)A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为,则有14n=84,n-6,又因为核磁共振氢谱表明分子中只有一种类型的氢,其结构简式应为,由于碳碳双键是平面型结构,而4个甲基与不饱和碳原子又直接相连,通过碳碳单键的旋转,每个甲基上有1个H可以与双键平面共面,即最多有10个原子共面;
(3)①冠醚中O含有孤电子对,碱金属离子有空轨道,冠醚通过配位键与碱金属离子结合,答案为B;②21-冠-7空腔直径为340~430pm,与之匹配的碱金属离子直径应在空腔直径的范围内,只有Cs直径:334pm符合,故答案为D;
(4)已知工业上电解熔融制备钛,使用无法制备,再结合表格数据可以推知,为离子晶体,为分子晶体,分子间作用力弱于化学键,故的熔沸点高于;
(5)晶胞沿z轴方向的投影,其中xy平面内的O和上面的O重合,则该投影图为B。
1.下列关于液晶的说法中,正确的是( )。
A.液晶是液体和晶体的混合物
B.液晶是一种晶体
C.液晶分子在特定方向排列比较整齐,但不稳定
D.所有物质在一定条件下都能成为液晶
2.目前热门的机器人材料液晶弹性体是一种智能材料,在外界刺激下,其相态或分子结构会产生变化,进而改变液晶基元的排列顺序,从而导致材料本身发生宏观形变,当撤去外界刺激后,液晶弹性体可以恢复到原来的形状。下列说法错误的是( )
A.该液晶同时具有各向异性和弹性
B.这种液晶弹性体机器人可以采用热、光、电、磁等进行驱动
C.该液晶弹性体具有形状记忆功能
D.液晶是介于液态和固态之间的物质状态,而固体是晶体
3.1925年贝尔德在英国首次成功装配世界第一台电视机,短短几十年时间,电视机经历了从黑白到彩色,从手动到遥控,从平板电视机到液晶电视机的发展历程。下列关于液晶的叙述中,错误的是( )
A.液晶是物质的一种聚集状态
B.液晶具有流动性
C.液晶和液态是物质的同一种聚集状态
D.液晶具有各向异性
4.关于超分子,说法错误的是( )
A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体
B.冠醚识别钾离子反映了超分子的“自组装”的特征
C.冠醚识别碱金属离子反映了超分子的“分子识别”的特征
D.利用超分子的分子识别特征,可以用“杯酚”和甲苯、氯仿等分离和
5.下列说法不正确的是( )
A.激光、焰火都与电子跃迁释放能量有关
B.可燃冰中甲烷与水分子间存在氢键
C.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别”
D.晶体的自范性是晶体在微观空间呈周期性有序排列的宏观表象
6.下列关于配合物和超分子的说法正确的是( )
A.冠醚有不同大小的空穴,可识别直径不同的碱金属离子
B.在中,给出孤电子对,提供空轨道
C.利用“杯酚”可分离和是因为超分子具有“自组装”的特征
D.中存在的化学键有离子键、配位键、极性键和氢键
7.下列有关化学概念或性质的判断正确的是( )
A.石英玻璃和水晶的X射线衍射图谱不同
B.冠醚与通过共价键连接得到超分子
C.相同条件下,乙烯和乙烷断裂1 mol C—H键吸收的能量相等
D.胸腺嘧啶核苷酸等多种核苷酸脱水缩合形成RNA的反应是缩聚反应
8.冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与形成的螯合离子的结构如图所示。下列说法错误的是( )
A.该螯合离子所形成的物质是离子晶体,晶体中存在离子键、极性键、非极性键。
B.该螯合离子有4种一氯代物,中心离子的配位数为6
C.该螯合离子有分子识别和自组装的功能
D.该螯合离子中C原子杂化方式有2种,6个O原子与可能在同一平面上
9.有前景的下一代储能铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下:
下列说法错误的是( )
A.化合物Ⅱ中阴、阳离子的空间构型均为正四面体
B.化合物Ⅱ中C、N原子的杂化轨道类型相同
C.化合物Ⅲ中O、F、S电负性顺序:F>O>S
D.化合物I、Ⅱ、Ⅲ均熔点低、难挥发
10.下列说法正确的是( )
A.金刚石莫氏硬度很大,经得起锤击,可用于切割玻璃
B.等离子体中含有带电粒子且能自由移动,可用于化学合成和材料表面改性
C.超分子具有分子识别特性,用冠醚(冠)可识别所有的碱金属离子
D.液晶属于晶态物质,具有晶体的各向异性,广泛应用于手机、电脑等显示器
11.冠醚与碱金属离子()可形成如图所示超分子。
下列有关叙述错误的是( )
A.图示杂化方式为的原子有两种
B.图示冠醚空腔中适配的碱金属离子从左往右顺序为:
C.向溶液中加入冠谜(冠)可加快其与乙烯的反应
D.图示超分子中的碳原子均在同一平面
12.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。某种超分子的结构如图所示。下列有关说法正确的是( )
A.该超分子中的键角小于的键角
B.该超分子中存在配位键,氢键等化学键
C.该超分子具有自组装的特征
D.该超分子不能发生水解反应
13.向甲苯和的混合溶液中加入18-冠-6晶体,和迁移过程示意图如图所示。下列说法错误的是( )
A.进入甲苯层符合电荷守恒定律
B.加入18-冠-6晶体可以加快反应速率
C.18-冠-6晶体能溶于水主要取决于结构中的多个0原子
D.反应开始后18-冠-6与继续保留在上层溶液中
14.冠醚在水相和油相均有一定的溶解度,是重要的相转移催化剂。18-冠-6是冠醚的一种,其结构如图A,下列说法不正确的是( )
A.18-冠-6中氧原子的杂化类型为
B.表示18-冠-6在油相中结构的是图B而不是图C
C.图D中与18-冠-6的空腔大小相近,且与氧原子之间通过弱相互作用形成稳定的超分子结构,体现超分子的分子识别功能
D.若18-冠-6的部分氢原子被氟原子取代,与形成的超分子稳定性将增强
15.请回答下列问题:
(1)下列各组物质中,互为同系物的有________,互为同分异构体的有________。(填序号)
①和
②白磷与红磷
③和
④对二甲苯和乙苯
⑤和
⑥和
⑦2,2-二用基丁烷与戊烷
⑧金刚石、石墨、
⑨和
(2)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。A的结构简式为________。1个A分子中最多有________个原子可以处于同一平面。
(3)冠醚是一系列重要的有机物质,可以与碱金属离子形成超分子,从而进行“分子识别”,如(21-冠-7)。
①冠醚通过________(填标号)与碱金属离子结合,体现了超分子“分子识别”的特征。
A.离子键
B.配位键
C.范德华力
D.氢键
②冠醚环的大小与金属离子匹配,其中21-冠-7空腔直径为,则与之匹配的碱金属离子为________。
A.直径:204pm B.直径:276pm
C.直径:304pm D.直径:334pm
(4)金属钛被誉为“未来金属”,工业上电解熔融制备钛,使用无法制备。已知和的熔沸点数据如下表所示,试解释的熔沸点高于的原因:________。
物质
熔点/℃ -25.0 1840
沸点/℃ 136.4 2900
(5)一种的四方晶胞(晶胞棱边夹角均为)如上图所示,上述晶胞沿z轴方向的投影图为________(填标号)。
A. B. C. D.
答案以及解析
1.答案:C
解析:液晶是在一定温度范围内既具有液体的可流动性,又表现出类似晶体的各向异性的一类物质,不是液体与晶体的混合物,它既不同于非晶体又不同于晶体,故A、B错误;在特定条件如外加电场作用下,液晶分子排列整齐,一旦移去电场又恢复原状,所以液晶分子不稳定,故C正确;并不是所有物质都具有液晶态,故D错误。
2.答案:D
解析:由题意可知,该液晶同时具有各向异性和弹性,A正确;在外界刺激下,其相态或分子结构会产生变化,故B正确;撤去外界刺激后,液晶弹性体可以恢复到原来的形状,则该液晶弹性体具有形状记忆功能,C正确;液晶是介于液态和晶态之间的物质状态,不是介于液态和固态之间的状态,D错误。
3.答案:C
解析:A.液晶是介于液态和晶态之间的一种特殊的聚集状态,A正确;
B.液晶是液态晶体的简称,具有液体的流动性,,B正确;
C.液晶是介于液态和晶态之间的一种特殊的聚集状态,C错误;
D.液晶是液态晶体的简称,具有晶体的各向异性,D正确;
故选:C。
4.答案:B
解析:A.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体,超分子这种聚集体,有的是有限的,有的是无限伸展的,故A正确;
B.冠醚识别钾离子反映了超分子的“分子识别”的特征,故B错误;
C.冠醚是一种超分子,可以识别碱金属离子,反映了超分子的“分子识别”的特征,故C正确;
D.“杯酚”和甲苯、氯仿都是超分子,可以利用超分子的分子识别特征,对和进行分离,故D正确。
综上所述,答案为B。
5.答案:B
解析:A.电子在基态和激发态之间的跃迁会引起能量的变化,并以光的形式体现,所以激光、焰火都与原子核外电子跃迁释放能量有关,故A正确;B.碳的电负性较小,甲烷分子与水分子间不能形成氢键,只存在分子间作用力,故B错误;C.冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子,从而能对碱金属离子进行“分子识别”,故C正确;D.晶体的自范性是指:在适宜的条件下,晶体能够自发地呈现封闭的规则和凸面体外形的性质,晶体的自范性是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象,故D正确;故选:B。
6.答案:A
解析:A.冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子,故A正确;
B.在中,给出孤电子对,提供空轨道,故B错误;
C.“杯酚”与不能形成超分子,“杯酚”能与和形成超分子,反映出超分子具有“分子识别”的特征,故C错误;
D.氢键是分子间作用力,不是化学键,故D错误;故选A。
7.答案:A
解析:石英玻璃是非晶体,水晶是晶体,在X射线衍射实验中,二者的图谱不同,A正确;冠醚与通过非共价键结合形成超分子,B错误;乙烯中的C—H键为键,乙烷中的C—H键为键,两种C—H键的键长不同,键能不同,C错误;RNA分子中的含氮碱基没有胸腺嘧啶,D错误。
8.答案:D
解析:A.螯合阳离子和阴离子结合形成离子晶体,阴阳离子间存在离子键,阳离子中存在C—H极性键和C—C非极性键,A项正确;
B.螯合离子上下对称、左右对称,只有如图4种等效氢,,的配位数为6,如图中“→”所示,B项正确;
C.分子识别和自组装是超分子的两大特征,C项正确;
D.螯合离子中,除苯环外,碳原子、氧原子均为杂化,不可能在同一平面上,D项错误;
故选D。
9.答案:A
解析:A.由图可知Ⅱ中阳离子中心N原子分别与3个甲基和1个氢原子相连,即价层电子对数为4对,没有孤电子对,因此阳离子的空间构型为四面体,并非正四面体,的中心原子Al的价层电子对数为:,没有孤电子对,因此空间构型为正四面体,故A错误;
B.化合物Ⅱ中C、N原子均是连接的四根单键,即价层电子对数为4对,因此杂化轨道类型均是杂化,故B正确;
C.同周期主族元素从左往右电负性逐渐增大,同主族从上往下电负性逐渐减小,因此O、F、S电负性由大到小的顺序为:,故C正确;
D.离子化合物中,离子半径越大,离子所带电荷数越小,则离子键越弱,离子键越弱则熔沸点越低,离子液体所含的离子键半径大,离子键弱,因此熔点低,而由于离子液体是由有机阳离子和无机阴离子组成,形成稳定的离子键,与传统有机溶剂相比,离子液体中的阳离子和阴离子的结合更加牢固,难以分离,从而保持了低挥发性的特点,故D正确;故答案选A。
10.答案:B
解析:A.金刚石的莫氏硬度很大,锤击易碎因此经不起锤击,可用于切割玻璃,A错误;
B. 等离子体,是由部分电子被剥夺后的原子及原子团被电离后产生的正负离子组成的离子化气体状物质。因此等离子体中含有带电粒子且能自由移动,可用于化学合成和材料表面改性,B正确;
C.超分子具有分子识别特性,用冠醚(冠)只能识别半径大小合适的碱金属离子,C错误;
D.液晶是介于液态和晶态之间的物质,既具有流动性、又有各向异性,不属于晶态物质,D错误;
故选B。
11.答案:D
解析:A.图示中C均形成4个单键,即形成4个键,无孤电子对,O均形成2个单键,即形成2个键,含2对孤电子对,二者的杂化轨道数均为4,杂化类型均为杂化,A正确;
B.电离层数逐渐增多,离子半径逐渐增大,与图示对应,B正确;
C.由图可知,冠醚(18-冠-6)与形成超分子,使存在于其空腔内,进而增大在有机溶剂中的溶解度,加快与乙烯的反应,C正确;
D.超分子中存在杂化的饱和碳原子,存在空间立体结构,碳原子不可能在同一平面,D错误;
答案选D。
12.答案:C
解析:的碳原子为杂化,无孤电子对,的氮原子为杂化,有1个孤电子对,孤电子对与成键电子对之间的排斥力>成键电子对之间的排斥力,的键角大于的键角,A错误;该超分子中无配位键,氢键是较强的分子间作用力,不是化学键,B错误;超分子具有自组装的特征,C正确;该超分子中含有酰胺键,碳氯键,能发生水解反应,D错误。
13.答案:D
解析:由题图可知,18-冠-6晶体对有识别作用,18-冠-6与进入甲苯层后,由于静电作用,也会进入上层溶液,促进和甲苯接触反应,加快反应速率,A、B说法正确;18-冠-6晶体既可溶于水,也可溶于甲苯,18-冠-6晶体可溶于水是因为其结构中的多个O原子可与形成分子间氢键,C说法正确;甲苯和发生氧化还原反应后,被还原为,上层溶液中的负电荷减少,迫使18-冠-6与回到下层溶液并将新的迁移至上层溶液中,D说法错误。
14.答案:D
解析:18-冠-6分子中氧原子都形成2个共价键且都存在2个孤电子对,故都采用杂化,A项正确;烃基亲油,O原子亲水,则能表示18-冠-6在油相中结构的是图B,B项正确;冠醚只能与空腔大小相接近的离子形成稳定结构,体现出超分子的分子识别特征,C项正确;F原子电负性比0原子大,吸引电子能力比0原子强,导致O原子电荷密度减小,配位能力降低,与形成的超分子稳定性将减弱,D项错误。
15.答案:(1)⑦⑨;①④
(2);10
(3)①B;②D
(4)为离子晶体,为分子晶体,分子间作用力弱于化学键
(5)B
解析:(1)质子数相同中子数不同的核素互为同位素,同素异形体是由同种元素组成的不同单质,红磷和白磷是组成元素相同、结构不同、性质不同的两种单质,互为同素异形体;结构相似、通式相同、相差个原子团,互为同系物,分子式相同而结构不同的物质互为同分异构体,二溴甲烷是四面体结构,只有一种结构;①和互为同分异构体;②白磷与红磷互为同素异形体;③和互为同位素;④对二甲苯和乙苯互为同分异构体;⑤和是同种物质;⑥和是苯酚和苯甲醇,属于不同类别的物质;⑦2,2-二甲基丁烷与戊烷互为同系物:⑧金刚石、石墨、是同素异形体;⑨和是烷烃,互为同系物:互为同系物的有⑦⑨,互为同分异构体的有①④;
(2)A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,则A应为烯烃,设分子式为,则有14n=84,n-6,又因为核磁共振氢谱表明分子中只有一种类型的氢,其结构简式应为,由于碳碳双键是平面型结构,而4个甲基与不饱和碳原子又直接相连,通过碳碳单键的旋转,每个甲基上有1个H可以与双键平面共面,即最多有10个原子共面;
(3)①冠醚中O含有孤电子对,碱金属离子有空轨道,冠醚通过配位键与碱金属离子结合,答案为B;②21-冠-7空腔直径为340~430pm,与之匹配的碱金属离子直径应在空腔直径的范围内,只有Cs直径:334pm符合,故答案为D;
(4)已知工业上电解熔融制备钛,使用无法制备,再结合表格数据可以推知,为离子晶体,为分子晶体,分子间作用力弱于化学键,故的熔沸点高于;
(5)晶胞沿z轴方向的投影,其中xy平面内的O和上面的O重合,则该投影图为B。
