第15练 晶体的化学式及计算 课时作业(含答案)2026届高三化学一轮总复习 (含解析)
文档属性
| 名称 | 第15练 晶体的化学式及计算 课时作业(含答案)2026届高三化学一轮总复习 (含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 720.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 16:11:34 | ||
图片预览



文档简介
第15练 晶体的化学式及计算
一、 单项选择题
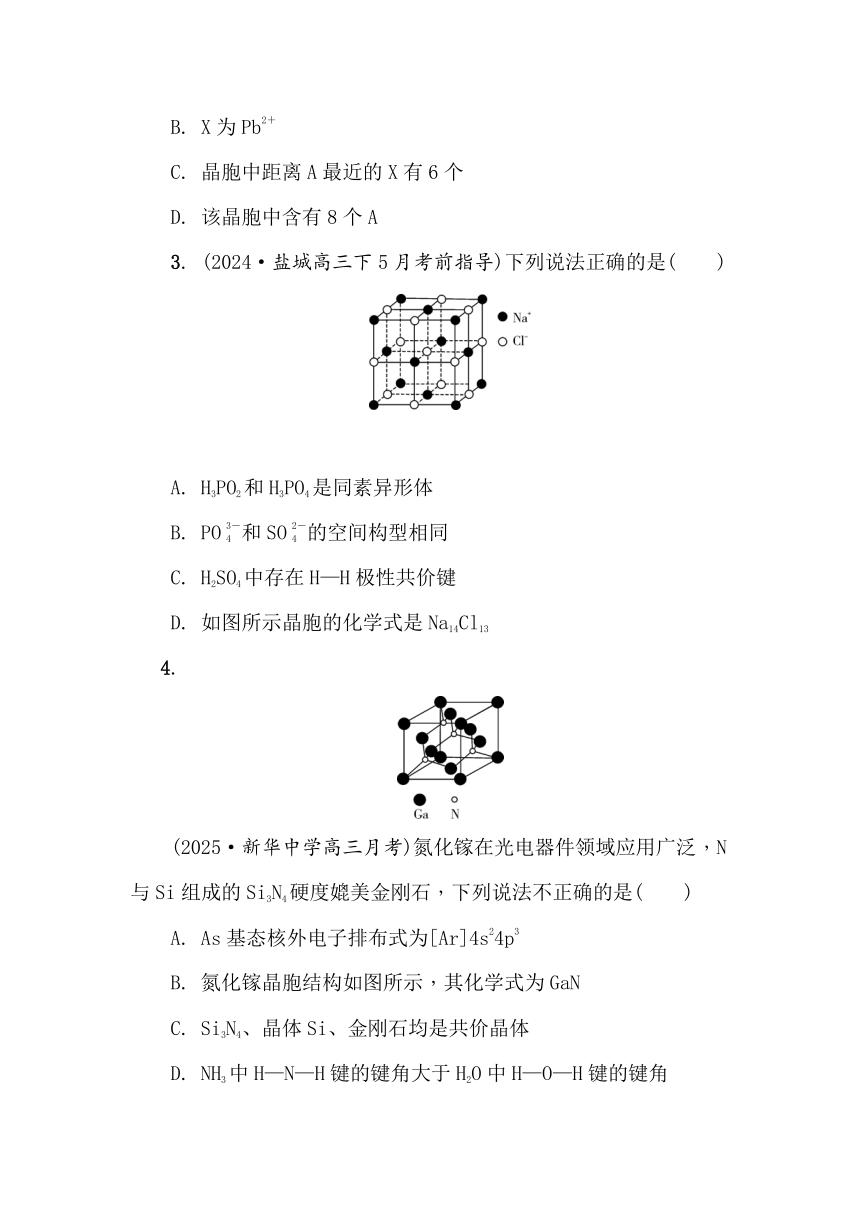
1. (2025·扬州中学高三下开学考)镁单质及其化合物用途广泛,某镁硼化合物的晶体结构单元如图所示。B原子占据独立一层且具有类似石墨的结构。正六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 该镁硼化合物的化学式为MgB2
B. 如图所示晶体结构单元是该镁硼化合物的晶胞
C. 每个B原子周围最近且等距的B原子数为2
D. B原子的价层电子轨道表示式为
2.
(2024·如皋高三上期初调研一)某太阳能光伏电池的有机半导材料晶胞结构如图所示,其中A为CH3NH,另两种离子为I-和Pb2+。下列说法正确的是( )
A. CH3NH中C和N的轨道杂化方式相同
B. X为Pb2+
C. 晶胞中距离A最近的X有6个
D. 该晶胞中含有8个A
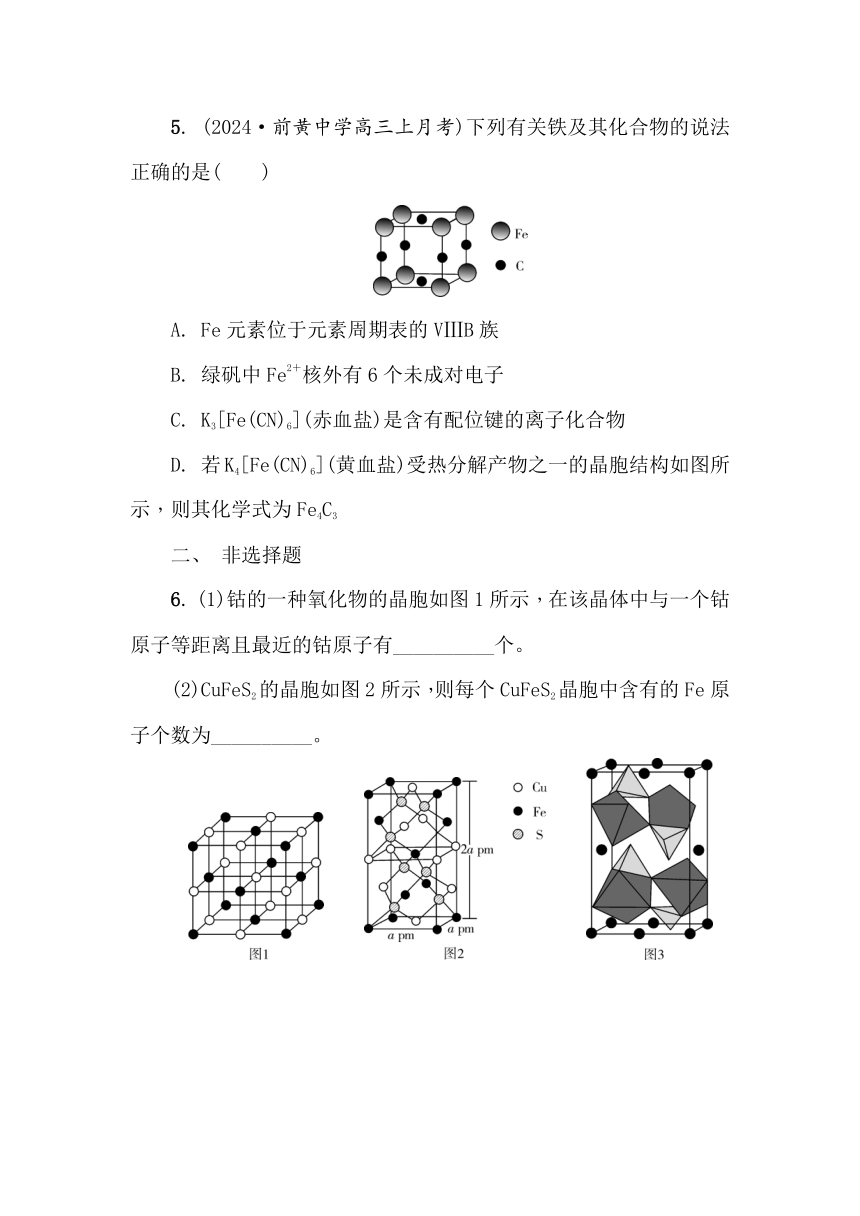
3. (2024·盐城高三下5月考前指导)下列说法正确的是( )
A. H3PO2和H3PO4是同素异形体
B. PO和SO的空间构型相同
C. H2SO4中存在H—H极性共价键
D. 如图所示晶胞的化学式是Na14Cl13
4.
(2025·新华中学高三月考)氮化镓在光电器件领域应用广泛,N与Si组成的Si3N4硬度媲美金刚石,下列说法不正确的是( )
A. As基态核外电子排布式为[Ar]4s24p3
B. 氮化镓晶胞结构如图所示,其化学式为GaN
C. Si3N4、晶体Si、金刚石均是共价晶体
D. NH3中H—N—H键的键角大于H2O中H—O—H键的键角
5. (2024·前黄中学高三上月考)下列有关铁及其化合物的说法正确的是( )
A. Fe元素位于元素周期表的VⅢB族
B. 绿矾中Fe2+核外有6个未成对电子
C. K3[Fe(CN)6](赤血盐)是含有配位键的离子化合物
D. 若K4[Fe(CN)6](黄血盐)受热分解产物之一的晶胞结构如图所示,则其化学式为Fe4C3
二、 非选择题
6. (1)钴的一种氧化物的晶胞如图1所示,在该晶体中与一个钴原子等距离且最近的钴原子有__________个。
(2)CuFeS2的晶胞如图2所示,则每个CuFeS2晶胞中含有的Fe原子个数为__________。
(3)磷酸铁锂电池具有循环稳定性好的优点。充电时Li+脱嵌形成Li1-xFePO4(0(4)催化时还可以使用一种无机固体电解质作催化剂,其由正离子An+、Bm+和负离子X-组成,该物质50.7 ℃以上形成无序结构(高温相),50.7 ℃以下变为有序结构(低温相),二者晶体晶胞结构如图4所示:
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的球为An+离子,●球为Bm+离子。
这种无机固体电解质的化学式为__________。
(5)将一定量KMnO4和MnSO4固体投入超纯水中混合搅拌,在120 ℃下反应10小时,得到黑色固体MnO2,再加入CuSO4和Na2CO3溶液,经过搅拌、陈化、造粒、干燥、煅烧等工序得到比表面积较高的催化剂。其中一种成分的晶胞结构如图5所示,每个O2-周围紧邻的Cu2+的个数为__________。
(6)ZnO的一种晶胞结构如图6所示,每个Zn原子周围紧邻的O原子个数为__________。
(7)氢能是一种极具发展潜力的清洁能源。可通过下列反应大规模制取氢气。
对催化剂载体CeO2改性,使其形成氧空位,可减少积碳。CeO2晶胞如图7所示。取干燥CeO2在Ar气条件下加热,热重分析显示样品一直处于质量损失状态;X射线衍射分析结果表明随着温度升高,该晶胞边长变长,但铈离子空间排列没有发生变化。加热后,当失重率(损失的质量/总质量)为2.32%时,每个晶胞拥有的O2-的个数为________。
(8)CeO2晶胞见图8,其中O原子位于Ce构成的____________空隙。(填“正四面体”或“正八面体”)
(9)图9是MnO2的一种晶型的晶胞,该晶胞中O2-所围成的空间构型是__________。
(10)一种CaBn是核工业屏蔽中子的新型材料。其晶胞中Ca处于晶胞的体心位置,占据晶胞8个顶点的是由B原子构成的正八面体。晶胞和正八面体结构如图10所示。CaBn中n=__________。
7. (1)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。硼氢化钠是一种常用的还原剂,其晶胞结构如图2所示:若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为____________。
(2)MgO—Al2O3是一种甲醇脱水的催化剂。MgO—Al2O3晶胞结构如图3所示(B中镁原子未画出)。用“●”标记出B中的镁原子__________。
(3)(2024·如皋一模)VO2是一种相变材料,其一种晶胞(部分O原子未标出)的结构如图4所示,在图中合适位置补充其余O原子__________。
(4)(2025·淮安高三开学考试)某学者分别使用Fe2O3和Fe3O4作催化剂对燃煤烟气脱硝脱硫进行了研究。
催化剂的回收。将回收的废催化剂进行处理,制成的改性Fe3O4是一种优良的磁性材料,该Fe3O4晶胞的的结构如图5所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+所在晶胞的位置__________,请说明确定理由:_______________________________________________________________。
8. (1)(2024·金陵中学高三上月考)已知ZnO的一种晶体晶胞是立方晶胞(如图),请在下图中画出该晶胞沿z轴方向的平面投影图。
(2)(2024·新高考基地第三次大联考)磷化硼(BP)是一种超硬耐磨涂层材料,它可用作金属的表面保护层。磷化硼晶胞结构如图1所示(白球代表磷原子,黑球代表硼原子)。
磷化硼(BP)晶体属于__________晶体。磷化硼晶胞沿着体对角线方向的投影如图2所示(图中表示原子的投影),图2中B原子的投影位置为______(用序号表示)。
第15练 晶体的化学式及计算
1. A 解析:根据均摊法,该晶体结构单元中含有12×+2×=3个Mg原子,含有6个B原子,故化学式为MgBr2,A正确;晶胞是晶体结构的基本单元,常规的晶胞都是平行六面体,镁硼化合物的晶胞如图,B错误;B原子占据独立一层且具有类似石墨的结构,所以B原子周围最近且等距的B原子数为3,C错误;B原子的价层电子轨道表示式为,虽然2p能级只填充了一个电子,有两个空轨道,但书写时空轨道不可省略,D错误。故选A。
2. A 解析:CH3NH中碳原子是饱和碳原子为sp3杂化,氮原子形成3个N—H键和1个C—N键,杂化方式为sp3,故A正确;根据均摊法,由晶胞结构可知,晶胞中有A离子8×=1个,有B离子1个,有X离子6×=3个,根据正负化合价代数和为0可知,X为I-,B为Pb2+,故B错误;由图可知,A为8个晶胞共用,与之距离最近的X处于面心,而面心为2个晶胞共用,则晶胞中距离A最近的X有=12个,故C错误;根据均摊法,由晶胞结构可知,晶胞中有A离子8×=1个,故D错误。故选A。
3. B 解析:H3PO2和H3PO4是化合物,不是同素异形体,A错误;SO的中心原子S原子的价层电子对数为4+=4,为sp3杂化,空间构型为正四面体形;PO的中心原子P原子的价层电子对数为4+=4,为sp3杂化,空间构型为正四面体形,B正确;H2SO4中存在O—H极性共价键,不存在氢氢键,C错误;根据“均摊法”,晶胞中含8×+6×=4个Na、12×+1=4个Cl,化学式是NaCl,D错误。故选B。
4. A 解析:已知As是33号元素,As基态核外电子排布式为[Ar]3d104s24p3,A错误;由题干氮化镓晶胞结构图可知,一个晶胞中含有Ga个数为:8×+6×=4,含有N个数为4,故其化学式为GaN,B正确;由题干信息可知,Si3N4的硬度媲美金刚石,则Si3N4属于共价晶体,晶体Si、金刚石均是共价晶体,C正确;已知NH3和H2O中心原子的价层电子对数均为4,但由于NH3中N原子周围有1对孤电子对,H2O中O原子周围有2对孤电子对,故NH3中H—N—H键的键角大于H2O中H—O—H键的键角,D正确。故选A。
5. C 解析:Fe是26号元素,位于周期表的第Ⅷ族,A项错误;Fe2+价电子排布为3d6,核外有4个未成对电子,B项错误;K3[Fe(CN)6](赤血盐)中Fe3+通过配位键与6个CN-结合为[Fe(CN)6]3-,K3[Fe(CN)6]是含有配位键的离子化合物,C项正确;若K4[Fe(CN)6](黄血盐)受热分解产物之一的晶胞结构如图所示,根据均摊原则,碳原子数为4×+2×=2、铁原子数为8×=1,则其化学式为FeC2,D项错误。故选C。
6. (1)12 (2)4 (3)0.25 (4)A2BX4 (5)4 (6)4 (7)7 (8)正四面体 (9)八面体 (10)6
解析:(1)假设黑色球是钴原子,以顶点钴原子为研究对象,与之最近的钴原子位于面心,每个顶点8个晶胞共用,每个面心为2个晶胞共用,在该晶胞中与一个钴原子等距离且最近的钴原子的个数为=12。
(2)图1为CuFeS2晶胞,则每个CuFeS2晶胞中含有的Fe原子个数为×8+×4+1=4。
(3)根据题中信息可知,Fe存在于由O构成的正八面体内部,P也存在于由O构成的正四面体中,从图2中可以看出晶胞中正八面体和四面体结构都为4个,所以晶胞中含有4个Fe和4个P原子则 LiFePO4单元中实际上构成是 Li4Fe4P4O16,Li+在8个顶点、4个棱和2个面心上,然后看图2中,结合题中信息得到,Li1-xFePO4比LiFePO4少了面心的2个Li+,少的个数是2×=1,则Li1-xFePO4晶胞为 Li3Fe4P4O16,所以1-x=,得到x=0.25。
(4)由低温相晶胞结构可知,晶胞中位于顶点、棱上、面上和体心X-的个数为8×+10×+4×+1=8,位于体内的An+、Bm+的个数分别为4、2,则无机固体电解质的化学式为A2BX4。故选A2BX4。
(5)由图5可知每个O2-周围紧邻的Cu2+的个数为4。
(6)图6中白色的球为Zn2+,从图6中可知,每个Zn原子周围紧邻的O原子个数为4个。
(7)一个CeO2晶胞中Ce4+个数为8×+6×=4、O2-在体内,个数为8,即一个CeO2晶胞中4个Ce4+、8个O2-,1 mol CeO2质量为172 g,加热后当失重率为2.32%时,损失的质量为氧元素的质量,即172 g×2.32%=4.0 g,n(O)=0.25 mol,因为铈离子空间排列没有发生变化,所以失去O2-的个数为0.25×4=1,每个晶胞拥有的O2-的个数为8-1=7。
(8)由晶胞结构,Ce处于晶胞的面心和定点,O原子位于三个面心Ce和一个顶点Ce构成的正四面体空隙。
(9)MnO2晶胞中灰球为Mn,白球为O2-,每个Mn的配位数为6,故该晶胞中O2-所围成的空间构型是八面体。
(10)由晶胞结构可知,该晶胞中含1个Ca,由B原子构成的正八面体占据晶胞8个顶点,则正八面体的个数为8×=1,则晶胞中B原子个数为6。
7. (1)(BO2)或BnO Na3Li(BH4)4 (2)图见解析 (3)图见解析
(4)c 该Fe3O4晶胞中含4×+3×=2个Fe3+、12×+1=4个O,结合化学式可知,还缺1个Fe2+离子,则Fe2+所在晶胞的位置体内c位置
解析:(1)由图1可知,每个B原子周围3个O原子,但只有1个O原子为B原子独有,另两个O原子各有二分之一属于B原子,故B有1个,O有1+2×=2个,化学式可表示为(BO2)或BnO。如图2所示的晶胞中,BH位于顶点、面心和体心位置,共8×+4×+1=4个,Na+位于面心、棱心位置,有6×+4×=4个:若硼氢化钠晶胞上下底心处的Na+被Li+取代,则Na+变为4×+4×=3个,Li+为2×=1个,故化学式为Na3Li(BH4)4。
(2)根据晶胞需满足“无隙并置”要求,则在B中标出Mg如图:。
(3)根据图4可以算出晶胞中V的个数为1+8×=2,根据化学式VO2,则一个晶胞中O的个数应为4,图4中O的个数为2+2×=3,根据上下底面的对称性,则上下底面个有1个O,此时则满足晶胞特点,且O的个数刚好为4,补充氧原子后的晶胞图为:。
(4)根据“均摊法”,该Fe3O4晶胞的中含4×+3×=2个Fe3+、12×+1=4个O,结合化学式可知,还缺1个Fe2+离子,则Fe2+所在晶胞的位置体内c位置。
8. (1)图见解析 (2)共价 1、2、4、6(或1、3、5、7)
解析:(1)观察题给晶胞结构可知,晶胞在z轴的投影情况是锌原子位于正方形的四个顶点上、四条棱的中心和面心上,4个氧原子分别位于面对角线离顶点处,可用图示表示为。
(2)根据已知磷化硼(BP)是一种超硬耐磨涂层材料,再结合B与P通过共价键相互结合,可以得磷化硼为共价晶体;根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,外侧大正六边形均由P原子构成,而内部小正六边形由3个B原子、3个P原子形间隔成,图乙中B原子的投影位置为1、2、4、6或1、3、5、7。
一、 单项选择题
1. (2025·扬州中学高三下开学考)镁单质及其化合物用途广泛,某镁硼化合物的晶体结构单元如图所示。B原子占据独立一层且具有类似石墨的结构。正六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 该镁硼化合物的化学式为MgB2
B. 如图所示晶体结构单元是该镁硼化合物的晶胞
C. 每个B原子周围最近且等距的B原子数为2
D. B原子的价层电子轨道表示式为
2.
(2024·如皋高三上期初调研一)某太阳能光伏电池的有机半导材料晶胞结构如图所示,其中A为CH3NH,另两种离子为I-和Pb2+。下列说法正确的是( )
A. CH3NH中C和N的轨道杂化方式相同
B. X为Pb2+
C. 晶胞中距离A最近的X有6个
D. 该晶胞中含有8个A
3. (2024·盐城高三下5月考前指导)下列说法正确的是( )
A. H3PO2和H3PO4是同素异形体
B. PO和SO的空间构型相同
C. H2SO4中存在H—H极性共价键
D. 如图所示晶胞的化学式是Na14Cl13
4.
(2025·新华中学高三月考)氮化镓在光电器件领域应用广泛,N与Si组成的Si3N4硬度媲美金刚石,下列说法不正确的是( )
A. As基态核外电子排布式为[Ar]4s24p3
B. 氮化镓晶胞结构如图所示,其化学式为GaN
C. Si3N4、晶体Si、金刚石均是共价晶体
D. NH3中H—N—H键的键角大于H2O中H—O—H键的键角
5. (2024·前黄中学高三上月考)下列有关铁及其化合物的说法正确的是( )
A. Fe元素位于元素周期表的VⅢB族
B. 绿矾中Fe2+核外有6个未成对电子
C. K3[Fe(CN)6](赤血盐)是含有配位键的离子化合物
D. 若K4[Fe(CN)6](黄血盐)受热分解产物之一的晶胞结构如图所示,则其化学式为Fe4C3
二、 非选择题
6. (1)钴的一种氧化物的晶胞如图1所示,在该晶体中与一个钴原子等距离且最近的钴原子有__________个。
(2)CuFeS2的晶胞如图2所示,则每个CuFeS2晶胞中含有的Fe原子个数为__________。
(3)磷酸铁锂电池具有循环稳定性好的优点。充电时Li+脱嵌形成Li1-xFePO4(0
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的球为An+离子,●球为Bm+离子。
这种无机固体电解质的化学式为__________。
(5)将一定量KMnO4和MnSO4固体投入超纯水中混合搅拌,在120 ℃下反应10小时,得到黑色固体MnO2,再加入CuSO4和Na2CO3溶液,经过搅拌、陈化、造粒、干燥、煅烧等工序得到比表面积较高的催化剂。其中一种成分的晶胞结构如图5所示,每个O2-周围紧邻的Cu2+的个数为__________。
(6)ZnO的一种晶胞结构如图6所示,每个Zn原子周围紧邻的O原子个数为__________。
(7)氢能是一种极具发展潜力的清洁能源。可通过下列反应大规模制取氢气。
对催化剂载体CeO2改性,使其形成氧空位,可减少积碳。CeO2晶胞如图7所示。取干燥CeO2在Ar气条件下加热,热重分析显示样品一直处于质量损失状态;X射线衍射分析结果表明随着温度升高,该晶胞边长变长,但铈离子空间排列没有发生变化。加热后,当失重率(损失的质量/总质量)为2.32%时,每个晶胞拥有的O2-的个数为________。
(8)CeO2晶胞见图8,其中O原子位于Ce构成的____________空隙。(填“正四面体”或“正八面体”)
(9)图9是MnO2的一种晶型的晶胞,该晶胞中O2-所围成的空间构型是__________。
(10)一种CaBn是核工业屏蔽中子的新型材料。其晶胞中Ca处于晶胞的体心位置,占据晶胞8个顶点的是由B原子构成的正八面体。晶胞和正八面体结构如图10所示。CaBn中n=__________。
7. (1)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。硼氢化钠是一种常用的还原剂,其晶胞结构如图2所示:若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到晶体的化学式为____________。
(2)MgO—Al2O3是一种甲醇脱水的催化剂。MgO—Al2O3晶胞结构如图3所示(B中镁原子未画出)。用“●”标记出B中的镁原子__________。
(3)(2024·如皋一模)VO2是一种相变材料,其一种晶胞(部分O原子未标出)的结构如图4所示,在图中合适位置补充其余O原子__________。
(4)(2025·淮安高三开学考试)某学者分别使用Fe2O3和Fe3O4作催化剂对燃煤烟气脱硝脱硫进行了研究。
催化剂的回收。将回收的废催化剂进行处理,制成的改性Fe3O4是一种优良的磁性材料,该Fe3O4晶胞的的结构如图5所示,研究发现结构中的Fe2+只可能出现在图中某一“▲”所示位置上,请确定Fe2+所在晶胞的位置__________,请说明确定理由:_______________________________________________________________。
8. (1)(2024·金陵中学高三上月考)已知ZnO的一种晶体晶胞是立方晶胞(如图),请在下图中画出该晶胞沿z轴方向的平面投影图。
(2)(2024·新高考基地第三次大联考)磷化硼(BP)是一种超硬耐磨涂层材料,它可用作金属的表面保护层。磷化硼晶胞结构如图1所示(白球代表磷原子,黑球代表硼原子)。
磷化硼(BP)晶体属于__________晶体。磷化硼晶胞沿着体对角线方向的投影如图2所示(图中表示原子的投影),图2中B原子的投影位置为______(用序号表示)。
第15练 晶体的化学式及计算
1. A 解析:根据均摊法,该晶体结构单元中含有12×+2×=3个Mg原子,含有6个B原子,故化学式为MgBr2,A正确;晶胞是晶体结构的基本单元,常规的晶胞都是平行六面体,镁硼化合物的晶胞如图,B错误;B原子占据独立一层且具有类似石墨的结构,所以B原子周围最近且等距的B原子数为3,C错误;B原子的价层电子轨道表示式为,虽然2p能级只填充了一个电子,有两个空轨道,但书写时空轨道不可省略,D错误。故选A。
2. A 解析:CH3NH中碳原子是饱和碳原子为sp3杂化,氮原子形成3个N—H键和1个C—N键,杂化方式为sp3,故A正确;根据均摊法,由晶胞结构可知,晶胞中有A离子8×=1个,有B离子1个,有X离子6×=3个,根据正负化合价代数和为0可知,X为I-,B为Pb2+,故B错误;由图可知,A为8个晶胞共用,与之距离最近的X处于面心,而面心为2个晶胞共用,则晶胞中距离A最近的X有=12个,故C错误;根据均摊法,由晶胞结构可知,晶胞中有A离子8×=1个,故D错误。故选A。
3. B 解析:H3PO2和H3PO4是化合物,不是同素异形体,A错误;SO的中心原子S原子的价层电子对数为4+=4,为sp3杂化,空间构型为正四面体形;PO的中心原子P原子的价层电子对数为4+=4,为sp3杂化,空间构型为正四面体形,B正确;H2SO4中存在O—H极性共价键,不存在氢氢键,C错误;根据“均摊法”,晶胞中含8×+6×=4个Na、12×+1=4个Cl,化学式是NaCl,D错误。故选B。
4. A 解析:已知As是33号元素,As基态核外电子排布式为[Ar]3d104s24p3,A错误;由题干氮化镓晶胞结构图可知,一个晶胞中含有Ga个数为:8×+6×=4,含有N个数为4,故其化学式为GaN,B正确;由题干信息可知,Si3N4的硬度媲美金刚石,则Si3N4属于共价晶体,晶体Si、金刚石均是共价晶体,C正确;已知NH3和H2O中心原子的价层电子对数均为4,但由于NH3中N原子周围有1对孤电子对,H2O中O原子周围有2对孤电子对,故NH3中H—N—H键的键角大于H2O中H—O—H键的键角,D正确。故选A。
5. C 解析:Fe是26号元素,位于周期表的第Ⅷ族,A项错误;Fe2+价电子排布为3d6,核外有4个未成对电子,B项错误;K3[Fe(CN)6](赤血盐)中Fe3+通过配位键与6个CN-结合为[Fe(CN)6]3-,K3[Fe(CN)6]是含有配位键的离子化合物,C项正确;若K4[Fe(CN)6](黄血盐)受热分解产物之一的晶胞结构如图所示,根据均摊原则,碳原子数为4×+2×=2、铁原子数为8×=1,则其化学式为FeC2,D项错误。故选C。
6. (1)12 (2)4 (3)0.25 (4)A2BX4 (5)4 (6)4 (7)7 (8)正四面体 (9)八面体 (10)6
解析:(1)假设黑色球是钴原子,以顶点钴原子为研究对象,与之最近的钴原子位于面心,每个顶点8个晶胞共用,每个面心为2个晶胞共用,在该晶胞中与一个钴原子等距离且最近的钴原子的个数为=12。
(2)图1为CuFeS2晶胞,则每个CuFeS2晶胞中含有的Fe原子个数为×8+×4+1=4。
(3)根据题中信息可知,Fe存在于由O构成的正八面体内部,P也存在于由O构成的正四面体中,从图2中可以看出晶胞中正八面体和四面体结构都为4个,所以晶胞中含有4个Fe和4个P原子则 LiFePO4单元中实际上构成是 Li4Fe4P4O16,Li+在8个顶点、4个棱和2个面心上,然后看图2中,结合题中信息得到,Li1-xFePO4比LiFePO4少了面心的2个Li+,少的个数是2×=1,则Li1-xFePO4晶胞为 Li3Fe4P4O16,所以1-x=,得到x=0.25。
(4)由低温相晶胞结构可知,晶胞中位于顶点、棱上、面上和体心X-的个数为8×+10×+4×+1=8,位于体内的An+、Bm+的个数分别为4、2,则无机固体电解质的化学式为A2BX4。故选A2BX4。
(5)由图5可知每个O2-周围紧邻的Cu2+的个数为4。
(6)图6中白色的球为Zn2+,从图6中可知,每个Zn原子周围紧邻的O原子个数为4个。
(7)一个CeO2晶胞中Ce4+个数为8×+6×=4、O2-在体内,个数为8,即一个CeO2晶胞中4个Ce4+、8个O2-,1 mol CeO2质量为172 g,加热后当失重率为2.32%时,损失的质量为氧元素的质量,即172 g×2.32%=4.0 g,n(O)=0.25 mol,因为铈离子空间排列没有发生变化,所以失去O2-的个数为0.25×4=1,每个晶胞拥有的O2-的个数为8-1=7。
(8)由晶胞结构,Ce处于晶胞的面心和定点,O原子位于三个面心Ce和一个顶点Ce构成的正四面体空隙。
(9)MnO2晶胞中灰球为Mn,白球为O2-,每个Mn的配位数为6,故该晶胞中O2-所围成的空间构型是八面体。
(10)由晶胞结构可知,该晶胞中含1个Ca,由B原子构成的正八面体占据晶胞8个顶点,则正八面体的个数为8×=1,则晶胞中B原子个数为6。
7. (1)(BO2)或BnO Na3Li(BH4)4 (2)图见解析 (3)图见解析
(4)c 该Fe3O4晶胞中含4×+3×=2个Fe3+、12×+1=4个O,结合化学式可知,还缺1个Fe2+离子,则Fe2+所在晶胞的位置体内c位置
解析:(1)由图1可知,每个B原子周围3个O原子,但只有1个O原子为B原子独有,另两个O原子各有二分之一属于B原子,故B有1个,O有1+2×=2个,化学式可表示为(BO2)或BnO。如图2所示的晶胞中,BH位于顶点、面心和体心位置,共8×+4×+1=4个,Na+位于面心、棱心位置,有6×+4×=4个:若硼氢化钠晶胞上下底心处的Na+被Li+取代,则Na+变为4×+4×=3个,Li+为2×=1个,故化学式为Na3Li(BH4)4。
(2)根据晶胞需满足“无隙并置”要求,则在B中标出Mg如图:。
(3)根据图4可以算出晶胞中V的个数为1+8×=2,根据化学式VO2,则一个晶胞中O的个数应为4,图4中O的个数为2+2×=3,根据上下底面的对称性,则上下底面个有1个O,此时则满足晶胞特点,且O的个数刚好为4,补充氧原子后的晶胞图为:。
(4)根据“均摊法”,该Fe3O4晶胞的中含4×+3×=2个Fe3+、12×+1=4个O,结合化学式可知,还缺1个Fe2+离子,则Fe2+所在晶胞的位置体内c位置。
8. (1)图见解析 (2)共价 1、2、4、6(或1、3、5、7)
解析:(1)观察题给晶胞结构可知,晶胞在z轴的投影情况是锌原子位于正方形的四个顶点上、四条棱的中心和面心上,4个氧原子分别位于面对角线离顶点处,可用图示表示为。
(2)根据已知磷化硼(BP)是一种超硬耐磨涂层材料,再结合B与P通过共价键相互结合,可以得磷化硼为共价晶体;根据晶胞结构分析,立方磷化硼晶胞沿着体对角线方向可以观察到六边形,中心B与P重合,外侧大正六边形均由P原子构成,而内部小正六边形由3个B原子、3个P原子形间隔成,图乙中B原子的投影位置为1、2、4、6或1、3、5、7。
同课章节目录
