4.1.2 化学式(第2课时) 优质课件 (共30张PPT)初中科粤版(2024)九年级上册
文档属性
| 名称 | 4.1.2 化学式(第2课时) 优质课件 (共30张PPT)初中科粤版(2024)九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 56.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 10:31:00 | ||
图片预览








文档简介
(共30张PPT)
4.1.2 化学式(第2课时)
核心素养目标
一、化学观念
理解化学式是物质组成的一种表达形式;能从宏观和微观相结合的视角,认识化学式的含义,构建 “宏观 - 微观 - 符号” 三重表征的思维方式。二、科学思维
基于化合价规则,运用归纳与推理的方法书写化合物化学式,根据化学式计算化合价、相对分子质量、元素质量比和质量分数,培养逻辑思维能力。
三、科学态度与责任
培养严谨、规范的科学态度,在书写化学式和计算过程中注重准确性和规范性。
学习重难点
重点:
1. 元素化合价的概念及常见元素化合价的记忆
2. 根据化合价书写化合物的化学式,根据化学式计算元素化合价、相对分子质量、元素质量比和质量分数
难点:
1. 理解化合价的本质及化合物中元素化合价代数和为零的应用
2. 熟练运用化合价规则书写复杂化合物的化学式及相关计算
01 化合价
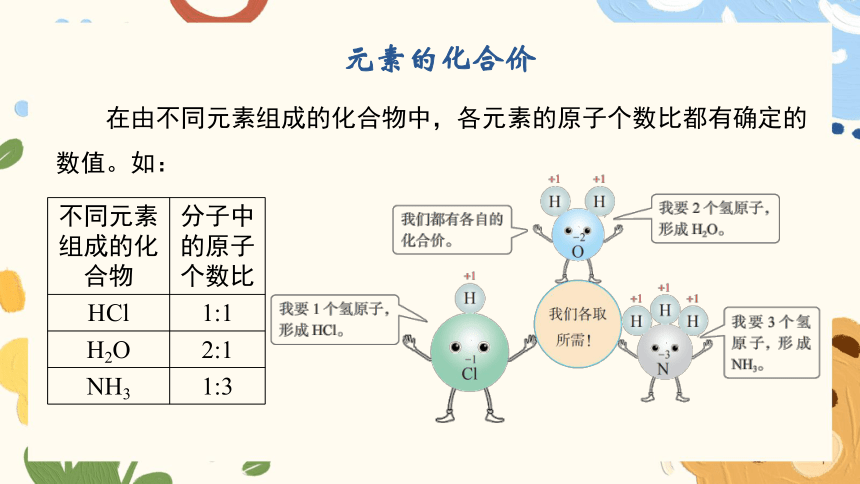
元素的化合价
在由不同元素组成的化合物中,各元素的原子个数比都有确定的
数值。如:
不同元素组成的化合物 分子中的原子个数比
HCl 1:1
H2O 2:1
NH3 1:3
元素的化合价
不同元素组成化合物时,它们的原子个数比是不同的,显示了
这些元素的某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
化合价的表示方法
+n
-n
化合价有正价、零价、负价,在元素的正上方写“+”或“-”后面加数值。
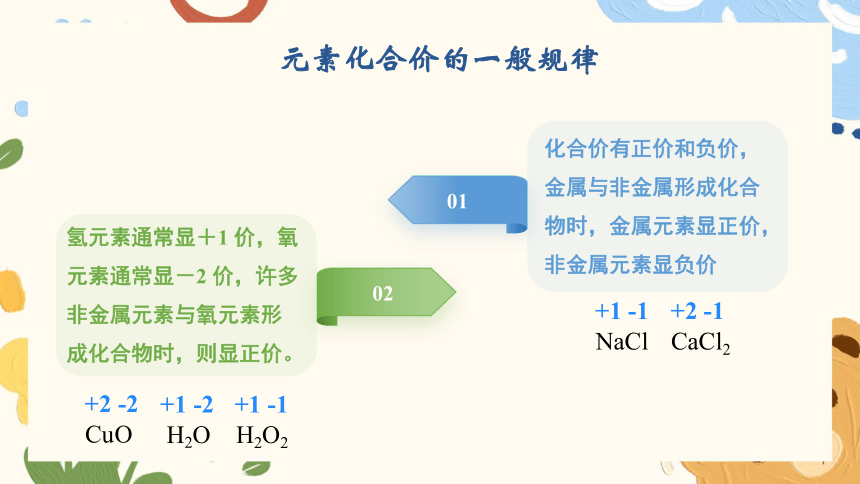
元素化合价的一般规律
01
化合价有正价和负价,金属与非金属形成化合物时,金属元素显正价,非金属元素显负价
02
氢元素通常显+1 价,氧元素通常显-2 价,许多非金属元素与氧元素形成化合物时,则显正价。
+1 -1
NaCl
+2 -1
CaCl2
+2 -2
CuO
+1 -2
H2O
+1 -1
H2O2
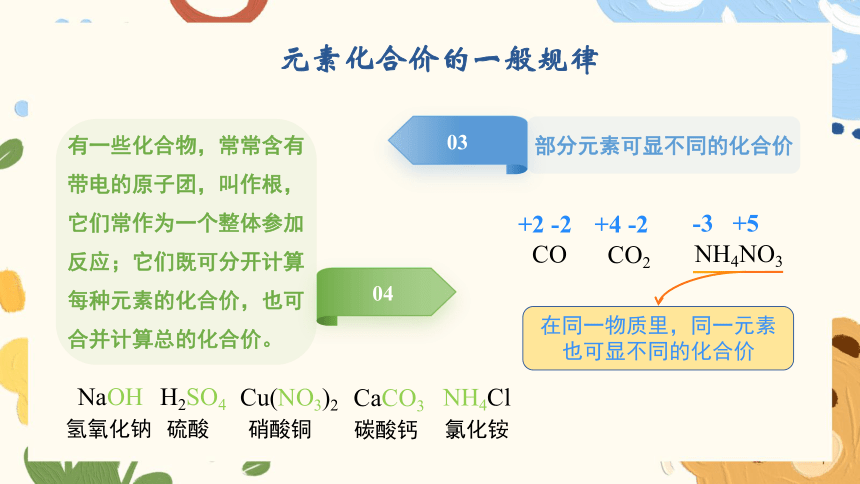
元素化合价的一般规律
03
部分元素可显不同的化合价
04
有一些化合物,常常含有带电的原子团,叫作根,它们常作为一个整体参加反应;它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
+2 -2
CO
+4 -2
CO2
-3 +5
NH4NO3
在同一物质里,同一元素也可显不同的化合价
NaOH
H2SO4
Cu(NO3)2
NH4Cl
CaCO3
氢氧化钠
硫酸
硝酸铜
氯化铵
碳酸钙
元素化合价的一般规律
05
化合物中各元素正负化合价代数和为 0。由于化合价是元素形成化合物时才表现出来的性质,因此,在单质中元素的化合价为 0。
+5 -2
P2O5
0
O2
0
N2
(+5) ×2+(-2)×5=0
+1+7 -2
KMnO4
(+1) +(+7)+(-2)×4=0
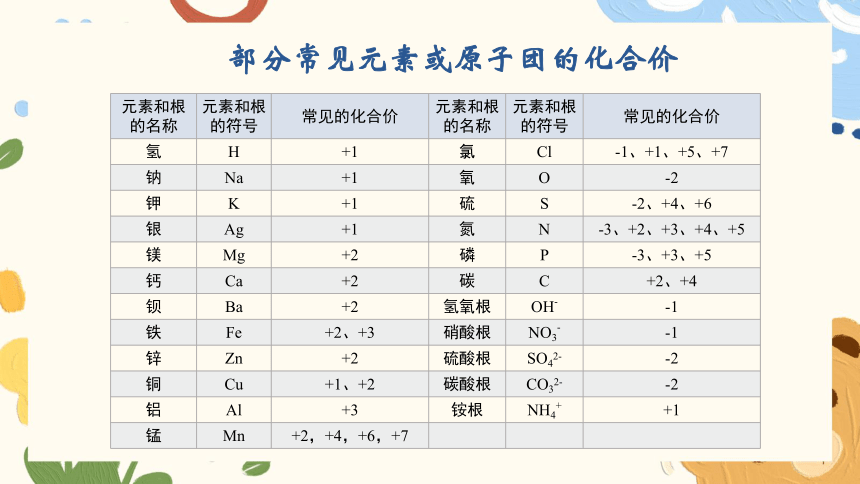
部分常见元素或原子团的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
氢 H +1 氯 Cl -1、+1、+5、+7
钠 Na +1 氧 O -2
钾 K +1 硫 S -2、+4、+6
银 Ag +1 氮 N -3、+2、+3、+4、+5
镁 Mg +2 磷 P -3、+3、+5
钙 Ca +2 碳 C +2、+4
钡 Ba +2 氢氧根 OH- -1
铁 Fe +2、+3 硝酸根 NO3- -1
锌 Zn +2 硫酸根 SO42- -2
铜 Cu +1、+2 碳酸根 CO32- -2
铝 Al +3 铵根 NH4+ +1
锰 Mn +2,+4,+6,+7
化合价记忆口诀
常见元素的化合价口诀
一价钾钠氯氢银,二价氧钙钡镁锌
三铝四硅五价磷,二三铁 二四碳
二四六硫要记全,铜汞二价最常见
氢一氧二为常规, 单质零价永不变
常见原子团的化合价口诀
负一硝酸氢氧根
负二硫酸碳酸根
负三价是磷酸根
正一价的是铵根
02 化合价与化学式
根据化合价写化学式
依据:在化合物里,各元素正负化合价的代数和为0。
步骤 写出水的化学式 练习:请写出氧化铝的化学式
1.写出组成化合物的元素符号,一般来说,正价元素居左,负价元素居右。
2. 标出有关元素的化合价。
3. 根据化合物中各种元素化合价代数和等于零的原则,确定各元素的原子数目。
4. 写出化学式。
H O
因为2×(+1)+1×(-2)=0
氢原子的个数为2
氧原子的个数为1
H2O
+1 -2
H O
Al O
2×(+3)+3×(-2)=0所以铝的原子数为2,
氧的原子数为3
Al2O3
+3 -2
Al O
根据化合价写化学式
步骤:排序、标价、化简、交叉
示例:写出+6价硫的氧化物的化学式
排序:S O
标价:S O
+6 -2
化简:S O
+3 -1
交叉:S1 O3
+3 -1
将3写在O右下角,1写在S右下角,原子个数为“1”时省略不写。即化学式为SO3
十字交叉法书写化学方程式
根据化学式求元素的化合价
依据:在化合物中,各元素正负化合价的代数和为0。
一般根据无变价元素的化合价,求有变价元素的化合价。
例:已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
解:设铁元素的化合价为x,列式:
2·x + 3×(-2)= 0
x = +3
答:在氧化铁(Fe2O3)中,铁元素的化合价为+3。
随堂练习
请你求出五氧化二磷(P2O5)中磷元素的化合价:________。
解:设磷的化合价为x,列式:
2 · x + 5×(-2)= 0
x = +5
答:磷元素的化合价为+5。
请你再求出 H2SO4 中硫元素的化合价:________。
解:设硫的化合价为x,列式:
x = +6
答:硫元素的化合价为+6。
2×(+1)+x +4×(-2)= 0
03 怎样读化合物的
化学式
单质化学式的读法
化学式的读法
单质 气态单质
非气态单质
特殊
读元素名称加“气”, 如 H2 (氢气)
直接读元素名称,如 Fe 读作铁,S 读作硫
O3(臭氧)
化学式的读法
化学式的读法
化 合 物 两种元素组成
含 原 子 团
通常从右向左读作“某化某”,如 CuO (氧化铜);
有时需要读出化学式中各元素的原子个数,
如 Fe3O4 (四氧化三铁)
含氢氧根:读作“氢氧化某”,如NaOH(氢氧化钠)
含酸根:读作“某酸某”,如Na2SO4(硫酸钠)
含铵根:若后面为酸根,读作“某酸铵”,如(NH4)2CO3;若后面为离子,读作“某化铵”,如NH4Cl(氯化铵)
04 怎样根据化学式
进行计算
计算相对分子质量
化学式中各原子的相对原子质量总和,叫作相对分子质量。和相对原子质量一样,相对分子质量也是比值,是相对质量。
例:水(H2O)的相对分子质量=1×2+16=18
请练习:碳酸氢铵(NH4HCO3)的相对分子质量。
计算公式:AmBn的相对分子质量=Ar(A)×m + Ar(B)×n
Mr(NH4 HCO3 )=1×14(N)+4×1(H)+1×12(C)+3×16(O)=78
计算化合物中各元素的质量比
化合物中各元素的质量比等于化合物中各元素的相对原子质量与原子个数的乘积之比。
例:求水(H2O)中氢元素和氧元素的质量比:
解:在 H2O 中,氢和氧的原子个数比为 2:1,则H2O中氢元素和氧元素的质量比为:1×2:16=1:8
请练习:H2SO4中各元素的质量比。
计算公式:AmBn中A元素与B元素的质量比为Ar(A)×m :Ar(B)×n
1:16:32
计算化合物中某一元素的质量分数
化合物中该元素的质量分数,即该元素的质量与组成化合物的各元素质量总和之比。
计算公式:化合物中某元素的质量分数
=
该元素的相对原子质量 × 该原子的个数
化合物的相对分子质量
×100%
计算化合物中某一元素的质量分数
例:计算水(H2O)中氧元素的质量分数。
解:水中氧元素的质量分数=
氧元素的相对原子质量 × 氧原子的个数
水的相对分子质量
16×1
18
= 88.9%
答:水中氧元素的质量分数为 88.9%。
×100%
=
×100%
总结归纳
随堂练习
1. 次氯酸是常见的消毒剂,含有氢、氯、氧三种元素,其中氯元素的化合价为+1 价,则次氯酸的化学式为( )
A. HCl B. HClO C. HClO3 D. HClO4
B
2. 常用药材金银花的有效成分之一绿原酸(化学式为 C16H18O9)具有抗菌、抗病毒等作用。下列关于绿原酸的说法正确的是( )
A. 碳、氧元素的质量比为 16:9
B. 相对分子质量为 258 g
C. 由 3 种元素组成
D. 由 43 个原子构成
随堂练习
C
随堂练习
3. 吸烟危害健康。吸烟时会吸入多种有害气体,其中有一种是氧化物,它所含的氧元素与另一种元素的质量比为 4:3,这种气体是( )
A. CO B. NO C. CO2 D. SO2
A
随堂练习
4. 市售加碘盐是在食盐中加入一定量的碘酸钾(化学式为KIO3),其中碘元素的化合价为( )
A. +5 B. +3 C. +1 D. -1
A
感谢您的观看
“THANK YOU”
4.1.2 化学式(第2课时)
核心素养目标
一、化学观念
理解化学式是物质组成的一种表达形式;能从宏观和微观相结合的视角,认识化学式的含义,构建 “宏观 - 微观 - 符号” 三重表征的思维方式。二、科学思维
基于化合价规则,运用归纳与推理的方法书写化合物化学式,根据化学式计算化合价、相对分子质量、元素质量比和质量分数,培养逻辑思维能力。
三、科学态度与责任
培养严谨、规范的科学态度,在书写化学式和计算过程中注重准确性和规范性。
学习重难点
重点:
1. 元素化合价的概念及常见元素化合价的记忆
2. 根据化合价书写化合物的化学式,根据化学式计算元素化合价、相对分子质量、元素质量比和质量分数
难点:
1. 理解化合价的本质及化合物中元素化合价代数和为零的应用
2. 熟练运用化合价规则书写复杂化合物的化学式及相关计算
01 化合价
元素的化合价
在由不同元素组成的化合物中,各元素的原子个数比都有确定的
数值。如:
不同元素组成的化合物 分子中的原子个数比
HCl 1:1
H2O 2:1
NH3 1:3
元素的化合价
不同元素组成化合物时,它们的原子个数比是不同的,显示了
这些元素的某种特性,即元素的化合价。
化学上用化合价来确定化合物中原子或离子之间相互结合的数目。
化合价的表示方法
+n
-n
化合价有正价、零价、负价,在元素的正上方写“+”或“-”后面加数值。
元素化合价的一般规律
01
化合价有正价和负价,金属与非金属形成化合物时,金属元素显正价,非金属元素显负价
02
氢元素通常显+1 价,氧元素通常显-2 价,许多非金属元素与氧元素形成化合物时,则显正价。
+1 -1
NaCl
+2 -1
CaCl2
+2 -2
CuO
+1 -2
H2O
+1 -1
H2O2
元素化合价的一般规律
03
部分元素可显不同的化合价
04
有一些化合物,常常含有带电的原子团,叫作根,它们常作为一个整体参加反应;它们既可分开计算每种元素的化合价,也可合并计算总的化合价。
+2 -2
CO
+4 -2
CO2
-3 +5
NH4NO3
在同一物质里,同一元素也可显不同的化合价
NaOH
H2SO4
Cu(NO3)2
NH4Cl
CaCO3
氢氧化钠
硫酸
硝酸铜
氯化铵
碳酸钙
元素化合价的一般规律
05
化合物中各元素正负化合价代数和为 0。由于化合价是元素形成化合物时才表现出来的性质,因此,在单质中元素的化合价为 0。
+5 -2
P2O5
0
O2
0
N2
(+5) ×2+(-2)×5=0
+1+7 -2
KMnO4
(+1) +(+7)+(-2)×4=0
部分常见元素或原子团的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
氢 H +1 氯 Cl -1、+1、+5、+7
钠 Na +1 氧 O -2
钾 K +1 硫 S -2、+4、+6
银 Ag +1 氮 N -3、+2、+3、+4、+5
镁 Mg +2 磷 P -3、+3、+5
钙 Ca +2 碳 C +2、+4
钡 Ba +2 氢氧根 OH- -1
铁 Fe +2、+3 硝酸根 NO3- -1
锌 Zn +2 硫酸根 SO42- -2
铜 Cu +1、+2 碳酸根 CO32- -2
铝 Al +3 铵根 NH4+ +1
锰 Mn +2,+4,+6,+7
化合价记忆口诀
常见元素的化合价口诀
一价钾钠氯氢银,二价氧钙钡镁锌
三铝四硅五价磷,二三铁 二四碳
二四六硫要记全,铜汞二价最常见
氢一氧二为常规, 单质零价永不变
常见原子团的化合价口诀
负一硝酸氢氧根
负二硫酸碳酸根
负三价是磷酸根
正一价的是铵根
02 化合价与化学式
根据化合价写化学式
依据:在化合物里,各元素正负化合价的代数和为0。
步骤 写出水的化学式 练习:请写出氧化铝的化学式
1.写出组成化合物的元素符号,一般来说,正价元素居左,负价元素居右。
2. 标出有关元素的化合价。
3. 根据化合物中各种元素化合价代数和等于零的原则,确定各元素的原子数目。
4. 写出化学式。
H O
因为2×(+1)+1×(-2)=0
氢原子的个数为2
氧原子的个数为1
H2O
+1 -2
H O
Al O
2×(+3)+3×(-2)=0所以铝的原子数为2,
氧的原子数为3
Al2O3
+3 -2
Al O
根据化合价写化学式
步骤:排序、标价、化简、交叉
示例:写出+6价硫的氧化物的化学式
排序:S O
标价:S O
+6 -2
化简:S O
+3 -1
交叉:S1 O3
+3 -1
将3写在O右下角,1写在S右下角,原子个数为“1”时省略不写。即化学式为SO3
十字交叉法书写化学方程式
根据化学式求元素的化合价
依据:在化合物中,各元素正负化合价的代数和为0。
一般根据无变价元素的化合价,求有变价元素的化合价。
例:已知氧化铁的化学式为Fe2O3,其中氧元素为-2价,求氧化铁中铁元素的化合价。
解:设铁元素的化合价为x,列式:
2·x + 3×(-2)= 0
x = +3
答:在氧化铁(Fe2O3)中,铁元素的化合价为+3。
随堂练习
请你求出五氧化二磷(P2O5)中磷元素的化合价:________。
解:设磷的化合价为x,列式:
2 · x + 5×(-2)= 0
x = +5
答:磷元素的化合价为+5。
请你再求出 H2SO4 中硫元素的化合价:________。
解:设硫的化合价为x,列式:
x = +6
答:硫元素的化合价为+6。
2×(+1)+x +4×(-2)= 0
03 怎样读化合物的
化学式
单质化学式的读法
化学式的读法
单质 气态单质
非气态单质
特殊
读元素名称加“气”, 如 H2 (氢气)
直接读元素名称,如 Fe 读作铁,S 读作硫
O3(臭氧)
化学式的读法
化学式的读法
化 合 物 两种元素组成
含 原 子 团
通常从右向左读作“某化某”,如 CuO (氧化铜);
有时需要读出化学式中各元素的原子个数,
如 Fe3O4 (四氧化三铁)
含氢氧根:读作“氢氧化某”,如NaOH(氢氧化钠)
含酸根:读作“某酸某”,如Na2SO4(硫酸钠)
含铵根:若后面为酸根,读作“某酸铵”,如(NH4)2CO3;若后面为离子,读作“某化铵”,如NH4Cl(氯化铵)
04 怎样根据化学式
进行计算
计算相对分子质量
化学式中各原子的相对原子质量总和,叫作相对分子质量。和相对原子质量一样,相对分子质量也是比值,是相对质量。
例:水(H2O)的相对分子质量=1×2+16=18
请练习:碳酸氢铵(NH4HCO3)的相对分子质量。
计算公式:AmBn的相对分子质量=Ar(A)×m + Ar(B)×n
Mr(NH4 HCO3 )=1×14(N)+4×1(H)+1×12(C)+3×16(O)=78
计算化合物中各元素的质量比
化合物中各元素的质量比等于化合物中各元素的相对原子质量与原子个数的乘积之比。
例:求水(H2O)中氢元素和氧元素的质量比:
解:在 H2O 中,氢和氧的原子个数比为 2:1,则H2O中氢元素和氧元素的质量比为:1×2:16=1:8
请练习:H2SO4中各元素的质量比。
计算公式:AmBn中A元素与B元素的质量比为Ar(A)×m :Ar(B)×n
1:16:32
计算化合物中某一元素的质量分数
化合物中该元素的质量分数,即该元素的质量与组成化合物的各元素质量总和之比。
计算公式:化合物中某元素的质量分数
=
该元素的相对原子质量 × 该原子的个数
化合物的相对分子质量
×100%
计算化合物中某一元素的质量分数
例:计算水(H2O)中氧元素的质量分数。
解:水中氧元素的质量分数=
氧元素的相对原子质量 × 氧原子的个数
水的相对分子质量
16×1
18
= 88.9%
答:水中氧元素的质量分数为 88.9%。
×100%
=
×100%
总结归纳
随堂练习
1. 次氯酸是常见的消毒剂,含有氢、氯、氧三种元素,其中氯元素的化合价为+1 价,则次氯酸的化学式为( )
A. HCl B. HClO C. HClO3 D. HClO4
B
2. 常用药材金银花的有效成分之一绿原酸(化学式为 C16H18O9)具有抗菌、抗病毒等作用。下列关于绿原酸的说法正确的是( )
A. 碳、氧元素的质量比为 16:9
B. 相对分子质量为 258 g
C. 由 3 种元素组成
D. 由 43 个原子构成
随堂练习
C
随堂练习
3. 吸烟危害健康。吸烟时会吸入多种有害气体,其中有一种是氧化物,它所含的氧元素与另一种元素的质量比为 4:3,这种气体是( )
A. CO B. NO C. CO2 D. SO2
A
随堂练习
4. 市售加碘盐是在食盐中加入一定量的碘酸钾(化学式为KIO3),其中碘元素的化合价为( )
A. +5 B. +3 C. +1 D. -1
A
感谢您的观看
“THANK YOU”
同课章节目录
