第24练 铜及其化合物 课时作业(含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第24练 铜及其化合物 课时作业(含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 196.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 10:32:35 | ||
图片预览



文档简介
第24练 铜及其化合物
一、 单项选择题
1. (2025·徐州七中高三月考)Cu2S在高温下与O2反应转化为Cu2O和SO2,生成的Cu2O与Cu2S进一步反应得到Cu和SO2。Cu2O在酸性溶液中会转化为Cu和Cu2+;Cu在O2存在下能与氨水反应生成[Cu(NH3)2]OH;CuSO4可用于水体的净化。下列物质的结构与性质或物质的性质与用途具有对应关系的是( )
A. Cu2S熔点高,可用作电池的负极材料
B. SO2具有还原性,可用作纸浆的漂白剂
C. NH3存在孤电子对,可与Cu+形成配位键
D. CuSO4溶液显酸性,可用于游泳池内水的消毒
2. (2024·盐城三模)在指定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq)Cl2(g)漂白粉(s)
B. CuO(s)Cu(OH)2(s)Cu2O(s)
C. Fe2O3(s)Fe(s)FeCl2(s)
D. Cu(s)NO2(g)Ca(NO3)2(aq)
3. (2025·丹阳中学高三月考)冶炼铜时可使Cu2S在高温下与O2反应转化为Cu2O,生成的Cu2O与Cu2S进一步反应得到Cu。Cu2O在酸性溶液中会转化为Cu和Cu2+;Cu2S能被浓硝酸氧化为Cu(NO3)2。Cu在O2存在下能与氨水反应生成[Cu(NH3)4]2+。则下列化学反应表示正确的是( )
A. Cu2S在高温下与O2反应:2Cu2S+4O22Cu2O+2SO3
B. Cu2S与浓硝酸反应:Cu2S+6HNO3(浓)2Cu(NO3)2+2NO2↑+H2S↑+2H2O
C. Cu2O溶于稀硫酸:Cu2O+2H+===Cu+Cu2++H2O
D. Cu在O2存在下与氨水反应:2Cu+8NH3+O2+4H+===2[Cu(NH3)4]2++2H2O
4.
部分含铜物质的价类关系如图所示。下列说法正确的是( )
A. a能与FeCl3溶液反应:Cu+Fe3+===Cu2++Fe2+
B. b在酸性环境中可以转化为a和e
C. c经一步反应可转化为d
D.若e为Cu(NO3)2,则其水溶液中可能大量存在H+、SO、Fe2+
5. 某小组用硫铜矿煅烧后的废渣(主要含Fe2O3、CuO、FeO)为原料制取Cu2O,流程如下:
下列说法正确的是( )
A. “酸浸”时使用98%的浓硫酸代替稀硫酸有利于提高原料利用率
B. “氧化”后溶液中存在的阳离子有:H+、Fe3+、Fe2+、Cu2+
C. “调节pH”时可以选择CuO或Cu(OH)2
D. “还原”过程中消耗的CuSO4、N2H4的物质的量之比为1∶4
二、 非选择题
6. 废弃的锂离子电池中含有多种金属元素,需回收处理。柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液。下图是某小组研究从柠檬酸浸出液中分离出铜并制备碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]的制备流程。
(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为________________________________________________________。
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效地将Cu(Ⅱ)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原Cu(OH)2的离子方程式为__________________________________________________________。
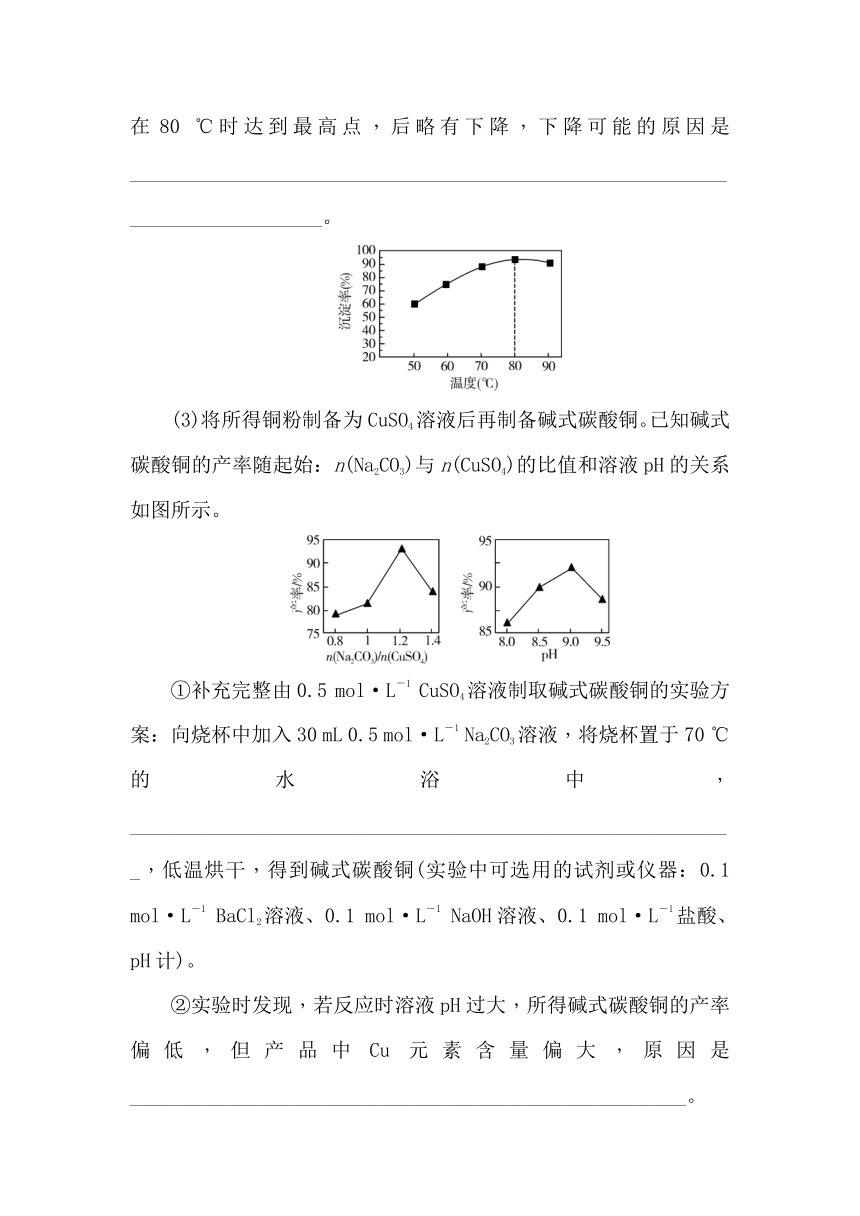
②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80 ℃时达到最高点,后略有下降,下降可能的原因是______________________________________________________________________________。
(3)将所得铜粉制备为CuSO4溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始:n(Na2CO3)与n(CuSO4)的比值和溶液pH的关系如图所示。
①补充完整由0.5 mol·L-1 CuSO4溶液制取碱式碳酸铜的实验方案:向烧杯中加入30 mL 0.5 mol·L-1 Na2CO3溶液,将烧杯置于70 ℃的水浴中,____________________________________________________________,低温烘干,得到碱式碳酸铜(实验中可选用的试剂或仪器:0.1 mol·L-1 BaCl2溶液、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1盐酸、pH计)。
②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是_______________________________________________________。
第24练 铜及其化合物
1. C 解析:Cu2S可用作电池的负极材料,是因为Cu2S可以被氧化,与其熔点高无关,故A错误;SO2可用作纸浆的漂白剂,是因为二氧化硫具有漂白性,与其还原性无关,故B错误;NH3中存在孤电子对,可与Cu+形成配位键,故C正确;硫酸铜溶液可用于游泳池内水的消毒,是因为铜离子是重金属离子,能使蛋白质变性,与其溶液显酸性无关,故D错误。故选C。
2. D 解析:电解NaCl溶液生成NaOH、H2、Cl2,Cl2和石灰乳反应得到漂白粉,故A不符合题意;CuO不和水反应,故B不符合题意;Fe2O3和Al高温下反应生成Fe,Fe和Cl2反应生成FeCl3,故C不符合题意;Cu和浓硝酸反应生成NO2,NO2和Ca(OH)2溶液反应生成Ca(NO3)2和NO,故D符合题意。故选D。
3. C 解析:Cu2S在高温下与O2反应生成氧化亚铜和二氧化硫,反应的化学方程式为:2Cu2S+3O22Cu2O+2SO2,A项错误;硝酸具有氧化性,硫化氢具有还原性,反应过程中会进一步转化为硫和二氧化氮,所以Cu2S与浓硝酸反应生成硝酸铜、NO2、S和水,反应的化学方程式为:Cu2S+8HNO3(浓)2Cu(NO3)2+4NO2↑+S↓+4H2O,B项错误;Cu2O溶于稀硫酸会发生氧化还原反应,生成硫酸铜、铜和水,反应的离子方程式为:Cu2O+2H+===Cu+Cu2++H2O,C项正确;氨水呈碱性,没有大量H+,Cu在O2存在下与氨水反应的离子方程式为:2Cu+8NH3·H2O+O2===2[Cu(NH3)4]2++2H2O+4OH-,D项错误。故选C。
4. B 解析:如图,a为铜单质;b为+1价铜的氧化物,为Cu2O;c为+2价铜的氧化物,为CuO;d为含铜的碱,为Cu(OH)2;e为+2价铜的盐,如CuCl2;氯化铁溶液可作为印刷电路板的刻蚀液,其反应为Cu+2Fe3+===Cu2++2Fe2+,故A错误;b为Cu2O,在酸性溶液中发生歧化反应,其反应为Cu2O+2H+===Cu+Cu2++H2O,故B正确;c为CuO,d为Cu(OH)2,CuO不能直接转化为Cu(OH)2,故C错误;若e为Cu(NO3)2,在酸性条件下NO具有氧化性,Fe2+具有还原性,发生反应3Fe2++4H++NO===3Fe3++NO↑+2H2O,所以Cu(NO3)2溶液中不能大量存在H+、Fe2+,故D错误。故选B。
5. C 解析:废渣(主要含Fe2O3、CuO、FeO)加入稀硫酸反应生成硫酸铁、硫酸亚铁、硫酸铜,加入双氧水氧化亚铁离子变为铁离子,调节溶液pH值沉淀铁离子,过滤,向滤液中加入N2H4还原硫酸铜生成氧化亚铜和氮气。“酸浸”时使用98%的浓硫酸会氧化亚铁离子,产生污染性的气体,消耗的硫酸量会增多,不利于提高原料利用率,故A错误;氧化的目的是将亚铁离子氧化为铁离子,因此“氧化”后溶液中存在的阳离子有:H+、Fe3+、Cu2+,故B错误;“调节pH”时主要是沉淀铁离子,而需要保留,因此选择CuO或Cu(OH)2来消耗氢离子,促进铁离子水解,故C正确;“还原”过程硫酸铜化合价降低1个价态,N2H4化合价升高变为氮气,升高4个价态,因此“还原”中消耗的CuSO4、N2H4的物质的量之比为4∶1,故D错误。故选C。
6. (1)柠檬酸具有较好的络合性,结合铜离子的能力强于氢氧根离子
(2)①C6H8O6+Cu(OH)2===Cu+2H2O+C6H6O6 ②反应开始阶段,随温度升高,反应速率较快,有利于铜的沉淀,但抗坏血酸不稳定,受热易分解,温度过高使其分解导致还原性降低,还原铜的能力降低
(3)①边搅拌边加入25 mL 0.5 mol·L-1 CuSO4溶液,在pH计测定溶液pH条件下,用0.1 mol·L-1 NaOH溶液或0.1 mol·L-1盐酸调节pH约为9,充分反应后,过滤、洗涤沉淀至最后一次洗涤液滴加BaCl2无沉淀生成
②溶液pH过大,反应生成了氢氧化铜沉淀,氢氧化铜中铜的含量大于碱式碳酸铜中铜的含量
解析:柠檬酸浸出液中加入碱调节pH,转化生成氢氧化铜,加入抗坏血酸还原得到铜单质,所得铜粉制备为CuSO4溶液后,向烧杯中加入30 mL 0.5 mol·L-1 Na2CO3溶液,将烧杯置于70 ℃的水浴中,边搅拌边加入25 mL 0.5 mol·L-1 CuSO4溶液,在pH计测定溶液pH条件下,用0.1 mol·L-1 NaOH溶液或0.1 mol·L-1盐酸调节pH约为9,充分反应后,过滤、洗涤沉淀至最后一次洗涤液滴加BaCl2无沉淀生成,低温烘干,得到碱式碳酸铜,据此分析。
(1)结合题干信息,柠檬酸具有较好的络合性,结合铜离子的能力强于氢氧根离子;
(2)①抗坏血酸还原Cu(OH)2的离子方程式为:C6H8O6+Cu(OH)2===Cu+2H2O+C6H6O6;②反应开始阶段,随温度升高,反应速率较快,有利于铜的沉淀,但抗坏血酸不稳定,受热易分解,温度过高使其分解导致还原性降低,还原铜的能力降低;
(3)①向烧杯中加入30 mL 0.5 mol·L-1 Na2CO3溶液,将烧杯置于70 ℃的水浴中,边搅拌边加入25 mL 0.5 mol·L-1 CuSO4溶液,在pH计测定溶液pH条件下,用0.1 mol·L-1 NaOH溶液或0.1 mol·L-1盐酸调节pH约为9,充分反应后,过滤、洗涤沉淀至最后一次洗涤液滴加BaCl2无沉淀生成,低温烘干,得到碱式碳酸铜;②溶液pH过大,反应生成了氢氧化铜沉淀,氢氧化铜中铜的含量大于碱式碳酸铜中铜的含量。
一、 单项选择题
1. (2025·徐州七中高三月考)Cu2S在高温下与O2反应转化为Cu2O和SO2,生成的Cu2O与Cu2S进一步反应得到Cu和SO2。Cu2O在酸性溶液中会转化为Cu和Cu2+;Cu在O2存在下能与氨水反应生成[Cu(NH3)2]OH;CuSO4可用于水体的净化。下列物质的结构与性质或物质的性质与用途具有对应关系的是( )
A. Cu2S熔点高,可用作电池的负极材料
B. SO2具有还原性,可用作纸浆的漂白剂
C. NH3存在孤电子对,可与Cu+形成配位键
D. CuSO4溶液显酸性,可用于游泳池内水的消毒
2. (2024·盐城三模)在指定条件下,下列选项所示的物质间转化均能实现的是( )
A. NaCl(aq)Cl2(g)漂白粉(s)
B. CuO(s)Cu(OH)2(s)Cu2O(s)
C. Fe2O3(s)Fe(s)FeCl2(s)
D. Cu(s)NO2(g)Ca(NO3)2(aq)
3. (2025·丹阳中学高三月考)冶炼铜时可使Cu2S在高温下与O2反应转化为Cu2O,生成的Cu2O与Cu2S进一步反应得到Cu。Cu2O在酸性溶液中会转化为Cu和Cu2+;Cu2S能被浓硝酸氧化为Cu(NO3)2。Cu在O2存在下能与氨水反应生成[Cu(NH3)4]2+。则下列化学反应表示正确的是( )
A. Cu2S在高温下与O2反应:2Cu2S+4O22Cu2O+2SO3
B. Cu2S与浓硝酸反应:Cu2S+6HNO3(浓)2Cu(NO3)2+2NO2↑+H2S↑+2H2O
C. Cu2O溶于稀硫酸:Cu2O+2H+===Cu+Cu2++H2O
D. Cu在O2存在下与氨水反应:2Cu+8NH3+O2+4H+===2[Cu(NH3)4]2++2H2O
4.
部分含铜物质的价类关系如图所示。下列说法正确的是( )
A. a能与FeCl3溶液反应:Cu+Fe3+===Cu2++Fe2+
B. b在酸性环境中可以转化为a和e
C. c经一步反应可转化为d
D.若e为Cu(NO3)2,则其水溶液中可能大量存在H+、SO、Fe2+
5. 某小组用硫铜矿煅烧后的废渣(主要含Fe2O3、CuO、FeO)为原料制取Cu2O,流程如下:
下列说法正确的是( )
A. “酸浸”时使用98%的浓硫酸代替稀硫酸有利于提高原料利用率
B. “氧化”后溶液中存在的阳离子有:H+、Fe3+、Fe2+、Cu2+
C. “调节pH”时可以选择CuO或Cu(OH)2
D. “还原”过程中消耗的CuSO4、N2H4的物质的量之比为1∶4
二、 非选择题
6. 废弃的锂离子电池中含有多种金属元素,需回收处理。柠檬酸因具有酸性和较好的络合性,可用于浸出金属离子并得到柠檬酸浸出液。下图是某小组研究从柠檬酸浸出液中分离出铜并制备碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]的制备流程。
(1)在“调pH分离铜”的步骤中,理论上铜离子完全沉淀时pH为6.67,本实验中测得pH=8时铜的沉淀率仅为7.2%,远小于理论分析结果,可能的原因为________________________________________________________。
(2)在“还原法沉铜”的步骤中,利用抗坏血酸(C6H8O6)能有效地将Cu(Ⅱ)还原成金属Cu。抗坏血酸(C6H8O6)易被氧化为脱氢抗坏血酸(C6H6O6);且受热易分解。
①抗坏血酸还原Cu(OH)2的离子方程式为__________________________________________________________。
②某实验小组研究了相同条件下温度对Cu沉淀率的影响。从如图可以看出,随着温度的升高,相同时间内Cu的沉淀率先逐渐增加,在80 ℃时达到最高点,后略有下降,下降可能的原因是______________________________________________________________________________。
(3)将所得铜粉制备为CuSO4溶液后再制备碱式碳酸铜。已知碱式碳酸铜的产率随起始:n(Na2CO3)与n(CuSO4)的比值和溶液pH的关系如图所示。
①补充完整由0.5 mol·L-1 CuSO4溶液制取碱式碳酸铜的实验方案:向烧杯中加入30 mL 0.5 mol·L-1 Na2CO3溶液,将烧杯置于70 ℃的水浴中,____________________________________________________________,低温烘干,得到碱式碳酸铜(实验中可选用的试剂或仪器:0.1 mol·L-1 BaCl2溶液、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1盐酸、pH计)。
②实验时发现,若反应时溶液pH过大,所得碱式碳酸铜的产率偏低,但产品中Cu元素含量偏大,原因是_______________________________________________________。
第24练 铜及其化合物
1. C 解析:Cu2S可用作电池的负极材料,是因为Cu2S可以被氧化,与其熔点高无关,故A错误;SO2可用作纸浆的漂白剂,是因为二氧化硫具有漂白性,与其还原性无关,故B错误;NH3中存在孤电子对,可与Cu+形成配位键,故C正确;硫酸铜溶液可用于游泳池内水的消毒,是因为铜离子是重金属离子,能使蛋白质变性,与其溶液显酸性无关,故D错误。故选C。
2. D 解析:电解NaCl溶液生成NaOH、H2、Cl2,Cl2和石灰乳反应得到漂白粉,故A不符合题意;CuO不和水反应,故B不符合题意;Fe2O3和Al高温下反应生成Fe,Fe和Cl2反应生成FeCl3,故C不符合题意;Cu和浓硝酸反应生成NO2,NO2和Ca(OH)2溶液反应生成Ca(NO3)2和NO,故D符合题意。故选D。
3. C 解析:Cu2S在高温下与O2反应生成氧化亚铜和二氧化硫,反应的化学方程式为:2Cu2S+3O22Cu2O+2SO2,A项错误;硝酸具有氧化性,硫化氢具有还原性,反应过程中会进一步转化为硫和二氧化氮,所以Cu2S与浓硝酸反应生成硝酸铜、NO2、S和水,反应的化学方程式为:Cu2S+8HNO3(浓)2Cu(NO3)2+4NO2↑+S↓+4H2O,B项错误;Cu2O溶于稀硫酸会发生氧化还原反应,生成硫酸铜、铜和水,反应的离子方程式为:Cu2O+2H+===Cu+Cu2++H2O,C项正确;氨水呈碱性,没有大量H+,Cu在O2存在下与氨水反应的离子方程式为:2Cu+8NH3·H2O+O2===2[Cu(NH3)4]2++2H2O+4OH-,D项错误。故选C。
4. B 解析:如图,a为铜单质;b为+1价铜的氧化物,为Cu2O;c为+2价铜的氧化物,为CuO;d为含铜的碱,为Cu(OH)2;e为+2价铜的盐,如CuCl2;氯化铁溶液可作为印刷电路板的刻蚀液,其反应为Cu+2Fe3+===Cu2++2Fe2+,故A错误;b为Cu2O,在酸性溶液中发生歧化反应,其反应为Cu2O+2H+===Cu+Cu2++H2O,故B正确;c为CuO,d为Cu(OH)2,CuO不能直接转化为Cu(OH)2,故C错误;若e为Cu(NO3)2,在酸性条件下NO具有氧化性,Fe2+具有还原性,发生反应3Fe2++4H++NO===3Fe3++NO↑+2H2O,所以Cu(NO3)2溶液中不能大量存在H+、Fe2+,故D错误。故选B。
5. C 解析:废渣(主要含Fe2O3、CuO、FeO)加入稀硫酸反应生成硫酸铁、硫酸亚铁、硫酸铜,加入双氧水氧化亚铁离子变为铁离子,调节溶液pH值沉淀铁离子,过滤,向滤液中加入N2H4还原硫酸铜生成氧化亚铜和氮气。“酸浸”时使用98%的浓硫酸会氧化亚铁离子,产生污染性的气体,消耗的硫酸量会增多,不利于提高原料利用率,故A错误;氧化的目的是将亚铁离子氧化为铁离子,因此“氧化”后溶液中存在的阳离子有:H+、Fe3+、Cu2+,故B错误;“调节pH”时主要是沉淀铁离子,而需要保留,因此选择CuO或Cu(OH)2来消耗氢离子,促进铁离子水解,故C正确;“还原”过程硫酸铜化合价降低1个价态,N2H4化合价升高变为氮气,升高4个价态,因此“还原”中消耗的CuSO4、N2H4的物质的量之比为4∶1,故D错误。故选C。
6. (1)柠檬酸具有较好的络合性,结合铜离子的能力强于氢氧根离子
(2)①C6H8O6+Cu(OH)2===Cu+2H2O+C6H6O6 ②反应开始阶段,随温度升高,反应速率较快,有利于铜的沉淀,但抗坏血酸不稳定,受热易分解,温度过高使其分解导致还原性降低,还原铜的能力降低
(3)①边搅拌边加入25 mL 0.5 mol·L-1 CuSO4溶液,在pH计测定溶液pH条件下,用0.1 mol·L-1 NaOH溶液或0.1 mol·L-1盐酸调节pH约为9,充分反应后,过滤、洗涤沉淀至最后一次洗涤液滴加BaCl2无沉淀生成
②溶液pH过大,反应生成了氢氧化铜沉淀,氢氧化铜中铜的含量大于碱式碳酸铜中铜的含量
解析:柠檬酸浸出液中加入碱调节pH,转化生成氢氧化铜,加入抗坏血酸还原得到铜单质,所得铜粉制备为CuSO4溶液后,向烧杯中加入30 mL 0.5 mol·L-1 Na2CO3溶液,将烧杯置于70 ℃的水浴中,边搅拌边加入25 mL 0.5 mol·L-1 CuSO4溶液,在pH计测定溶液pH条件下,用0.1 mol·L-1 NaOH溶液或0.1 mol·L-1盐酸调节pH约为9,充分反应后,过滤、洗涤沉淀至最后一次洗涤液滴加BaCl2无沉淀生成,低温烘干,得到碱式碳酸铜,据此分析。
(1)结合题干信息,柠檬酸具有较好的络合性,结合铜离子的能力强于氢氧根离子;
(2)①抗坏血酸还原Cu(OH)2的离子方程式为:C6H8O6+Cu(OH)2===Cu+2H2O+C6H6O6;②反应开始阶段,随温度升高,反应速率较快,有利于铜的沉淀,但抗坏血酸不稳定,受热易分解,温度过高使其分解导致还原性降低,还原铜的能力降低;
(3)①向烧杯中加入30 mL 0.5 mol·L-1 Na2CO3溶液,将烧杯置于70 ℃的水浴中,边搅拌边加入25 mL 0.5 mol·L-1 CuSO4溶液,在pH计测定溶液pH条件下,用0.1 mol·L-1 NaOH溶液或0.1 mol·L-1盐酸调节pH约为9,充分反应后,过滤、洗涤沉淀至最后一次洗涤液滴加BaCl2无沉淀生成,低温烘干,得到碱式碳酸铜;②溶液pH过大,反应生成了氢氧化铜沉淀,氢氧化铜中铜的含量大于碱式碳酸铜中铜的含量。
同课章节目录
