第27练 含氯化合物之间的转化 课时作业(含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第27练 含氯化合物之间的转化 课时作业(含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 223.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 10:35:41 | ||
图片预览




文档简介
第27练 含氯化合物之间的转化
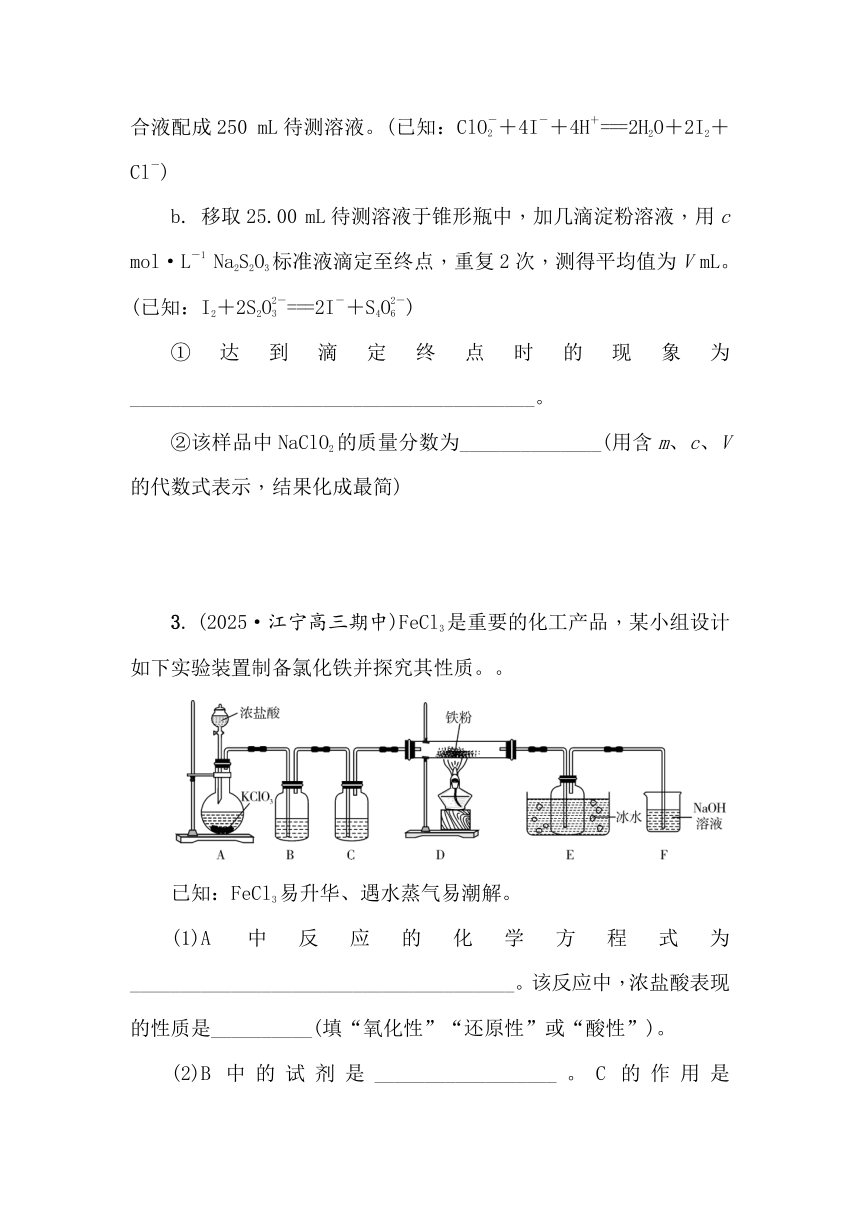
1. (2024·姜堰、如东、前黄三校联考)[Co(NH3)6]Cl3(三氯化六氨合钴,Mr=267.5)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备[Co(NH3)6]Cl3。
已知:①在pH=9.4时,Co2+恰好完全沉淀为Co(OH)2;
②不同温度下[Co(NH3)6]Cl3在水中的溶解度如图所示;
③CoCl2易潮解,Co(Ⅲ)的氧化性强于Cl2。
制备步骤如下:
Ⅰ. CoCl2的制备:用金属钴与氯气反应制备CoCl2,实验中利用如图装置(连接处橡胶管省略)进行制备。
Ⅱ. 在100 mL锥形瓶内加入5.2 g研细的CoCl2、3.5 g NH4Cl和6 mL水,加热溶解后加入0.3 g活性炭作催化剂。
Ⅲ. 冷却后,加入浓氨水混合均匀。控制温度在10 ℃以下并缓慢加入12 mL H2O2溶液。
Ⅳ. 在60 ℃下反应一段时间后,经过____________、过滤、洗涤、干燥等操作,得到橙黄色的[Co(NH3)6]Cl3晶体7.2 g。
请回答下列问题:
(1)仪器a的名称为______________。
(2)用图中的装置组合制备CoCl2,仪器的连接顺序为________________。装置B的作用是_________________________________________________________________________________________________________________________________。
(3)制备三氯化六氨合钴的反应方程式为__________________________________________________。
(4)在制备[Co(NH3)6]Cl3时,加入浓氨水前,需在步骤Ⅱ中加入NH4Cl,请结合平衡移动原理解释原因_________________________________________________________________________________________________。
(5)步骤Ⅲ中在加入H2O2溶液时,控制温度在10 ℃以下缓慢加入的目的是______________________________。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为____________、____________。
(7)制得[Co(NH3)6]Cl3产品的产率为__________%(精确到0.1%)。
2. 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中鼓入空气的作用可能是__________。
a. 将SO2氧化成SO3,增强酸性 b. 将NaClO3还原为ClO2 c. 稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为________________________________________________。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是__________(填序号)。
a. Na2O2 b. Na2S c. FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是__________(填序号)。
a. 蒸馏 b. 蒸发 c. 灼烧
d. 过滤 e. 冷却结晶
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a. 准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO+4I-+4H+===2H2O+2I2+Cl-)
b. 移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL。(已知:I2+2S2O===2I-+S4O)
①达到滴定终点时的现象为________________________________________。
②该样品中NaClO2的质量分数为______________(用含m、c、V的代数式表示,结果化成最简)
3. (2025·江宁高三期中)FeCl3是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。。
已知:FeCl3易升华、遇水蒸气易潮解。
(1)A中反应的化学方程式为______________________________________。该反应中,浓盐酸表现的性质是__________(填“氧化性”“还原性”或“酸性”)。
(2)B中的试剂是__________________。C的作用是____________。
(3)E装置中冰水浴的作用是______________________________。
(4)F中反应的离子方程式为_____________________________________________________。
(5)上述实验装置存在两处缺陷:一是______________________________________;二是________________________________。
(6)经改进,继续完成实验。实验完毕后,取产品探究其性质:
实验 操作 现象
① 取少量固体溶于蒸馏水,滴加KSCN溶液 溶液变红色
② 取少量固体溶于稀硫酸 固体溶解,无气泡产生
根据上述实验现象,__________(填“能”或“不能”)确定产品中是否含有铁单质,理由是________________________(用文字描述)。
第27练 含氯化合物之间的转化
1. (1)圆底烧瓶
(2)A→D→C→E→B 吸收多余的Cl2,防止污染空气;同时防止空气中的水蒸气进入装置E,使CoCl2潮解
(3)2CoCl2+10NH3·H2O+2NH4Cl+H2O22[Co(NH3)6]Cl3+12H2O
(4)NH4Cl溶于水电离出NH,使NH3·H2O的电离平衡逆向移动,防止加入氨水时溶液中c(OH-)过大,生成Co(OH)2沉淀
(5)控制反应速率,防止温度过高使H2O2和NH3·H2O分解
(6)趁热过滤 冷却结晶
(7)67.3
解析:利用浓盐酸和高锰酸钾反应制取氯气,通过饱和食盐水除去氯化氢杂质,再通过浓硫酸干燥,得到干燥的氯气,氯气在E中和钴加热条件下生成氯化钴,再利用氯化钴和氯化铵、氨气在活性炭催化下得到[Co(NH3)6]Cl3。
(1)仪器a的名称为圆底烧瓶。
(2)先制取氯气,再进行氯气除杂和干燥和钴反应,故顺序为A→D→C→E→B;CoCl2易潮解,防止空气中的水蒸气进入装置E,氯气有毒,也用于氯气的尾气处理。
(3)根据得失电子,元素守恒可得化学方程式为2CoCl2+10NH3·H2O+2NH4Cl+H2O22[Co(NH3)6]Cl3+12H2O。
(4)NH4Cl溶于水电离出NH,使NH3·H2O的电离平衡逆向移动,防止加入氨水时溶液中c(OH-)过大,生成Co(OH)2沉淀。
(5)缓慢加入是控制反应速率,过氧化氢和一水合氨容易分解,故温度不能过高。
(6)趁热过滤除去活性炭杂质,[Co(NH3)6]Cl3的溶解度在低温下比较小,冷却结晶得到更多产品。
(7)5.2 g研细的CoCl2,则n(CoCl2)==0.04 mol,理论上可得到[Co(NH3)6]Cl3为0.04 mol,为0.04×267.5=10.7 g,实际得到7.2 g,故产率=%=%=67.3%。
2. (1)c
(2)2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2
(3)a
(4)bed
(5)①滴加最后半滴标准液时,溶液由蓝色变成无色,且半分钟内不变色 ②%
解析:氯酸钠溶于水,加入稀硫酸,通入二氧化硫和空气发生反应生成ClO2,ClO2在二氧化硫和空气混合气体中被稀释,以防止ClO2爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2↑,生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2·3H2O,以此解答该题。
(1)由信息②可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸,故答案为c;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原,则H2O2必定被氧化,有氧气产生,反应化学方程式为:2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2;
(3)还原性要适中,还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2,Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,故答案为a;
(4)NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2·3H2O,滤液中得到NaClO2·3H2O粗晶体的实验操作依次是b、e、d,得到的粗晶体经过重结晶可得到纯度更高的晶体,故答案为b、e、d;
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O===2I-+S4O,I2与指示剂淀粉产生蓝色,故终点是滴加最后半滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO~2I2~4S2O,25.00 mL待测溶液中n(NaClO2)=×cV×10-3 mol,m(NaClO2)=×90.5cV×10-3 g;样品m g配成250 mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为×100%=%。
3. (1)KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O 还原性和酸性
(2)饱和氯化钠溶液 干燥氯气
(3)冷凝,使升华的FeCl3顺利凝结,便于收集FeCl3
(4)Cl2+2OH-===Cl-+ClO-+H2O
(5)D与E间的导气管太细,易堵塞 E和F之间缺少除水装置,F中的水蒸气易使FeCl3潮解
(6)不能 过量的三价铁离子能将少量单质铁氧化
解析:(1)A中KClO3和浓HCl反应生成Cl2、KCl、H2O,反应的化学方程式为KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。该反应中,部分浓盐酸中Cl元素化合价升高被氧化,部分氯元素化合价不变生成盐,浓盐酸表现的性质是还原性和酸性;
(2)装置B的作用是除氯气中的氯化氢,B中的试剂是饱和氯化钠溶液。装置C的作用是干燥氯气,C中的试剂是浓硫酸;
(3)FeCl3易升华,E装置中冰水浴的作用是冷凝,使升华的FeCl3顺利凝结,便于收集FeCl3;
(4)F中氢氧化钠和氯气反应生成氯化钠、次氯酸钠、水,反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O;
(5)FeCl3易升华,D与E间的导气管太细,易堵塞;FeCl3易升华、遇水蒸气易潮解,E和F之间缺少除水装置,F中的水蒸气易使FeCl3潮解;
(6)过量的三价铁离子能将少量单质铁氧化,根据上述实验现象,不能确定产品中是否含有铁单质。
1. (2024·姜堰、如东、前黄三校联考)[Co(NH3)6]Cl3(三氯化六氨合钴,Mr=267.5)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备[Co(NH3)6]Cl3。
已知:①在pH=9.4时,Co2+恰好完全沉淀为Co(OH)2;
②不同温度下[Co(NH3)6]Cl3在水中的溶解度如图所示;
③CoCl2易潮解,Co(Ⅲ)的氧化性强于Cl2。
制备步骤如下:
Ⅰ. CoCl2的制备:用金属钴与氯气反应制备CoCl2,实验中利用如图装置(连接处橡胶管省略)进行制备。
Ⅱ. 在100 mL锥形瓶内加入5.2 g研细的CoCl2、3.5 g NH4Cl和6 mL水,加热溶解后加入0.3 g活性炭作催化剂。
Ⅲ. 冷却后,加入浓氨水混合均匀。控制温度在10 ℃以下并缓慢加入12 mL H2O2溶液。
Ⅳ. 在60 ℃下反应一段时间后,经过____________、过滤、洗涤、干燥等操作,得到橙黄色的[Co(NH3)6]Cl3晶体7.2 g。
请回答下列问题:
(1)仪器a的名称为______________。
(2)用图中的装置组合制备CoCl2,仪器的连接顺序为________________。装置B的作用是_________________________________________________________________________________________________________________________________。
(3)制备三氯化六氨合钴的反应方程式为__________________________________________________。
(4)在制备[Co(NH3)6]Cl3时,加入浓氨水前,需在步骤Ⅱ中加入NH4Cl,请结合平衡移动原理解释原因_________________________________________________________________________________________________。
(5)步骤Ⅲ中在加入H2O2溶液时,控制温度在10 ℃以下缓慢加入的目的是______________________________。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为____________、____________。
(7)制得[Co(NH3)6]Cl3产品的产率为__________%(精确到0.1%)。
2. 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)发生器中鼓入空气的作用可能是__________。
a. 将SO2氧化成SO3,增强酸性 b. 将NaClO3还原为ClO2 c. 稀释ClO2以防止爆炸
(2)吸收塔内发生反应的化学方程式为________________________________________________。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是__________(填序号)。
a. Na2O2 b. Na2S c. FeCl2
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是__________(填序号)。
a. 蒸馏 b. 蒸发 c. 灼烧
d. 过滤 e. 冷却结晶
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a. 准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO+4I-+4H+===2H2O+2I2+Cl-)
b. 移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL。(已知:I2+2S2O===2I-+S4O)
①达到滴定终点时的现象为________________________________________。
②该样品中NaClO2的质量分数为______________(用含m、c、V的代数式表示,结果化成最简)
3. (2025·江宁高三期中)FeCl3是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。。
已知:FeCl3易升华、遇水蒸气易潮解。
(1)A中反应的化学方程式为______________________________________。该反应中,浓盐酸表现的性质是__________(填“氧化性”“还原性”或“酸性”)。
(2)B中的试剂是__________________。C的作用是____________。
(3)E装置中冰水浴的作用是______________________________。
(4)F中反应的离子方程式为_____________________________________________________。
(5)上述实验装置存在两处缺陷:一是______________________________________;二是________________________________。
(6)经改进,继续完成实验。实验完毕后,取产品探究其性质:
实验 操作 现象
① 取少量固体溶于蒸馏水,滴加KSCN溶液 溶液变红色
② 取少量固体溶于稀硫酸 固体溶解,无气泡产生
根据上述实验现象,__________(填“能”或“不能”)确定产品中是否含有铁单质,理由是________________________(用文字描述)。
第27练 含氯化合物之间的转化
1. (1)圆底烧瓶
(2)A→D→C→E→B 吸收多余的Cl2,防止污染空气;同时防止空气中的水蒸气进入装置E,使CoCl2潮解
(3)2CoCl2+10NH3·H2O+2NH4Cl+H2O22[Co(NH3)6]Cl3+12H2O
(4)NH4Cl溶于水电离出NH,使NH3·H2O的电离平衡逆向移动,防止加入氨水时溶液中c(OH-)过大,生成Co(OH)2沉淀
(5)控制反应速率,防止温度过高使H2O2和NH3·H2O分解
(6)趁热过滤 冷却结晶
(7)67.3
解析:利用浓盐酸和高锰酸钾反应制取氯气,通过饱和食盐水除去氯化氢杂质,再通过浓硫酸干燥,得到干燥的氯气,氯气在E中和钴加热条件下生成氯化钴,再利用氯化钴和氯化铵、氨气在活性炭催化下得到[Co(NH3)6]Cl3。
(1)仪器a的名称为圆底烧瓶。
(2)先制取氯气,再进行氯气除杂和干燥和钴反应,故顺序为A→D→C→E→B;CoCl2易潮解,防止空气中的水蒸气进入装置E,氯气有毒,也用于氯气的尾气处理。
(3)根据得失电子,元素守恒可得化学方程式为2CoCl2+10NH3·H2O+2NH4Cl+H2O22[Co(NH3)6]Cl3+12H2O。
(4)NH4Cl溶于水电离出NH,使NH3·H2O的电离平衡逆向移动,防止加入氨水时溶液中c(OH-)过大,生成Co(OH)2沉淀。
(5)缓慢加入是控制反应速率,过氧化氢和一水合氨容易分解,故温度不能过高。
(6)趁热过滤除去活性炭杂质,[Co(NH3)6]Cl3的溶解度在低温下比较小,冷却结晶得到更多产品。
(7)5.2 g研细的CoCl2,则n(CoCl2)==0.04 mol,理论上可得到[Co(NH3)6]Cl3为0.04 mol,为0.04×267.5=10.7 g,实际得到7.2 g,故产率=%=%=67.3%。
2. (1)c
(2)2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2
(3)a
(4)bed
(5)①滴加最后半滴标准液时,溶液由蓝色变成无色,且半分钟内不变色 ②%
解析:氯酸钠溶于水,加入稀硫酸,通入二氧化硫和空气发生反应生成ClO2,ClO2在二氧化硫和空气混合气体中被稀释,以防止ClO2爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2↑,生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2·3H2O,以此解答该题。
(1)由信息②可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸,故答案为c;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原,则H2O2必定被氧化,有氧气产生,反应化学方程式为:2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2;
(3)还原性要适中,还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2,Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,故答案为a;
(4)NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2·3H2O,滤液中得到NaClO2·3H2O粗晶体的实验操作依次是b、e、d,得到的粗晶体经过重结晶可得到纯度更高的晶体,故答案为b、e、d;
(5)①因为是用Na2S2O3标准液滴定至终点,反应是I2+2S2O===2I-+S4O,I2与指示剂淀粉产生蓝色,故终点是滴加最后半滴液体时溶液由蓝色变成无色且半分钟内不变色;
②由反应中的I元素守恒可知:ClO~2I2~4S2O,25.00 mL待测溶液中n(NaClO2)=×cV×10-3 mol,m(NaClO2)=×90.5cV×10-3 g;样品m g配成250 mL待测溶液中的NaClO2质量扩大10倍,故样品中NaClO2的质量分数为×100%=%。
3. (1)KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O 还原性和酸性
(2)饱和氯化钠溶液 干燥氯气
(3)冷凝,使升华的FeCl3顺利凝结,便于收集FeCl3
(4)Cl2+2OH-===Cl-+ClO-+H2O
(5)D与E间的导气管太细,易堵塞 E和F之间缺少除水装置,F中的水蒸气易使FeCl3潮解
(6)不能 过量的三价铁离子能将少量单质铁氧化
解析:(1)A中KClO3和浓HCl反应生成Cl2、KCl、H2O,反应的化学方程式为KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。该反应中,部分浓盐酸中Cl元素化合价升高被氧化,部分氯元素化合价不变生成盐,浓盐酸表现的性质是还原性和酸性;
(2)装置B的作用是除氯气中的氯化氢,B中的试剂是饱和氯化钠溶液。装置C的作用是干燥氯气,C中的试剂是浓硫酸;
(3)FeCl3易升华,E装置中冰水浴的作用是冷凝,使升华的FeCl3顺利凝结,便于收集FeCl3;
(4)F中氢氧化钠和氯气反应生成氯化钠、次氯酸钠、水,反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O;
(5)FeCl3易升华,D与E间的导气管太细,易堵塞;FeCl3易升华、遇水蒸气易潮解,E和F之间缺少除水装置,F中的水蒸气易使FeCl3潮解;
(6)过量的三价铁离子能将少量单质铁氧化,根据上述实验现象,不能确定产品中是否含有铁单质。
同课章节目录
