第28练 卤素 卤素离子的检验 课时作业(含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第28练 卤素 卤素离子的检验 课时作业(含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 252.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 10:37:50 | ||
图片预览




文档简介
第28练 卤素 卤素离子的检验
一、 单项选择题
1. (2024·常州中学高三上开学考)探究卤族元素单质及其化合物的性质,下列实验方案能达到探究目的的是( )
实验方案 探究目的
A 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液,观察溶液颜色变化 氧化性:Cl2>Br2>I2
B 往碘的CCl4溶液中加入等体积浓KI溶液,振荡分层,下层由紫红色变成浅粉红色,上层呈棕黄色 碘在浓KI溶液的溶解能力大于在CCl4中的溶解能力
C 常温下,向盛有NaCl、NaI的混合溶液中加入2滴0.1 mol·L-1 AgNO3溶液,观察沉淀颜色 Ksp(AgCl)>Ksp(AgI)
D 取两份新制氯水,分别滴加AgNO3溶液和淀粉KI溶液,观察实验现象 氯气与水的反应是否存在限度
2. 下列说法不正确的是( )
A. 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量新制氯水,充分反应后加入1~2滴淀粉溶液,溶液变蓝,则证明海带中含有碘元素
B. 将X溶液滴在淀粉碘化钾淀粉试纸上,试纸变蓝色,说明X溶液中一定含有I2
C. 饱和氯水既有酸性,又有漂白性,加入适量NaHCO3固体,其漂白性增强
D. 向品红溶液中滴加新制氯水,观察溶液颜色变化,探究氯水是否具有漂白性
3. (2024·灌南高中高三上检测)一种海水提溴的部分工艺流程如图所示。下列说法错误的是( )
“氧化”和“转化”工序中Cl2的主要作用相同
B. 水相Ⅰ和水相Ⅱ中均含有H+和Cl-
C. “洗脱”工序可完成R3NCl的再生
D. 保存液溴时加适量水的主要作用是防止溴单质被氧化
4. (2024·姜堰、如东、沐阳如东三校高三联考)以卤水(富含I-)为原料用高分子树脂提取碘的工艺流程如图所示,下列说法不正确的是( )
A. “氧化1”过程既可以用Cl2,也可以用H2O2
B. “解脱”用Na2SO3将I2还原为I-,离子方程式为I2+SO+2OH-===2I-+SO+H2O
C. 用高分子树脂“吸附”,再“解脱”是为了便于分离富集碘元素
D. “提纯”过程先萃取分液、蒸馏得到粗产品,再升华纯化
二、 非选择题
5.
(2024·常州中学高三上开学考)无水碘化钠是一种白色粉末被广泛地应用于石油探测、安检、环境监测等领域。按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按NaHCO3、I2和水合肼的投料顺序分批加入。
已知:①I2+2NaHCO3===NaI+NaIO+H2O+2CO2↑ ΔH1<0
3I2+6NaHCO3===5NaI+NaIO3+3H2O+6CO2↑ ΔH2<0
②I2(s)+I-(aq)??I(aq) ΔH3
③水合肼(N2H4·H2O)具有强还原性,可分别将IO-、IO和I2,还原为I-,自身被氧化为无污染的气体;
(1)①写出I与NaHCO3反应生成IO的离子方程式_________________________________________。
②加入稍过量水合肼与IO-反应的离子方程式为_____________________________________________。
③常温常压时,下列措施一定能提高NaI的生成效率的是__________(填字母)。
a. 将碘块研成粉末 b. 起始时加少量NaI c. 将溶液加热 d. 加大高纯水的用量
(2)I2与NaHCO3溶液反应适宜温度为50~60 ℃,原因是____________________________________________,整个实验过程中都需要开动搅拌器,其目的是____________________________________。
(3)所得溶液(含SO)进行提纯,可制得较纯的NaI晶体。实验方案为:________________________________,得到NaI晶体。[实验中须使用的试剂:HI溶液、Na2CO3溶液、Ba(OH)2溶液、高纯水:除常用仪器外须使用的仪器:pH计]
6. 工业上以浓缩海水为原料提取溴的部分流程如下:
已知:吸收塔中的主要反应为3Br2+3CO===5Br-+BrO+3CO2。
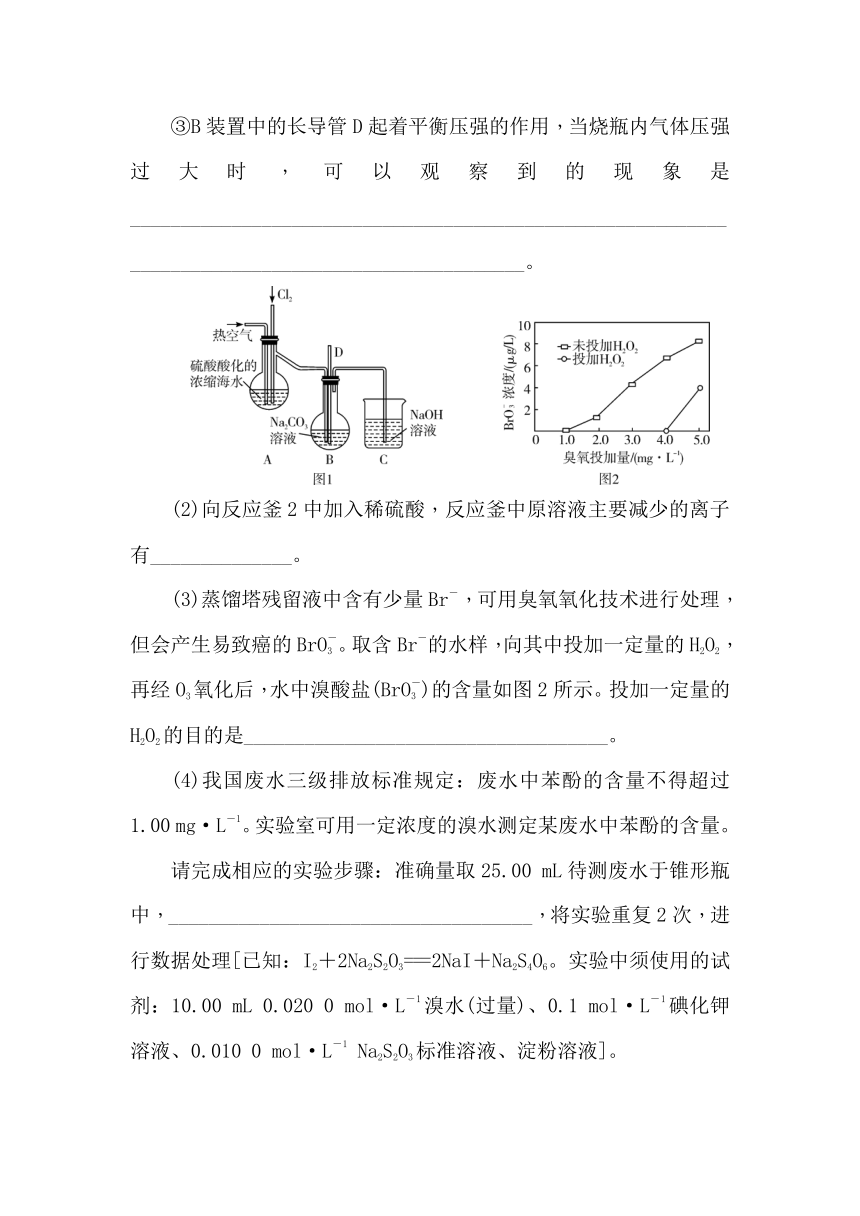
(1)实验室使用如图1所示装置模拟上述流程的①~③。
①实验室以浓盐酸和MnO2为原料在加热条件下制取氯气的离子方程式为_____________________________。
②A装置中,先通入Cl2一段时间,再通入热空气。通入热空气的目的是________________________________。
③B装置中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,可以观察到的现象是__________________________________________________________________________________________________。
(2)向反应釜2中加入稀硫酸,反应釜中原溶液主要减少的离子有______________。
(3)蒸馏塔残留液中含有少量Br-,可用臭氧氧化技术进行处理,但会产生易致癌的BrO。取含Br-的水样,向其中投加一定量的H2O2,再经O3氧化后,水中溴酸盐(BrO)的含量如图2所示。投加一定量的H2O2的目的是____________________________________。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00 mg·L-1。实验室可用一定浓度的溴水测定某废水中苯酚的含量。
请完成相应的实验步骤:准确量取25.00 mL待测废水于锥形瓶中,____________________________________,将实验重复2次,进行数据处理[已知:I2+2Na2S2O3===2NaI+Na2S4O6。实验中须使用的试剂:10.00 mL 0.020 0 mol·L-1溴水(过量)、0.1 mol·L-1碘化钾溶液、0.010 0 mol·L-1 Na2S2O3标准溶液、淀粉溶液]。
第28练 卤素 卤素离子的检验
1. B 解析:过量氯水会优先与碘化钾溶液反应生成单质碘使淀粉溶液变蓝色,反应生成的溴不能与碘化钾溶液反应,则无法比较溴和碘的非金属性强弱,A错误;向碘的四氯化碳溶液中加入等体积浓KI溶液,振荡,静置,溶液分层,下层由紫红色变为浅粉红色,上层呈棕黄色,说明碘的四氯化碳溶液中的I2与KI溶液中I-反应生成I使上层溶液呈棕黄色,证明碘在浓KI溶液中的溶解能力大于在四氯化碳中的溶解能力,B正确;向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成,说明先生成碘化银沉淀,由于未指明NaCl、NaI的浓度,所以无法判断Ksp(AgCl)、Ksp(AgI)的相对大小,C错误;新制氯水中的氯气和次氯酸都能与碘化钾溶液反应生成使淀粉变蓝色的碘,则溶液变蓝色不能说明溶液中存在氯气分子,无法证明氯气与水的反应存在限度,D错误。故选B。
2. B 解析:淀粉溶液遇I2变蓝,将X溶液滴在淀粉碘化钾试纸上,试纸变蓝,不能说明X溶液中一定有I2,也可能是X溶液具有氧化性,能将淀粉碘化钾试纸上的I-氧化为I2,B错误。
3. D 解析:卤水“氧化”时氯气与卤水反应置换出Br2,同时氯气与水反应生成HCl进入水相Ⅰ;“还原”时SO2与R3N[ClBr2]反应生成H2SO4、HBr、R3NCl,R3NCl再与HBr反应生成HCl和R3NBr,用盐酸“洗脱”R3NBr生成HBr和R3NCl,HBr被氯气氧化得到溴单质,蒸馏得到液溴。“氧化”和“转化”工序中Cl2的主要作用均为氧化Br-,A项正确;由流程中转化关系知,“氧化”时氯气与卤水反应置换出Br2,同时氯气与水反应生成HCl进入水相Ⅰ;“还原”时SO2与R3N[ClBr2]反应生成H2SO4、HBr、R3NCl,R3NCl再与HBr反应生成HCl和R3NBr,故水相Ⅱ中含H+和Cl-,则水相Ⅰ和水相Ⅱ中均含有H+和Cl-,B项正确;用盐酸“洗脱”R3NBr生成HBr同时生成R3NCl,可完成R3NCl的再生,C项正确;保存液溴时加适量水的主要作用是防止溴单质挥发,D项错误。故选D。
4. B 解析:由题给流程可知,卤水酸化后,通入氯气或加入过氧化氢等氧化剂将碘离子氧化为碘,用高分子树脂吸附溶液中的碘,向吸附后的树脂中加入亚硫酸钠溶液将碘还原为碘离子得到解脱液,向解脱液中通入氯气或加入过氧化氢等氧化剂将碘离子氧化为碘,向反应后的溶液中加入有机溶剂,经萃取分液、蒸馏得到粗产品,粗产品再升华纯化得到碘产品。由分析可知,卤水酸化后,通入氯气或加入过氧化氢等氧化剂将碘离子氧化为碘,故A正确;由分析可知,解脱发生的反应为亚硫酸钠溶液与碘反应生成硫酸钠和氢碘酸,反应的离子方程式为I2+SO+H2O===2I-+SO+2H+,故B错误;由分析可知,卤水经酸化、氧化1后,用高分子树脂“吸附”,再“解脱”增大了溶液中的碘离子浓度,则用高分子树脂“吸附”,再“解脱”的目的是便于分离富集碘元素,故C正确;由分析可知,“提纯”过程为向反应后的溶液中加入有机溶剂,经萃取分液、蒸馏得到粗产品,粗产品再升华纯化得到碘产品,故D正确。故选B。
5. (1)①3I+6HCO===IO+8I-+6CO2↑+3H2O ②N2H4·H2O+2IO-===2I-+N2↑+3H2O ③ab
(2)温度过低,反应速率过慢;温度过高,I2易升华 使物质混合均匀,散热、让气体逸出
(3)向所得液中依次加入过量的Ba(OH)2溶液、Na2CO3溶液,过滤,在滤液中加入HI溶液并用pH计测定大约为7,滤液经蒸发浓缩,降温结晶,过滤,用高纯水洗涤2~3次,干燥
解析:向三颈烧瓶中先加入适量的高纯水,然后加入NaHCO3、I2,充分反应后生成IO-、IO、I-,再向生成的混合溶液中加入水合肼并分批加入,将IO-、IO和I2还原为I-,水合肼被氧化为氮气。
(1)①根据3I2+6NaHCO3===5NaI+NaIO3+3H2O+6CO2↑减去方程式I2(s)+I-(aq)??I(aq)的3倍得到I与NaHCO3反应生成IO的离子方程式:3I+6HCO===IO+8I-+6CO2↑+3H2O;②根据水合肼(N2H4·H2O)具有强还原性,能将IO-还原为I-,自身被氧化为无污染的气体;则加入稍过量水合肼与IO-反应的离子方程式为N2H4·H2O+2IO-===2I-+N2↑+3H2O;③将碘块研成粉末,增大接触面积,加快反应速率,从而提高NaI的生成效率,a符合题意;起始时加少量NaI,由于I2(s)+I-(aq)??I(aq),则使单质碘变为I(aq),与NaHCO3溶液接触更充分,会加快反应速率,从而提高NaI的生成效率,故b符合题意;生成NaI的反应均为放热反应,将溶液适当加热,使平衡逆向移动,不利于生成NaI,故c不符合题意;加大高纯水的用量,浓度降低,反应速率减慢,不利于提高NaI的生成效率,故d不符合题意。故选ab;
(2)I2与NaHCO3溶液反应适宜温度为50~60 ℃,主要从速率和单质碘的性质分析,其原因是温度过低,反应速率过慢,温度过高,I2易升华;I2与NaHCO3溶液反应是放热反应,因此整个实验过程中都需要开动搅拌器,其目的是使物质混合均匀,散热、让气体逸出;
(3)所得溶液(含SO)进行提纯,可制得较纯的NaI晶体。实验方案为:向所得液中依次加入过量的Ba(OH)2溶液除掉硫酸根离子,再向溶液中加入Na2CO3溶液沉淀多余的钡离子并过滤,在滤液中加入HI溶液中和氢氧根和碳酸根并用pH计测定大约为7,滤液经蒸发浓缩,降温结晶,过滤,用高纯水洗涤2~3次,干燥。
6. (1)①4H++2Cl-+MnO2Cl2↑+Mn2++2H2O ②将Br2从溶液中吹出
③长导管D中液面上升
(2)Br-、BrO
(3)与生成的BrO反应,消耗BrO
(4)将10.00 mL 0.02 mol·L-1溴水迅速加入锥形瓶中,塞紧瓶塞,振荡,打开瓶塞,向锥形瓶中加入过量的0.1 mol·L-1 KI溶液(至颜色不再变深),振荡,滴入2~3滴淀粉溶液,再用0.01 mol·L-1 Na2S2O3标准溶液滴定至蓝色恰好褪去,记录消耗Na2S2O3溶液的体积
解析:(1)②A装置中,先通入Cl2,Cl2将海水中的Br-氧化为Br2,再通入热空气,将A装置中的Br2吹入B装置中,然后被Na2CO3溶液吸收。③当烧瓶内气体压强过大时,长导管D中液面上升。
(2)Na2CO3溶液吸收Br2的离子方程式为3Br2+3CO===5Br-+BrO+3CO2,向反应釜中加硫酸,发生的反应为5Br-+BrO+6H+===3Br2+3H2O,故反应釜中原溶液主要减少的离子为Br-、BrO。
(3)分析图像可知,加入一定量的H2O2,溶液中BrO浓度明显减小,H2O2作用是与生成的溴酸盐反应,消耗溴酸盐。
(4)测定原理:先向废水中加入过量溴水将苯酚完全反应,过量的溴水用KI还原为Br-,最后用Na2S2O3标准溶液滴定生成的I2。
一、 单项选择题
1. (2024·常州中学高三上开学考)探究卤族元素单质及其化合物的性质,下列实验方案能达到探究目的的是( )
实验方案 探究目的
A 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液,观察溶液颜色变化 氧化性:Cl2>Br2>I2
B 往碘的CCl4溶液中加入等体积浓KI溶液,振荡分层,下层由紫红色变成浅粉红色,上层呈棕黄色 碘在浓KI溶液的溶解能力大于在CCl4中的溶解能力
C 常温下,向盛有NaCl、NaI的混合溶液中加入2滴0.1 mol·L-1 AgNO3溶液,观察沉淀颜色 Ksp(AgCl)>Ksp(AgI)
D 取两份新制氯水,分别滴加AgNO3溶液和淀粉KI溶液,观察实验现象 氯气与水的反应是否存在限度
2. 下列说法不正确的是( )
A. 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量新制氯水,充分反应后加入1~2滴淀粉溶液,溶液变蓝,则证明海带中含有碘元素
B. 将X溶液滴在淀粉碘化钾淀粉试纸上,试纸变蓝色,说明X溶液中一定含有I2
C. 饱和氯水既有酸性,又有漂白性,加入适量NaHCO3固体,其漂白性增强
D. 向品红溶液中滴加新制氯水,观察溶液颜色变化,探究氯水是否具有漂白性
3. (2024·灌南高中高三上检测)一种海水提溴的部分工艺流程如图所示。下列说法错误的是( )
“氧化”和“转化”工序中Cl2的主要作用相同
B. 水相Ⅰ和水相Ⅱ中均含有H+和Cl-
C. “洗脱”工序可完成R3NCl的再生
D. 保存液溴时加适量水的主要作用是防止溴单质被氧化
4. (2024·姜堰、如东、沐阳如东三校高三联考)以卤水(富含I-)为原料用高分子树脂提取碘的工艺流程如图所示,下列说法不正确的是( )
A. “氧化1”过程既可以用Cl2,也可以用H2O2
B. “解脱”用Na2SO3将I2还原为I-,离子方程式为I2+SO+2OH-===2I-+SO+H2O
C. 用高分子树脂“吸附”,再“解脱”是为了便于分离富集碘元素
D. “提纯”过程先萃取分液、蒸馏得到粗产品,再升华纯化
二、 非选择题
5.
(2024·常州中学高三上开学考)无水碘化钠是一种白色粉末被广泛地应用于石油探测、安检、环境监测等领域。按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按NaHCO3、I2和水合肼的投料顺序分批加入。
已知:①I2+2NaHCO3===NaI+NaIO+H2O+2CO2↑ ΔH1<0
3I2+6NaHCO3===5NaI+NaIO3+3H2O+6CO2↑ ΔH2<0
②I2(s)+I-(aq)??I(aq) ΔH3
③水合肼(N2H4·H2O)具有强还原性,可分别将IO-、IO和I2,还原为I-,自身被氧化为无污染的气体;
(1)①写出I与NaHCO3反应生成IO的离子方程式_________________________________________。
②加入稍过量水合肼与IO-反应的离子方程式为_____________________________________________。
③常温常压时,下列措施一定能提高NaI的生成效率的是__________(填字母)。
a. 将碘块研成粉末 b. 起始时加少量NaI c. 将溶液加热 d. 加大高纯水的用量
(2)I2与NaHCO3溶液反应适宜温度为50~60 ℃,原因是____________________________________________,整个实验过程中都需要开动搅拌器,其目的是____________________________________。
(3)所得溶液(含SO)进行提纯,可制得较纯的NaI晶体。实验方案为:________________________________,得到NaI晶体。[实验中须使用的试剂:HI溶液、Na2CO3溶液、Ba(OH)2溶液、高纯水:除常用仪器外须使用的仪器:pH计]
6. 工业上以浓缩海水为原料提取溴的部分流程如下:
已知:吸收塔中的主要反应为3Br2+3CO===5Br-+BrO+3CO2。
(1)实验室使用如图1所示装置模拟上述流程的①~③。
①实验室以浓盐酸和MnO2为原料在加热条件下制取氯气的离子方程式为_____________________________。
②A装置中,先通入Cl2一段时间,再通入热空气。通入热空气的目的是________________________________。
③B装置中的长导管D起着平衡压强的作用,当烧瓶内气体压强过大时,可以观察到的现象是__________________________________________________________________________________________________。
(2)向反应釜2中加入稀硫酸,反应釜中原溶液主要减少的离子有______________。
(3)蒸馏塔残留液中含有少量Br-,可用臭氧氧化技术进行处理,但会产生易致癌的BrO。取含Br-的水样,向其中投加一定量的H2O2,再经O3氧化后,水中溴酸盐(BrO)的含量如图2所示。投加一定量的H2O2的目的是____________________________________。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00 mg·L-1。实验室可用一定浓度的溴水测定某废水中苯酚的含量。
请完成相应的实验步骤:准确量取25.00 mL待测废水于锥形瓶中,____________________________________,将实验重复2次,进行数据处理[已知:I2+2Na2S2O3===2NaI+Na2S4O6。实验中须使用的试剂:10.00 mL 0.020 0 mol·L-1溴水(过量)、0.1 mol·L-1碘化钾溶液、0.010 0 mol·L-1 Na2S2O3标准溶液、淀粉溶液]。
第28练 卤素 卤素离子的检验
1. B 解析:过量氯水会优先与碘化钾溶液反应生成单质碘使淀粉溶液变蓝色,反应生成的溴不能与碘化钾溶液反应,则无法比较溴和碘的非金属性强弱,A错误;向碘的四氯化碳溶液中加入等体积浓KI溶液,振荡,静置,溶液分层,下层由紫红色变为浅粉红色,上层呈棕黄色,说明碘的四氯化碳溶液中的I2与KI溶液中I-反应生成I使上层溶液呈棕黄色,证明碘在浓KI溶液中的溶解能力大于在四氯化碳中的溶解能力,B正确;向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成,说明先生成碘化银沉淀,由于未指明NaCl、NaI的浓度,所以无法判断Ksp(AgCl)、Ksp(AgI)的相对大小,C错误;新制氯水中的氯气和次氯酸都能与碘化钾溶液反应生成使淀粉变蓝色的碘,则溶液变蓝色不能说明溶液中存在氯气分子,无法证明氯气与水的反应存在限度,D错误。故选B。
2. B 解析:淀粉溶液遇I2变蓝,将X溶液滴在淀粉碘化钾试纸上,试纸变蓝,不能说明X溶液中一定有I2,也可能是X溶液具有氧化性,能将淀粉碘化钾试纸上的I-氧化为I2,B错误。
3. D 解析:卤水“氧化”时氯气与卤水反应置换出Br2,同时氯气与水反应生成HCl进入水相Ⅰ;“还原”时SO2与R3N[ClBr2]反应生成H2SO4、HBr、R3NCl,R3NCl再与HBr反应生成HCl和R3NBr,用盐酸“洗脱”R3NBr生成HBr和R3NCl,HBr被氯气氧化得到溴单质,蒸馏得到液溴。“氧化”和“转化”工序中Cl2的主要作用均为氧化Br-,A项正确;由流程中转化关系知,“氧化”时氯气与卤水反应置换出Br2,同时氯气与水反应生成HCl进入水相Ⅰ;“还原”时SO2与R3N[ClBr2]反应生成H2SO4、HBr、R3NCl,R3NCl再与HBr反应生成HCl和R3NBr,故水相Ⅱ中含H+和Cl-,则水相Ⅰ和水相Ⅱ中均含有H+和Cl-,B项正确;用盐酸“洗脱”R3NBr生成HBr同时生成R3NCl,可完成R3NCl的再生,C项正确;保存液溴时加适量水的主要作用是防止溴单质挥发,D项错误。故选D。
4. B 解析:由题给流程可知,卤水酸化后,通入氯气或加入过氧化氢等氧化剂将碘离子氧化为碘,用高分子树脂吸附溶液中的碘,向吸附后的树脂中加入亚硫酸钠溶液将碘还原为碘离子得到解脱液,向解脱液中通入氯气或加入过氧化氢等氧化剂将碘离子氧化为碘,向反应后的溶液中加入有机溶剂,经萃取分液、蒸馏得到粗产品,粗产品再升华纯化得到碘产品。由分析可知,卤水酸化后,通入氯气或加入过氧化氢等氧化剂将碘离子氧化为碘,故A正确;由分析可知,解脱发生的反应为亚硫酸钠溶液与碘反应生成硫酸钠和氢碘酸,反应的离子方程式为I2+SO+H2O===2I-+SO+2H+,故B错误;由分析可知,卤水经酸化、氧化1后,用高分子树脂“吸附”,再“解脱”增大了溶液中的碘离子浓度,则用高分子树脂“吸附”,再“解脱”的目的是便于分离富集碘元素,故C正确;由分析可知,“提纯”过程为向反应后的溶液中加入有机溶剂,经萃取分液、蒸馏得到粗产品,粗产品再升华纯化得到碘产品,故D正确。故选B。
5. (1)①3I+6HCO===IO+8I-+6CO2↑+3H2O ②N2H4·H2O+2IO-===2I-+N2↑+3H2O ③ab
(2)温度过低,反应速率过慢;温度过高,I2易升华 使物质混合均匀,散热、让气体逸出
(3)向所得液中依次加入过量的Ba(OH)2溶液、Na2CO3溶液,过滤,在滤液中加入HI溶液并用pH计测定大约为7,滤液经蒸发浓缩,降温结晶,过滤,用高纯水洗涤2~3次,干燥
解析:向三颈烧瓶中先加入适量的高纯水,然后加入NaHCO3、I2,充分反应后生成IO-、IO、I-,再向生成的混合溶液中加入水合肼并分批加入,将IO-、IO和I2还原为I-,水合肼被氧化为氮气。
(1)①根据3I2+6NaHCO3===5NaI+NaIO3+3H2O+6CO2↑减去方程式I2(s)+I-(aq)??I(aq)的3倍得到I与NaHCO3反应生成IO的离子方程式:3I+6HCO===IO+8I-+6CO2↑+3H2O;②根据水合肼(N2H4·H2O)具有强还原性,能将IO-还原为I-,自身被氧化为无污染的气体;则加入稍过量水合肼与IO-反应的离子方程式为N2H4·H2O+2IO-===2I-+N2↑+3H2O;③将碘块研成粉末,增大接触面积,加快反应速率,从而提高NaI的生成效率,a符合题意;起始时加少量NaI,由于I2(s)+I-(aq)??I(aq),则使单质碘变为I(aq),与NaHCO3溶液接触更充分,会加快反应速率,从而提高NaI的生成效率,故b符合题意;生成NaI的反应均为放热反应,将溶液适当加热,使平衡逆向移动,不利于生成NaI,故c不符合题意;加大高纯水的用量,浓度降低,反应速率减慢,不利于提高NaI的生成效率,故d不符合题意。故选ab;
(2)I2与NaHCO3溶液反应适宜温度为50~60 ℃,主要从速率和单质碘的性质分析,其原因是温度过低,反应速率过慢,温度过高,I2易升华;I2与NaHCO3溶液反应是放热反应,因此整个实验过程中都需要开动搅拌器,其目的是使物质混合均匀,散热、让气体逸出;
(3)所得溶液(含SO)进行提纯,可制得较纯的NaI晶体。实验方案为:向所得液中依次加入过量的Ba(OH)2溶液除掉硫酸根离子,再向溶液中加入Na2CO3溶液沉淀多余的钡离子并过滤,在滤液中加入HI溶液中和氢氧根和碳酸根并用pH计测定大约为7,滤液经蒸发浓缩,降温结晶,过滤,用高纯水洗涤2~3次,干燥。
6. (1)①4H++2Cl-+MnO2Cl2↑+Mn2++2H2O ②将Br2从溶液中吹出
③长导管D中液面上升
(2)Br-、BrO
(3)与生成的BrO反应,消耗BrO
(4)将10.00 mL 0.02 mol·L-1溴水迅速加入锥形瓶中,塞紧瓶塞,振荡,打开瓶塞,向锥形瓶中加入过量的0.1 mol·L-1 KI溶液(至颜色不再变深),振荡,滴入2~3滴淀粉溶液,再用0.01 mol·L-1 Na2S2O3标准溶液滴定至蓝色恰好褪去,记录消耗Na2S2O3溶液的体积
解析:(1)②A装置中,先通入Cl2,Cl2将海水中的Br-氧化为Br2,再通入热空气,将A装置中的Br2吹入B装置中,然后被Na2CO3溶液吸收。③当烧瓶内气体压强过大时,长导管D中液面上升。
(2)Na2CO3溶液吸收Br2的离子方程式为3Br2+3CO===5Br-+BrO+3CO2,向反应釜中加硫酸,发生的反应为5Br-+BrO+6H+===3Br2+3H2O,故反应釜中原溶液主要减少的离子为Br-、BrO。
(3)分析图像可知,加入一定量的H2O2,溶液中BrO浓度明显减小,H2O2作用是与生成的溴酸盐反应,消耗溴酸盐。
(4)测定原理:先向废水中加入过量溴水将苯酚完全反应,过量的溴水用KI还原为Br-,最后用Na2S2O3标准溶液滴定生成的I2。
同课章节目录
