第22练 铁的重要化合物的转化(实验及工艺流程) 课时作业(含解析)2026届高三化学一轮总复习
文档属性
| 名称 | 第22练 铁的重要化合物的转化(实验及工艺流程) 课时作业(含解析)2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 430.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 10:41:59 | ||
图片预览




文档简介
第22练 铁的重要化合物的转化(实验及工艺流程)
一、 单项选择题
1. (2024·常州高三下模拟预测)实验室用如图所示装置(夹持仪器已省略)制备半导体材料纳米二硫化亚铁(FeS2):将一定比例的Fe2O3、硫粉加入三颈烧瓶中,再加入一定量的有机物X(沸点为350 ℃)和有机酸Y;290 ℃条件下搅拌,一段时间后得到黑色悬浊液;冷却、分离、干燥得到产品。下列对实验事实的解释不合理的是( )
实验事实 解释
A 反应的溶剂用有机物X而不用水 有机物X易溶解硫且沸点较高
B 有机酸Y有利于Fe2O3的转化 有机酸Y能与Fe2O3反应,有利于Fe3+参与后续反应
C 冷凝管内出现黄色气体 加热条件下有硫蒸气产生
D 产品中n(Fe)∶n(S)=1∶1.87 产品中与S结合的Fe2+部分转化为Fe3+
2. (2025·楚中、新马高三期中联考)由硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)制取绿矾的流程如下:
下列有关说法不正确的是( )
A. “酸溶”时先将烧渣粉碎并不断搅拌,可提高铁元素的浸出率
B. “反应”时发生的主要反应为2Fe3++Fe===3Fe2+
C. “检验”时可用K4[Fe(CN)6]溶液检验上一步“反应”是否进行完全
D. 将第二次“过滤”所得滤液加热,经蒸发结晶可以制得绿矾
二、 非选择题
3. 实验室以FeS2为原料制备磷酸亚铁晶体[Fe3(PO4)2·8H2O],其部分实验过程如下:
(1)将一定体积98%的浓硫酸稀释为200 mL 30%的硫酸,除量筒外,还必须使用的玻璃仪器有______________。
(2)检验“还原”已完全的实验操作为______________________________________________________。
(3)向过滤后的滤液中加入Na2HPO4,并用氨水或CH3COONa调节溶液pH,“共沉淀”生成Fe3(PO4)2·8H2O。
①若使用CH3COONa调节溶液pH,“共沉淀”反应的离子方程式为_____________________________________。
②不使用NaOH调节溶液pH的原因是_____________________________________________________。
③补充完整利用图所示装置(夹持装置已略去)制取Fe3(PO4)2·8H2O的实验方案:向三颈烧瓶中加入抗坏血酸溶液,_______________至混合液pH≈4,____________________________________________________________,充分搅拌一段时间,过滤,洗涤固体,真空干燥。(已知:所用抗坏血酸溶液pH=2.8,当溶液pH控制在4~6之间时,所得晶体质量最好。恒压滴液漏斗a、b中分别盛放FeSO4溶液和CH3COONa—Na2HPO4混合液。)
(4)测定样品中Fe3(PO4)2·8H2O(M=502 g·mol-1)的纯度。取0.627 5 g样品完全溶解后配制成250 mL溶液,取出25.00 mL于锥形瓶中,加入一定量的H2O2将铁元素完全氧化,以磺基水杨酸为指示剂,用0.020 00 mol·L-1 EDTA标准溶液进行滴定至终点(Fe3+与EDTA按物质的量之比为1∶1发生反应),消耗EDTA溶液15.00 mL。计算该磷酸亚铁晶体样品的纯度(写出计算过程)。
4. (2024·苏州三模)乙二胺四乙酸铁钠(化学式NaFeY·3H2O)是一种重要补铁剂,某小组以铁屑为原料制备NaFeY·3H2O并测定其含量。
已知:①NaFeY·3H2O是一种配合物,微溶于乙醇,20 ℃时水中的溶解度为4.3 g。
②乙二胺四乙酸(EDTA,用H4Y表示)是一种弱酸。
Ⅰ. 制备NaFeY·3H2O
实验室用铁屑制备NaFeY·3H2O的主要流程如图:
(1)“酸浸”时,下列措施一定能提高铁元素浸出率的是__________
A. 升高温度 B. 加快搅拌速率 C. 缩短浸取时间
(2)向酸浸所得滤液中通入足量O2,过程中浓度减少的离子有__________(填离子符号)。
(3)“制备”步骤,向氧化所得的FeCl3溶液中加入一定量EDTA(H4Y),控制反应温度为70~80 ℃,加入NaHCO3溶液调节pH为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为4NaHCO3+FeCl3+H4YNaFeY+3NaCl+4CO2↑+4H2O。
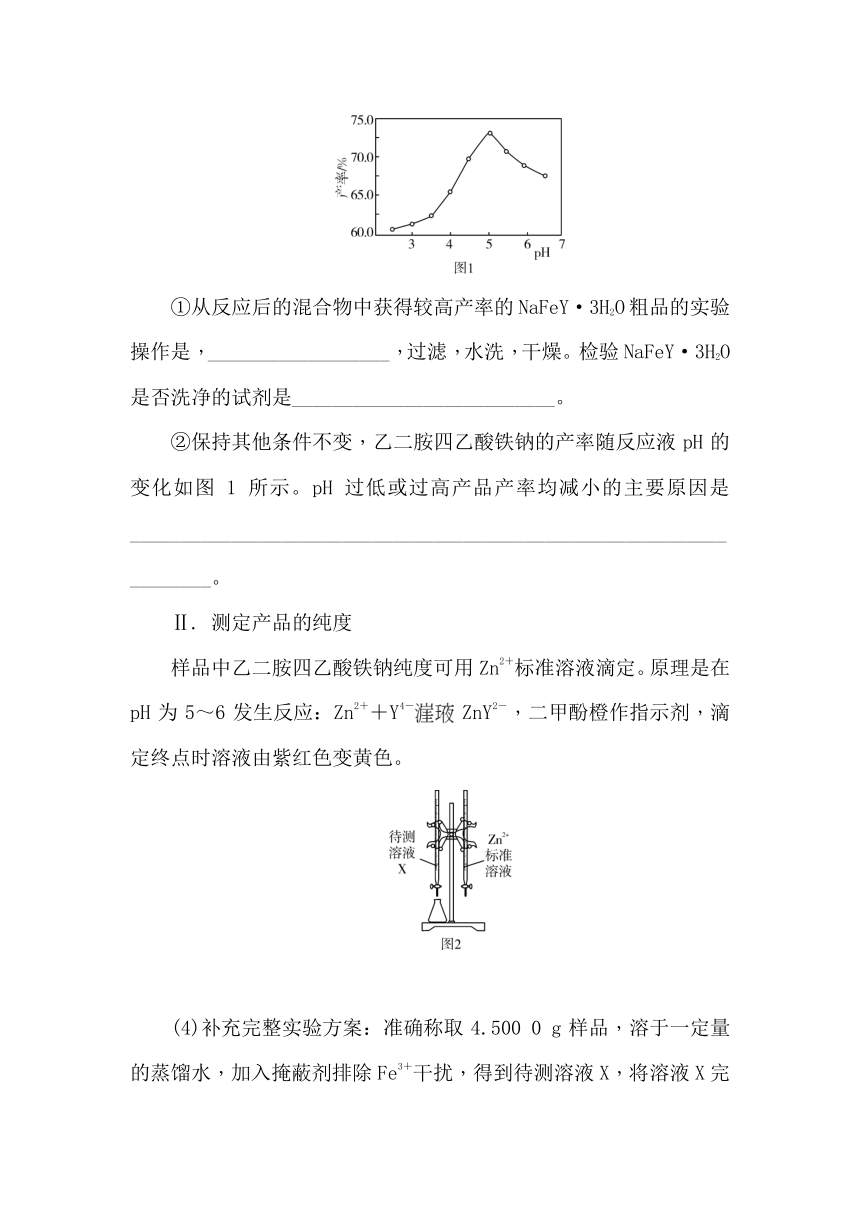
①从反应后的混合物中获得较高产率的NaFeY·3H2O粗品的实验操作是,__________________,过滤,水洗,干燥。检验NaFeY·3H2O是否洗净的试剂是__________________________。
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液pH的变化如图1所示。pH过低或过高产品产率均减小的主要原因是___________________________________________________________________。
Ⅱ. 测定产品的纯度
样品中乙二胺四乙酸铁钠纯度可用Zn2+标准溶液滴定。原理是在pH为5~6发生反应:Zn2++Y4-??ZnY2-,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取4.500 0 g样品,溶于一定量的蒸馏水,加入掩蔽剂排除Fe3+干扰,得到待测溶液X,将溶液X完全转移到250 mL容量瓶中定容;按规定操作分别将0.010 00 mol·L-1 Zn2+标准溶液和待测溶液X装入如图2所示的滴定管中:____________________________________________________________。
5. (2024·淮安五校高三上联考)柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 Al3+ Fe2+ Fe3+
沉淀开始pH 3.1 5.9 1.2
沉淀完全pH 5.1 6.9 3.2
(1)基态Fe价电子排布式为______________。
(2)“浸泡”时加入过量硫酸的目的:_____________________________________________________。
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
_____________________________________________________________________________________________。
途径一:
途径二:
(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
Na2CO3溶液的浓度大于4 mol·L-1时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是
________________________________________________________________________。
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:______________________________________________________________,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、4 mol·L-1 Na2CO3溶液、柠檬酸溶液、无水乙醇)
6. 硫酸亚铁晶体(FeSO4·7H2O)可用于生产聚合硫酸铁。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体的实验流程如图:
(1)“酸浸”时,Fe3O4发生反应的离子方程式为______________________________________________。
(2)将“滤渣”返回“酸浸”工序,其目的是______________________________________________。
(3)与普通过滤相比,使用图1装置进行过滤的优点是_________________________________________。
(4)固定其他条件不变,反应温度、反应时间、铁粉过量系数分别对“滤液”中Fe3+还原率的影响如图2、图3、图4所示。
设计由100 mL“滤液”[其中c(Fe3+)=0.8 mol·L-1]制备硫酸亚铁粗品的实验方案:________________________________________________________________________
________________________________________________________________________。(须使用的试剂和仪器:铁粉、冰水、真空蒸发仪)
(5)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.200 0 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.020 00 mol·L-1 KMnO4标准溶液滴定至终点(MnO转化为Mn2+),平行滴定3次,平均消耗KMnO4标准溶液42.90 mL。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
第22练 铁的重要化合物的转化(实验及工艺流程)
1. D 解析:由题给信息可知,反应温度为290 ℃,水的沸点为100 ℃,且硫无法溶于水,因此使用沸点为350 ℃的有机物X做溶剂,A正确;氧化铁为固体,不易参与反应,有机酸可与氧化铁反应生成铁离子,有利于铁离子参与后续反应,B正确;硫单质为淡黄色,冷凝管中出现淡黄色气体,说明加热条件下有硫蒸气产生,C正确;二硫化亚铁中铁与硫的物质的量之比为1∶2,若有铁离子存在根据电荷守恒需要更多的S,二者比例会小于,D错误。故选D。
2. D 解析:硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)中加入稀硫酸酸溶,Fe2O3、Al2O3溶解得到Fe3+、Al3+的酸性溶液,SiO2不反应,过滤,滤渣为SiO2,滤液中加入过量铁粉还原,离子方程式为:2Fe3++Fe===3Fe2+,然后用K4[Fe(CN)4]溶液检验“反应”步骤是否进行完全,加入NaOH溶液调节溶液pH除铝,过滤,滤渣为氢氧化铝,滤液中含有FeSO4,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到绿矾FeSO4·7H2O。“酸溶”时先将烧渣粉碎并不断搅拌,能增大反应物的接触面积,加快反应速率,从而提高铁元素的浸出效率,A正确;“反应”时加入的过量铁粉与铁离子反应生成亚铁离子,主要发生反应的离子方程式为:2Fe3++Fe===3Fe2+,B正确;“检验”时可用K4[Fe(CN)6]检验反应后的溶液中是否存在Fe3+,C正确;滤液中含有FeSO4,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O,如果直接蒸发结晶易失去结晶水,D错误。故选D。
3. (1)烧杯、玻璃棒
(2)取少量还原后的溶液于试管中,滴加KSCN溶液(或亚铁氰化钾),若无明显现象,则证明还原已完全,若溶液变为气泡,则证明未完全。
(3)①3Fe2++2HPO+2CH3COO-+8H2O===Fe3(PO4)2·8H2O↓+2CH3COOH ②NaOH碱性强,容易造成局部pH过高,生成Fe(OH)2等杂质 ③向三颈烧瓶中滴加CH3COONa—Na2HPO4混合溶液 再向三颈烧瓶中滴加FeSO4溶液,通过调节恒压滴液漏斗a、b的活塞,控制溶液pH为4~6
(4)80.00%(过程见解析)
解析:二硫化亚铁煅烧得到氧化铁,硫酸酸溶后得到硫酸铁,用二硫化亚铁还原生成硫酸亚铁和硫沉淀,过滤,滤液用磷酸氢二钠共沉淀生成磷酸亚铁晶体[Fe3(PO4)2·8H2O]。
(1)将一定体积98%的浓硫酸稀释为200 mL 30%的硫酸,使用的仪器除量筒外,还必须使用的玻璃仪器有烧杯、玻璃棒;
(2)“还原”时,硫酸铁用二硫化亚铁还原生成硫酸亚铁和硫沉淀,反应已完全检验溶液中无铁离子,其实验操作为取少量还原后的溶液于试管中,滴加KSCN溶液(或亚铁氰化钾),溶液变红(或生成蓝色沉淀),说明含有铁离子,反之则不含有,“还原”已完全;
(3)①若使用CH3COONa调节溶液pH,“共沉淀”反应生成Fe3(PO4)2·8H2O和醋酸,其反应的离子方程式为3Fe2++2HPO+2CH3COO-+8H2O===Fe3(PO4)2·8H2O↓+2CH3COOH;②不使用NaOH调节溶液pH的原因是NaOH碱性强,容易造成局部pH过高,生成Fe(OH)2等杂质;③制取Fe3(PO4)2·8H2O的实验方案:向三颈烧瓶中加入抗坏血酸溶液,向三颈烧瓶中滴加CH3COONa—Na2HPO4混合溶液至混合液pH≈4,再向三颈烧瓶中滴加FeSO4溶液,通过调节恒压滴液漏斗a、b的活塞,控制溶液pH为4~6,充分搅拌一段时间,过滤,洗涤固体,真空干燥;
(4)每25.00 mL溶液中n(Fe2+)=0.020 00 mol·L-1×15.00 mL×10-3 L·mL-1=3.000×10-4 mol,n[Fe3(PO4)2·8H2O]=1.000×10-4 mol,0.627 5 g样品中含n[Fe3(PO4)2·8H2O]=1.000×10-4 mol×=1.000×10-3 mol,m[Fe3(PO4)2·8H2O]=1.000×10-3 mol×502 g·mol-1=0.502 0 g,纯度为×100%=80.00%。
4. (1)B (2)Fe2+、H+
(3)①冷却至室温,加入乙醇 AgNO3溶液和稀硝酸 ②pH过低,H4Y电离出的Y4-浓度小(或pH过低,H4Y在水中溶出量小),pH过大,Fe3+转为Fe(OH)3,溶液中Fe3+浓度减小
(4)准确量取25.00 mL(10~30 mL均可)待测溶液X于锥形瓶中,调节溶液pH至5~6,滴加2~3滴二甲酚橙为指示剂,向锥形瓶内逐滴滴加0.010 00 mol·L-1 Zn2+标准溶液,当最后半滴标准溶液滴入时,溶液颜色恰好由紫红色变黄色,且半分钟内不恢复,记录标准液体积,重复操作2~3次
解析:(1)能够提高矿石中元素浸出率的方法一般是:适当提高温度、适当提高浓度、矿石粉碎、加速搅拌等,但是考虑此题加入的是稀盐酸,升高温度会让盐酸挥发,导致矿石反应不彻底,所以不能选择“升高温度”。故选B;
(2)向酸浸所得滤液中通入足量O2,溶液中浸出的Fe2+,在酸性情况下与氧气反应4Fe2++O2+4H+===4Fe3++2H2O,所以此过程中浓度减少的离子有Fe2+和H+;
(3)①结合题目意思,NaFeY·3H2O是微溶于乙醇,20 ℃时水中的溶解度为4.3 g,常温下溶解度低,使用乙醇溶解和降低温度都有利于其产品析出;②由于溶液中存在大量未消耗的氯离子,所以应该检测洗涤液中是否存在氯离子。故选AgNO3溶液和稀硝酸,③pH过低,H4Y在水中溶出量小,pH过大,Fe3+转为Fe(OH)3,所以产率降低。
5. (1)3d64s2
(2)使烧渣充分溶解,提高铁元素的浸出率;抑制Fe3+水解
(3)途径一较合理,途径一获得的FeSO4纯度高,途径二中FeSO4溶液中混有Al2(SO4)3
(4)Na2CO3溶液的浓度大于4 mol·L-1时,有更多的Fe2+转化为Fe(OH)2,FeCO3产率下降,Fe(OH)2中Fe元素质量分数大于FeCO3中,故沉淀中铁元素质量分数仍在上升
(5)向硫酸亚铁溶液中逐滴加入4 mol·L-1 Na2CO3溶液,待沉淀不再增加后,过滤,将滤渣溶于足量的柠檬酸溶液中,同时加入适量铁粉,充分反应后将滤液浓缩,加入适量的无水乙醇
解析:硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)加硫酸浸泡、过滤得到含Fe3+、Al3+的溶液,通过除杂除去铝离子、将铁离子转化为亚铁离子,然后利用碳酸钠进行沉淀,再将碳酸亚铁转化为柠檬酸亚铁。
(1)Fe为26号元素,价电子排布式为3d64s2;
(2)加入过量硫酸,可以使烧渣充分溶解,提高铁元素的浸出率;且Fe3+易水解,加入过量硫酸可抑制Fe3+的水解;
(3)途径一:浸泡液中加入铁粉,发生Fe+2Fe3+===3Fe2+,调pH在5.1~5.9,Al3+全部转化成Al(OH)3沉淀,过滤,得到硫酸亚铁溶液;途径二:调pH使Fe3+全部沉淀时,有部分Al3+也以Al(OH)3的形式沉淀出来,因此制备的FeSO4溶液中混有Al2(SO4)3;
(4)Na2CO3溶液的浓度大于4 mol·L-1时,碱性太强,有更多的Fe2+转化为Fe(OH)2,FeCO3产率下降,Fe(OH)2中Fe元素质量分数大于FeCO3中,故沉淀中铁元素质量分数仍在上升;
(5)从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:向硫酸亚铁溶液中逐滴加入4 mol·L-1 Na2CO3溶液,待沉淀不再增加后,过滤,将滤渣溶于足量的柠檬酸溶液中,同时加入适量铁粉,充分反应后将滤液浓缩,加入适量的无水乙醇,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。
6. (1)Fe3O4+8H+===2Fe3++Fe2++4H2O
(2)提高铁元素的浸出率
(3)过滤速度更快
(4)在80 ℃水浴加热条件下,向“滤液”中加入2.688 g铁粉,搅拌下反应2 h后,过滤;滤液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤
(5)99.39%(过程见解析)
解析:废渣溶于硫酸生成硫酸亚铁和硫酸铁,过滤后滤液中加足量铁粉将硫酸铁还原为硫酸亚铁,再过滤,通过蒸发浓缩冷却结晶得到粗品,再重结晶得到硫酸亚铁晶体,据此解答。
(1)Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁,反应离子方程式为:Fe3O4+8H+===2Fe3++Fe2++4H2O;
(2)将“滤渣”返回“酸浸”工序,可使Fe3O4和氧化铁更充分与硫酸发生反应,提高铁的浸取率;
(3)抽滤装置通过减小锥形瓶内的压强,可以加快过滤速率;
(4)由图可知温度在80 ℃时还原率最高,因此温度选80 ℃;在温度一定时过量系数为1.2时还原率最高,因此过量系数为1.2,而在前两者相同时反应时间2 h时还原率高,因此搅拌时间控制在2 h,结合过量系数可得:应加入铁粉的量为氯化铁消耗铁粉量的1.2倍,则100 mL“滤液”[其中c(Fe3+)=0.8 mol·L-1],结合反应可知消耗铁粉0.04 mol,则需加0.04×1.2 mol=0.048 mol,铁粉质量为0.048×56=2.688 g,同时为防止硫酸亚铁被氧化,应在真空蒸发仪中蒸发,然后冷却结晶后过滤,具体步骤为:在80 ℃水浴加热条件下,向“滤液”中加入2.688 g铁粉,搅拌下反应2 h后,过滤;滤液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤;
(5)根据电子得失守恒可得关系式:MnO~5Fe2+,n(Fe2+)=5n(MnO)=0.020 00 mol·L-1×0.042 9 L×5=0.004 29 mol,硫酸亚铁晶体样品中FeSO4·7H2O的质量分数=×100%≈99.39%。
一、 单项选择题
1. (2024·常州高三下模拟预测)实验室用如图所示装置(夹持仪器已省略)制备半导体材料纳米二硫化亚铁(FeS2):将一定比例的Fe2O3、硫粉加入三颈烧瓶中,再加入一定量的有机物X(沸点为350 ℃)和有机酸Y;290 ℃条件下搅拌,一段时间后得到黑色悬浊液;冷却、分离、干燥得到产品。下列对实验事实的解释不合理的是( )
实验事实 解释
A 反应的溶剂用有机物X而不用水 有机物X易溶解硫且沸点较高
B 有机酸Y有利于Fe2O3的转化 有机酸Y能与Fe2O3反应,有利于Fe3+参与后续反应
C 冷凝管内出现黄色气体 加热条件下有硫蒸气产生
D 产品中n(Fe)∶n(S)=1∶1.87 产品中与S结合的Fe2+部分转化为Fe3+
2. (2025·楚中、新马高三期中联考)由硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)制取绿矾的流程如下:
下列有关说法不正确的是( )
A. “酸溶”时先将烧渣粉碎并不断搅拌,可提高铁元素的浸出率
B. “反应”时发生的主要反应为2Fe3++Fe===3Fe2+
C. “检验”时可用K4[Fe(CN)6]溶液检验上一步“反应”是否进行完全
D. 将第二次“过滤”所得滤液加热,经蒸发结晶可以制得绿矾
二、 非选择题
3. 实验室以FeS2为原料制备磷酸亚铁晶体[Fe3(PO4)2·8H2O],其部分实验过程如下:
(1)将一定体积98%的浓硫酸稀释为200 mL 30%的硫酸,除量筒外,还必须使用的玻璃仪器有______________。
(2)检验“还原”已完全的实验操作为______________________________________________________。
(3)向过滤后的滤液中加入Na2HPO4,并用氨水或CH3COONa调节溶液pH,“共沉淀”生成Fe3(PO4)2·8H2O。
①若使用CH3COONa调节溶液pH,“共沉淀”反应的离子方程式为_____________________________________。
②不使用NaOH调节溶液pH的原因是_____________________________________________________。
③补充完整利用图所示装置(夹持装置已略去)制取Fe3(PO4)2·8H2O的实验方案:向三颈烧瓶中加入抗坏血酸溶液,_______________至混合液pH≈4,____________________________________________________________,充分搅拌一段时间,过滤,洗涤固体,真空干燥。(已知:所用抗坏血酸溶液pH=2.8,当溶液pH控制在4~6之间时,所得晶体质量最好。恒压滴液漏斗a、b中分别盛放FeSO4溶液和CH3COONa—Na2HPO4混合液。)
(4)测定样品中Fe3(PO4)2·8H2O(M=502 g·mol-1)的纯度。取0.627 5 g样品完全溶解后配制成250 mL溶液,取出25.00 mL于锥形瓶中,加入一定量的H2O2将铁元素完全氧化,以磺基水杨酸为指示剂,用0.020 00 mol·L-1 EDTA标准溶液进行滴定至终点(Fe3+与EDTA按物质的量之比为1∶1发生反应),消耗EDTA溶液15.00 mL。计算该磷酸亚铁晶体样品的纯度(写出计算过程)。
4. (2024·苏州三模)乙二胺四乙酸铁钠(化学式NaFeY·3H2O)是一种重要补铁剂,某小组以铁屑为原料制备NaFeY·3H2O并测定其含量。
已知:①NaFeY·3H2O是一种配合物,微溶于乙醇,20 ℃时水中的溶解度为4.3 g。
②乙二胺四乙酸(EDTA,用H4Y表示)是一种弱酸。
Ⅰ. 制备NaFeY·3H2O
实验室用铁屑制备NaFeY·3H2O的主要流程如图:
(1)“酸浸”时,下列措施一定能提高铁元素浸出率的是__________
A. 升高温度 B. 加快搅拌速率 C. 缩短浸取时间
(2)向酸浸所得滤液中通入足量O2,过程中浓度减少的离子有__________(填离子符号)。
(3)“制备”步骤,向氧化所得的FeCl3溶液中加入一定量EDTA(H4Y),控制反应温度为70~80 ℃,加入NaHCO3溶液调节pH为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为4NaHCO3+FeCl3+H4YNaFeY+3NaCl+4CO2↑+4H2O。
①从反应后的混合物中获得较高产率的NaFeY·3H2O粗品的实验操作是,__________________,过滤,水洗,干燥。检验NaFeY·3H2O是否洗净的试剂是__________________________。
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液pH的变化如图1所示。pH过低或过高产品产率均减小的主要原因是___________________________________________________________________。
Ⅱ. 测定产品的纯度
样品中乙二胺四乙酸铁钠纯度可用Zn2+标准溶液滴定。原理是在pH为5~6发生反应:Zn2++Y4-??ZnY2-,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取4.500 0 g样品,溶于一定量的蒸馏水,加入掩蔽剂排除Fe3+干扰,得到待测溶液X,将溶液X完全转移到250 mL容量瓶中定容;按规定操作分别将0.010 00 mol·L-1 Zn2+标准溶液和待测溶液X装入如图2所示的滴定管中:____________________________________________________________。
5. (2024·淮安五校高三上联考)柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:
已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 Al3+ Fe2+ Fe3+
沉淀开始pH 3.1 5.9 1.2
沉淀完全pH 5.1 6.9 3.2
(1)基态Fe价电子排布式为______________。
(2)“浸泡”时加入过量硫酸的目的:_____________________________________________________。
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
_____________________________________________________________________________________________。
途径一:
途径二:
(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
Na2CO3溶液的浓度大于4 mol·L-1时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是
________________________________________________________________________。
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:______________________________________________________________,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、4 mol·L-1 Na2CO3溶液、柠檬酸溶液、无水乙醇)
6. 硫酸亚铁晶体(FeSO4·7H2O)可用于生产聚合硫酸铁。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体的实验流程如图:
(1)“酸浸”时,Fe3O4发生反应的离子方程式为______________________________________________。
(2)将“滤渣”返回“酸浸”工序,其目的是______________________________________________。
(3)与普通过滤相比,使用图1装置进行过滤的优点是_________________________________________。
(4)固定其他条件不变,反应温度、反应时间、铁粉过量系数分别对“滤液”中Fe3+还原率的影响如图2、图3、图4所示。
设计由100 mL“滤液”[其中c(Fe3+)=0.8 mol·L-1]制备硫酸亚铁粗品的实验方案:________________________________________________________________________
________________________________________________________________________。(须使用的试剂和仪器:铁粉、冰水、真空蒸发仪)
(5)通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.200 0 g样品置于锥形瓶中,用50 mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.020 00 mol·L-1 KMnO4标准溶液滴定至终点(MnO转化为Mn2+),平行滴定3次,平均消耗KMnO4标准溶液42.90 mL。计算硫酸亚铁晶体样品中FeSO4·7H2O的质量分数(写出计算过程)。
第22练 铁的重要化合物的转化(实验及工艺流程)
1. D 解析:由题给信息可知,反应温度为290 ℃,水的沸点为100 ℃,且硫无法溶于水,因此使用沸点为350 ℃的有机物X做溶剂,A正确;氧化铁为固体,不易参与反应,有机酸可与氧化铁反应生成铁离子,有利于铁离子参与后续反应,B正确;硫单质为淡黄色,冷凝管中出现淡黄色气体,说明加热条件下有硫蒸气产生,C正确;二硫化亚铁中铁与硫的物质的量之比为1∶2,若有铁离子存在根据电荷守恒需要更多的S,二者比例会小于,D错误。故选D。
2. D 解析:硫铁矿烧渣(主要含Fe2O3、Al2O3、SiO2)中加入稀硫酸酸溶,Fe2O3、Al2O3溶解得到Fe3+、Al3+的酸性溶液,SiO2不反应,过滤,滤渣为SiO2,滤液中加入过量铁粉还原,离子方程式为:2Fe3++Fe===3Fe2+,然后用K4[Fe(CN)4]溶液检验“反应”步骤是否进行完全,加入NaOH溶液调节溶液pH除铝,过滤,滤渣为氢氧化铝,滤液中含有FeSO4,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到绿矾FeSO4·7H2O。“酸溶”时先将烧渣粉碎并不断搅拌,能增大反应物的接触面积,加快反应速率,从而提高铁元素的浸出效率,A正确;“反应”时加入的过量铁粉与铁离子反应生成亚铁离子,主要发生反应的离子方程式为:2Fe3++Fe===3Fe2+,B正确;“检验”时可用K4[Fe(CN)6]检验反应后的溶液中是否存在Fe3+,C正确;滤液中含有FeSO4,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到FeSO4·7H2O,如果直接蒸发结晶易失去结晶水,D错误。故选D。
3. (1)烧杯、玻璃棒
(2)取少量还原后的溶液于试管中,滴加KSCN溶液(或亚铁氰化钾),若无明显现象,则证明还原已完全,若溶液变为气泡,则证明未完全。
(3)①3Fe2++2HPO+2CH3COO-+8H2O===Fe3(PO4)2·8H2O↓+2CH3COOH ②NaOH碱性强,容易造成局部pH过高,生成Fe(OH)2等杂质 ③向三颈烧瓶中滴加CH3COONa—Na2HPO4混合溶液 再向三颈烧瓶中滴加FeSO4溶液,通过调节恒压滴液漏斗a、b的活塞,控制溶液pH为4~6
(4)80.00%(过程见解析)
解析:二硫化亚铁煅烧得到氧化铁,硫酸酸溶后得到硫酸铁,用二硫化亚铁还原生成硫酸亚铁和硫沉淀,过滤,滤液用磷酸氢二钠共沉淀生成磷酸亚铁晶体[Fe3(PO4)2·8H2O]。
(1)将一定体积98%的浓硫酸稀释为200 mL 30%的硫酸,使用的仪器除量筒外,还必须使用的玻璃仪器有烧杯、玻璃棒;
(2)“还原”时,硫酸铁用二硫化亚铁还原生成硫酸亚铁和硫沉淀,反应已完全检验溶液中无铁离子,其实验操作为取少量还原后的溶液于试管中,滴加KSCN溶液(或亚铁氰化钾),溶液变红(或生成蓝色沉淀),说明含有铁离子,反之则不含有,“还原”已完全;
(3)①若使用CH3COONa调节溶液pH,“共沉淀”反应生成Fe3(PO4)2·8H2O和醋酸,其反应的离子方程式为3Fe2++2HPO+2CH3COO-+8H2O===Fe3(PO4)2·8H2O↓+2CH3COOH;②不使用NaOH调节溶液pH的原因是NaOH碱性强,容易造成局部pH过高,生成Fe(OH)2等杂质;③制取Fe3(PO4)2·8H2O的实验方案:向三颈烧瓶中加入抗坏血酸溶液,向三颈烧瓶中滴加CH3COONa—Na2HPO4混合溶液至混合液pH≈4,再向三颈烧瓶中滴加FeSO4溶液,通过调节恒压滴液漏斗a、b的活塞,控制溶液pH为4~6,充分搅拌一段时间,过滤,洗涤固体,真空干燥;
(4)每25.00 mL溶液中n(Fe2+)=0.020 00 mol·L-1×15.00 mL×10-3 L·mL-1=3.000×10-4 mol,n[Fe3(PO4)2·8H2O]=1.000×10-4 mol,0.627 5 g样品中含n[Fe3(PO4)2·8H2O]=1.000×10-4 mol×=1.000×10-3 mol,m[Fe3(PO4)2·8H2O]=1.000×10-3 mol×502 g·mol-1=0.502 0 g,纯度为×100%=80.00%。
4. (1)B (2)Fe2+、H+
(3)①冷却至室温,加入乙醇 AgNO3溶液和稀硝酸 ②pH过低,H4Y电离出的Y4-浓度小(或pH过低,H4Y在水中溶出量小),pH过大,Fe3+转为Fe(OH)3,溶液中Fe3+浓度减小
(4)准确量取25.00 mL(10~30 mL均可)待测溶液X于锥形瓶中,调节溶液pH至5~6,滴加2~3滴二甲酚橙为指示剂,向锥形瓶内逐滴滴加0.010 00 mol·L-1 Zn2+标准溶液,当最后半滴标准溶液滴入时,溶液颜色恰好由紫红色变黄色,且半分钟内不恢复,记录标准液体积,重复操作2~3次
解析:(1)能够提高矿石中元素浸出率的方法一般是:适当提高温度、适当提高浓度、矿石粉碎、加速搅拌等,但是考虑此题加入的是稀盐酸,升高温度会让盐酸挥发,导致矿石反应不彻底,所以不能选择“升高温度”。故选B;
(2)向酸浸所得滤液中通入足量O2,溶液中浸出的Fe2+,在酸性情况下与氧气反应4Fe2++O2+4H+===4Fe3++2H2O,所以此过程中浓度减少的离子有Fe2+和H+;
(3)①结合题目意思,NaFeY·3H2O是微溶于乙醇,20 ℃时水中的溶解度为4.3 g,常温下溶解度低,使用乙醇溶解和降低温度都有利于其产品析出;②由于溶液中存在大量未消耗的氯离子,所以应该检测洗涤液中是否存在氯离子。故选AgNO3溶液和稀硝酸,③pH过低,H4Y在水中溶出量小,pH过大,Fe3+转为Fe(OH)3,所以产率降低。
5. (1)3d64s2
(2)使烧渣充分溶解,提高铁元素的浸出率;抑制Fe3+水解
(3)途径一较合理,途径一获得的FeSO4纯度高,途径二中FeSO4溶液中混有Al2(SO4)3
(4)Na2CO3溶液的浓度大于4 mol·L-1时,有更多的Fe2+转化为Fe(OH)2,FeCO3产率下降,Fe(OH)2中Fe元素质量分数大于FeCO3中,故沉淀中铁元素质量分数仍在上升
(5)向硫酸亚铁溶液中逐滴加入4 mol·L-1 Na2CO3溶液,待沉淀不再增加后,过滤,将滤渣溶于足量的柠檬酸溶液中,同时加入适量铁粉,充分反应后将滤液浓缩,加入适量的无水乙醇
解析:硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)加硫酸浸泡、过滤得到含Fe3+、Al3+的溶液,通过除杂除去铝离子、将铁离子转化为亚铁离子,然后利用碳酸钠进行沉淀,再将碳酸亚铁转化为柠檬酸亚铁。
(1)Fe为26号元素,价电子排布式为3d64s2;
(2)加入过量硫酸,可以使烧渣充分溶解,提高铁元素的浸出率;且Fe3+易水解,加入过量硫酸可抑制Fe3+的水解;
(3)途径一:浸泡液中加入铁粉,发生Fe+2Fe3+===3Fe2+,调pH在5.1~5.9,Al3+全部转化成Al(OH)3沉淀,过滤,得到硫酸亚铁溶液;途径二:调pH使Fe3+全部沉淀时,有部分Al3+也以Al(OH)3的形式沉淀出来,因此制备的FeSO4溶液中混有Al2(SO4)3;
(4)Na2CO3溶液的浓度大于4 mol·L-1时,碱性太强,有更多的Fe2+转化为Fe(OH)2,FeCO3产率下降,Fe(OH)2中Fe元素质量分数大于FeCO3中,故沉淀中铁元素质量分数仍在上升;
(5)从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:向硫酸亚铁溶液中逐滴加入4 mol·L-1 Na2CO3溶液,待沉淀不再增加后,过滤,将滤渣溶于足量的柠檬酸溶液中,同时加入适量铁粉,充分反应后将滤液浓缩,加入适量的无水乙醇,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。
6. (1)Fe3O4+8H+===2Fe3++Fe2++4H2O
(2)提高铁元素的浸出率
(3)过滤速度更快
(4)在80 ℃水浴加热条件下,向“滤液”中加入2.688 g铁粉,搅拌下反应2 h后,过滤;滤液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤
(5)99.39%(过程见解析)
解析:废渣溶于硫酸生成硫酸亚铁和硫酸铁,过滤后滤液中加足量铁粉将硫酸铁还原为硫酸亚铁,再过滤,通过蒸发浓缩冷却结晶得到粗品,再重结晶得到硫酸亚铁晶体,据此解答。
(1)Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁,反应离子方程式为:Fe3O4+8H+===2Fe3++Fe2++4H2O;
(2)将“滤渣”返回“酸浸”工序,可使Fe3O4和氧化铁更充分与硫酸发生反应,提高铁的浸取率;
(3)抽滤装置通过减小锥形瓶内的压强,可以加快过滤速率;
(4)由图可知温度在80 ℃时还原率最高,因此温度选80 ℃;在温度一定时过量系数为1.2时还原率最高,因此过量系数为1.2,而在前两者相同时反应时间2 h时还原率高,因此搅拌时间控制在2 h,结合过量系数可得:应加入铁粉的量为氯化铁消耗铁粉量的1.2倍,则100 mL“滤液”[其中c(Fe3+)=0.8 mol·L-1],结合反应可知消耗铁粉0.04 mol,则需加0.04×1.2 mol=0.048 mol,铁粉质量为0.048×56=2.688 g,同时为防止硫酸亚铁被氧化,应在真空蒸发仪中蒸发,然后冷却结晶后过滤,具体步骤为:在80 ℃水浴加热条件下,向“滤液”中加入2.688 g铁粉,搅拌下反应2 h后,过滤;滤液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤;
(5)根据电子得失守恒可得关系式:MnO~5Fe2+,n(Fe2+)=5n(MnO)=0.020 00 mol·L-1×0.042 9 L×5=0.004 29 mol,硫酸亚铁晶体样品中FeSO4·7H2O的质量分数=×100%≈99.39%。
同课章节目录
