4.2 质量守恒定律 优质课件 (共30张PPT)初中科粤版(2024)九年级上册
文档属性
| 名称 | 4.2 质量守恒定律 优质课件 (共30张PPT)初中科粤版(2024)九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 49.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 10:48:05 | ||
图片预览










文档简介
(共30张PPT)
4.2 质量守恒定律
核心素养目标
一、化学观念
形成 “质量守恒” 的观念,理解化学反应中物质的质量关系,能从定量角度认识化学变化;认识到化学反应的本质是原子的重新组合,建立宏观与微观相联系的思维方式。
二、科学思维
通过对不同实验方案的分析、比较,培养逻辑推理、归纳总结的能力。
运用质量守恒定律解决实际化学问题,提升证据推理和模型认知能力。
三、科学态度与责任
培养严谨、认真、实事求是的科学态度,在实验探究中尊重实验事实和数据。
学习重难点
重点:
1. 理解质量守恒定律的内容及微观本质
2. 能够运用质量守恒定律解释常见的实验现象和问题
难点:
1. 从微观角度理解质量守恒定律中 “质量守恒” 的原因
2. 设计实验探究质量守恒定律并分析实验结果
新课导入
生活中,我们都见过蜡烛燃烧,随着时间推移,蜡烛越来越短,似乎质量在不断减少;而铁生锈后,表面会生成一层铁锈,感觉铁的质量增加了。那化学反应前后,物质的总质量到底是怎样的情况呢?是减少、增加还是不变?
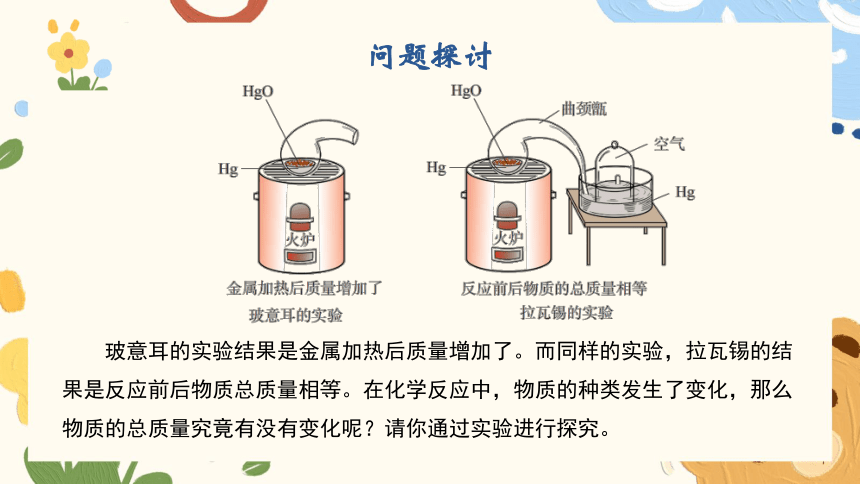
问题探讨
玻意耳的实验结果是金属加热后质量增加了。而同样的实验,拉瓦锡的结果是反应前后物质总质量相等。在化学反应中,物质的种类发生了变化,那么物质的总质量究竟有没有变化呢?请你通过实验进行探究。
01 质量守恒定律的探究
探究活动
[提出问题]物质发生化学变化的前后,参加反应的各物质的质量
总和会等于生成的各物质的质量总和吗?
[形成假设]参加反应的各物质的质量总和会 (填“大于”
“等于”或“小于”)生成的各物质的质量总和,并说出你的理由。
等于
。
物质发生化学反应时,只是反应物的原子重新组合,生成新物质,反应前后原子的种类和数目都不改变。
探究活动
[设计与实施实验]
双氧水分解的敞口体系
【实验 4-1】如图装置,锥形瓶中装入
少量二氧化锰粉末,将一支量程为 5 mL
的装有 3 mL 过氧化氢溶液(3%)的注射
器针头插入胶塞,另将一支注射器的针头
(无针筒)插入胶塞,使瓶内与大气相通。
实验时,推压注射器活塞至 1 mL 刻度处,
观察实验现象,记录数据。
探究活动
[设计与实施实验]
【实验 4-2】如图 4.2-2 装置,锥形瓶
中装入少量二氧化锰粉末,将一支量程为
5 mL 的装有 3 mL 过氧化氢溶液(3%)
的注射器针头插入胶塞。推压注射器活塞
至 1 mL 刻度处,观察实验现象,记录数据。
双氧水分解的密闭体系
探究活动
[设计与实施实验]
【实验 4-3】如图 4.2-3 装置,锥形瓶中
装入 5 mL 硫酸铜溶液,将一支量程为 5 mL
的装有 3 mL 氢氧化钠溶液的注射器针头插
入胶塞,再插入一支无针筒的针头(同 [ 实
验 4-1])。推压注射器活塞至 1 mL 刻度处,
观察实验现象,记录数据。
硫酸铜和氢氧化钠反应
的敞口体系
探究活动
[设计与实施实验]
【实验 4-4】如图 4.2-4 装置,锥形瓶中
装入 5 mL 硫酸铜溶液,将一支量程为 5 mL
的装有 3 mL 氢氧化钠溶液的注射器针头插
入胶塞。推压注射器活塞至 1 mL 刻度处,
观察实验现象,记录数据。
硫酸铜和氢氧化钠反应的
密闭体系
探究活动
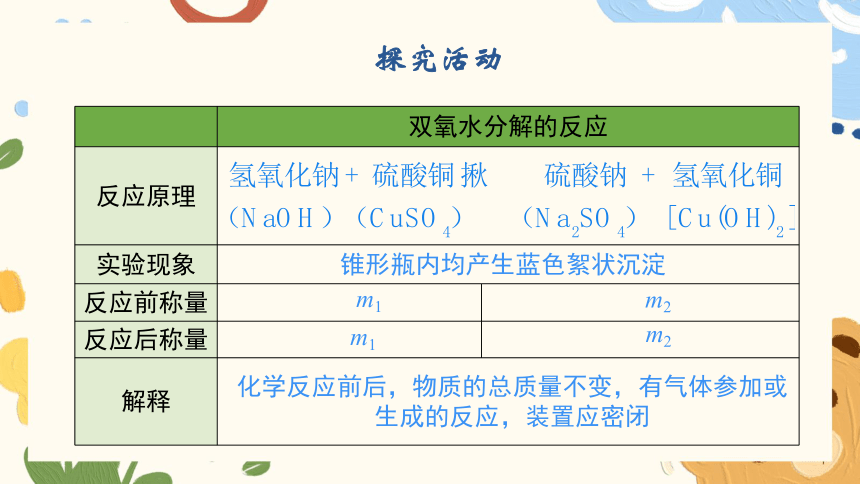
双氧水分解的反应 反应原理 实验现象 反应前称量
反应后称量
解释 锥形瓶内均产生蓝色絮状沉淀
m1
m2
m1
m2
化学反应前后,物质的总质量不变,有气体参加或
生成的反应,装置应密闭
讨论与交流
请大家比较上述实验得到的数据,并研讨三个问题:
1. 为什么 [ 实验 4-1 ] 和 [ 实验 4-2 ] 发生的都是同一个反应,电
子天平的示数前者减小而后者不变?
反应生成了气体,[实验4-1]在敞口体系中,生成的气体(氧气)
会逸出,导致质量损失;[实验4-2]在密闭体系中,所有反应物和生成
物都被保留在体系内,因此质量保持不变。
讨论与交流
2. 请你思考应当以哪些实验为依据来探究化学反应前后物质质
量总和的关系,能从中得到什么结论。
应当以密闭体系的实验为依据,即[实验4-2]和[实验4-4];在化学
反应前后物质的总质量保持不变。
讨论与交流
3. 如何从化学反应的微观角度进行解释?
H2O2
( )
二氧化锰
过氧化氢
( )
( )
( O2 )
+
氧气
水
H2O
02 质量守恒的原因及应用
质量守恒定律的内容
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。(质量守恒定律是经许多事实证明了的基本规律。)
不适用于物理变化
不包括未参与反应的部分
固态、液态、气态的参与反应的所有物质
仅指“质量守恒”,不包括体积等其他方面的守恒
质量守恒的原因
在化学反应中,反应前后原子的种类没有改变,数目没有增减,质量没有改变。
+
H
H
H
H
O
O
O
H
H
O
H
H
氢气
(H2)
+
氧气
(O2)
水
(H2O)
化学反应前后的变与不变
六个 不变 宏观
微观
两个一定变 宏观
微观
两个可能变 宏观
微观
元素的种类不变;元素的质量不变;
物质的总质量不变
元素的种类不变;元素的质量不变;
物质的总质量不变
物质的种类一定改变
分子的种类一定改变
元素的化合价可能改变
分子的数目可能改变
质量守恒定律的应用
求反应中某元素的质量
1
2
3
4
5
解释化学变化中质量变化的原因
推断化学反应的基本类型
推断物质的元素组成
求反应中某物质的质量
验证质量守恒定律
为了验证质量守恒定
律,某同学在电子天平上
放一块陶土网,并在陶土
网上放一段经过砂纸打磨
过的镁条,称量。然后点
燃镁条,将生成的白色固
体全部收集在陶土网上,
冷却后再称量。
验证质量守恒定律
镁条剧烈燃烧,发出耀眼的白光,产生白烟,生成白色固体。
天平示数变大。
[实验现象]
[反应原理]
验证质量守恒定律
如何解释反应前后质量不相等的现象?
[思考讨论]
镁条燃烧是镁与空气中的氧气反应。生成白色固体氧化镁,
反应物的总质量应包含参加反应的镁的质量和参加反应的氧气的
质量,因此生成物氧化镁的质量比镁条的质量大。
如何设计用镁条燃烧实验来验证质量守恒定律?
使反应在密闭容器中进行。
验证质量守恒定律
设计实验验证质量守恒定律时应注意:
实验中必须发生化学变化,物理变化不能验证质量守恒定律
若反应中有气体参与反应或生成,则实验必须在密闭装置中进行
总结归纳
随堂练习
1. 下列实验能够直接用于验证质量守恒定律的是( )
A. B.
C. D.
D
2. 下列叙述完全符合质量守恒定律的是( )
A. 水结成冰前后,质量保持不变
B. 10 g 氯化钠完全溶解于 90 g 水中,得到 100 g 氯化钠溶液
C. 3 mL 水完全电解可生成 2 mL 氢气和 1 mL 氧气
D. 1.2 g 碳与 3.2 g 氧气恰好完全反应可生成 4.4 g 二氧化碳
随堂练习
D
随堂练习
3. 绿色植物的光合作用为:
由此推知葡萄糖( )
A. 一定含碳、氢、氧元素
B. 一定含碳、氢元素,不含氧元素
C. 一定含碳、氢元素,可能含氧元素
D. 无法确定
C
随堂练习
4. 红磷在氧气中燃烧后生成五氧化二磷,文字表达式是:
据此,下列说法中正确的是( )。
①该反应属于化合反应 ②生成物是氧化物 ③反应遵守质量守恒定律
④反应前后分子和原子种类都不变 ⑤分子在化学变化中可以再分,而原子不能再分
A. ①②③⑤ B. ①②④⑤ C. ①③④⑤ D. ①②③④⑤
A
感谢您的观看
“THANK YOU”
4.2 质量守恒定律
核心素养目标
一、化学观念
形成 “质量守恒” 的观念,理解化学反应中物质的质量关系,能从定量角度认识化学变化;认识到化学反应的本质是原子的重新组合,建立宏观与微观相联系的思维方式。
二、科学思维
通过对不同实验方案的分析、比较,培养逻辑推理、归纳总结的能力。
运用质量守恒定律解决实际化学问题,提升证据推理和模型认知能力。
三、科学态度与责任
培养严谨、认真、实事求是的科学态度,在实验探究中尊重实验事实和数据。
学习重难点
重点:
1. 理解质量守恒定律的内容及微观本质
2. 能够运用质量守恒定律解释常见的实验现象和问题
难点:
1. 从微观角度理解质量守恒定律中 “质量守恒” 的原因
2. 设计实验探究质量守恒定律并分析实验结果
新课导入
生活中,我们都见过蜡烛燃烧,随着时间推移,蜡烛越来越短,似乎质量在不断减少;而铁生锈后,表面会生成一层铁锈,感觉铁的质量增加了。那化学反应前后,物质的总质量到底是怎样的情况呢?是减少、增加还是不变?
问题探讨
玻意耳的实验结果是金属加热后质量增加了。而同样的实验,拉瓦锡的结果是反应前后物质总质量相等。在化学反应中,物质的种类发生了变化,那么物质的总质量究竟有没有变化呢?请你通过实验进行探究。
01 质量守恒定律的探究
探究活动
[提出问题]物质发生化学变化的前后,参加反应的各物质的质量
总和会等于生成的各物质的质量总和吗?
[形成假设]参加反应的各物质的质量总和会 (填“大于”
“等于”或“小于”)生成的各物质的质量总和,并说出你的理由。
等于
。
物质发生化学反应时,只是反应物的原子重新组合,生成新物质,反应前后原子的种类和数目都不改变。
探究活动
[设计与实施实验]
双氧水分解的敞口体系
【实验 4-1】如图装置,锥形瓶中装入
少量二氧化锰粉末,将一支量程为 5 mL
的装有 3 mL 过氧化氢溶液(3%)的注射
器针头插入胶塞,另将一支注射器的针头
(无针筒)插入胶塞,使瓶内与大气相通。
实验时,推压注射器活塞至 1 mL 刻度处,
观察实验现象,记录数据。
探究活动
[设计与实施实验]
【实验 4-2】如图 4.2-2 装置,锥形瓶
中装入少量二氧化锰粉末,将一支量程为
5 mL 的装有 3 mL 过氧化氢溶液(3%)
的注射器针头插入胶塞。推压注射器活塞
至 1 mL 刻度处,观察实验现象,记录数据。
双氧水分解的密闭体系
探究活动
[设计与实施实验]
【实验 4-3】如图 4.2-3 装置,锥形瓶中
装入 5 mL 硫酸铜溶液,将一支量程为 5 mL
的装有 3 mL 氢氧化钠溶液的注射器针头插
入胶塞,再插入一支无针筒的针头(同 [ 实
验 4-1])。推压注射器活塞至 1 mL 刻度处,
观察实验现象,记录数据。
硫酸铜和氢氧化钠反应
的敞口体系
探究活动
[设计与实施实验]
【实验 4-4】如图 4.2-4 装置,锥形瓶中
装入 5 mL 硫酸铜溶液,将一支量程为 5 mL
的装有 3 mL 氢氧化钠溶液的注射器针头插
入胶塞。推压注射器活塞至 1 mL 刻度处,
观察实验现象,记录数据。
硫酸铜和氢氧化钠反应的
密闭体系
探究活动
双氧水分解的反应 反应原理 实验现象 反应前称量
反应后称量
解释 锥形瓶内均产生蓝色絮状沉淀
m1
m2
m1
m2
化学反应前后,物质的总质量不变,有气体参加或
生成的反应,装置应密闭
讨论与交流
请大家比较上述实验得到的数据,并研讨三个问题:
1. 为什么 [ 实验 4-1 ] 和 [ 实验 4-2 ] 发生的都是同一个反应,电
子天平的示数前者减小而后者不变?
反应生成了气体,[实验4-1]在敞口体系中,生成的气体(氧气)
会逸出,导致质量损失;[实验4-2]在密闭体系中,所有反应物和生成
物都被保留在体系内,因此质量保持不变。
讨论与交流
2. 请你思考应当以哪些实验为依据来探究化学反应前后物质质
量总和的关系,能从中得到什么结论。
应当以密闭体系的实验为依据,即[实验4-2]和[实验4-4];在化学
反应前后物质的总质量保持不变。
讨论与交流
3. 如何从化学反应的微观角度进行解释?
H2O2
( )
二氧化锰
过氧化氢
( )
( )
( O2 )
+
氧气
水
H2O
02 质量守恒的原因及应用
质量守恒定律的内容
在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。(质量守恒定律是经许多事实证明了的基本规律。)
不适用于物理变化
不包括未参与反应的部分
固态、液态、气态的参与反应的所有物质
仅指“质量守恒”,不包括体积等其他方面的守恒
质量守恒的原因
在化学反应中,反应前后原子的种类没有改变,数目没有增减,质量没有改变。
+
H
H
H
H
O
O
O
H
H
O
H
H
氢气
(H2)
+
氧气
(O2)
水
(H2O)
化学反应前后的变与不变
六个 不变 宏观
微观
两个一定变 宏观
微观
两个可能变 宏观
微观
元素的种类不变;元素的质量不变;
物质的总质量不变
元素的种类不变;元素的质量不变;
物质的总质量不变
物质的种类一定改变
分子的种类一定改变
元素的化合价可能改变
分子的数目可能改变
质量守恒定律的应用
求反应中某元素的质量
1
2
3
4
5
解释化学变化中质量变化的原因
推断化学反应的基本类型
推断物质的元素组成
求反应中某物质的质量
验证质量守恒定律
为了验证质量守恒定
律,某同学在电子天平上
放一块陶土网,并在陶土
网上放一段经过砂纸打磨
过的镁条,称量。然后点
燃镁条,将生成的白色固
体全部收集在陶土网上,
冷却后再称量。
验证质量守恒定律
镁条剧烈燃烧,发出耀眼的白光,产生白烟,生成白色固体。
天平示数变大。
[实验现象]
[反应原理]
验证质量守恒定律
如何解释反应前后质量不相等的现象?
[思考讨论]
镁条燃烧是镁与空气中的氧气反应。生成白色固体氧化镁,
反应物的总质量应包含参加反应的镁的质量和参加反应的氧气的
质量,因此生成物氧化镁的质量比镁条的质量大。
如何设计用镁条燃烧实验来验证质量守恒定律?
使反应在密闭容器中进行。
验证质量守恒定律
设计实验验证质量守恒定律时应注意:
实验中必须发生化学变化,物理变化不能验证质量守恒定律
若反应中有气体参与反应或生成,则实验必须在密闭装置中进行
总结归纳
随堂练习
1. 下列实验能够直接用于验证质量守恒定律的是( )
A. B.
C. D.
D
2. 下列叙述完全符合质量守恒定律的是( )
A. 水结成冰前后,质量保持不变
B. 10 g 氯化钠完全溶解于 90 g 水中,得到 100 g 氯化钠溶液
C. 3 mL 水完全电解可生成 2 mL 氢气和 1 mL 氧气
D. 1.2 g 碳与 3.2 g 氧气恰好完全反应可生成 4.4 g 二氧化碳
随堂练习
D
随堂练习
3. 绿色植物的光合作用为:
由此推知葡萄糖( )
A. 一定含碳、氢、氧元素
B. 一定含碳、氢元素,不含氧元素
C. 一定含碳、氢元素,可能含氧元素
D. 无法确定
C
随堂练习
4. 红磷在氧气中燃烧后生成五氧化二磷,文字表达式是:
据此,下列说法中正确的是( )。
①该反应属于化合反应 ②生成物是氧化物 ③反应遵守质量守恒定律
④反应前后分子和原子种类都不变 ⑤分子在化学变化中可以再分,而原子不能再分
A. ①②③⑤ B. ①②④⑤ C. ①③④⑤ D. ①②③④⑤
A
感谢您的观看
“THANK YOU”
同课章节目录
