第32练 氮及其氧化物 课时作业(含解析 )2026届高三化学一轮总复习
文档属性
| 名称 | 第32练 氮及其氧化物 课时作业(含解析 )2026届高三化学一轮总复习 |  | |
| 格式 | doc | ||
| 文件大小 | 689.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 16:51:55 | ||
图片预览



文档简介
第32练 氮及其氧化物
一、 单项选择题
1. (2024·淮安五校高三上联考)液氨是一种很好的溶剂,液氨可以微弱的电离产生NH和NH。NH3中的一个H原子若被—NH2取代可形成N2H4(联氨),若被—OH取代可形成NH2OH(羟胺)。在有NH存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。在题给条件下,下列选项所示的物质间转化不可以实现的是( )
A. NO2(g)HNO3(aq)
B. NH3(g)NO2(g)
C. N2(g)NO(g)
D. Cu(OH)2(s)eq \o(――→,\s\up7(NH(aq)),\s\do5(氨水))[Cu(NH3)4]2+(aq)
2. (2024·苏锡常镇二模)煤燃烧时,烟气中NO含量随温度和氧气含量的变化如图所示。下列说法不正确的是( )
A. 燃煤过程中发生了氮的固定
B. 燃煤温度越高,NOx污染越重
C. 含氧量越高,越容易生成NO
D. 煤燃烧不影响自然界氮循环
二、 非选择题
3. (2024·连云港五校高三上12月联考)氮元素是一种重要元素,其单质及化合物在化工、生产等领域应用非常广泛。请回答下列问题:
(1)氮元素的常见单质有N2、N4、N8,在三种分子中的每个氮原子均为8电子稳定结构,则N4的结构简式为__________。
(2)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)―→2I(g)(快反应)
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)
实验表明:含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A. 升高温度,第一步向右进行的程度变大
B. 第二步的活化能比第三步小
C. IO为反应的催化剂
D. N2O分解反应的速率与是否含碘蒸气有关
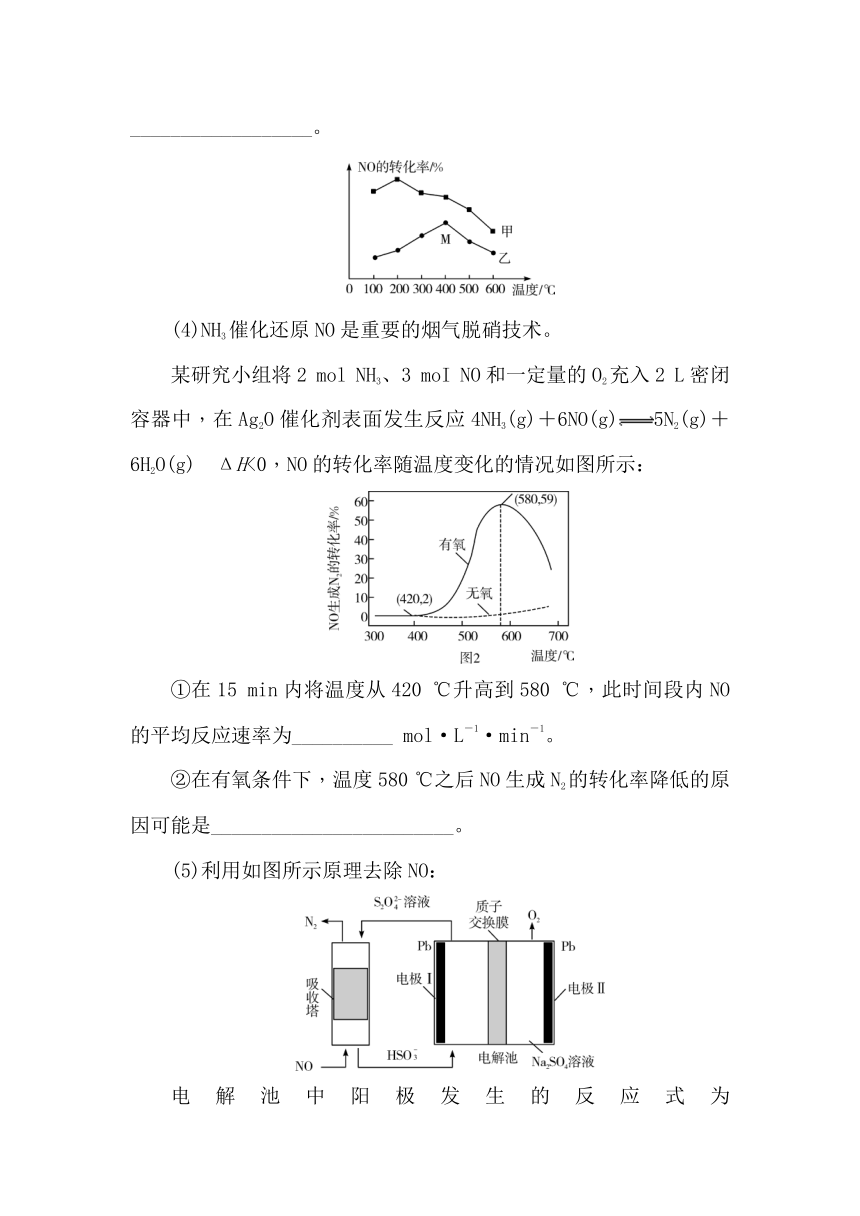
(3)为探究温度及不同催化剂对反应2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示。在催化剂乙作用下,图中M点对应的速率(对应温度400 ℃)v(正)__________v(逆)(填“>”、“<”或“=”),温度升高后,两种催化剂条件下NO转化效率均明显降低,原因可能是__________________。
(4)NH3催化还原NO是重要的烟气脱硝技术。
某研究小组将2 mol NH3、3 moI NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生反应4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH<0,NO的转化率随温度变化的情况如图所示:
①在15 min内将温度从420 ℃升高到580 ℃,此时间段内NO的平均反应速率为__________ mol·L-1·min-1。
②在有氧条件下,温度580 ℃之后NO生成N2的转化率降低的原因可能是________________________。
(5)利用如图所示原理去除NO:
电解池中阳极发生的反应式为__________________________________________,通过将甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入SO2气体的方法可制得Na2S2O4;每产生224 mL O2(体积已换算成标准状况,不考虑O2的溶解),可处理NO的物质的量为__________ mol。
4. 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)二价铜微粒[CuⅡ(NH3)2]2+可用作汽车尾气脱硝的催化剂,其可能的催化机理如图1所示,反应过程中不同态物质体系所含的能量如图2所示。下列说法正确的是__________。
a. 使用[CuⅡ(NH3)2]2+催化剂,可以提高NOx的脱除速率和平衡转化率
b. 状态②到状态③的变化过程决定了整个历程的反应速率
c. 状态③到状态④中有非极性键和极性键生成
d. 在题图1所示历程中,铜元素的化合价发生变化
(2)隔膜电解法同时脱硫脱硝的装置如图3所示,其中电极A、B均为惰性电极,电解液为稀硫酸。为提高脱除效率,将阴极室的溶液pH调至4~7,则阴极上的电极反应为________________________________________。
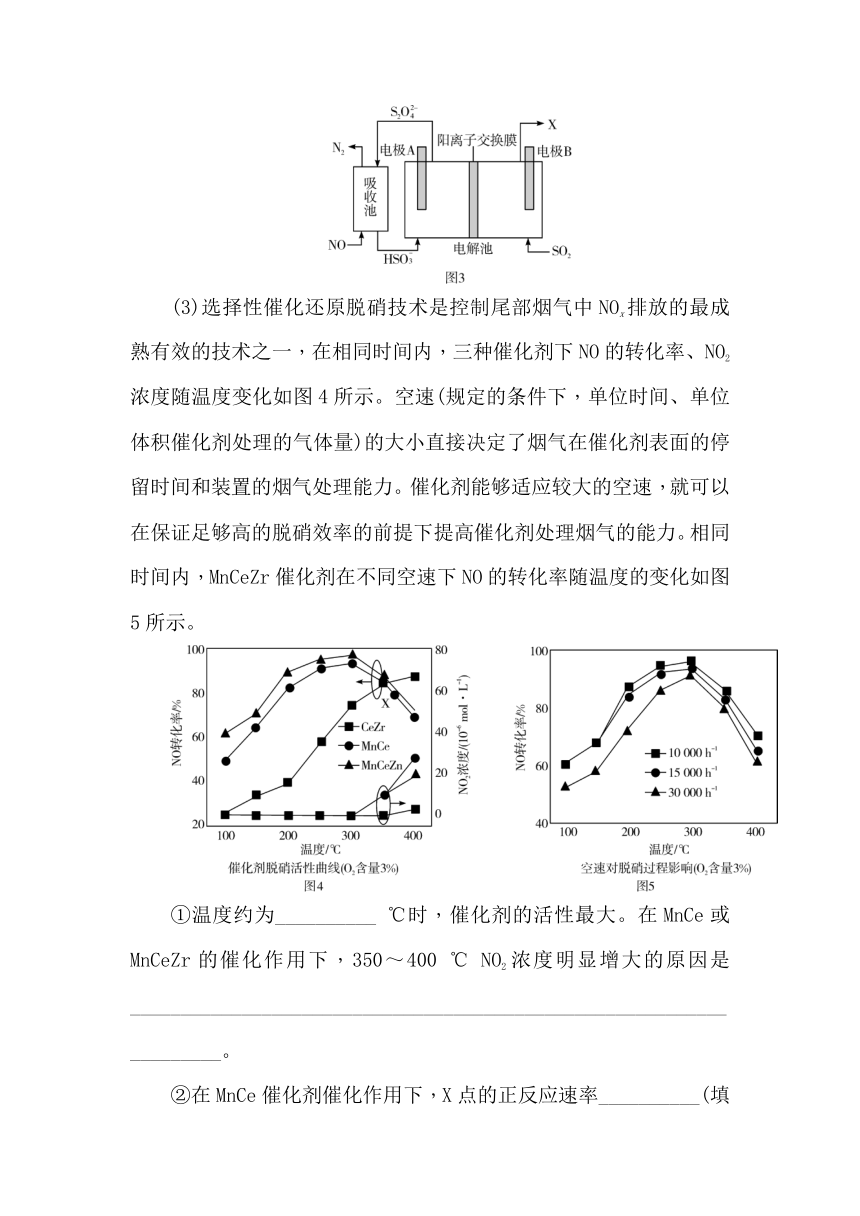
(3)选择性催化还原脱硝技术是控制尾部烟气中NOx排放的最成熟有效的技术之一,在相同时间内,三种催化剂下NO的转化率、NO2浓度随温度变化如图4所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图5所示。
①温度约为__________ ℃时,催化剂的活性最大。在MnCe或MnCeZr的催化作用下,350~400 ℃ NO2浓度明显增大的原因是____________________________________________________________________。
②在MnCe催化剂催化作用下,X点的正反应速率__________(填“>”、“<”或“=”)逆反应速率,说明理由:__________________________________________________________________________________________。
③在MnCeZr的催化作用下,实际工业脱硝应选择的空速为30 000 h-1,原因是_________________________________________________________________________________________________。
5. (2024·徐州三模)亚硝酸钠(NaNO2)在工业上多个领域有着广泛应用。
(1)实验室利用工业废气(主要含NO、NO2、CO2)模拟制备NaNO2的装置如图所示:
已知:室温下,2NO+Na2O2===2NaNO2;酸性条件下,NO、NO都能与MnO反应生成NO和Mn2+。
①装置A中使用稀硫酸的目的是____________________________________________。
②装置B内盛放的试剂可能是__________(填字母)。
a. P2O5 b. 碱石灰 c. 无水CaCl2 d. 无水硫酸铜
③装置D中发生反应的离子方程式为________________________________________________________。
(2)请补充完整利用工业废渣(主要成分为NaNO3和NaNO2)制备KNO3的实验方案:将100 g废渣加入80 mL热水中,充分搅拌,______________________________________________________________________________,过滤,______________________________________________________________________(须使用的试剂及用量:60 L 0.008 g·L-1 O3和80 g KCl固体)。已知:KNO3的产率及纯度与浓缩蒸发水量、温度的关系如图1、图2所示,溶解度关系如图3所示。
6. (2024·淮安、宿迁七校联考)含氮化合物的处理对环境保护意义重大。
(1)用H2或CO催化还原NO均能达到消除污染的目的,反应的还原产物为__________。
(2)实验室常用NaOH溶液吸收NOx(NO和NO2的混合气体),不考虑NO2与N2O4的转化。
①若NOx能被NaOH溶液完全吸收,则x的取值范围为______________。
②若用100 mL 5 mol·L-1 NaOH吸收NOx,NaOH恰好完全反应,则被吸收的NOx的体积为______________(标准状况)。
(3)用V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图所示,则总反应的化学方程式为_________________________________________________________________________________________________。
(4)一种将氨氮(NH)废水中的氮元素转变为N2脱除的机理如图所示。已知:氧气浓度越高,厌氧氨氧化菌活性越低。
NHNOeq \o(――→,\s\up7(NH),\s\do5(厌氧氨氧化菌,Ⅱ))N2
①参与Ⅰ中反应的n(NH)∶n(O2)=__________。
②废水溶解氧浓度(DO)对氮的脱除率的影响如图所示。当1 mg·L-1<DO<2 mg·L-1时,随着DO的增大氮的脱除率下降,其原因可能是________________________________________________________________________。
第32练 氮及其氧化物
1. B 解析:常温下,3NO2+H2O===2HNO3+NO,即NO2(g)HNO3(aq)可以实现,A不合题意;常温下,NH3与O2不反应,即NH3(g)NO2(g)不可实现,B符合题意;N2和O2在放电情况下反应生成NO,即N2(g)NO(g)能够实现,C不合题意;Cu(OH)2(s)Cu2+(aq)+2OH-(aq),NH结合OH-促进上述溶解平衡,且Cu2+能与NH3形成[Cu(NH3)4]2+,故Cu(OH)2(s)eq \o(――→,\s\up7(NH(aq)),\s\do5(氨水))[Cu(NH3)4]2+(aq)能够实现,D不合题意。故选B。
2. D 解析:燃煤过程中,N2转化为NO,发生了氮的固定,A正确;由图可知,随着温度升高,NO含量升高,污染加重,B正确;由图可知,O2浓度升高,NO含量升高,则含氧量越高,越容易生成NO,C正确;煤燃烧将N2转化为NO,污染环境,影响了氮循环,D错误。
3. (1)
(2)AD
(3)> 温度升高,催化剂活性降低
(4)①0.057 ②该反应为放热反应,温度升高,平衡逆向移动,NO转化率降低
(5)2H2O-4e-===4H++O2↑ 0.02
解析:(1)N4中每个N为8电子稳定结构,N4为四面体结构;
(2)断键吸热,所以升高温度,第一步向右进行的程度变大,A正确;第二步的慢反应,其活化能比第三步大,B错误;IO为中间产物,I2是反应的催化剂,C错误;根据含碘时分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数),可判断N2O分解反应的速率与是否含碘蒸气有关,D正确。故选AD;
(3)由于在催化剂乙作用下,图中M点对应的转化率低于催化剂甲时对应的转化率,因此反应没有达到平衡状态,反应向正反应方向进行,则速率(对应温度400 ℃)v(正)>v(逆);温度高于400 ℃,NO转化率降低的原因可能是温度升高催化剂活性降低;
(4)①420 ℃ NO的转化率2%,此时消耗的NO为3 mol×2%=0.06 mol,580 ℃ NO的转化率59%,此时消耗NO为3 mol×59%=1.77 mol,故在420~580 ℃,NO的改变量为1.77 mol-0.06 mol=1.71 mol,速率为v====0.057 mol·L-1;②温度升高,NH3与O2反应生成了NO。
(5)由图可知,电解池中阴极的亚硫酸氢根离子得到电子发生还原反应生成S2O,反应式为2HSO+2e-+2H+===S2O+2H2O;阳极反应为2H2O-4e-===4H++O2↑;2NO+S2O===N2↑+2HSO,则2NO~4e-~O2,当224 mL O2,n(O2)===0.01 mol,则可处理NO的物质的量为0.02 mol。
4. (1)cd
(2)2HSO+2e-+2H+===S2O+2H2O
(3)①300 ℃ 在较高温度下,随着催化剂活性的下降,没有参加反应的NO逐渐被氧化成了NO2 ②> X点反应未达最大限度,反应仍在正向进行 ③不同的空速条件下,NO的转化率相差不大。但使用较大的空速,可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力
解析:(1)催化剂只能提高脱硝的速率,不能改变平衡转化率,故a错误;慢反应决定了整个历程的反应速率,故状态③到状态④的变化过程决定了整个历程的反应速率,故b错误;状态③到状态④中有N与N之间非极性键和H与O之间极性键生成,故c正确;在图1所示历程中铜元素的化合价经历+2→+1→+2的变化过程,故d正确;故选cd;
(2)由图可知,阴极发生还原反应,则阴极上的电极反应为HSO得到电子被还原为S2O,电极反应式为:2HSO+2e-+2H+===S2O+2H2O;
(3)①结合题图1可知,温度300 ℃、MnCeZr做催化剂时,NO的转化率最高。由题图2结合题干信息“催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力”可知空速30 000 h-1时NO的转化率足够高。故选取工业脱硝的最佳反应条件为MnCeZr做催化剂、300 ℃、空速30 000 h-1;50~400 ℃产生较多NO2的原因为:在较高温度下,MnCeZr、MnCe催化活性均下降,反应速率减慢,随着脱硝效率的下降,没有参加反应的NO逐渐被氧化成了NO2;②较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是Mn的存在改善了催化剂的低温活性。在MnCe催化剂催化下,X点的正反应速率>逆反应速率,其理由为:平衡是可逆反应所能达到的最大限度,相同温度下,X点时NO的转化率不是最大的(MnCeZr做催化剂时NO的转化率更大),所以X点时反应没有达到平衡,反应仍在正向进行,即正反应速率大于逆反应速率;③在MnCeZr的催化作用下,实际工业脱硝应选择的空速为30 000 h-1,原因是:不同的空速条件下,NO的转化率相差不大。但使用较大的空速,可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。
5. (1)①使NO(或NO2)充分转化为NO,提高N元素的利用率 ②b ③3MnO+4H++5NO===3Mn2++5NO+2H2O
(2)缓慢通入60 L 0.008 g·L-1 O3充分反应,再分批加入80 g KCl固体充分反应 将滤液浓缩蒸发水量25%,再冷却到10 ℃(或10 ℃以下)结晶,过滤得KNO3粗品,再重结晶提纯得到KNO3
解析:(1)①由3NO2+H2O===2HNO3+NO、3Cu+8H++2NO===3Cu2++2NO↑+4H2O可知,使用稀硫酸时,能将NO(或NO2)充分转化为NO。②经过装置A洗气后的气体主要含有NO和CO2,故装置B中装有碱石灰,用于除去NO气体中混有的CO2。③在装置D中,未参加反应的NO被酸性高锰酸钾溶液氧化为NO。(2)将废渣加入水中后,应先加入O3将NaNO2氧化为NaNO3,再加入KCl,充分反应后生成KNO3,结合图1可知,过滤后的滤液应浓缩蒸发水量的25%,结合图2可知,蒸发25%的水后,冷却到10 ℃结晶,过滤得到KNO3粗产品,结合图3可知,KNO3的溶解度随温度升高变化幅度较大,而NaCl的溶解度随温度升高变化幅度较小,故可通过重结晶提纯得到KNO3。
6. (1)N2
(2)①1.5≤x<2 ②11.2 L
(3)4NH3+4NO+O24N2+6H2O
(4)①2∶3 ②随着DO的增大,厌氧氨氧化菌活性降低;部分NO被氧化为NO
解析:(1)用H2或CO催化还原NO生成无污染的物质,NO为氧化剂,还原产物为N2。
(2)①NO不能与NaOH溶液反应,NO、NO2按物质的量之比1∶1时发生的反应为NO+NO2+2NaOH===2NaNO2+H2O,此时x=1.5;NO2与NaOH溶液发生的反应为2NO2+2NaOH===NaNO2+NaNO3+H2O,此时x=2。NOx能被NaOH溶液完全吸收,x的取值范围为1.5≤x<2。②若用100 mL 5 mol·L-1 NaOH溶液吸收NOx生成NaNO2、NaNO3,NaOH恰好完全反应,根据原子守恒知,n(NOx)=n(N)=n(Na)=n(NaOH)=100×10-3 L×5 mol·L-1=0.5 mol,标准状况下,被吸收的NOx的体积=0.5 mol×22.4 L·mol-1=11.2 L。
(4)①反应Ⅰ中,NH被O2氧化为NO,N元素的化合价由-3升高为+3,O元素的化合价由0降低为-2,根据得失电子守恒知,参与Ⅰ中反应的n(NH)∶n(O2)=2∶3。②根据题目信息知,O2浓度越高,厌氧氨氧化菌活性越低,氮的脱除率下降,同时可能部分NO被氧化为NO。
一、 单项选择题
1. (2024·淮安五校高三上联考)液氨是一种很好的溶剂,液氨可以微弱的电离产生NH和NH。NH3中的一个H原子若被—NH2取代可形成N2H4(联氨),若被—OH取代可形成NH2OH(羟胺)。在有NH存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。在题给条件下,下列选项所示的物质间转化不可以实现的是( )
A. NO2(g)HNO3(aq)
B. NH3(g)NO2(g)
C. N2(g)NO(g)
D. Cu(OH)2(s)eq \o(――→,\s\up7(NH(aq)),\s\do5(氨水))[Cu(NH3)4]2+(aq)
2. (2024·苏锡常镇二模)煤燃烧时,烟气中NO含量随温度和氧气含量的变化如图所示。下列说法不正确的是( )
A. 燃煤过程中发生了氮的固定
B. 燃煤温度越高,NOx污染越重
C. 含氧量越高,越容易生成NO
D. 煤燃烧不影响自然界氮循环
二、 非选择题
3. (2024·连云港五校高三上12月联考)氮元素是一种重要元素,其单质及化合物在化工、生产等领域应用非常广泛。请回答下列问题:
(1)氮元素的常见单质有N2、N4、N8,在三种分子中的每个氮原子均为8电子稳定结构,则N4的结构简式为__________。
(2)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步:I2(g)―→2I(g)(快反应)
第二步:I(g)+N2O(g)―→N2(g)+IO(g)(慢反应)
第三步:IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)
实验表明:含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A. 升高温度,第一步向右进行的程度变大
B. 第二步的活化能比第三步小
C. IO为反应的催化剂
D. N2O分解反应的速率与是否含碘蒸气有关
(3)为探究温度及不同催化剂对反应2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示。在催化剂乙作用下,图中M点对应的速率(对应温度400 ℃)v(正)__________v(逆)(填“>”、“<”或“=”),温度升高后,两种催化剂条件下NO转化效率均明显降低,原因可能是__________________。
(4)NH3催化还原NO是重要的烟气脱硝技术。
某研究小组将2 mol NH3、3 moI NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生反应4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH<0,NO的转化率随温度变化的情况如图所示:
①在15 min内将温度从420 ℃升高到580 ℃,此时间段内NO的平均反应速率为__________ mol·L-1·min-1。
②在有氧条件下,温度580 ℃之后NO生成N2的转化率降低的原因可能是________________________。
(5)利用如图所示原理去除NO:
电解池中阳极发生的反应式为__________________________________________,通过将甲酸与溶于甲醇和水混合溶剂里的NaOH混合,再通入SO2气体的方法可制得Na2S2O4;每产生224 mL O2(体积已换算成标准状况,不考虑O2的溶解),可处理NO的物质的量为__________ mol。
4. 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)二价铜微粒[CuⅡ(NH3)2]2+可用作汽车尾气脱硝的催化剂,其可能的催化机理如图1所示,反应过程中不同态物质体系所含的能量如图2所示。下列说法正确的是__________。
a. 使用[CuⅡ(NH3)2]2+催化剂,可以提高NOx的脱除速率和平衡转化率
b. 状态②到状态③的变化过程决定了整个历程的反应速率
c. 状态③到状态④中有非极性键和极性键生成
d. 在题图1所示历程中,铜元素的化合价发生变化
(2)隔膜电解法同时脱硫脱硝的装置如图3所示,其中电极A、B均为惰性电极,电解液为稀硫酸。为提高脱除效率,将阴极室的溶液pH调至4~7,则阴极上的电极反应为________________________________________。
(3)选择性催化还原脱硝技术是控制尾部烟气中NOx排放的最成熟有效的技术之一,在相同时间内,三种催化剂下NO的转化率、NO2浓度随温度变化如图4所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图5所示。
①温度约为__________ ℃时,催化剂的活性最大。在MnCe或MnCeZr的催化作用下,350~400 ℃ NO2浓度明显增大的原因是____________________________________________________________________。
②在MnCe催化剂催化作用下,X点的正反应速率__________(填“>”、“<”或“=”)逆反应速率,说明理由:__________________________________________________________________________________________。
③在MnCeZr的催化作用下,实际工业脱硝应选择的空速为30 000 h-1,原因是_________________________________________________________________________________________________。
5. (2024·徐州三模)亚硝酸钠(NaNO2)在工业上多个领域有着广泛应用。
(1)实验室利用工业废气(主要含NO、NO2、CO2)模拟制备NaNO2的装置如图所示:
已知:室温下,2NO+Na2O2===2NaNO2;酸性条件下,NO、NO都能与MnO反应生成NO和Mn2+。
①装置A中使用稀硫酸的目的是____________________________________________。
②装置B内盛放的试剂可能是__________(填字母)。
a. P2O5 b. 碱石灰 c. 无水CaCl2 d. 无水硫酸铜
③装置D中发生反应的离子方程式为________________________________________________________。
(2)请补充完整利用工业废渣(主要成分为NaNO3和NaNO2)制备KNO3的实验方案:将100 g废渣加入80 mL热水中,充分搅拌,______________________________________________________________________________,过滤,______________________________________________________________________(须使用的试剂及用量:60 L 0.008 g·L-1 O3和80 g KCl固体)。已知:KNO3的产率及纯度与浓缩蒸发水量、温度的关系如图1、图2所示,溶解度关系如图3所示。
6. (2024·淮安、宿迁七校联考)含氮化合物的处理对环境保护意义重大。
(1)用H2或CO催化还原NO均能达到消除污染的目的,反应的还原产物为__________。
(2)实验室常用NaOH溶液吸收NOx(NO和NO2的混合气体),不考虑NO2与N2O4的转化。
①若NOx能被NaOH溶液完全吸收,则x的取值范围为______________。
②若用100 mL 5 mol·L-1 NaOH吸收NOx,NaOH恰好完全反应,则被吸收的NOx的体积为______________(标准状况)。
(3)用V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图所示,则总反应的化学方程式为_________________________________________________________________________________________________。
(4)一种将氨氮(NH)废水中的氮元素转变为N2脱除的机理如图所示。已知:氧气浓度越高,厌氧氨氧化菌活性越低。
NHNOeq \o(――→,\s\up7(NH),\s\do5(厌氧氨氧化菌,Ⅱ))N2
①参与Ⅰ中反应的n(NH)∶n(O2)=__________。
②废水溶解氧浓度(DO)对氮的脱除率的影响如图所示。当1 mg·L-1<DO<2 mg·L-1时,随着DO的增大氮的脱除率下降,其原因可能是________________________________________________________________________。
第32练 氮及其氧化物
1. B 解析:常温下,3NO2+H2O===2HNO3+NO,即NO2(g)HNO3(aq)可以实现,A不合题意;常温下,NH3与O2不反应,即NH3(g)NO2(g)不可实现,B符合题意;N2和O2在放电情况下反应生成NO,即N2(g)NO(g)能够实现,C不合题意;Cu(OH)2(s)Cu2+(aq)+2OH-(aq),NH结合OH-促进上述溶解平衡,且Cu2+能与NH3形成[Cu(NH3)4]2+,故Cu(OH)2(s)eq \o(――→,\s\up7(NH(aq)),\s\do5(氨水))[Cu(NH3)4]2+(aq)能够实现,D不合题意。故选B。
2. D 解析:燃煤过程中,N2转化为NO,发生了氮的固定,A正确;由图可知,随着温度升高,NO含量升高,污染加重,B正确;由图可知,O2浓度升高,NO含量升高,则含氧量越高,越容易生成NO,C正确;煤燃烧将N2转化为NO,污染环境,影响了氮循环,D错误。
3. (1)
(2)AD
(3)> 温度升高,催化剂活性降低
(4)①0.057 ②该反应为放热反应,温度升高,平衡逆向移动,NO转化率降低
(5)2H2O-4e-===4H++O2↑ 0.02
解析:(1)N4中每个N为8电子稳定结构,N4为四面体结构;
(2)断键吸热,所以升高温度,第一步向右进行的程度变大,A正确;第二步的慢反应,其活化能比第三步大,B错误;IO为中间产物,I2是反应的催化剂,C错误;根据含碘时分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数),可判断N2O分解反应的速率与是否含碘蒸气有关,D正确。故选AD;
(3)由于在催化剂乙作用下,图中M点对应的转化率低于催化剂甲时对应的转化率,因此反应没有达到平衡状态,反应向正反应方向进行,则速率(对应温度400 ℃)v(正)>v(逆);温度高于400 ℃,NO转化率降低的原因可能是温度升高催化剂活性降低;
(4)①420 ℃ NO的转化率2%,此时消耗的NO为3 mol×2%=0.06 mol,580 ℃ NO的转化率59%,此时消耗NO为3 mol×59%=1.77 mol,故在420~580 ℃,NO的改变量为1.77 mol-0.06 mol=1.71 mol,速率为v====0.057 mol·L-1;②温度升高,NH3与O2反应生成了NO。
(5)由图可知,电解池中阴极的亚硫酸氢根离子得到电子发生还原反应生成S2O,反应式为2HSO+2e-+2H+===S2O+2H2O;阳极反应为2H2O-4e-===4H++O2↑;2NO+S2O===N2↑+2HSO,则2NO~4e-~O2,当224 mL O2,n(O2)===0.01 mol,则可处理NO的物质的量为0.02 mol。
4. (1)cd
(2)2HSO+2e-+2H+===S2O+2H2O
(3)①300 ℃ 在较高温度下,随着催化剂活性的下降,没有参加反应的NO逐渐被氧化成了NO2 ②> X点反应未达最大限度,反应仍在正向进行 ③不同的空速条件下,NO的转化率相差不大。但使用较大的空速,可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力
解析:(1)催化剂只能提高脱硝的速率,不能改变平衡转化率,故a错误;慢反应决定了整个历程的反应速率,故状态③到状态④的变化过程决定了整个历程的反应速率,故b错误;状态③到状态④中有N与N之间非极性键和H与O之间极性键生成,故c正确;在图1所示历程中铜元素的化合价经历+2→+1→+2的变化过程,故d正确;故选cd;
(2)由图可知,阴极发生还原反应,则阴极上的电极反应为HSO得到电子被还原为S2O,电极反应式为:2HSO+2e-+2H+===S2O+2H2O;
(3)①结合题图1可知,温度300 ℃、MnCeZr做催化剂时,NO的转化率最高。由题图2结合题干信息“催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力”可知空速30 000 h-1时NO的转化率足够高。故选取工业脱硝的最佳反应条件为MnCeZr做催化剂、300 ℃、空速30 000 h-1;50~400 ℃产生较多NO2的原因为:在较高温度下,MnCeZr、MnCe催化活性均下降,反应速率减慢,随着脱硝效率的下降,没有参加反应的NO逐渐被氧化成了NO2;②较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是Mn的存在改善了催化剂的低温活性。在MnCe催化剂催化下,X点的正反应速率>逆反应速率,其理由为:平衡是可逆反应所能达到的最大限度,相同温度下,X点时NO的转化率不是最大的(MnCeZr做催化剂时NO的转化率更大),所以X点时反应没有达到平衡,反应仍在正向进行,即正反应速率大于逆反应速率;③在MnCeZr的催化作用下,实际工业脱硝应选择的空速为30 000 h-1,原因是:不同的空速条件下,NO的转化率相差不大。但使用较大的空速,可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。
5. (1)①使NO(或NO2)充分转化为NO,提高N元素的利用率 ②b ③3MnO+4H++5NO===3Mn2++5NO+2H2O
(2)缓慢通入60 L 0.008 g·L-1 O3充分反应,再分批加入80 g KCl固体充分反应 将滤液浓缩蒸发水量25%,再冷却到10 ℃(或10 ℃以下)结晶,过滤得KNO3粗品,再重结晶提纯得到KNO3
解析:(1)①由3NO2+H2O===2HNO3+NO、3Cu+8H++2NO===3Cu2++2NO↑+4H2O可知,使用稀硫酸时,能将NO(或NO2)充分转化为NO。②经过装置A洗气后的气体主要含有NO和CO2,故装置B中装有碱石灰,用于除去NO气体中混有的CO2。③在装置D中,未参加反应的NO被酸性高锰酸钾溶液氧化为NO。(2)将废渣加入水中后,应先加入O3将NaNO2氧化为NaNO3,再加入KCl,充分反应后生成KNO3,结合图1可知,过滤后的滤液应浓缩蒸发水量的25%,结合图2可知,蒸发25%的水后,冷却到10 ℃结晶,过滤得到KNO3粗产品,结合图3可知,KNO3的溶解度随温度升高变化幅度较大,而NaCl的溶解度随温度升高变化幅度较小,故可通过重结晶提纯得到KNO3。
6. (1)N2
(2)①1.5≤x<2 ②11.2 L
(3)4NH3+4NO+O24N2+6H2O
(4)①2∶3 ②随着DO的增大,厌氧氨氧化菌活性降低;部分NO被氧化为NO
解析:(1)用H2或CO催化还原NO生成无污染的物质,NO为氧化剂,还原产物为N2。
(2)①NO不能与NaOH溶液反应,NO、NO2按物质的量之比1∶1时发生的反应为NO+NO2+2NaOH===2NaNO2+H2O,此时x=1.5;NO2与NaOH溶液发生的反应为2NO2+2NaOH===NaNO2+NaNO3+H2O,此时x=2。NOx能被NaOH溶液完全吸收,x的取值范围为1.5≤x<2。②若用100 mL 5 mol·L-1 NaOH溶液吸收NOx生成NaNO2、NaNO3,NaOH恰好完全反应,根据原子守恒知,n(NOx)=n(N)=n(Na)=n(NaOH)=100×10-3 L×5 mol·L-1=0.5 mol,标准状况下,被吸收的NOx的体积=0.5 mol×22.4 L·mol-1=11.2 L。
(4)①反应Ⅰ中,NH被O2氧化为NO,N元素的化合价由-3升高为+3,O元素的化合价由0降低为-2,根据得失电子守恒知,参与Ⅰ中反应的n(NH)∶n(O2)=2∶3。②根据题目信息知,O2浓度越高,厌氧氨氧化菌活性越低,氮的脱除率下降,同时可能部分NO被氧化为NO。
同课章节目录
