第33练 氨和铵盐 课时作业(含解析 )2026届高三化学一轮总复习
文档属性
| 名称 | 第33练 氨和铵盐 课时作业(含解析 )2026届高三化学一轮总复习 |
|
|
| 格式 | doc | ||
| 文件大小 | 405.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 00:00:00 | ||
图片预览




文档简介
第33练 氨和铵盐
一、 单项选择题
1. (2024·灌云附中、灌南二中高三上联考)下列有关含氮物质的性质与用途具有对应关系的是( )
A. NH3具有还原性,可用作制冷剂
B. N2难溶于水,可用作瓜果保护气
C. NO2具有强氧化性,可作火箭燃料推进剂
D. NH4HCO3受热易分解,可用作氮肥
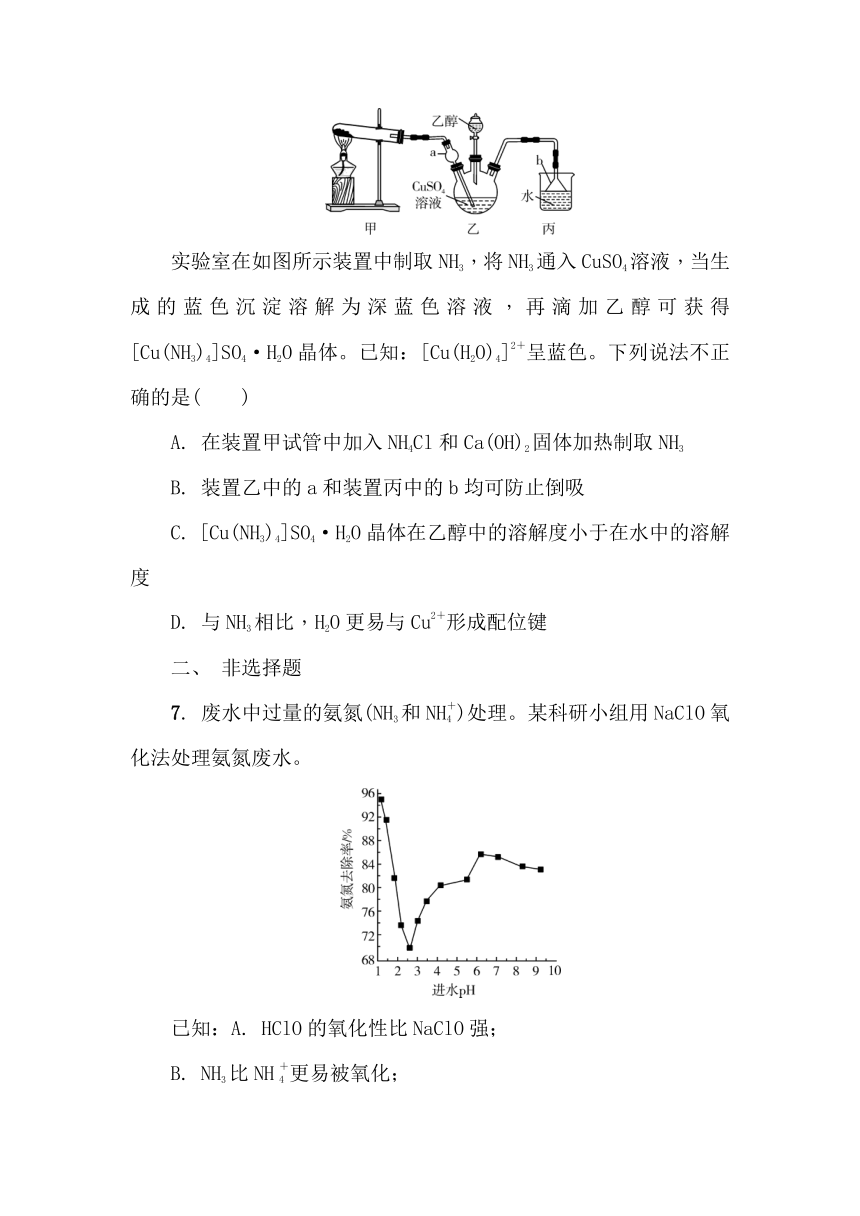
2. (2025·沭阳中学高三下月考)实验室制备NH3的实验原理及装置均正确的是( )
A. B.
C. D.
3. (2024·江苏高三上期初)兴趣小组利用以下装置,进行如下实验。下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制备NH3 B. 用装置乙干燥NH3 C. 用装置丙收集NH3 D. 用装置丁做喷泉实验
4.
(2024·苏锡常镇二模)用电解法对酸性含氯氨氮废水进行无害化处理的过程如图所示。下列说法正确的是( )
A. DSA电极与外接电源的负极连接
B. Cl-发生的电极反应为Cl-+H2O-2e-===ClO-+2H+
C. 降解过程中应该控制条件避免发生反应②
D. 1 mol HO·和足量NH3反应,转移的电子数为2×6.02×1023
5.
氮及其化合物在工农业生产和生命活动中起着重要的作用,一种利用电化学制备NH3的转化历程如图所示。下列说法不正确的是( )
A. 步骤Ⅱ属于氮的固定
B. 物质X为离子化合物
C. LiOH可视为该历程中的催化剂
D. 由该历程说明N2的氧化性强于O2
6.
实验室在如图所示装置中制取NH3,将NH3通入CuSO4溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得[Cu(NH3)4]SO4·H2O晶体。已知:[Cu(H2O)4]2+呈蓝色。下列说法不正确的是( )
A. 在装置甲试管中加入NH4Cl和Ca(OH)2固体加热制取NH3
B. 装置乙中的a和装置丙中的b均可防止倒吸
C. [Cu(NH3)4]SO4·H2O晶体在乙醇中的溶解度小于在水中的溶解度
D. 与NH3相比,H2O更易与Cu2+形成配位键
二、 非选择题
7. 废水中过量的氨氮(NH3和NH)处理。某科研小组用NaClO氧化法处理氨氮废水。
已知:A. HClO的氧化性比NaClO强;
B. NH3比NH更易被氧化;
C. 国家标准要求经处理过的氨氮废水pH要控制在6~9。
进水pH对氨氮去除率的影响如下图所示。
(1)进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_______________________________。
(2)写出酸性条件下ClO-氧化NH的离子方程式_________________________________________。
(3)已知:a. O2的氧化性比NaClO弱;b. O2氧化氨氮速率比NaClO慢。
在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率______________(填“显著变大”“显著变小”或“几乎不变”)。
8. (2025·常州高三上期中)实验室在如图所示装置(部分夹持装置已省略)中,用氨气和金属钠反应制得氨基钠(NaNH2)。
已知:常温下氨基钠为白色晶体,熔点为210 ℃,沸点为400 ℃,露置于空气中遇水蒸气剧烈反应生成NaOH和NH3。金属钠的熔点为97.8 ℃,沸点为882.9 ℃。
(1)实验时,应首先点燃装置__________(填“①”或“③”)中的酒精灯。
(2)写出装置①中发生反应的化学方程式:_________________________________________________。
(3)装置④中冷凝管的进水口应接在__________(填“a”或“b”)处。冷凝管主要用于冷凝回流的物质是__________(填化学式)。
(4)装置⑤中的球形干燥管除干燥气体便于后续点燃外,还起到______________________________________________________的作用。
(5)上述方法制得的氨基钠中往往混有杂质钠。称取0.150 0 g实验制得的样品溶于足量去离子水中,加热,使NH3完全蒸出,并用50.00 mL 0.300 0 mol·L-1 H3BO3溶液充分吸收NH3。再向吸收液中逐滴加入0.250 0 mol·L-1硫酸,恰好反应时,消耗硫酸的体积为4.70 mL。
已知:2NH3+4H3BO3===(NH4)2B4O7+5H2O、(NH4)2B4O7+H2SO4+5H2O===(NH4)2SO4+4H3BO3。
计算该样品中氨基钠的质量分数(写出计算过程)。
9. (2024·南通高三下模拟预测)氨的制备是当前研究的重要课题。
(1)CH4、N2偶联活化制NH3。研究发现,[TiAlO4]+(M=139 g·mol-1)可以活化CH4,为合成氨提供活性氢原子。
①将[TiAlO4]+暴露在CH4中,反应产生微粒有·CH3、[TiAlO3H2]+、[TiAlO4H]+、[TiAlO4H2]+、HCHO。实验过程中的质谱图如图1所示。图中质荷比为125对应的微粒为____________,生成该微粒的同时,还生成____________。
②为探究[TiAlO4]+活化CH4的反应过程,研究人员从反应体系中不断去除[TiAlO4H]+,得到的质谱图如图2所示。[TiAlO4]+与CH4反应生成[TiAlO4H2]+的过程可描述为____________________________________________。
③[TiAlO4]+活化CH4后,产生活性H原子与N2反应生成NH3。活化过程中生成多种副产物导致NH3的选择性较低,其中不含非极性键的含氮副产物分子可能有__________________(写两种)。
(2)电催化还原N2制NH3。在碱性水溶液中,通过电催化使N2还原为NH3的电极反应式为________________________________________。该制氨方法尚未能应用于工业生产,除因为N2的溶解度低、难吸附在电极和催化剂表面外,还有____________________________________________。
(3)电催化还原NO制NH3。NF是一种电极载体,分别以Ni2P/NF、Fe/NF、NF为阴极材料,电解含NO的中性溶液(电极材料与溶液不发生反应)。控制电压恒定、催化剂的面积为0.25 cm2,电解2小时后,不同电极上NH3的产率及NH3的选择性如图3所示。
①分别以Ni2P/NF、Fe/NF电极电解NaNO2溶液相同时间:c(NO)Ni2/NF>c(NO)Fe/NF,原因是____________________________________________________。
②已知:NH3的产率=;NH3的选择性=eq \f(n(NH3)生成,n(NO)消耗)×100%。以Ni2P/NF为电极电解NaNO2溶液2小时,消耗n(NO)总=__________ mol。
第33练 氨和铵盐
1. C 解析:NH3易液化,液氨气化吸收大量的热,使周围环境温度降低,因此可用作制冷剂,与其具有还原性无关,A不符合题意;N2不能帮助呼吸,能够使害虫窒息而死,因此可用作瓜果保护气,与其是否难溶于水的性质无关,B不符合题意;NO2具有强氧化性,可在火箭燃料中作氧化剂,与N2H4反应生成N2、H2O,因此可作火箭燃料推进剂,C符合题意;NH4HCO3含有农作物生长需要的氮元素,因此可用作氮肥,与其不稳定,受热易分解的性质无关,D不符合题意。故选C。
2. C 解析:NH4Cl在试管底加热时发生分解,生成NH3和HCl,在试管口遇冷又化合为NH4Cl固体,附着在试管内壁或导管内,不能制取NH3,A不符合题意;氯化钙通常可作中性气体或酸性气体的干燥剂,但能与NH3反应生成CaCl2·8NH3而不能用于干燥NH3,B不符合题意;NH3的密度比空气小,可用向下排空气法收集,为防止氨气与空气发生对流,在集气试管口通常放一团疏松的棉花,C符合题意;将NH3通入稀H2SO4溶液中,会发生倒吸,煤油起不到防止倒吸的作用,D不符合题意。故选C。
3. C 解析:CaO与浓氨水混合后与水反应并放出大量的热,促使NH3挥发,可用此装置制备NH3,故不选A;NH3为碱性气体,可用碱石灰干燥NH3,故不选B;NH3的密度比空气小,可采用向下排空气法收集,装置丙中导气管“长进短出”,为向上排空气法。故选C;NH3极易溶于水,溶于水后圆底烧瓶内压强减小,从而产生喷泉,故不选D。故选C。
4. C 解析:由“NH3→N2、Cl-→Cl2”可知,DSA电极上发生的是失电子的氧化反应,故DSA为阳极,与外接电源的正极连接,A错误;Cl-发生的电极反应式为2Cl--2e-===Cl2↑,B错误;N2对环境无污染,反应②生成NO,降解过程中应该控制条件避免发生反应②,C正确;反应过程中,1 mol HO·可得到1 mol电子,故转移电子数约为6.02×1023,D错误。
5. D 解析:步骤Ⅱ中,N2转化为Li3N,属于氮的固定,A正确;X为Li3N,Li3N是由N3-和Li+构成的离子化合物,B正确;LiOH先消耗后生成,可视为该历程中的催化剂,C正确;该反应历程中,步骤Ⅰ通过电解发生,不能说明N2的氧化性强于O2,D错误。
6. D 解析:甲装置中实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气,乙装置中NH3通入CuSO4溶液,生成的蓝色沉淀为Cu(OH)2,后溶解为[Cu(NH3)4]2+,丙装置进行尾气处理并防倒吸,据此作答。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气,制取装置中试管口略向下倾斜,防止水倒流引起试管炸裂,A正确;氨气极易溶于水,易发生倒吸,装置乙中a的容积较大,可防止制备过程中发生倒吸现象,倒扣的漏斗与液面相切,液体很难倒吸,因此倒扣的漏斗可防止液体倒吸,B正确;由向深蓝色溶液中加入乙醇,深蓝色溶液变浑浊,静置后有深蓝色[Cu(NH3)4]SO4·H2O晶体析出,因此[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小于在水中的溶解度,故C正确;由向硫酸铜溶液中逐滴滴加浓氨水,先生成蓝色沉淀,蓝色沉淀逐渐溶解为深蓝色溶液可知,氨分子比水分子更容易与铜离子反应形成配合物,故D错误。故选D。
7. (1)随着pH升高,氨氮废水中NH3含量增大,氨氮更易被氧化
(2)3ClO-+2NH===N2↑+3Cl-+3H2O+2H+(或写为3HClO+2NH===N2↑+3Cl-+3H2O+5H+)
(3)几乎不变
解析:(1)废水中溶液pH越大,其中含有的NH3含量就越高,由于NH3比NH更易被氧化,因此氨氮更易被氧化;
(2)在酸性条件下ClO-、NH发生氧化还原反应产生N2、Cl-,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为:3ClO-+2NH===N2↑+3Cl-+3H2O+2H+(或写为3HClO+2NH===N2↑+3Cl-+3H2O+5H+);
(3)由于a. O2的氧化性比NaClO弱;b. O2氧化氨氮速率比NaClO慢,因此在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率几乎不变。
8. (1)①
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)a NaNH2
(4)吸收NH3,且防止空气中的水蒸气进入三颈烧瓶中与氨基钠反应
(5)61.10%(计算过程见解析)
解析:(1)Na能与空气中的O2反应,实验时,应先点燃①处酒精灯排尽装置内的空气。
(3)为了达到较好的冷凝效果,装置④中冷凝管的进水口应接在a处。根据题给信息可知,NaNH2的沸点比金属钠低,故冷凝管主要冷凝回流的物质是NaNH2。
(4)未反应完的NH3会污染空气,NaNH2遇水蒸气剧烈反应,故装置⑤中的球形干燥管除干燥气体便于后续点燃外,还能吸收多余的NH3,同时防止空气中的水蒸气进入三颈烧瓶中与氨基钠反应。
(5)根据题给信息可得关系式:2NaNH2~2NH3~(NH4)2B4O7~H2SO4,n(NaNH2)=2n(H2SO4)=2×0.25 mol·L-1×4.7×10-3 L=2.35×10-3 mol;m(NaNH2)=39 g·mol-1×2.35×10-3 mol=0.091 65 g,样品中氨基钠的质量分数=×100%=61.10%。
9. (1)①[TiAlO3H2]+ HCHO ②[TiAlO4]+和CH4反应生成[TiAlO4H]+和·CH3,[TiAlO4H]+再与CH4反应生成[TiAlO4H2]+和·CH3 ③CH3NH2、(CH3)2NH、(CH3)3N
(2)N2+6e-+6H2O===2NH3+6OH- N2和H2O(H+)在阴极表面同时发生得电子的竞争反应
(3)①NO在Fe/NF电极放电过程中转化为其他含氮物质,且转化速率大 ②
解析:(1)①质谱图中质荷比为125对应的微粒相对分子质量为125,对应的是[TiAlO3H2]+,生成[TiAlO3H2]+时,发生反应:[TiAlO4]++CH4―→[TiAlO3H2]++HCHO,还生成了HCHO;②[TiAlO4]+活化CH4的过程中将CH4转化为·CH3,质荷比为141对应的微粒为[TiAlO4H2]+,[TiAlO4]+与CH4反应生成[TiAlO4H2]+的过程可描述为:[TiAlO4]+和CH4反应生成[TiAlO4H]+和·CH3,[TiAlO4H]+再与CH4反应生成[TiAlO4H2]+和·CH3;③[TiAlO4]+活化CH4得到·CH3,产生活性H原子与N2反应生成NH3活化过程中·CH3会代替NH3中的H原子生成多种副产物:CH3NH2、(CH3)2NH、(CH3)3N。
(2)N2得到电子生成NH3,根据得失电子守恒和电荷守恒配平电极方程式为:N2+6e-+6H2O===2NH3+6OH-。该制氨方法尚未能应用于工业生产,除因为N2的溶解度低、难吸附在电极和催化剂表面外,还有N2和H2O(H+)在阴极表面同时发生得电子的竞争反应。
(3)①分别以Ni2P/NF、Fe/NF电极电解NaNO2溶液相同时间:c(NO)Ni2/NF>c(NO)Fe/NF,原因是NO在Fe/NF电极放电过程中转化为其他含氮物质,且转化速率大;②由图可知,以Ni2P/NF为电极电解NaNO2溶液2小时,NH3的产率=3 400 mg·h-1·cm-2,NH3的选择性为70%,则消耗n(NH3)生成==0.1 mol,消耗n(NO)总=== mol。
一、 单项选择题
1. (2024·灌云附中、灌南二中高三上联考)下列有关含氮物质的性质与用途具有对应关系的是( )
A. NH3具有还原性,可用作制冷剂
B. N2难溶于水,可用作瓜果保护气
C. NO2具有强氧化性,可作火箭燃料推进剂
D. NH4HCO3受热易分解,可用作氮肥
2. (2025·沭阳中学高三下月考)实验室制备NH3的实验原理及装置均正确的是( )
A. B.
C. D.
3. (2024·江苏高三上期初)兴趣小组利用以下装置,进行如下实验。下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制备NH3 B. 用装置乙干燥NH3 C. 用装置丙收集NH3 D. 用装置丁做喷泉实验
4.
(2024·苏锡常镇二模)用电解法对酸性含氯氨氮废水进行无害化处理的过程如图所示。下列说法正确的是( )
A. DSA电极与外接电源的负极连接
B. Cl-发生的电极反应为Cl-+H2O-2e-===ClO-+2H+
C. 降解过程中应该控制条件避免发生反应②
D. 1 mol HO·和足量NH3反应,转移的电子数为2×6.02×1023
5.
氮及其化合物在工农业生产和生命活动中起着重要的作用,一种利用电化学制备NH3的转化历程如图所示。下列说法不正确的是( )
A. 步骤Ⅱ属于氮的固定
B. 物质X为离子化合物
C. LiOH可视为该历程中的催化剂
D. 由该历程说明N2的氧化性强于O2
6.
实验室在如图所示装置中制取NH3,将NH3通入CuSO4溶液,当生成的蓝色沉淀溶解为深蓝色溶液,再滴加乙醇可获得[Cu(NH3)4]SO4·H2O晶体。已知:[Cu(H2O)4]2+呈蓝色。下列说法不正确的是( )
A. 在装置甲试管中加入NH4Cl和Ca(OH)2固体加热制取NH3
B. 装置乙中的a和装置丙中的b均可防止倒吸
C. [Cu(NH3)4]SO4·H2O晶体在乙醇中的溶解度小于在水中的溶解度
D. 与NH3相比,H2O更易与Cu2+形成配位键
二、 非选择题
7. 废水中过量的氨氮(NH3和NH)处理。某科研小组用NaClO氧化法处理氨氮废水。
已知:A. HClO的氧化性比NaClO强;
B. NH3比NH更易被氧化;
C. 国家标准要求经处理过的氨氮废水pH要控制在6~9。
进水pH对氨氮去除率的影响如下图所示。
(1)进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_______________________________。
(2)写出酸性条件下ClO-氧化NH的离子方程式_________________________________________。
(3)已知:a. O2的氧化性比NaClO弱;b. O2氧化氨氮速率比NaClO慢。
在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率______________(填“显著变大”“显著变小”或“几乎不变”)。
8. (2025·常州高三上期中)实验室在如图所示装置(部分夹持装置已省略)中,用氨气和金属钠反应制得氨基钠(NaNH2)。
已知:常温下氨基钠为白色晶体,熔点为210 ℃,沸点为400 ℃,露置于空气中遇水蒸气剧烈反应生成NaOH和NH3。金属钠的熔点为97.8 ℃,沸点为882.9 ℃。
(1)实验时,应首先点燃装置__________(填“①”或“③”)中的酒精灯。
(2)写出装置①中发生反应的化学方程式:_________________________________________________。
(3)装置④中冷凝管的进水口应接在__________(填“a”或“b”)处。冷凝管主要用于冷凝回流的物质是__________(填化学式)。
(4)装置⑤中的球形干燥管除干燥气体便于后续点燃外,还起到______________________________________________________的作用。
(5)上述方法制得的氨基钠中往往混有杂质钠。称取0.150 0 g实验制得的样品溶于足量去离子水中,加热,使NH3完全蒸出,并用50.00 mL 0.300 0 mol·L-1 H3BO3溶液充分吸收NH3。再向吸收液中逐滴加入0.250 0 mol·L-1硫酸,恰好反应时,消耗硫酸的体积为4.70 mL。
已知:2NH3+4H3BO3===(NH4)2B4O7+5H2O、(NH4)2B4O7+H2SO4+5H2O===(NH4)2SO4+4H3BO3。
计算该样品中氨基钠的质量分数(写出计算过程)。
9. (2024·南通高三下模拟预测)氨的制备是当前研究的重要课题。
(1)CH4、N2偶联活化制NH3。研究发现,[TiAlO4]+(M=139 g·mol-1)可以活化CH4,为合成氨提供活性氢原子。
①将[TiAlO4]+暴露在CH4中,反应产生微粒有·CH3、[TiAlO3H2]+、[TiAlO4H]+、[TiAlO4H2]+、HCHO。实验过程中的质谱图如图1所示。图中质荷比为125对应的微粒为____________,生成该微粒的同时,还生成____________。
②为探究[TiAlO4]+活化CH4的反应过程,研究人员从反应体系中不断去除[TiAlO4H]+,得到的质谱图如图2所示。[TiAlO4]+与CH4反应生成[TiAlO4H2]+的过程可描述为____________________________________________。
③[TiAlO4]+活化CH4后,产生活性H原子与N2反应生成NH3。活化过程中生成多种副产物导致NH3的选择性较低,其中不含非极性键的含氮副产物分子可能有__________________(写两种)。
(2)电催化还原N2制NH3。在碱性水溶液中,通过电催化使N2还原为NH3的电极反应式为________________________________________。该制氨方法尚未能应用于工业生产,除因为N2的溶解度低、难吸附在电极和催化剂表面外,还有____________________________________________。
(3)电催化还原NO制NH3。NF是一种电极载体,分别以Ni2P/NF、Fe/NF、NF为阴极材料,电解含NO的中性溶液(电极材料与溶液不发生反应)。控制电压恒定、催化剂的面积为0.25 cm2,电解2小时后,不同电极上NH3的产率及NH3的选择性如图3所示。
①分别以Ni2P/NF、Fe/NF电极电解NaNO2溶液相同时间:c(NO)Ni2/NF>c(NO)Fe/NF,原因是____________________________________________________。
②已知:NH3的产率=;NH3的选择性=eq \f(n(NH3)生成,n(NO)消耗)×100%。以Ni2P/NF为电极电解NaNO2溶液2小时,消耗n(NO)总=__________ mol。
第33练 氨和铵盐
1. C 解析:NH3易液化,液氨气化吸收大量的热,使周围环境温度降低,因此可用作制冷剂,与其具有还原性无关,A不符合题意;N2不能帮助呼吸,能够使害虫窒息而死,因此可用作瓜果保护气,与其是否难溶于水的性质无关,B不符合题意;NO2具有强氧化性,可在火箭燃料中作氧化剂,与N2H4反应生成N2、H2O,因此可作火箭燃料推进剂,C符合题意;NH4HCO3含有农作物生长需要的氮元素,因此可用作氮肥,与其不稳定,受热易分解的性质无关,D不符合题意。故选C。
2. C 解析:NH4Cl在试管底加热时发生分解,生成NH3和HCl,在试管口遇冷又化合为NH4Cl固体,附着在试管内壁或导管内,不能制取NH3,A不符合题意;氯化钙通常可作中性气体或酸性气体的干燥剂,但能与NH3反应生成CaCl2·8NH3而不能用于干燥NH3,B不符合题意;NH3的密度比空气小,可用向下排空气法收集,为防止氨气与空气发生对流,在集气试管口通常放一团疏松的棉花,C符合题意;将NH3通入稀H2SO4溶液中,会发生倒吸,煤油起不到防止倒吸的作用,D不符合题意。故选C。
3. C 解析:CaO与浓氨水混合后与水反应并放出大量的热,促使NH3挥发,可用此装置制备NH3,故不选A;NH3为碱性气体,可用碱石灰干燥NH3,故不选B;NH3的密度比空气小,可采用向下排空气法收集,装置丙中导气管“长进短出”,为向上排空气法。故选C;NH3极易溶于水,溶于水后圆底烧瓶内压强减小,从而产生喷泉,故不选D。故选C。
4. C 解析:由“NH3→N2、Cl-→Cl2”可知,DSA电极上发生的是失电子的氧化反应,故DSA为阳极,与外接电源的正极连接,A错误;Cl-发生的电极反应式为2Cl--2e-===Cl2↑,B错误;N2对环境无污染,反应②生成NO,降解过程中应该控制条件避免发生反应②,C正确;反应过程中,1 mol HO·可得到1 mol电子,故转移电子数约为6.02×1023,D错误。
5. D 解析:步骤Ⅱ中,N2转化为Li3N,属于氮的固定,A正确;X为Li3N,Li3N是由N3-和Li+构成的离子化合物,B正确;LiOH先消耗后生成,可视为该历程中的催化剂,C正确;该反应历程中,步骤Ⅰ通过电解发生,不能说明N2的氧化性强于O2,D错误。
6. D 解析:甲装置中实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气,乙装置中NH3通入CuSO4溶液,生成的蓝色沉淀为Cu(OH)2,后溶解为[Cu(NH3)4]2+,丙装置进行尾气处理并防倒吸,据此作答。实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取少量氨气,制取装置中试管口略向下倾斜,防止水倒流引起试管炸裂,A正确;氨气极易溶于水,易发生倒吸,装置乙中a的容积较大,可防止制备过程中发生倒吸现象,倒扣的漏斗与液面相切,液体很难倒吸,因此倒扣的漏斗可防止液体倒吸,B正确;由向深蓝色溶液中加入乙醇,深蓝色溶液变浑浊,静置后有深蓝色[Cu(NH3)4]SO4·H2O晶体析出,因此[Cu(NH3)4]SO4·H2O在乙醇中的溶解度小于在水中的溶解度,故C正确;由向硫酸铜溶液中逐滴滴加浓氨水,先生成蓝色沉淀,蓝色沉淀逐渐溶解为深蓝色溶液可知,氨分子比水分子更容易与铜离子反应形成配合物,故D错误。故选D。
7. (1)随着pH升高,氨氮废水中NH3含量增大,氨氮更易被氧化
(2)3ClO-+2NH===N2↑+3Cl-+3H2O+2H+(或写为3HClO+2NH===N2↑+3Cl-+3H2O+5H+)
(3)几乎不变
解析:(1)废水中溶液pH越大,其中含有的NH3含量就越高,由于NH3比NH更易被氧化,因此氨氮更易被氧化;
(2)在酸性条件下ClO-、NH发生氧化还原反应产生N2、Cl-,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为:3ClO-+2NH===N2↑+3Cl-+3H2O+2H+(或写为3HClO+2NH===N2↑+3Cl-+3H2O+5H+);
(3)由于a. O2的氧化性比NaClO弱;b. O2氧化氨氮速率比NaClO慢,因此在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率几乎不变。
8. (1)①
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)a NaNH2
(4)吸收NH3,且防止空气中的水蒸气进入三颈烧瓶中与氨基钠反应
(5)61.10%(计算过程见解析)
解析:(1)Na能与空气中的O2反应,实验时,应先点燃①处酒精灯排尽装置内的空气。
(3)为了达到较好的冷凝效果,装置④中冷凝管的进水口应接在a处。根据题给信息可知,NaNH2的沸点比金属钠低,故冷凝管主要冷凝回流的物质是NaNH2。
(4)未反应完的NH3会污染空气,NaNH2遇水蒸气剧烈反应,故装置⑤中的球形干燥管除干燥气体便于后续点燃外,还能吸收多余的NH3,同时防止空气中的水蒸气进入三颈烧瓶中与氨基钠反应。
(5)根据题给信息可得关系式:2NaNH2~2NH3~(NH4)2B4O7~H2SO4,n(NaNH2)=2n(H2SO4)=2×0.25 mol·L-1×4.7×10-3 L=2.35×10-3 mol;m(NaNH2)=39 g·mol-1×2.35×10-3 mol=0.091 65 g,样品中氨基钠的质量分数=×100%=61.10%。
9. (1)①[TiAlO3H2]+ HCHO ②[TiAlO4]+和CH4反应生成[TiAlO4H]+和·CH3,[TiAlO4H]+再与CH4反应生成[TiAlO4H2]+和·CH3 ③CH3NH2、(CH3)2NH、(CH3)3N
(2)N2+6e-+6H2O===2NH3+6OH- N2和H2O(H+)在阴极表面同时发生得电子的竞争反应
(3)①NO在Fe/NF电极放电过程中转化为其他含氮物质,且转化速率大 ②
解析:(1)①质谱图中质荷比为125对应的微粒相对分子质量为125,对应的是[TiAlO3H2]+,生成[TiAlO3H2]+时,发生反应:[TiAlO4]++CH4―→[TiAlO3H2]++HCHO,还生成了HCHO;②[TiAlO4]+活化CH4的过程中将CH4转化为·CH3,质荷比为141对应的微粒为[TiAlO4H2]+,[TiAlO4]+与CH4反应生成[TiAlO4H2]+的过程可描述为:[TiAlO4]+和CH4反应生成[TiAlO4H]+和·CH3,[TiAlO4H]+再与CH4反应生成[TiAlO4H2]+和·CH3;③[TiAlO4]+活化CH4得到·CH3,产生活性H原子与N2反应生成NH3活化过程中·CH3会代替NH3中的H原子生成多种副产物:CH3NH2、(CH3)2NH、(CH3)3N。
(2)N2得到电子生成NH3,根据得失电子守恒和电荷守恒配平电极方程式为:N2+6e-+6H2O===2NH3+6OH-。该制氨方法尚未能应用于工业生产,除因为N2的溶解度低、难吸附在电极和催化剂表面外,还有N2和H2O(H+)在阴极表面同时发生得电子的竞争反应。
(3)①分别以Ni2P/NF、Fe/NF电极电解NaNO2溶液相同时间:c(NO)Ni2/NF>c(NO)Fe/NF,原因是NO在Fe/NF电极放电过程中转化为其他含氮物质,且转化速率大;②由图可知,以Ni2P/NF为电极电解NaNO2溶液2小时,NH3的产率=3 400 mg·h-1·cm-2,NH3的选择性为70%,则消耗n(NH3)生成==0.1 mol,消耗n(NO)总=== mol。
同课章节目录
