【任务驱动式】1.2《离子反应》教学设计 高中化学 人教版(2019) 必修 第一册
文档属性
| 名称 | 【任务驱动式】1.2《离子反应》教学设计 高中化学 人教版(2019) 必修 第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 367.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-01 11:43:58 | ||
图片预览

文档简介
离子反应
教学目标:
1.通过实验、假设、推理等过程,以探究的方式建构电离模型,并以此认识电解质;能用电离的方程式表示某些酸、碱、盐的电离过程。
2.通过分析酸、碱、盐之间的反应事实,认识离子反应,归纳离子反应发生的条件,正确书写这些反应的离子方程式。
3.通过实验了解常见离子的检验方法,进一步理解离子反应。
内容分析:
本节内容分为两部分,电解质的电离离子反应。
首先,教材结合生活常识创设情境,以真实、有意义的问题来激发学生的学习兴趣,引发学生思考。然后以实验1-2为基础介绍电解质和电离的概念。
教材基于实验证据提出问题:为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电呢?随后,教材结合构成NaCl固体的粒子、NaCl固体在水溶液中溶解和形成水合离子的过程,以及NaCl固体受热熔化时粒子运动的变化等,从微观角度对上述问题作出解释。为了帮助学生深入理解,教材辅以相应的微观过程示意图。在此基础上,介绍电离的概念和电离方程式,并结合电力离方程式,引导学生从电离的角度认识酸、碱的本质。
在学习电离和电离方程式的基础上,教材通过实验1-3的现象和分析,得出Na2SO4稀溶液与BaCl2稀溶液反应的微观实质,从而引出离子反应和离子方程式,并介绍离子方程式的书写步骤。然后,教材以“思考与讨论”的形式得出中和反应的实质,引导学生深入认识离子反应。最后,教材说明,酸、碱、盐在水溶液中发生复分解反应的微观实质,并总结这类离子反应发生的条件等。
本节内容的特点是概念多、抽象、理论性强。在呈现方式上,教材一方面紧密结合实验引入概念,充分发挥实验在化学概念形成中的重要功能,如现象直观、易懂、有利于激发学习兴趣等;另一方面注重基于实验证据进行分析和推理,逐步引导学生认识物质导电性及电解质在溶液中反应的本质特征,建立电离与离子反应的概念模型,体会模型在解释化学现象、揭示现象的本质中所发挥的重要作用,发展化学学科核心素养。
教学重点和难点:
重点:离子方程式的书写
难点:电解质概念,离子反应发生的条件
教学过程:
学习任务一:电离、电解质、非电解质。
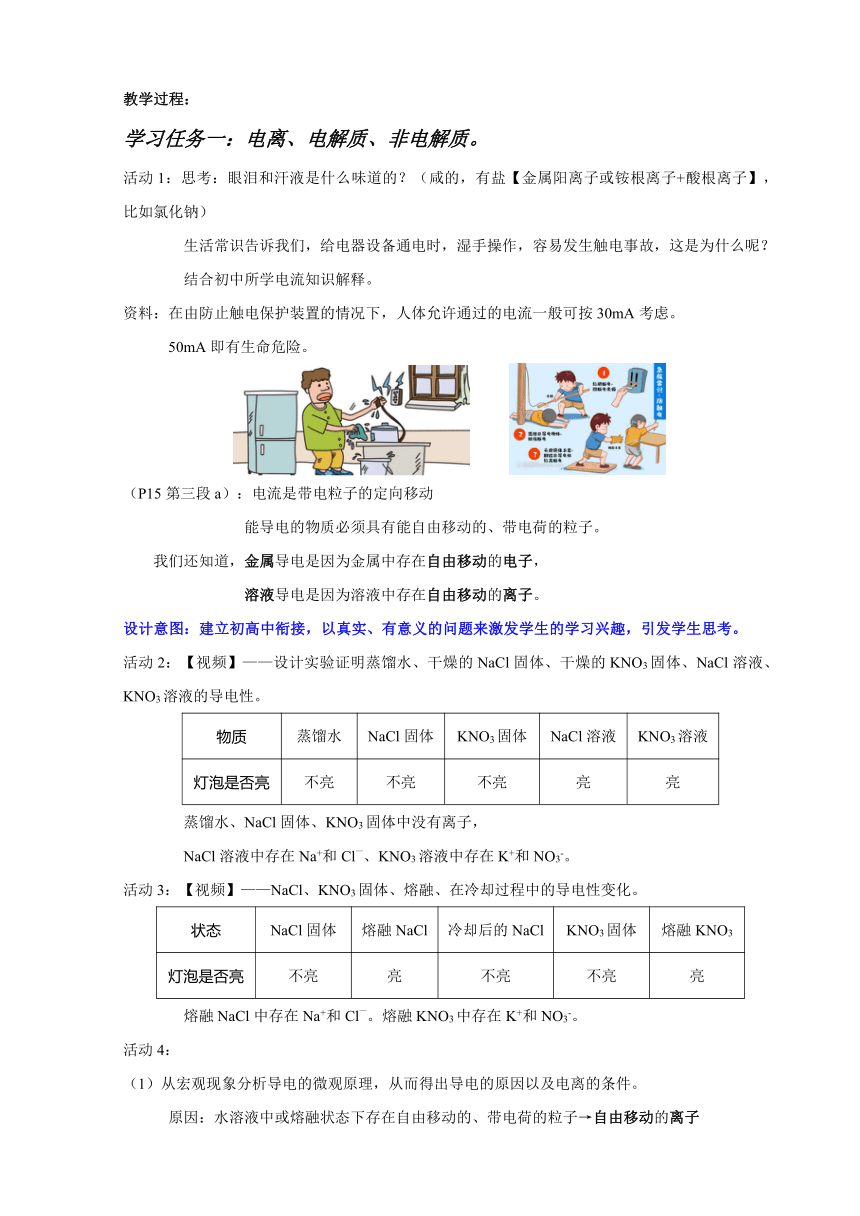
活动1:思考:眼泪和汗液是什么味道的?(咸的,有盐【金属阳离子或铵根离子+酸根离子】,比如氯化钠)
生活常识告诉我们,给电器设备通电时,湿手操作,容易发生触电事故,这是为什么呢?
结合初中所学电流知识解释。
资料:在由防止触电保护装置的情况下,人体允许通过的电流一般可按30mA考虑。
50mA即有生命危险。
(P15第三段a):电流是带电粒子的定向移动
能导电的物质必须具有能自由移动的、带电荷的粒子。
我们还知道,金属导电是因为金属中存在自由移动的电子,
溶液导电是因为溶液中存在自由移动的离子。
设计意图:建立初高中衔接,以真实、有意义的问题来激发学生的学习兴趣,引发学生思考。
活动2:【视频】——设计实验证明蒸馏水、干燥的NaCl固体、干燥的KNO3固体、NaCl溶液、KNO3溶液的导电性。
物质 蒸馏水 NaCl固体 KNO3固体 NaCl溶液 KNO3溶液
灯泡是否亮 不亮 不亮 不亮 亮 亮
蒸馏水、NaCl固体、KNO3固体中没有离子,
NaCl溶液中存在Na+和Cl—、KNO3溶液中存在K+和NO3-。
活动3:【视频】——NaCl、KNO3固体、熔融、在冷却过程中的导电性变化。
状态 NaCl固体 熔融NaCl 冷却后的NaCl KNO3固体 熔融KNO3
灯泡是否亮 不亮 亮 不亮 不亮 亮
熔融NaCl中存在Na+和Cl—。熔融KNO3中存在K+和NO3-。
活动4:
(1)从宏观现象分析导电的微观原理,从而得出导电的原因以及电离的条件。
原因:水溶液中或熔融状态下存在自由移动的、带电荷的粒子→自由移动的离子
条件:水溶液中或熔融状态下可以电离
(2)得出电解质、电离的概念。
电解质:在水溶液或熔融状态下能够导电的化合物叫电解质
酸、碱、盐都是电解质。P15第一段
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程叫电离
活动5:解决活动1中的触电原因的解释。
解释湿手直接接触电源时容易发生触电事故的原因。P15第二段
电解质溶液能够导电。
设计意图:设计意图,通过分析实验现象,培养学生证据推理的学科素养。
活动6:写出下列物质的电离方程式
HCl、H2SO4、HNO3
NaOH、KOH、Ca(OH)2、Ba(OH)2
NaCl、Na2CO3
活动7:基于电离产生的离子种类,从微观本质定义酸、碱、盐。
电离时生成的阳离子全部是H+的化合物叫做酸。
电离时生成的阴离子全部是OH—的化合物叫做碱。
电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物叫盐。
说明:P14①P16①,水也是电解质。
注意:硫酸氢钠(NaHSO4) 碱式碳酸铜(Cu2(OH)2CO3)
活动8:【视频】
分析图例1-10、1-11,阅读课文“方法导引”,分析电离是电解质溶于水自动解离的过程。
分析图例1-12,P16第一、二自然段。
阅读:P17“方法导引”。
设计意图:拓展学生“物质分类”的微观角度,使学生认识到从微观角度认识物质更加深入、更接近本质。
学习任务二:离子反应。
活动1:演示实验1-3
学生活动:在烧杯中画出下列溶液中物质的存在形式,描述反应现象。
混合前溶液中的离子(或粒子) 混合后溶液中的离子(或粒子) 反应现象 离子方程式
Na2SO4溶液 BaCl2溶液 有白色沉淀产生 SO42-+Ba2+ →BaSO4↓
盐+盐→两种新盐
活动2:视频——向氢氧化钡溶液中滴加稀硫酸(数字化实验【电导率】)
通过向氢氧化钡溶液中滴加稀硫酸过程中灯泡的明亮程度分析水溶液中电解质的行为,建立离子反应的核心概念。
混合前溶液中的离子(或粒子) 混合后溶液中的离子(或粒子) 反应现象 离子方程式
H2SO4溶液 Ba(OH)2溶液 有白色沉淀产生 2H++SO42-+Ba2+ +2OH—→ BaSO4↓+2H2O
酸+碱→盐+水
说明:水也是电解质,也能微弱的电离,但是,离子浓度很小,我们的设备测不出导电性而已。
活动3:学生活动:按照上述方法分析下列反应。
Na2CO3溶液和稀硫酸反应:___________________________________________
CaCO3和稀盐酸反应:___________________________________________
MgCl2溶液和NaOH溶液反应:___________________________________________
稀盐酸与NaOH溶液反应:___________________________________________
CO2和NaOH溶液反应:___________________________________________
CaO和稀盐酸反应:___________________________________________
新概念:离子反应、离子方程式
离子反应:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
反之,为非离子反应。
离子方程式(离子反应的实质):用实际参加反应的离子符号来表示反应的式子叫离子方程式。
延伸:能发生反应的两种离子不能同时存在于同一个溶液中【离子共存问题】
即,离子之间反应叫离子不共存,离子之间不反应叫离子共存。
练习:课本P20 4
设计意图:通过活动1、2、3,建立离子反应的思维模型,从宏观现象到微观解析离子反应的实质。
活动4:讨论完成“思考与讨论”,总结出离子反应的意义。
先写化学方程式,再按照活动1、2的方法分析“P19 思考与讨论”,【酸+碱→盐+水】
稀盐酸与NaOH溶液反应:_______________________ ____________________
稀盐酸与KOH溶液反应:________________________ ___________________
稀硫酸与NaOH溶液反应:_______________________ ___________________
稀硫酸与KOH溶液反应:________________________ ____________________
离子方程式的意义:不仅可以表示某个具体的化学反应,还表示同一类型的离子反应。
活动5:分析上述反应的反应类型,总结出复分解型离子反应发生的条件
条件:生成沉淀、放出气体或生成水。
活动6:用上述方法分析下列反应。
反应前溶液中的离子(或粒子) 反应后溶液中的离子(或粒子) 反应现象 离子方程式 反应类型
Zn+H2SO4溶液 有气泡产生 Zn+2H+→Zn2++H2 ↑ 置换反应
金属单质+酸→盐+氢气 【非复分解型的离子反应】
活动7:通过以上离子反应的讨论,总结出,离子方程式书写过程中的注意事项。
单质、沉淀、气体、氧化物、弱电解质写化学式,其余要拆开。
学习评价:利用离子反应的概念解决粗盐提纯的实际问题。
(1)从离子角度认识粗盐的成分(氯化钠 氯化钙 氯化镁 硫酸钠)
(2)依据微粒间相互作用及离子反应发生的条件选择合适的试剂完成实验设计
(3)从定量层面分析试剂的用量,并调整试剂的添加顺序完成实验设计。
(4)书写实验设计中的离子方程式。
教学目标:
1.通过实验、假设、推理等过程,以探究的方式建构电离模型,并以此认识电解质;能用电离的方程式表示某些酸、碱、盐的电离过程。
2.通过分析酸、碱、盐之间的反应事实,认识离子反应,归纳离子反应发生的条件,正确书写这些反应的离子方程式。
3.通过实验了解常见离子的检验方法,进一步理解离子反应。
内容分析:
本节内容分为两部分,电解质的电离离子反应。
首先,教材结合生活常识创设情境,以真实、有意义的问题来激发学生的学习兴趣,引发学生思考。然后以实验1-2为基础介绍电解质和电离的概念。
教材基于实验证据提出问题:为什么NaCl、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电呢?随后,教材结合构成NaCl固体的粒子、NaCl固体在水溶液中溶解和形成水合离子的过程,以及NaCl固体受热熔化时粒子运动的变化等,从微观角度对上述问题作出解释。为了帮助学生深入理解,教材辅以相应的微观过程示意图。在此基础上,介绍电离的概念和电离方程式,并结合电力离方程式,引导学生从电离的角度认识酸、碱的本质。
在学习电离和电离方程式的基础上,教材通过实验1-3的现象和分析,得出Na2SO4稀溶液与BaCl2稀溶液反应的微观实质,从而引出离子反应和离子方程式,并介绍离子方程式的书写步骤。然后,教材以“思考与讨论”的形式得出中和反应的实质,引导学生深入认识离子反应。最后,教材说明,酸、碱、盐在水溶液中发生复分解反应的微观实质,并总结这类离子反应发生的条件等。
本节内容的特点是概念多、抽象、理论性强。在呈现方式上,教材一方面紧密结合实验引入概念,充分发挥实验在化学概念形成中的重要功能,如现象直观、易懂、有利于激发学习兴趣等;另一方面注重基于实验证据进行分析和推理,逐步引导学生认识物质导电性及电解质在溶液中反应的本质特征,建立电离与离子反应的概念模型,体会模型在解释化学现象、揭示现象的本质中所发挥的重要作用,发展化学学科核心素养。
教学重点和难点:
重点:离子方程式的书写
难点:电解质概念,离子反应发生的条件
教学过程:
学习任务一:电离、电解质、非电解质。
活动1:思考:眼泪和汗液是什么味道的?(咸的,有盐【金属阳离子或铵根离子+酸根离子】,比如氯化钠)
生活常识告诉我们,给电器设备通电时,湿手操作,容易发生触电事故,这是为什么呢?
结合初中所学电流知识解释。
资料:在由防止触电保护装置的情况下,人体允许通过的电流一般可按30mA考虑。
50mA即有生命危险。
(P15第三段a):电流是带电粒子的定向移动
能导电的物质必须具有能自由移动的、带电荷的粒子。
我们还知道,金属导电是因为金属中存在自由移动的电子,
溶液导电是因为溶液中存在自由移动的离子。
设计意图:建立初高中衔接,以真实、有意义的问题来激发学生的学习兴趣,引发学生思考。
活动2:【视频】——设计实验证明蒸馏水、干燥的NaCl固体、干燥的KNO3固体、NaCl溶液、KNO3溶液的导电性。
物质 蒸馏水 NaCl固体 KNO3固体 NaCl溶液 KNO3溶液
灯泡是否亮 不亮 不亮 不亮 亮 亮
蒸馏水、NaCl固体、KNO3固体中没有离子,
NaCl溶液中存在Na+和Cl—、KNO3溶液中存在K+和NO3-。
活动3:【视频】——NaCl、KNO3固体、熔融、在冷却过程中的导电性变化。
状态 NaCl固体 熔融NaCl 冷却后的NaCl KNO3固体 熔融KNO3
灯泡是否亮 不亮 亮 不亮 不亮 亮
熔融NaCl中存在Na+和Cl—。熔融KNO3中存在K+和NO3-。
活动4:
(1)从宏观现象分析导电的微观原理,从而得出导电的原因以及电离的条件。
原因:水溶液中或熔融状态下存在自由移动的、带电荷的粒子→自由移动的离子
条件:水溶液中或熔融状态下可以电离
(2)得出电解质、电离的概念。
电解质:在水溶液或熔融状态下能够导电的化合物叫电解质
酸、碱、盐都是电解质。P15第一段
电离:电解质溶于水或受热熔化时,形成自由移动的离子的过程叫电离
活动5:解决活动1中的触电原因的解释。
解释湿手直接接触电源时容易发生触电事故的原因。P15第二段
电解质溶液能够导电。
设计意图:设计意图,通过分析实验现象,培养学生证据推理的学科素养。
活动6:写出下列物质的电离方程式
HCl、H2SO4、HNO3
NaOH、KOH、Ca(OH)2、Ba(OH)2
NaCl、Na2CO3
活动7:基于电离产生的离子种类,从微观本质定义酸、碱、盐。
电离时生成的阳离子全部是H+的化合物叫做酸。
电离时生成的阴离子全部是OH—的化合物叫做碱。
电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物叫盐。
说明:P14①P16①,水也是电解质。
注意:硫酸氢钠(NaHSO4) 碱式碳酸铜(Cu2(OH)2CO3)
活动8:【视频】
分析图例1-10、1-11,阅读课文“方法导引”,分析电离是电解质溶于水自动解离的过程。
分析图例1-12,P16第一、二自然段。
阅读:P17“方法导引”。
设计意图:拓展学生“物质分类”的微观角度,使学生认识到从微观角度认识物质更加深入、更接近本质。
学习任务二:离子反应。
活动1:演示实验1-3
学生活动:在烧杯中画出下列溶液中物质的存在形式,描述反应现象。
混合前溶液中的离子(或粒子) 混合后溶液中的离子(或粒子) 反应现象 离子方程式
Na2SO4溶液 BaCl2溶液 有白色沉淀产生 SO42-+Ba2+ →BaSO4↓
盐+盐→两种新盐
活动2:视频——向氢氧化钡溶液中滴加稀硫酸(数字化实验【电导率】)
通过向氢氧化钡溶液中滴加稀硫酸过程中灯泡的明亮程度分析水溶液中电解质的行为,建立离子反应的核心概念。
混合前溶液中的离子(或粒子) 混合后溶液中的离子(或粒子) 反应现象 离子方程式
H2SO4溶液 Ba(OH)2溶液 有白色沉淀产生 2H++SO42-+Ba2+ +2OH—→ BaSO4↓+2H2O
酸+碱→盐+水
说明:水也是电解质,也能微弱的电离,但是,离子浓度很小,我们的设备测不出导电性而已。
活动3:学生活动:按照上述方法分析下列反应。
Na2CO3溶液和稀硫酸反应:___________________________________________
CaCO3和稀盐酸反应:___________________________________________
MgCl2溶液和NaOH溶液反应:___________________________________________
稀盐酸与NaOH溶液反应:___________________________________________
CO2和NaOH溶液反应:___________________________________________
CaO和稀盐酸反应:___________________________________________
新概念:离子反应、离子方程式
离子反应:电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
反之,为非离子反应。
离子方程式(离子反应的实质):用实际参加反应的离子符号来表示反应的式子叫离子方程式。
延伸:能发生反应的两种离子不能同时存在于同一个溶液中【离子共存问题】
即,离子之间反应叫离子不共存,离子之间不反应叫离子共存。
练习:课本P20 4
设计意图:通过活动1、2、3,建立离子反应的思维模型,从宏观现象到微观解析离子反应的实质。
活动4:讨论完成“思考与讨论”,总结出离子反应的意义。
先写化学方程式,再按照活动1、2的方法分析“P19 思考与讨论”,【酸+碱→盐+水】
稀盐酸与NaOH溶液反应:_______________________ ____________________
稀盐酸与KOH溶液反应:________________________ ___________________
稀硫酸与NaOH溶液反应:_______________________ ___________________
稀硫酸与KOH溶液反应:________________________ ____________________
离子方程式的意义:不仅可以表示某个具体的化学反应,还表示同一类型的离子反应。
活动5:分析上述反应的反应类型,总结出复分解型离子反应发生的条件
条件:生成沉淀、放出气体或生成水。
活动6:用上述方法分析下列反应。
反应前溶液中的离子(或粒子) 反应后溶液中的离子(或粒子) 反应现象 离子方程式 反应类型
Zn+H2SO4溶液 有气泡产生 Zn+2H+→Zn2++H2 ↑ 置换反应
金属单质+酸→盐+氢气 【非复分解型的离子反应】
活动7:通过以上离子反应的讨论,总结出,离子方程式书写过程中的注意事项。
单质、沉淀、气体、氧化物、弱电解质写化学式,其余要拆开。
学习评价:利用离子反应的概念解决粗盐提纯的实际问题。
(1)从离子角度认识粗盐的成分(氯化钠 氯化钙 氯化镁 硫酸钠)
(2)依据微粒间相互作用及离子反应发生的条件选择合适的试剂完成实验设计
(3)从定量层面分析试剂的用量,并调整试剂的添加顺序完成实验设计。
(4)书写实验设计中的离子方程式。
