氧化还原反应(共22张PPT)
文档属性
| 名称 | 氧化还原反应(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 19:27:00 | ||
图片预览





文档简介
(共22张PPT)
想一想:图中展示的现象,涉及到的物质发生了什么化学变化?
钢铁生锈
食物腐败
苹果变色
人教版2019
高中化学必修第一册
第一章 物质及其变化
氧化还原反应
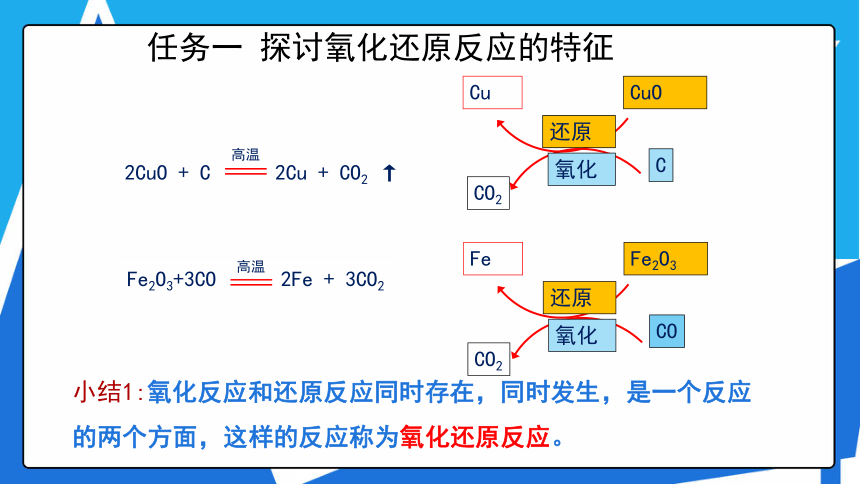
任务一 探讨氧化还原反应的特征
活动1 请根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
CuO Fe2O3
Cu Fe
还原反应
氧化反应
Fe2O3+3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
Cu
CuO
C
CO2
氧化
还原
Fe
Fe2O3
CO
CO2
氧化
还原
小结1:氧化反应和还原反应同时存在,同时发生,是一个反应的两个方面,这样的反应称为氧化还原反应。
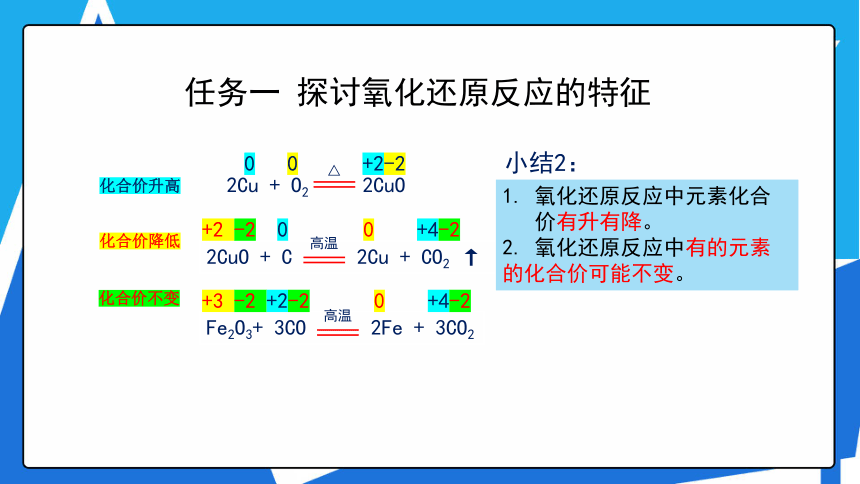
任务一 探讨氧化还原反应的特征
活动2 请你标出下列反应中各物质所含元素化合价素,比较氧化还原反应前后同种元素价态有无变化?
任务一 探讨氧化还原反应的特征
Fe2O3+ 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
2Cu + O2 2CuO
△
Fe2O3+ 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
+2 -2 0 0 +4-2
+3 -2 +2-2 0 +4-2
任务一 探讨氧化还原反应的特征
0 0 +2-2
2Cu + O2 2CuO
△
氧化还原反应中元素化合价有升有降。
2. 氧化还原反应中有的元素的化合价可能不变。
小结2:
化合价升高
化合价降低
化合价不变
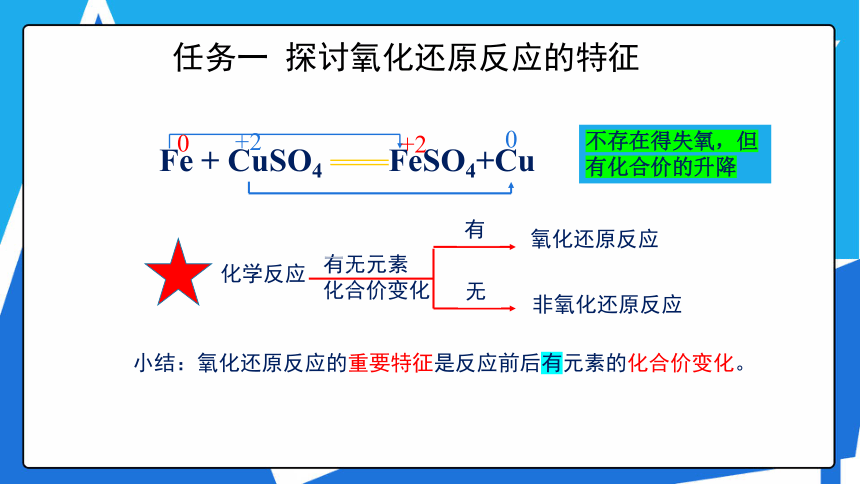
Fe + CuSO4 FeSO4+Cu
+2
0
0
+2
小结:氧化还原反应的重要特征是反应前后有元素的化合价变化。
有无元素
化合价变化
化学反应
氧化还原反应
非氧化还原反应
有
无
任务一 探讨氧化还原反应的特征
不存在得失氧,但有化合价的升降
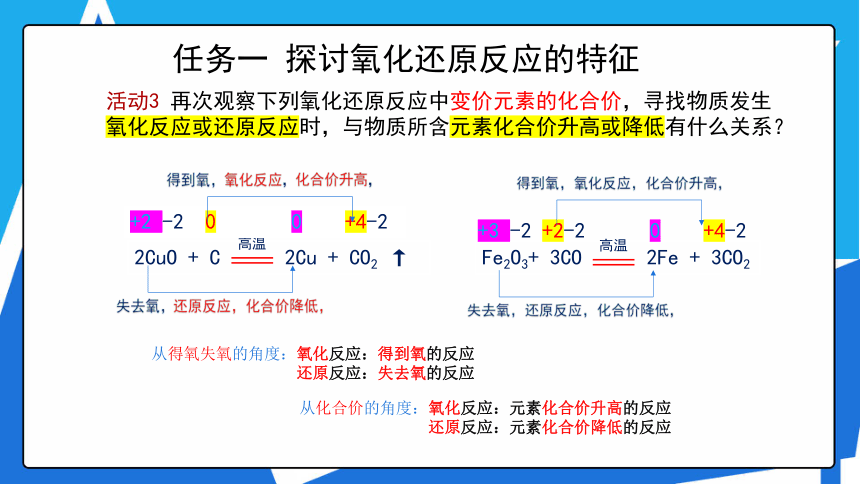
活动3 再次观察下列氧化还原反应中变价元素的化合价,寻找物质发生氧化反应或还原反应时,与物质所含元素化合价升高或降低有什么关系?
任务一 探讨氧化还原反应的特征
Fe2O3+ 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
+2 -2 0 0 +4-2
+3 -2 +2-2 0 +4-2
得到氧,氧化反应,化合价升高,
得到氧,氧化反应,化合价升高,
失去氧,还原反应,化合价降低,
失去氧,还原反应,化合价降低,
从化合价的角度:氧化反应:元素化合价升高的反应
还原反应:元素化合价降低的反应
从得氧失氧的角度:氧化反应:得到氧的反应
还原反应:失去氧的反应
2Na + Cl2 = 2NaCl
点燃
H2 +Cl2 = 2HCl
点燃
CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
活动4 请你判断,以下反应属于氧化还原反应吗?为什么?
任务一 探讨氧化还原反应的特征
活动1 根据氯化钠和氯化氢的形成示意图,①从原子结构的角度解释氯化钠和氯化氢的形成过程,②分析是什么原因导致元素的化合价发生变化?
微观分析
2Na + Cl2 = 2NaCl
点燃
符号表征
0 0 +1 -1
任务二 探究氧化还原反应的本质
H2 + Cl2 = 2HCl
点燃
符号表征
微观分析
0 0 +1 -1
①电子的得失
②电子对偏移
化合价的升降的原因:
电子的转移
小结:氧化还原反应的本质是电子的转移
任务二 探究氧化还原反应的本质
活动2:电子得失或者电子对的偏移和化合价升降有何关系?
任务二 探究氧化还原反应的本质
双线桥表示电子转移
反应中得失电子数目电子数等于一个原子转移的电子数目乘以被氧化或被还原的原子数目
2Na + Cl2 = 2NaCl
点燃
H2 + Cl2 = 2HCl
点燃
活动3 利用图中装置进行铁与稀硫酸溶液反应的实验,实验现象之一是电流计的指针发生偏转。请你根据这一实验现象感受氧化还原反应的实质。
任务二 探究氧化还原反应的本质
电流产生
电子定向移动
Fe + H2SO4 = FeSO4+H2 ↑
环节三 寻找基本反应类型与氧化还原反应的关系
活动1 根据不同的分类标准对下列反应进行分类连线,
说出四大基本反应类型与氧化还原反应的关系。
H2O + CaO Ca(OH)2
CaCO3 CaO + CO2 ↑
2H2O2 2H2O + O2 ↑
Fe + H2SO4 FeSO4 + H2 ↑
HCl + NaOH NaCl + H2O
2Na + Cl2 2NaCl
△
高温
MnO2
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
活动2 感受氧化还原反应的应用
黑火药反应——S+2KNO3+3C=K2S+N2↑+3CO2↑
航天领域——我国长征系列火箭发射原理
化工领域——冶炼金属
医疗领域——氢气在医学上的应用
日常生活——葡萄酒中加二氧化硫的原因
氧化还原反应
化学反应
电子转移(本质)
得氧失氧(片面)
化合价升降(特征)
反应类型
微观本质
氧化反应
元素化合价升高
失电子(电子对偏离)
还原反应
元素化合价降低
得电子(电子对偏向)
升失氧
降得还
设计意图:
帮助学生再次梳理知识,把握本节课重点。
环节四 全面认识氧化还原反应
宏观特征
得到氧
失去氧
活动1 课堂总结
1. 下列反应属于氧化还原反应的是( )
A. CuO+2HCl =CuCl2+H2O B. 2Na2O2+2H2O =4NaOH+O2
C. FeO+2HCl =FeCl2+ H2O D. Ca(OH)2+CO2= CaCO3 + H2O
B
活动2 当堂检测
2、下列叙述正确的是( )
A. 在氧化还原反应中,失去电子的物质,所含元素化合价降低。
B. 凡是有元素化合价升降的化学反应都是氧化还原反应。
C. 在氧化还原反应中一定所有的元素化合价都发生变化。
D. 没有单质参加的反应一定不是氧化还原反应。
B
3. 下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
课后作业——预习型、基础型、理解型必做,拓展型选做
基础巩固型(5min):课本课后习题P25 1,4,5,6,
理解分析型(3min):
拓展提升型:利用周末时间网上查阅资料了解课上氧化还原反应在四个领域方面典例的应用
1.下列判断正确的是 ( )
预习型(7min):围绕以下问题预习氧化剂还原剂
①氧化剂和还原剂的定义是什么?
②氧化剂和还原剂各自具有什么性质?
③常见的氧化剂、还原剂有什么?
THANK
YOU
想一想:图中展示的现象,涉及到的物质发生了什么化学变化?
钢铁生锈
食物腐败
苹果变色
人教版2019
高中化学必修第一册
第一章 物质及其变化
氧化还原反应
任务一 探讨氧化还原反应的特征
活动1 请根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
CuO Fe2O3
Cu Fe
还原反应
氧化反应
Fe2O3+3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
Cu
CuO
C
CO2
氧化
还原
Fe
Fe2O3
CO
CO2
氧化
还原
小结1:氧化反应和还原反应同时存在,同时发生,是一个反应的两个方面,这样的反应称为氧化还原反应。
任务一 探讨氧化还原反应的特征
活动2 请你标出下列反应中各物质所含元素化合价素,比较氧化还原反应前后同种元素价态有无变化?
任务一 探讨氧化还原反应的特征
Fe2O3+ 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
2Cu + O2 2CuO
△
Fe2O3+ 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
+2 -2 0 0 +4-2
+3 -2 +2-2 0 +4-2
任务一 探讨氧化还原反应的特征
0 0 +2-2
2Cu + O2 2CuO
△
氧化还原反应中元素化合价有升有降。
2. 氧化还原反应中有的元素的化合价可能不变。
小结2:
化合价升高
化合价降低
化合价不变
Fe + CuSO4 FeSO4+Cu
+2
0
0
+2
小结:氧化还原反应的重要特征是反应前后有元素的化合价变化。
有无元素
化合价变化
化学反应
氧化还原反应
非氧化还原反应
有
无
任务一 探讨氧化还原反应的特征
不存在得失氧,但有化合价的升降
活动3 再次观察下列氧化还原反应中变价元素的化合价,寻找物质发生氧化反应或还原反应时,与物质所含元素化合价升高或降低有什么关系?
任务一 探讨氧化还原反应的特征
Fe2O3+ 3CO 2Fe + 3CO2
2CuO + C 2Cu + CO2 ↑
高温
高温
+2 -2 0 0 +4-2
+3 -2 +2-2 0 +4-2
得到氧,氧化反应,化合价升高,
得到氧,氧化反应,化合价升高,
失去氧,还原反应,化合价降低,
失去氧,还原反应,化合价降低,
从化合价的角度:氧化反应:元素化合价升高的反应
还原反应:元素化合价降低的反应
从得氧失氧的角度:氧化反应:得到氧的反应
还原反应:失去氧的反应
2Na + Cl2 = 2NaCl
点燃
H2 +Cl2 = 2HCl
点燃
CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
活动4 请你判断,以下反应属于氧化还原反应吗?为什么?
任务一 探讨氧化还原反应的特征
活动1 根据氯化钠和氯化氢的形成示意图,①从原子结构的角度解释氯化钠和氯化氢的形成过程,②分析是什么原因导致元素的化合价发生变化?
微观分析
2Na + Cl2 = 2NaCl
点燃
符号表征
0 0 +1 -1
任务二 探究氧化还原反应的本质
H2 + Cl2 = 2HCl
点燃
符号表征
微观分析
0 0 +1 -1
①电子的得失
②电子对偏移
化合价的升降的原因:
电子的转移
小结:氧化还原反应的本质是电子的转移
任务二 探究氧化还原反应的本质
活动2:电子得失或者电子对的偏移和化合价升降有何关系?
任务二 探究氧化还原反应的本质
双线桥表示电子转移
反应中得失电子数目电子数等于一个原子转移的电子数目乘以被氧化或被还原的原子数目
2Na + Cl2 = 2NaCl
点燃
H2 + Cl2 = 2HCl
点燃
活动3 利用图中装置进行铁与稀硫酸溶液反应的实验,实验现象之一是电流计的指针发生偏转。请你根据这一实验现象感受氧化还原反应的实质。
任务二 探究氧化还原反应的本质
电流产生
电子定向移动
Fe + H2SO4 = FeSO4+H2 ↑
环节三 寻找基本反应类型与氧化还原反应的关系
活动1 根据不同的分类标准对下列反应进行分类连线,
说出四大基本反应类型与氧化还原反应的关系。
H2O + CaO Ca(OH)2
CaCO3 CaO + CO2 ↑
2H2O2 2H2O + O2 ↑
Fe + H2SO4 FeSO4 + H2 ↑
HCl + NaOH NaCl + H2O
2Na + Cl2 2NaCl
△
高温
MnO2
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
活动2 感受氧化还原反应的应用
黑火药反应——S+2KNO3+3C=K2S+N2↑+3CO2↑
航天领域——我国长征系列火箭发射原理
化工领域——冶炼金属
医疗领域——氢气在医学上的应用
日常生活——葡萄酒中加二氧化硫的原因
氧化还原反应
化学反应
电子转移(本质)
得氧失氧(片面)
化合价升降(特征)
反应类型
微观本质
氧化反应
元素化合价升高
失电子(电子对偏离)
还原反应
元素化合价降低
得电子(电子对偏向)
升失氧
降得还
设计意图:
帮助学生再次梳理知识,把握本节课重点。
环节四 全面认识氧化还原反应
宏观特征
得到氧
失去氧
活动1 课堂总结
1. 下列反应属于氧化还原反应的是( )
A. CuO+2HCl =CuCl2+H2O B. 2Na2O2+2H2O =4NaOH+O2
C. FeO+2HCl =FeCl2+ H2O D. Ca(OH)2+CO2= CaCO3 + H2O
B
活动2 当堂检测
2、下列叙述正确的是( )
A. 在氧化还原反应中,失去电子的物质,所含元素化合价降低。
B. 凡是有元素化合价升降的化学反应都是氧化还原反应。
C. 在氧化还原反应中一定所有的元素化合价都发生变化。
D. 没有单质参加的反应一定不是氧化还原反应。
B
3. 下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
课后作业——预习型、基础型、理解型必做,拓展型选做
基础巩固型(5min):课本课后习题P25 1,4,5,6,
理解分析型(3min):
拓展提升型:利用周末时间网上查阅资料了解课上氧化还原反应在四个领域方面典例的应用
1.下列判断正确的是 ( )
预习型(7min):围绕以下问题预习氧化剂还原剂
①氧化剂和还原剂的定义是什么?
②氧化剂和还原剂各自具有什么性质?
③常见的氧化剂、还原剂有什么?
THANK
YOU
