2.1 活泼的金属单质—钠(共17张PPT)
文档属性
| 名称 | 2.1 活泼的金属单质—钠(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 46.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 19:28:55 | ||
图片预览





文档简介
(共17张PPT)
活泼的金属单质—钠
人教版高中化学必修第一册 第二章 第一节 第一课时
制备过氧化钠
新型钠电池
钠钾合金做冷却剂
染料
检测氯
标题
其他
高压钠灯
化工产业中做强除水剂
冶炼钛等贵金属
钠
钠的用途
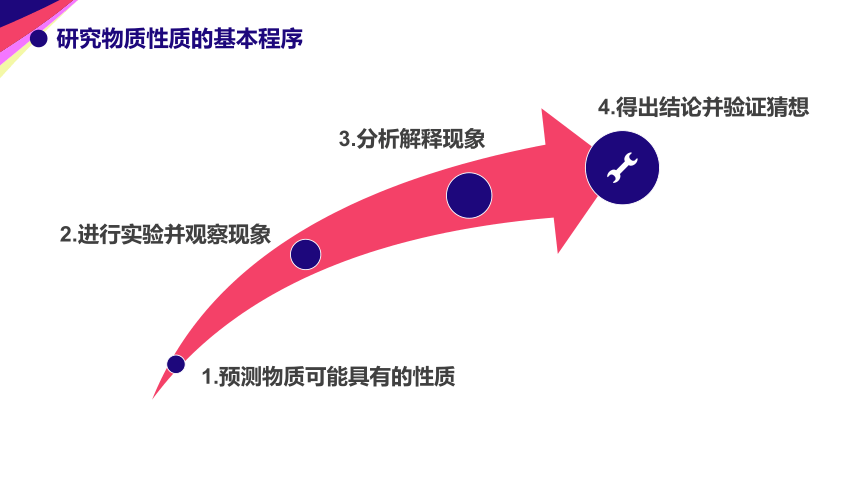
3.分析解释现象
2.进行实验并观察现象
1.预测物质可能具有的性质
4.得出结论并验证猜想
研究物质性质的基本程序
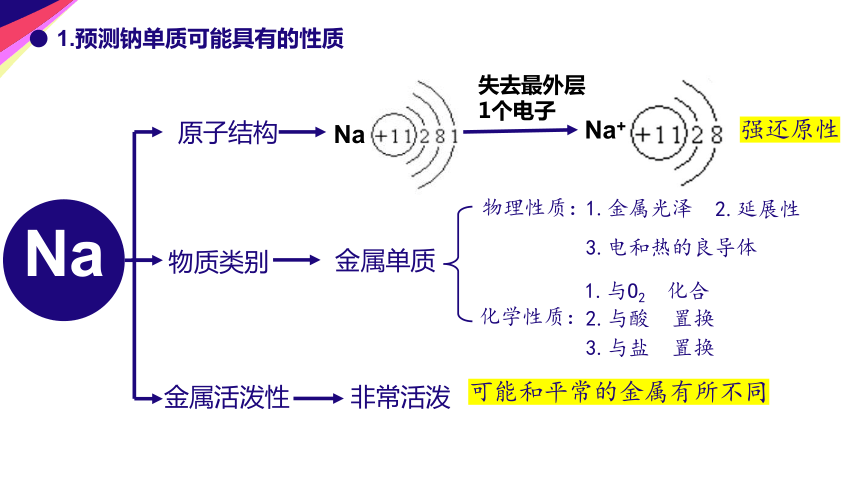
1.预测钠单质可能具有的性质
Na
原子结构
金属活泼性
物质类别
Na
Na+
失去最外层
1个电子
强还原性
非常活泼
可能和平常的金属有所不同
金属单质
物理性质:
化学性质:
1.金属光泽
2.延展性
3.电和热的良导体
2.与酸 置换
1.与O2 化合
3.与盐 置换
2.实验验证
钠单质的切割
注意观察新切开的钠的表面所发生的变化。
3.现象分析与解释
观察现象 解释现象
4.结论
钠在常温下可以与氧气的反应:
4Na + O2 = 2Na2O
可用小刀切割
钠的硬度小
金属光泽
金属通性
光泽迅速变暗
钠与氧气发生了反应
2.实验验证
钠的燃烧
注意观察以下几点:
1.钠加热后,未燃烧前的状态。
2.火焰颜色
3.生成物状态、颜色。
3.现象分析与解释
观察现象 解释现象
4.结论
钠在加热下可以与氧气的反应:
2Na + O2 2Na2O2
钠受热先熔化
钠的熔点低(97.8°C)
火焰呈黄色
生成淡黄色固体
钠与氧气发生了反应
产物不再是Na2O
1.保存钠,用液封法隔绝氧气时,为何不用最常见的水?
疑问
2.我国的制备钠单质的工厂大多在干燥的内陆地区,比如内蒙、宁夏、银川等地,而不在气候湿润且离海近的沿海地区。
1.预测钠单质与水反应的产物
【预测】从氧化还原角度和物质组成(元素守恒)角度,预测Na与H2O发生反应的产物是什么?
Na + H2O =
Na+
+
H2↑
O2-
Na2O
NaOH
NaOH
【设计】我们如何验证产物?
H2↑
指示剂
酚酞变红
收集
验纯
点燃
蓝色火焰
干冷烧杯
2.实验验证
钠与水的反应
注意观察钠在水中的位置、形状变化、运动、反应声音以及溶液颜色。
3.现象分析与解释
实验现象 分析结论
钠在水中的位置
钠的形状变化
钠的运动
反应的声音
溶液的颜色变化
浮于水面上
钠的密度小于水
0.971g·cm-3
熔成一个小球
反应放热,钠的熔点低
四处游动
生成气体
发出嘶嘶的响声
反应放热,热的钠使水蒸发
溶液变为红色
生成碱性物质
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
97.8℃
浮
熔
游
响
红
4.结论
钠与水可以发生剧烈反应:
解答
1.保存钠,选用密度比钠小,且不与钠反应的煤油或者石蜡油进行液封
1.数量较多的钠着火,灭火不能用水,而需要用沙土。
总结
金属
Na
物理性质
化学性质
银白色固体,有金属光泽
熔点低
硬度小
密度比水小
与氧气化合
与水置换出氢气
加热:Na2O2
常温:Na2O
1.内容:钠单质的性质
1.方法:研究物质性质的方法
练习
1.根据钠与氧气的反应,预测钠能否与氯气、硫发生反应。写出反应方程式。
练习
2.根据钠与水的反应,预测钠与CuSO4溶液,钠与FeCl3溶液反应,能否将Cu与铁置换出来。反应可能会有怎样的现象?写出反应方程式。(可分步书写)
THANKS
活泼的金属单质—钠
人教版高中化学必修第一册 第二章 第一节 第一课时
制备过氧化钠
新型钠电池
钠钾合金做冷却剂
染料
检测氯
标题
其他
高压钠灯
化工产业中做强除水剂
冶炼钛等贵金属
钠
钠的用途
3.分析解释现象
2.进行实验并观察现象
1.预测物质可能具有的性质
4.得出结论并验证猜想
研究物质性质的基本程序
1.预测钠单质可能具有的性质
Na
原子结构
金属活泼性
物质类别
Na
Na+
失去最外层
1个电子
强还原性
非常活泼
可能和平常的金属有所不同
金属单质
物理性质:
化学性质:
1.金属光泽
2.延展性
3.电和热的良导体
2.与酸 置换
1.与O2 化合
3.与盐 置换
2.实验验证
钠单质的切割
注意观察新切开的钠的表面所发生的变化。
3.现象分析与解释
观察现象 解释现象
4.结论
钠在常温下可以与氧气的反应:
4Na + O2 = 2Na2O
可用小刀切割
钠的硬度小
金属光泽
金属通性
光泽迅速变暗
钠与氧气发生了反应
2.实验验证
钠的燃烧
注意观察以下几点:
1.钠加热后,未燃烧前的状态。
2.火焰颜色
3.生成物状态、颜色。
3.现象分析与解释
观察现象 解释现象
4.结论
钠在加热下可以与氧气的反应:
2Na + O2 2Na2O2
钠受热先熔化
钠的熔点低(97.8°C)
火焰呈黄色
生成淡黄色固体
钠与氧气发生了反应
产物不再是Na2O
1.保存钠,用液封法隔绝氧气时,为何不用最常见的水?
疑问
2.我国的制备钠单质的工厂大多在干燥的内陆地区,比如内蒙、宁夏、银川等地,而不在气候湿润且离海近的沿海地区。
1.预测钠单质与水反应的产物
【预测】从氧化还原角度和物质组成(元素守恒)角度,预测Na与H2O发生反应的产物是什么?
Na + H2O =
Na+
+
H2↑
O2-
Na2O
NaOH
NaOH
【设计】我们如何验证产物?
H2↑
指示剂
酚酞变红
收集
验纯
点燃
蓝色火焰
干冷烧杯
2.实验验证
钠与水的反应
注意观察钠在水中的位置、形状变化、运动、反应声音以及溶液颜色。
3.现象分析与解释
实验现象 分析结论
钠在水中的位置
钠的形状变化
钠的运动
反应的声音
溶液的颜色变化
浮于水面上
钠的密度小于水
0.971g·cm-3
熔成一个小球
反应放热,钠的熔点低
四处游动
生成气体
发出嘶嘶的响声
反应放热,热的钠使水蒸发
溶液变为红色
生成碱性物质
2Na + 2H2O = 2NaOH + H2↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
97.8℃
浮
熔
游
响
红
4.结论
钠与水可以发生剧烈反应:
解答
1.保存钠,选用密度比钠小,且不与钠反应的煤油或者石蜡油进行液封
1.数量较多的钠着火,灭火不能用水,而需要用沙土。
总结
金属
Na
物理性质
化学性质
银白色固体,有金属光泽
熔点低
硬度小
密度比水小
与氧气化合
与水置换出氢气
加热:Na2O2
常温:Na2O
1.内容:钠单质的性质
1.方法:研究物质性质的方法
练习
1.根据钠与氧气的反应,预测钠能否与氯气、硫发生反应。写出反应方程式。
练习
2.根据钠与水的反应,预测钠与CuSO4溶液,钠与FeCl3溶液反应,能否将Cu与铁置换出来。反应可能会有怎样的现象?写出反应方程式。(可分步书写)
THANKS
