3.1.1铁的单质、氧化物和氢氧化物(共17张PPT)
文档属性
| 名称 | 3.1.1铁的单质、氧化物和氢氧化物(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 19:35:57 | ||
图片预览





文档简介
(共17张PPT)
人教版必修第一册
网
科
学
第三章 铁 金属材料
第1节 铁及其化合物
3.1.1 铁的单质、氧化物和氢氧化物
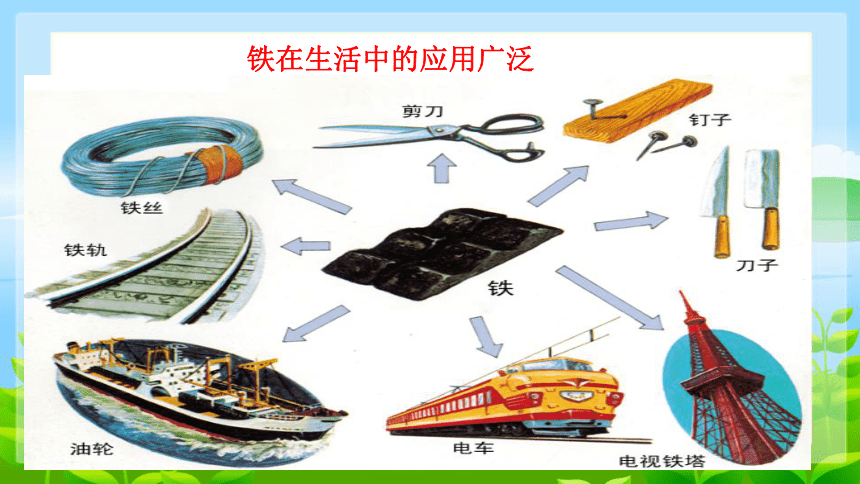
铁在生活中的应用广泛
一、铁元素在自然界中的分布
陨铁
赤铁矿
磁铁矿
陨铁是自然界中铁元素的单质形态,但是铁元素更多地主要以+2价和+3价化合物的形式存在于矿石中。人类最早使用的铁,是来自太空的陨铁。
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
二、单质铁
1、铁的物理性质
方铁
圆铁
化学性质比较活泼,它能与许多物质发生化学反应。
①银白色金属,能被磁体吸引
②导电性(不如铜、铝) 、
导热性、延展性
③熔点:1535℃,沸点:2750℃,
密度7.86 g/cm3
2、铁的化学性质
思考·讨论
1.观察下列化学反应方程式,铁的化合价变化有何异同?
Fe + 2HCl——2FeCl2 + H2
2Fe + 3Cl2——2FeCl3
点燃
Fe + CuSO4——FeSO4 + Cu
Fe
FeCl3
化合价升高
0
+3
Fe
FeCl2
化合价升高
0
+2
Fe
FeSO4
化合价升高
0
+2
2、为什么有的化学方程式中铁的化合价变成+2,有的变成+3?
Fe
Fe2+
Fe3+
弱氧化剂
S、H+、Cu2+等
强氧化剂
Cl2、HNO3等
①与非金属反应
2Fe+3Cl2 2FeCl3
Δ
3Fe+2O2 Fe3O4
点燃
Fe + S FeS
Δ
②与酸反应
Fe+2H+= Fe2++H2↑
③与盐反应
Fe+Cu2+=Cu+Fe2+
3、在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理。这是为什么呢?
钢水注入干燥的模具
提示:铁与水会反应吗?
生活经验告诉我们,常温下,铁与水是不发生反应的。但在高温下,铁能与水发生反应。
思考与交流:
假设铁能与水反应,反应条件能否是常温?为什么?
钠在常温下与冷水剧烈反应;镁在加热条件下与热水剧烈反应;铝在加热条件下与沸水才能反应;根据金属活动性顺序可以推断,铁与水反应的条件应该比铝还高而不是常温。
模拟实验方案:
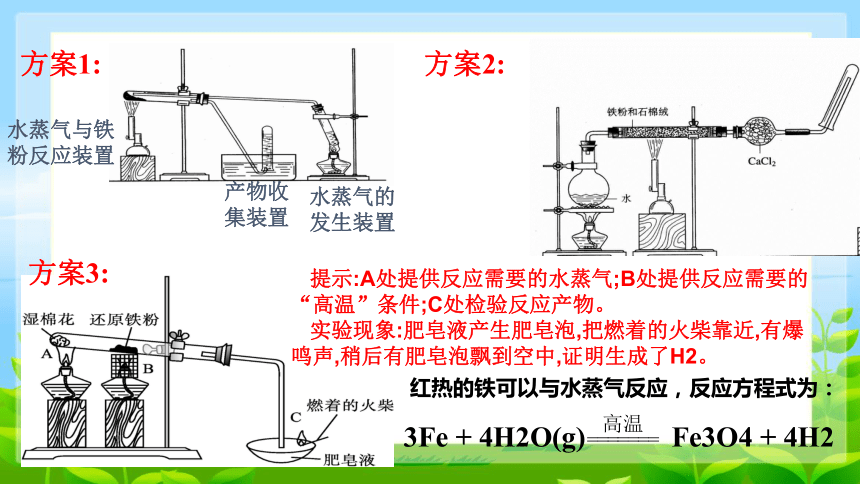
为了检验铁与水在一定条件下是否能够发生反应,有人设计了如下三种方案进行了实验并得到了不错的实验效果。
方案1:
水蒸气与铁粉反应装置
产物收集装置
水蒸气的发生装置
方案2:
方案3:
提示:A处提供反应需要的水蒸气;B处提供反应需要的“高温”条件;C处检验反应产物。
实验现象:肥皂液产生肥皂泡,把燃着的火柴靠近,有爆鸣声,稍后有肥皂泡飘到空中,证明生成了H2。
红热的铁可以与水蒸气反应,反应方程式为:
3Fe + 4H2O(g) Fe3O4 + 4H2
【思考与交流】
2Na+2H2O=2NaOH+H2↑
金属性越强,越容易与水反应,反应越剧烈
比较钠和铁分别与水的反应,总结金属与水的反应规律
3Fe + 4H2O(g) Fe3O4 + 4H2
钠与冷水剧烈反应;铁常温下和加热条件下与液态水不反应,高温水蒸气才能与铁粉反应。金属与水反应的本质是金属与水电离产生的H+反应生成氢气。
典例剖析
某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是 ,
烧瓶底部放碎瓷片的作用是 。
(2)写出装置B中发生反应的化学
方程式: ,
该反应中氧化剂是 ,
氧化产物是 。
(3)D的作用是 。
(4)E中的实验现象是 。
(5)A、B两个装置中应先点燃 处的酒精灯(或酒精喷灯),点燃E处酒精灯之前应进行的操作是 。
产生水蒸气
防止加热时液体暴沸
吸收未反应的水蒸气,干燥H2
黑色固体变成红色,玻璃管内壁上有水珠生成
A
收集H2并检验其纯度
3Fe + 4H2O(g) Fe3O4 + 4H2
H2O
Fe3O4
FeO Fe2O3 Fe3O4
稳定性
铁的 化合价
色、态
俗称
溶解性 分类 与盐酸反应 用途 +2
不稳定
黑色粉末
红棕色粉末
黑色晶体
铁红
磁性氧化铁
都不溶于水
FeO+2H+ =
Fe2++H2O
Fe2O3+6H+ =2Fe3++3H2O
氧化铁:涂料等
Fe3O4 + 8 H+ =
Fe2++2Fe3+ + 4H2O
+3
+2 、+3
碱性氧化物
碱性氧化物
(FeO·Fe2O3)
四氧化三铁:做磁铁
冶炼铁的原料
稳 定
稳 定
二、铁的氧化物
6FeO + O2 = 2Fe3O4
Δ
红砖和青砖都是生活中用到的建筑材料
两者颜色不同的原因是两者所含的铁的氧化物是不一样的,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是氧化铁,青砖中含的是四氧化三铁
为什么不是氧化亚铁?
氧化亚铁不稳定
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为四氧化三铁,而制得青砖。
实验:在氯化铁溶液和硫酸亚铁溶液中分别滴加氢氧化钠溶液
反应
向硫酸亚铁溶液中滴加氢氧化钠溶液,最终得到的还是红褐色沉淀
白色
Fe(OH)2
灰绿色
红褐色
反应
红褐色Fe(OH)3
Fe3+ + 3OH- = Fe(OH)3↓
Fe2+ + 2OH- = Fe(OH)2↓
铁的两种氢氧化物可以分别由相对应的可溶性盐和碱溶液反应制得
红褐色沉淀是什么物质?
Fe(OH)3
什么氧化了Fe(OH)2?
氧气
白色絮状 灰绿色 红褐色
很快
Fe(OH)2
最终
Fe(OH)3
铁的氢氧化物 氢氧化铁 氢氧化亚铁
化学式
物理性质 色、态
水溶性
化学性质 与盐酸
热稳定性
阅读课本 “铁的氢氧化物”部分,完成表格:(发生反应的写化学方程式)
三、铁的氢氧化物
易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
问题:制得Fe(OH)2后,其颜色发生变化的原因是什么?(用化学方程式表示并变出价态变化,指出氧化剂、还原剂)
4Fe(OH)2+O2+2H2O=4Fe(OH)3
+2 0 +3 -2
还原剂
氧化剂
Fe(OH)2显还原性
Fe(OH)3
Fe(OH)2
红褐色固体
白色絮状固体
不 溶
Fe(OH)3+3HCl=FeCl3+3H2O
Fe(OH)2+2HCl=FeCl2+2H2O
2Fe(OH)3 = Fe2O3+3H2O
制备氢氧化亚铁的关键:隔绝空气,防止O2将Fe(OH)2氧化
如何得到纯净的氢氧化亚铁?
思考·讨论
Fe(OH)2被氧化 的原因 改进方法 改进装置
反应试剂中溶有氧气
配制试剂的蒸馏水要煮沸
试剂与空气接触
①在FeSO4溶液的液面上加少量苯(或植物油)
②胶头滴管插入液面下加入NaOH溶液
NaOH溶液
植物油
新制FeSO4溶液
除去试管和溶液中氧气,创造无氧环境
操作:
先滴加 ,然后 ,
当氢气纯净后,再滴加 。
收集氢气并验纯
NaOH溶液
稀硫酸
改进方案二
改进方案三
操作:
先 止水夹,在试管Ⅱ出口处 ,
当 后,
止水夹。产生的氢气使Ⅰ中压强 ,将生成的硫酸亚铁溶液从长导管排入 .
打开
收集氢气并验纯
氢气纯净
关闭
增大
Ⅱ中
改进实验装置,创造无氧环境
铁屑
稀H2SO4
NaOH溶液
改进方案四
铁粉
稀硫酸
NaOH溶液
操作:
先 活塞a,在锥形瓶出口处 , 当 后, 活塞a。产生的氢气使A中压强 ,将生成的硫酸亚铁溶液从长导管排入 .
打开
收集氢气并 验纯
关闭
增大
B中
氢气纯净
课堂小结
铁及其化合物
铁的单质
①铁具有延展性和导热性。
②铁能导电,但其导电性不如铜和铝。
③铁能被磁体吸引。
④铁的熔点是:1535℃;沸点是2750℃;密度是7.86g/cm3。
铁的氧化物
氧化亚铁:是一种黑色粉末,不稳定,在空气里受热迅速被氧化成四氧化三铁
氧化铁:是一种红棕色粉末,俗称铁红,常用做红色油漆和涂料,赤铁矿的主要成分
四氧化三铁:是一种具有磁性的黑色晶体,俗称磁性氧化铁
铁的氢氧化物
氢氧化亚铁:白色固体Fe2++2OH-——Fe(OH)2↓
氢氧化铁:红棕色粉末或胶体Fe3++3OH-——Fe(OH)3↓
人教版必修第一册
网
科
学
第三章 铁 金属材料
第1节 铁及其化合物
3.1.1 铁的单质、氧化物和氢氧化物
铁在生活中的应用广泛
一、铁元素在自然界中的分布
陨铁
赤铁矿
磁铁矿
陨铁是自然界中铁元素的单质形态,但是铁元素更多地主要以+2价和+3价化合物的形式存在于矿石中。人类最早使用的铁,是来自太空的陨铁。
铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
二、单质铁
1、铁的物理性质
方铁
圆铁
化学性质比较活泼,它能与许多物质发生化学反应。
①银白色金属,能被磁体吸引
②导电性(不如铜、铝) 、
导热性、延展性
③熔点:1535℃,沸点:2750℃,
密度7.86 g/cm3
2、铁的化学性质
思考·讨论
1.观察下列化学反应方程式,铁的化合价变化有何异同?
Fe + 2HCl——2FeCl2 + H2
2Fe + 3Cl2——2FeCl3
点燃
Fe + CuSO4——FeSO4 + Cu
Fe
FeCl3
化合价升高
0
+3
Fe
FeCl2
化合价升高
0
+2
Fe
FeSO4
化合价升高
0
+2
2、为什么有的化学方程式中铁的化合价变成+2,有的变成+3?
Fe
Fe2+
Fe3+
弱氧化剂
S、H+、Cu2+等
强氧化剂
Cl2、HNO3等
①与非金属反应
2Fe+3Cl2 2FeCl3
Δ
3Fe+2O2 Fe3O4
点燃
Fe + S FeS
Δ
②与酸反应
Fe+2H+= Fe2++H2↑
③与盐反应
Fe+Cu2+=Cu+Fe2+
3、在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理。这是为什么呢?
钢水注入干燥的模具
提示:铁与水会反应吗?
生活经验告诉我们,常温下,铁与水是不发生反应的。但在高温下,铁能与水发生反应。
思考与交流:
假设铁能与水反应,反应条件能否是常温?为什么?
钠在常温下与冷水剧烈反应;镁在加热条件下与热水剧烈反应;铝在加热条件下与沸水才能反应;根据金属活动性顺序可以推断,铁与水反应的条件应该比铝还高而不是常温。
模拟实验方案:
为了检验铁与水在一定条件下是否能够发生反应,有人设计了如下三种方案进行了实验并得到了不错的实验效果。
方案1:
水蒸气与铁粉反应装置
产物收集装置
水蒸气的发生装置
方案2:
方案3:
提示:A处提供反应需要的水蒸气;B处提供反应需要的“高温”条件;C处检验反应产物。
实验现象:肥皂液产生肥皂泡,把燃着的火柴靠近,有爆鸣声,稍后有肥皂泡飘到空中,证明生成了H2。
红热的铁可以与水蒸气反应,反应方程式为:
3Fe + 4H2O(g) Fe3O4 + 4H2
【思考与交流】
2Na+2H2O=2NaOH+H2↑
金属性越强,越容易与水反应,反应越剧烈
比较钠和铁分别与水的反应,总结金属与水的反应规律
3Fe + 4H2O(g) Fe3O4 + 4H2
钠与冷水剧烈反应;铁常温下和加热条件下与液态水不反应,高温水蒸气才能与铁粉反应。金属与水反应的本质是金属与水电离产生的H+反应生成氢气。
典例剖析
某化学兴趣小组利用如图装置(铁架台及夹持装置已省略)进行“铁与水蒸气反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是 ,
烧瓶底部放碎瓷片的作用是 。
(2)写出装置B中发生反应的化学
方程式: ,
该反应中氧化剂是 ,
氧化产物是 。
(3)D的作用是 。
(4)E中的实验现象是 。
(5)A、B两个装置中应先点燃 处的酒精灯(或酒精喷灯),点燃E处酒精灯之前应进行的操作是 。
产生水蒸气
防止加热时液体暴沸
吸收未反应的水蒸气,干燥H2
黑色固体变成红色,玻璃管内壁上有水珠生成
A
收集H2并检验其纯度
3Fe + 4H2O(g) Fe3O4 + 4H2
H2O
Fe3O4
FeO Fe2O3 Fe3O4
稳定性
铁的 化合价
色、态
俗称
溶解性 分类 与盐酸反应 用途 +2
不稳定
黑色粉末
红棕色粉末
黑色晶体
铁红
磁性氧化铁
都不溶于水
FeO+2H+ =
Fe2++H2O
Fe2O3+6H+ =2Fe3++3H2O
氧化铁:涂料等
Fe3O4 + 8 H+ =
Fe2++2Fe3+ + 4H2O
+3
+2 、+3
碱性氧化物
碱性氧化物
(FeO·Fe2O3)
四氧化三铁:做磁铁
冶炼铁的原料
稳 定
稳 定
二、铁的氧化物
6FeO + O2 = 2Fe3O4
Δ
红砖和青砖都是生活中用到的建筑材料
两者颜色不同的原因是两者所含的铁的氧化物是不一样的,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是氧化铁,青砖中含的是四氧化三铁
为什么不是氧化亚铁?
氧化亚铁不稳定
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为四氧化三铁,而制得青砖。
实验:在氯化铁溶液和硫酸亚铁溶液中分别滴加氢氧化钠溶液
反应
向硫酸亚铁溶液中滴加氢氧化钠溶液,最终得到的还是红褐色沉淀
白色
Fe(OH)2
灰绿色
红褐色
反应
红褐色Fe(OH)3
Fe3+ + 3OH- = Fe(OH)3↓
Fe2+ + 2OH- = Fe(OH)2↓
铁的两种氢氧化物可以分别由相对应的可溶性盐和碱溶液反应制得
红褐色沉淀是什么物质?
Fe(OH)3
什么氧化了Fe(OH)2?
氧气
白色絮状 灰绿色 红褐色
很快
Fe(OH)2
最终
Fe(OH)3
铁的氢氧化物 氢氧化铁 氢氧化亚铁
化学式
物理性质 色、态
水溶性
化学性质 与盐酸
热稳定性
阅读课本 “铁的氢氧化物”部分,完成表格:(发生反应的写化学方程式)
三、铁的氢氧化物
易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
问题:制得Fe(OH)2后,其颜色发生变化的原因是什么?(用化学方程式表示并变出价态变化,指出氧化剂、还原剂)
4Fe(OH)2+O2+2H2O=4Fe(OH)3
+2 0 +3 -2
还原剂
氧化剂
Fe(OH)2显还原性
Fe(OH)3
Fe(OH)2
红褐色固体
白色絮状固体
不 溶
Fe(OH)3+3HCl=FeCl3+3H2O
Fe(OH)2+2HCl=FeCl2+2H2O
2Fe(OH)3 = Fe2O3+3H2O
制备氢氧化亚铁的关键:隔绝空气,防止O2将Fe(OH)2氧化
如何得到纯净的氢氧化亚铁?
思考·讨论
Fe(OH)2被氧化 的原因 改进方法 改进装置
反应试剂中溶有氧气
配制试剂的蒸馏水要煮沸
试剂与空气接触
①在FeSO4溶液的液面上加少量苯(或植物油)
②胶头滴管插入液面下加入NaOH溶液
NaOH溶液
植物油
新制FeSO4溶液
除去试管和溶液中氧气,创造无氧环境
操作:
先滴加 ,然后 ,
当氢气纯净后,再滴加 。
收集氢气并验纯
NaOH溶液
稀硫酸
改进方案二
改进方案三
操作:
先 止水夹,在试管Ⅱ出口处 ,
当 后,
止水夹。产生的氢气使Ⅰ中压强 ,将生成的硫酸亚铁溶液从长导管排入 .
打开
收集氢气并验纯
氢气纯净
关闭
增大
Ⅱ中
改进实验装置,创造无氧环境
铁屑
稀H2SO4
NaOH溶液
改进方案四
铁粉
稀硫酸
NaOH溶液
操作:
先 活塞a,在锥形瓶出口处 , 当 后, 活塞a。产生的氢气使A中压强 ,将生成的硫酸亚铁溶液从长导管排入 .
打开
收集氢气并 验纯
关闭
增大
B中
氢气纯净
课堂小结
铁及其化合物
铁的单质
①铁具有延展性和导热性。
②铁能导电,但其导电性不如铜和铝。
③铁能被磁体吸引。
④铁的熔点是:1535℃;沸点是2750℃;密度是7.86g/cm3。
铁的氧化物
氧化亚铁:是一种黑色粉末,不稳定,在空气里受热迅速被氧化成四氧化三铁
氧化铁:是一种红棕色粉末,俗称铁红,常用做红色油漆和涂料,赤铁矿的主要成分
四氧化三铁:是一种具有磁性的黑色晶体,俗称磁性氧化铁
铁的氢氧化物
氢氧化亚铁:白色固体Fe2++2OH-——Fe(OH)2↓
氢氧化铁:红棕色粉末或胶体Fe3++3OH-——Fe(OH)3↓
