盐类的水解教学设计
图片预览
文档简介
盐类的水解教学设计
【内容出处】人教版高中化学选择性必修1第三章第三节
【课标要求】认识盐类水解的原理和影响盐类水解的主要因素
【教材分析】
本课时内容是人教版选择性必修1第三章“水溶液中的离子平衡”第三节第一课时内容。从课本编排来看,“盐类的水解”位于弱电解电离、水的电离和溶液的酸碱性之后,学生已经能从微观粒子角度认识溶液的酸碱性。在此基础上再来学习“盐类的水解”,既能进一步促进学生的认知发展,也能对平衡原理和弱电解质电离进行具体应用和再认识,以达到强化的目的。从知识结构上看,盐类的水解平衡是又一个电解质溶液平衡,有利于学生形成完整的电解质溶液平衡体系的认知。因此本节教学重点是帮助学生从弱电解质在水中存在电离平衡的角度认识盐类水解的本质,进一步应用水溶液分析思维模型分析可水解的盐溶液,能清晰认识到可水解的盐与强酸强碱盐的差异。学生对于水溶液的认识从弱电解质水溶液扩展到盐溶液,形成相对稳定的认识思路。
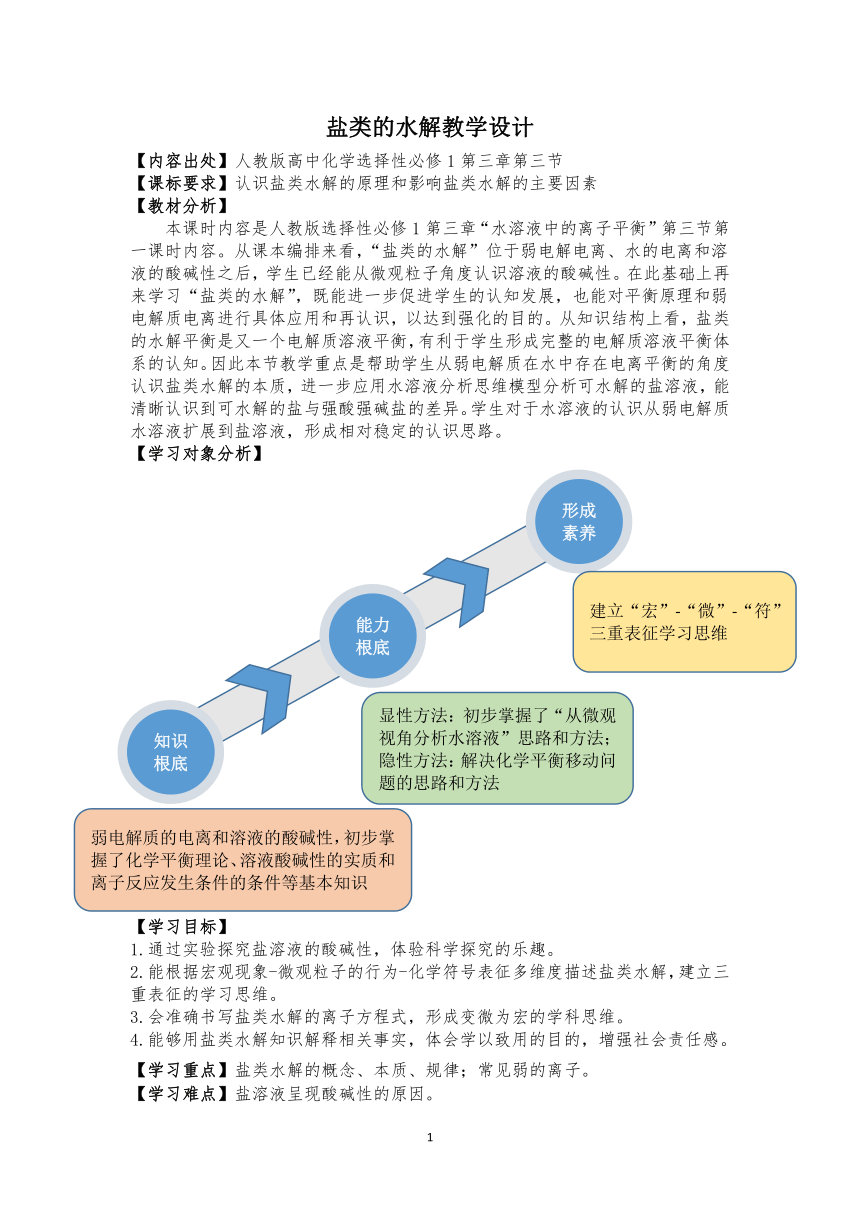
【学习对象分析】
【学习目标】
1.通过实验探究盐溶液的酸碱性,体验科学探究的乐趣。
2.能根据宏观现象-微观粒子的行为-化学符号表征多维度描述盐类水解,建立三重表征的学习思维。
3.会准确书写盐类水解的离子方程式,形成变微为宏的学科思维。
4.能够用盐类水解知识解释相关事实,体会学以致用的目的,增强社会责任感。
【学习重点】盐类水解的概念、本质、规律;常见弱的离子。
【学习难点】盐溶液呈现酸碱性的原因。
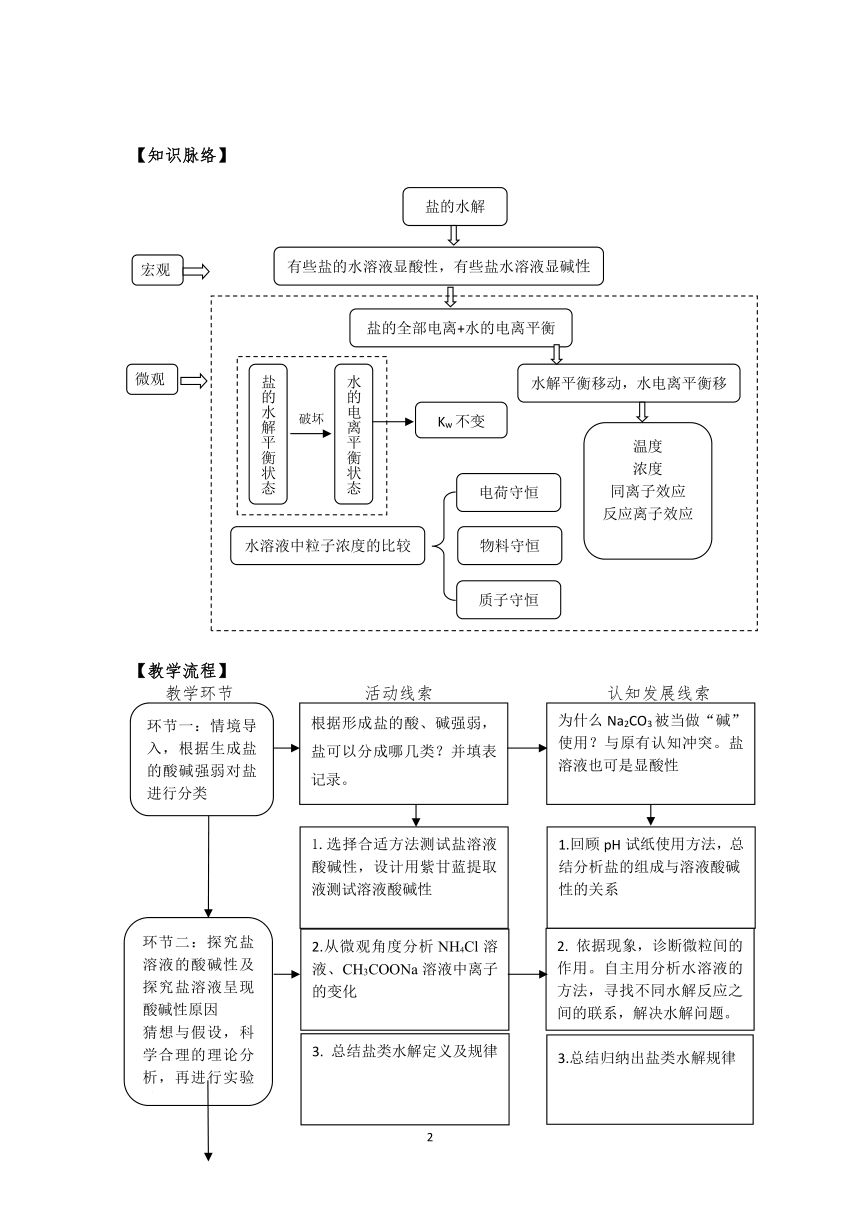
【知识脉络】
【教学流程】
教学环节 活动线索 认知发展线索
【教学过程】
教学环节 教师活动 学生活动 设计意图
环节1 情境导入 引用生活经验,激发兴趣,引入新课 用5%-10%比例的碱水清洗厨房用具,快速去油污;中和面食制作过程中产生的酸性物质;处理被蜜蜂或蚂蚁咬过的伤口,能中和伤口处的酸性物质,缓解红肿、疼痛…… 为什么Na2CO3被当做“碱”使用? 展示ppt中的生活经验图片,引导和激发学生思考 密切联系生活,通过生活经验,激发学生的思考,通过从已有知识中寻找新知识的生长点,激发学生探究欲望,促进知识经验的生长,促进学生的知识建构活动。
简单回顾课前准备中对强酸、弱酸和强碱、弱碱,引导学生思考不同的酸和碱反应生成的盐的分类和酸碱性。 完成课前准备 巩固盐的分类和常见的弱酸和弱碱,为盐类水解作知识铺垫。
环节2 根据生成盐的酸碱强弱对盐进行分类 任务一:根据生成盐的酸碱强弱对盐进行分类 引导提示填写表格 思考盐溶液的酸碱性填写表格 结合已有经验建构新知识
环节3 实验探究盐溶液的酸碱性 溶液酸碱性的测量方法 选择合适的方法测试盐溶液的酸碱性 ①酸碱指示剂法(紫甘蓝汁做指示剂) ②PH试纸法 ③PH计法 讨论:盐的类型与盐溶液的酸碱性之间有何规律? 回忆pH试纸的使用方法。 分六大组,自选方法分别测量六组盐的pH值,判断盐溶液的酸碱性。 实验可提起学生学习兴趣,为引入后面的重点知识做铺垫。
【跟踪练习】判断下列盐溶液的类型和酸碱性 盐溶液类型酸碱性FeCl3NaClONa2S K2SO4
通过练习,加深理解。 练习可以反馈学生知识的掌握情况,加深理解。
环节4 探究盐溶液呈现酸碱性的原因 1、溶液的酸碱性取决于什么? 2、是什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢? 运用以前学习过的知识,使学生得出盐溶液显酸碱性是因为盐电离出的离子,改变了水的电离平衡,导致溶液中c(H+)和c(OH-)浓度不等。 本节课的难点内容,该部分需要重点讲解。
讨论1:向水中加NH4Cl形成溶液呈酸性的原因 自主或同桌之间探究。 对该部分内容加深理解。 强化理解。
讨论2:试用类似方法分析CH3COONa溶液呈碱性、NaCl溶液呈中性的原因。 自主或同桌之间探究。 对该部分内容加深理解。 培养学生总结归纳能力。
板书讲解:盐类水解的概念、本质 [讲解]盐类水解的规律 依照实验探究得出的盐溶液的酸碱性和盐的分类得出盐类水解的规律 新概念的引入。
介绍应用 【学以致用】引导学生用学到的知识解决实际内容。 实际问题: 1.纯碱为什么可以去除油污? 2. NH4Cl溶液为什么可以除去铁锈? 让学生意识到生活与化学是息息相关的。
课堂小结 引导学生回顾本基础知识 学生在老师的引导下,总结本节课内容: 盐类水解的概念、本质、规律、条件和实质。 完善课程结构,加深学生理解。
板书设计 盐类的水解 1.定义:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应。 2.本质:盐破坏并促进了水的电离。 3盐类水解的规律:谁强显谁性,同强显中性; 有弱才水解,谁弱谁水解。 4盐类水解的特点: 可逆、吸热、微弱
【内容出处】人教版高中化学选择性必修1第三章第三节
【课标要求】认识盐类水解的原理和影响盐类水解的主要因素
【教材分析】
本课时内容是人教版选择性必修1第三章“水溶液中的离子平衡”第三节第一课时内容。从课本编排来看,“盐类的水解”位于弱电解电离、水的电离和溶液的酸碱性之后,学生已经能从微观粒子角度认识溶液的酸碱性。在此基础上再来学习“盐类的水解”,既能进一步促进学生的认知发展,也能对平衡原理和弱电解质电离进行具体应用和再认识,以达到强化的目的。从知识结构上看,盐类的水解平衡是又一个电解质溶液平衡,有利于学生形成完整的电解质溶液平衡体系的认知。因此本节教学重点是帮助学生从弱电解质在水中存在电离平衡的角度认识盐类水解的本质,进一步应用水溶液分析思维模型分析可水解的盐溶液,能清晰认识到可水解的盐与强酸强碱盐的差异。学生对于水溶液的认识从弱电解质水溶液扩展到盐溶液,形成相对稳定的认识思路。
【学习对象分析】
【学习目标】
1.通过实验探究盐溶液的酸碱性,体验科学探究的乐趣。
2.能根据宏观现象-微观粒子的行为-化学符号表征多维度描述盐类水解,建立三重表征的学习思维。
3.会准确书写盐类水解的离子方程式,形成变微为宏的学科思维。
4.能够用盐类水解知识解释相关事实,体会学以致用的目的,增强社会责任感。
【学习重点】盐类水解的概念、本质、规律;常见弱的离子。
【学习难点】盐溶液呈现酸碱性的原因。
【知识脉络】
【教学流程】
教学环节 活动线索 认知发展线索
【教学过程】
教学环节 教师活动 学生活动 设计意图
环节1 情境导入 引用生活经验,激发兴趣,引入新课 用5%-10%比例的碱水清洗厨房用具,快速去油污;中和面食制作过程中产生的酸性物质;处理被蜜蜂或蚂蚁咬过的伤口,能中和伤口处的酸性物质,缓解红肿、疼痛…… 为什么Na2CO3被当做“碱”使用? 展示ppt中的生活经验图片,引导和激发学生思考 密切联系生活,通过生活经验,激发学生的思考,通过从已有知识中寻找新知识的生长点,激发学生探究欲望,促进知识经验的生长,促进学生的知识建构活动。
简单回顾课前准备中对强酸、弱酸和强碱、弱碱,引导学生思考不同的酸和碱反应生成的盐的分类和酸碱性。 完成课前准备 巩固盐的分类和常见的弱酸和弱碱,为盐类水解作知识铺垫。
环节2 根据生成盐的酸碱强弱对盐进行分类 任务一:根据生成盐的酸碱强弱对盐进行分类 引导提示填写表格 思考盐溶液的酸碱性填写表格 结合已有经验建构新知识
环节3 实验探究盐溶液的酸碱性 溶液酸碱性的测量方法 选择合适的方法测试盐溶液的酸碱性 ①酸碱指示剂法(紫甘蓝汁做指示剂) ②PH试纸法 ③PH计法 讨论:盐的类型与盐溶液的酸碱性之间有何规律? 回忆pH试纸的使用方法。 分六大组,自选方法分别测量六组盐的pH值,判断盐溶液的酸碱性。 实验可提起学生学习兴趣,为引入后面的重点知识做铺垫。
【跟踪练习】判断下列盐溶液的类型和酸碱性 盐溶液类型酸碱性FeCl3NaClONa2S K2SO4
通过练习,加深理解。 练习可以反馈学生知识的掌握情况,加深理解。
环节4 探究盐溶液呈现酸碱性的原因 1、溶液的酸碱性取决于什么? 2、是什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大小的差异呢? 运用以前学习过的知识,使学生得出盐溶液显酸碱性是因为盐电离出的离子,改变了水的电离平衡,导致溶液中c(H+)和c(OH-)浓度不等。 本节课的难点内容,该部分需要重点讲解。
讨论1:向水中加NH4Cl形成溶液呈酸性的原因 自主或同桌之间探究。 对该部分内容加深理解。 强化理解。
讨论2:试用类似方法分析CH3COONa溶液呈碱性、NaCl溶液呈中性的原因。 自主或同桌之间探究。 对该部分内容加深理解。 培养学生总结归纳能力。
板书讲解:盐类水解的概念、本质 [讲解]盐类水解的规律 依照实验探究得出的盐溶液的酸碱性和盐的分类得出盐类水解的规律 新概念的引入。
介绍应用 【学以致用】引导学生用学到的知识解决实际内容。 实际问题: 1.纯碱为什么可以去除油污? 2. NH4Cl溶液为什么可以除去铁锈? 让学生意识到生活与化学是息息相关的。
课堂小结 引导学生回顾本基础知识 学生在老师的引导下,总结本节课内容: 盐类水解的概念、本质、规律、条件和实质。 完善课程结构,加深学生理解。
板书设计 盐类的水解 1.定义:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应。 2.本质:盐破坏并促进了水的电离。 3盐类水解的规律:谁强显谁性,同强显中性; 有弱才水解,谁弱谁水解。 4盐类水解的特点: 可逆、吸热、微弱
