金属钠及氧化钠、过氧化钠的性质(共33张PPT)
文档属性
| 名称 | 金属钠及氧化钠、过氧化钠的性质(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 20:44:36 | ||
图片预览











文档简介
(共33张PPT)
钠及其化合物
基于核心素养目标下的单元整体教学设计
目录
Contents
评价目标
教学过程
作业设计
课时目标
基于发展学生核心素养的“教学评一体化”的教学设计
第一节《钠及其化合物》课时教学设计
第一课时教学设计 课题 钠、氧化钠、过氧化钠
课型 新授课 章/单元复习课□ 习题/试卷讲评课□
01
PART
教学过程
课时目标
课时目标
01
02
03
ADD TITLE
ADD TITLE
add your words here,according to your need to draw the text box size
通过完成金属钠的相关实验,了解钠、氧化钠、过氧化钠的主要性质,正确书写有关的化学方程式。
通过学习钠及其化合物在生产和生活中的应用,感受化学的魅力,发展社会参与意识。
通过钠、氧化钠、过氧化钠知识的学习,逐步形成金属及其化合物的研究思路。
01
02
ADD TITLE
ADD TITLE
add your words here,according to your need to draw the text box size
重点:钠与水的反应,钠及其化合物的研究思路和方法的建构,感受宏观与微观相结合的思想
难点:钠与水反应的探究实验
02
PART
评价目标
ADD TITLE
add your words here,according to your need to draw the text box size
1.通过Na、 Na2O、Na2O2性质的实验探究和对比学习,诊断并发展学生从分类角度对物质组成、物质性质、离子反应的认识水平,氧化还原理论的运用,提升实验探究的能力水平,从宏微观相结合的视角分析与解决实际问题的能力水平,以及对化学应用价值的认识水平。
2.通过以钠、氧化钠、过氧化钠知识的学习为线索,逐步形成金属及其化合物的研究思路。
03
PART
教学过程
课时目标
教学过程
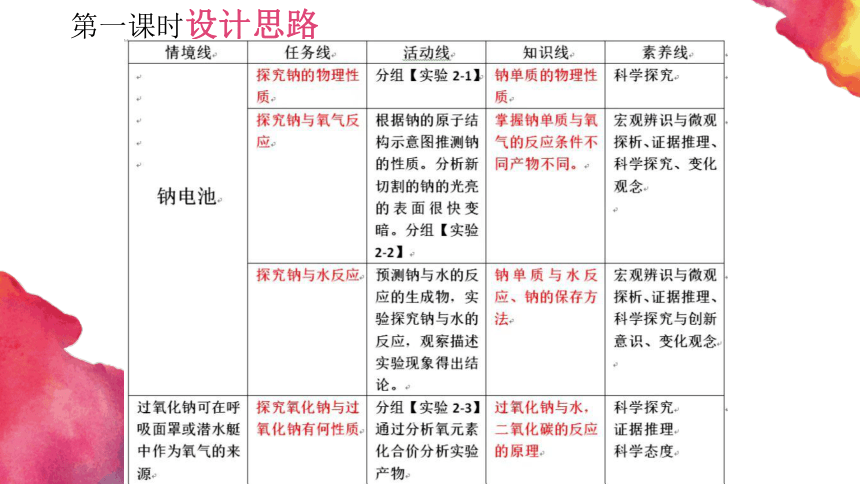
第一课时设计思路
教 学 过 程.
从宏观角度认识从氧化还原的观点探析,钠在常温与加热条件下都能与氧气反应。从变化观念角度:条件不同,产物不同,而条件是可以控制的。
学习任务4
学习任务2
学习任务1
学习任务3
学习任务5
感受钠的来源及钠离子电池为情境引入,从微观角度认识(钠的原子结构)钠单质的性质;从物质类别角度预测钠的性质。
从宏观角度观察、微观角度分析、动手实验感受钠单质的物理性质。
从宏观角度观察、从物质组成与氧化还原理论的角度分析,认识钠与水的反应
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原反应理论预测、研究过氧化钠性质,由性质入手,得出过氧化钠的用途。
地球表面总面积约5.1亿平方千米,其中海洋面积3.61亿平方千米,占地球表面积的71%。 浩瀚的大海美丽而且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水中含量较高的元素,也是典型的金属元素和非金属元素。
海水中溶解的盐分含量分布图
钠
氯
钠
海水
转化
晒盐
粗盐
提纯、精制
NaCl
海水
2NaCl(熔融)=== 2Na + Cl2↑
电解
Cl2
原料
产品
富集
分离提纯
转化
【学习任务1】 感受钠的来源;从微观角度(钠的原子结构)认识钠单质的性质;从物质类别角度预测钠的性质。
钠具有强
还原性
金属的共性
与非金属单质、
酸、一些盐等反应
原子结构
预
测
金属活动性顺序
K Ca Na Mg Al
Zn Fe……
共性
分类法
特性
比较法
【学习任务1】写出钠的原子结构示意图,结合物质的类别和金属活动顺序表预测钠单质的化学性质
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的颜色和光泽,并注意新切开的钠的表面所发生的变化。
实验现象:
新切开的金属钠有银白色的金属光泽,在空气中很快变暗
预测钠的物理性质以及钠在空气中为什么会变暗?
教材P32【实验2-1】
【学习任务2】从宏观角度观察、微观角度分析、动手实验感受钠单质的物理性质
颜色:
硬度:
密度:
熔点:
钠可以用小刀切割,说明什么?
状态
银白色,具有金属光泽
固体
质软,可用小刀切割
小于水,大于煤油
熔点低
一、钠的物理性质
【学习任务2】从宏观角度观察、微观角度分析、动手实验感受钠单质的物理性质
【思考与讨论】
钠与氧气发生反应,在钠的表面生成了一层白色的氧化钠
4Na + O2 ==== 2Na2O(白色固体)
【想一想】
新切开的钠光亮的表面为什么很快变暗?
【写一写】
此过程的化学方程式?
实验室金属钠保存保存在煤油或石蜡油中
【学习任务3】从宏观角度认识从氧化还原的观点探析,钠在常温与加热条件下都能与氧气反应。从变化观念角度:条件不同,产物不同,而条件是可以控制的。
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热片刻,待钠熔化后立即撤掉酒精灯,观察现象。
受热后熔化 剧烈反应 黄色火焰 生成淡黄色固体
教材P33【实验2-2】
2Na + O2 ==== Na2O2
熔点低
Na2O2
【学习任务3】从宏观角度认识从氧化还原的观点探析,钠在常温与加热条件下都能与氧气反应。从变化观念角度:条件不同,产物不同,而条件是可以控制的。
分析预测
从物质组成及氧化还原反应的角度,预测钠与水反应的产物:
【学习任务4】从宏观角度观察、从物质组成与氧化还原理论的角度分析,认识钠与水的反应
在烧杯中加入一些水,滴入几滴酚酞溶液, 然后把一
小块绿豆大小的金属钠放入水中。
请从钠在水中的位置、钠的形状变化、溶液颜色的变
化等方面观察和描述实验现象
【实验】
【提示】
教材P34【探究】 钠与水的反应
【学习任务4】从宏观角度从物质组成与氧化还原的角度分析认识钠与水的反应
实验现象 分析及结论
钠浮在水面上
钠熔成光亮的小球
发出“嘶嘶”的响声
钠的密度比水小
钠与水反应放热,钠熔点低
生成了气体
小球在水面上游动
溶液变红且澄清
生成溶液呈碱性
浮、熔、游、响、红
教材P34【探究】 钠与水的反应
【学习任务4】从宏观角度从物质组成与氧化还原的角度分析认识钠与水的反应
【思考与讨论】
写出钠和水反应的离子方程式
钠和水反应的实质是什么?
钠可以与酸反应吗?剧烈程度如何?
钠不慎着火,该如何灭火?
【学习任务4】从宏观角度从物质组成与氧化还原的角度分析认识钠与水的反应
【学习任务5】
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原
反应理论预测、研 究过氧化钠性质,由性质入手,得出过氧化钠的用途。
【学习任务5】
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原反应理论预测、研究过氧化钠性质,由性质入手,得出过氧化钠的用途。
【学习任务5】
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原反应理论预测、研究过氧化钠性质,由性质入手,得出过氧化钠的用途。
04
PART
教学过程
课时目标
作业设计
合格考训练
1. 下列关于钠的叙述中,不正确的是( )。(考察钠的性质 )
A. 钠燃烧时发出黄色的火焰 B. 钠燃烧时生成氧化钠
C. 钠具有很强的还原性 D. 钠原子的最外电子层上只有1个电子
2.下列物质放置在空气中,因发生氧化还原反应而变质的是( )。(考察钠的性质 )
A. Na B. NaOH C. NaCl D. Na2CO3
3.(1)将包有少量 色Na2O2固体的棉花放入坩埚,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。由该实验你能得出的结论是 。
(2)在潜水艇和消防员的呼吸面具中,Na2O2所发生反应的化学方程式为 从氧化剂和还原剂的角度分析,
在这个反应中Na2O2的作用是 。某潜水艇上有50人,如果每人每分钟消耗的O2在标准状况下体积为0.80 L(标准状况下O2的密度为1.429 g/L),假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需要的Na2O2的质量是 kg。
(考察过氧化钠的性质 )
4.能正确表示下列反应的离子方程式是( )(考察钠与各种溶液反应情况 )
A. 钠与水反应:
B. 钠与KCl溶液反应:
C. 钠与盐酸反应:
D. 钠与CuSO4溶液反应:
2某溶液中含大量NH4+、Na+、HCO3-、CO32-、CH3COO- 离子,其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )(考察过氧化钠的性质 )
A.Na+ B.CO32-、NH4+
C.CH3COO- D.CH3COO-、Na+
合格考训练
钠长期置于空气中,最后形成的物质是 (填化学式),该物质与氯化钙溶液混合后,发生反应的离子方程式为 。
(考察钠长期置于空气的变化)
等级考训练
等级考训练
3.请选择适当的化学试剂和实验用品,用下图所示的装置(C中盛放的是过氧化钠)进行实验,证明
过氧化钠可在呼吸面具和潜水艇中做供氧剂。(考察过氧化钠的性质 )
(1) A是实验室中制取CO2的装置。写出A中发生反应的离子方程式: 。
( 2)填写下表中的空白
(3)写出C中发生反应的化学方程式: 。
( 4) F中得到的是 。如何验证?
物理性质
密度比煤油大,比水小
质软
银白色固体
熔点低
钠的性质
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
Na2O2
化学性质
很活泼
2Na+2H2O=2NaOH + H2↑
4Na+O2=2Na2O
2Na +O2=Na2O2
板书设计
欢迎大家批评指正
钠及其化合物
基于核心素养目标下的单元整体教学设计
目录
Contents
评价目标
教学过程
作业设计
课时目标
基于发展学生核心素养的“教学评一体化”的教学设计
第一节《钠及其化合物》课时教学设计
第一课时教学设计 课题 钠、氧化钠、过氧化钠
课型 新授课 章/单元复习课□ 习题/试卷讲评课□
01
PART
教学过程
课时目标
课时目标
01
02
03
ADD TITLE
ADD TITLE
add your words here,according to your need to draw the text box size
通过完成金属钠的相关实验,了解钠、氧化钠、过氧化钠的主要性质,正确书写有关的化学方程式。
通过学习钠及其化合物在生产和生活中的应用,感受化学的魅力,发展社会参与意识。
通过钠、氧化钠、过氧化钠知识的学习,逐步形成金属及其化合物的研究思路。
01
02
ADD TITLE
ADD TITLE
add your words here,according to your need to draw the text box size
重点:钠与水的反应,钠及其化合物的研究思路和方法的建构,感受宏观与微观相结合的思想
难点:钠与水反应的探究实验
02
PART
评价目标
ADD TITLE
add your words here,according to your need to draw the text box size
1.通过Na、 Na2O、Na2O2性质的实验探究和对比学习,诊断并发展学生从分类角度对物质组成、物质性质、离子反应的认识水平,氧化还原理论的运用,提升实验探究的能力水平,从宏微观相结合的视角分析与解决实际问题的能力水平,以及对化学应用价值的认识水平。
2.通过以钠、氧化钠、过氧化钠知识的学习为线索,逐步形成金属及其化合物的研究思路。
03
PART
教学过程
课时目标
教学过程
第一课时设计思路
教 学 过 程.
从宏观角度认识从氧化还原的观点探析,钠在常温与加热条件下都能与氧气反应。从变化观念角度:条件不同,产物不同,而条件是可以控制的。
学习任务4
学习任务2
学习任务1
学习任务3
学习任务5
感受钠的来源及钠离子电池为情境引入,从微观角度认识(钠的原子结构)钠单质的性质;从物质类别角度预测钠的性质。
从宏观角度观察、微观角度分析、动手实验感受钠单质的物理性质。
从宏观角度观察、从物质组成与氧化还原理论的角度分析,认识钠与水的反应
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原反应理论预测、研究过氧化钠性质,由性质入手,得出过氧化钠的用途。
地球表面总面积约5.1亿平方千米,其中海洋面积3.61亿平方千米,占地球表面积的71%。 浩瀚的大海美丽而且富饶。海洋是一个巨大的化学资源宝库,含有80多种元素,钠元素和氯元素是海水中含量较高的元素,也是典型的金属元素和非金属元素。
海水中溶解的盐分含量分布图
钠
氯
钠
海水
转化
晒盐
粗盐
提纯、精制
NaCl
海水
2NaCl(熔融)=== 2Na + Cl2↑
电解
Cl2
原料
产品
富集
分离提纯
转化
【学习任务1】 感受钠的来源;从微观角度(钠的原子结构)认识钠单质的性质;从物质类别角度预测钠的性质。
钠具有强
还原性
金属的共性
与非金属单质、
酸、一些盐等反应
原子结构
预
测
金属活动性顺序
K Ca Na Mg Al
Zn Fe……
共性
分类法
特性
比较法
【学习任务1】写出钠的原子结构示意图,结合物质的类别和金属活动顺序表预测钠单质的化学性质
用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的颜色和光泽,并注意新切开的钠的表面所发生的变化。
实验现象:
新切开的金属钠有银白色的金属光泽,在空气中很快变暗
预测钠的物理性质以及钠在空气中为什么会变暗?
教材P32【实验2-1】
【学习任务2】从宏观角度观察、微观角度分析、动手实验感受钠单质的物理性质
颜色:
硬度:
密度:
熔点:
钠可以用小刀切割,说明什么?
状态
银白色,具有金属光泽
固体
质软,可用小刀切割
小于水,大于煤油
熔点低
一、钠的物理性质
【学习任务2】从宏观角度观察、微观角度分析、动手实验感受钠单质的物理性质
【思考与讨论】
钠与氧气发生反应,在钠的表面生成了一层白色的氧化钠
4Na + O2 ==== 2Na2O(白色固体)
【想一想】
新切开的钠光亮的表面为什么很快变暗?
【写一写】
此过程的化学方程式?
实验室金属钠保存保存在煤油或石蜡油中
【学习任务3】从宏观角度认识从氧化还原的观点探析,钠在常温与加热条件下都能与氧气反应。从变化观念角度:条件不同,产物不同,而条件是可以控制的。
将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中。继续加热片刻,待钠熔化后立即撤掉酒精灯,观察现象。
受热后熔化 剧烈反应 黄色火焰 生成淡黄色固体
教材P33【实验2-2】
2Na + O2 ==== Na2O2
熔点低
Na2O2
【学习任务3】从宏观角度认识从氧化还原的观点探析,钠在常温与加热条件下都能与氧气反应。从变化观念角度:条件不同,产物不同,而条件是可以控制的。
分析预测
从物质组成及氧化还原反应的角度,预测钠与水反应的产物:
【学习任务4】从宏观角度观察、从物质组成与氧化还原理论的角度分析,认识钠与水的反应
在烧杯中加入一些水,滴入几滴酚酞溶液, 然后把一
小块绿豆大小的金属钠放入水中。
请从钠在水中的位置、钠的形状变化、溶液颜色的变
化等方面观察和描述实验现象
【实验】
【提示】
教材P34【探究】 钠与水的反应
【学习任务4】从宏观角度从物质组成与氧化还原的角度分析认识钠与水的反应
实验现象 分析及结论
钠浮在水面上
钠熔成光亮的小球
发出“嘶嘶”的响声
钠的密度比水小
钠与水反应放热,钠熔点低
生成了气体
小球在水面上游动
溶液变红且澄清
生成溶液呈碱性
浮、熔、游、响、红
教材P34【探究】 钠与水的反应
【学习任务4】从宏观角度从物质组成与氧化还原的角度分析认识钠与水的反应
【思考与讨论】
写出钠和水反应的离子方程式
钠和水反应的实质是什么?
钠可以与酸反应吗?剧烈程度如何?
钠不慎着火,该如何灭火?
【学习任务4】从宏观角度从物质组成与氧化还原的角度分析认识钠与水的反应
【学习任务5】
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原
反应理论预测、研 究过氧化钠性质,由性质入手,得出过氧化钠的用途。
【学习任务5】
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原反应理论预测、研究过氧化钠性质,由性质入手,得出过氧化钠的用途。
【学习任务5】
从宏观角度,物质类别角度,对比认识氧化钠、过氧化钠。用氧化还原反应理论预测、研究过氧化钠性质,由性质入手,得出过氧化钠的用途。
04
PART
教学过程
课时目标
作业设计
合格考训练
1. 下列关于钠的叙述中,不正确的是( )。(考察钠的性质 )
A. 钠燃烧时发出黄色的火焰 B. 钠燃烧时生成氧化钠
C. 钠具有很强的还原性 D. 钠原子的最外电子层上只有1个电子
2.下列物质放置在空气中,因发生氧化还原反应而变质的是( )。(考察钠的性质 )
A. Na B. NaOH C. NaCl D. Na2CO3
3.(1)将包有少量 色Na2O2固体的棉花放入坩埚,用滴管向棉花上滴几滴水,棉花立刻燃烧起来。由该实验你能得出的结论是 。
(2)在潜水艇和消防员的呼吸面具中,Na2O2所发生反应的化学方程式为 从氧化剂和还原剂的角度分析,
在这个反应中Na2O2的作用是 。某潜水艇上有50人,如果每人每分钟消耗的O2在标准状况下体积为0.80 L(标准状况下O2的密度为1.429 g/L),假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需要的Na2O2的质量是 kg。
(考察过氧化钠的性质 )
4.能正确表示下列反应的离子方程式是( )(考察钠与各种溶液反应情况 )
A. 钠与水反应:
B. 钠与KCl溶液反应:
C. 钠与盐酸反应:
D. 钠与CuSO4溶液反应:
2某溶液中含大量NH4+、Na+、HCO3-、CO32-、CH3COO- 离子,其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )(考察过氧化钠的性质 )
A.Na+ B.CO32-、NH4+
C.CH3COO- D.CH3COO-、Na+
合格考训练
钠长期置于空气中,最后形成的物质是 (填化学式),该物质与氯化钙溶液混合后,发生反应的离子方程式为 。
(考察钠长期置于空气的变化)
等级考训练
等级考训练
3.请选择适当的化学试剂和实验用品,用下图所示的装置(C中盛放的是过氧化钠)进行实验,证明
过氧化钠可在呼吸面具和潜水艇中做供氧剂。(考察过氧化钠的性质 )
(1) A是实验室中制取CO2的装置。写出A中发生反应的离子方程式: 。
( 2)填写下表中的空白
(3)写出C中发生反应的化学方程式: 。
( 4) F中得到的是 。如何验证?
物理性质
密度比煤油大,比水小
质软
银白色固体
熔点低
钠的性质
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
Na2O2
化学性质
很活泼
2Na+2H2O=2NaOH + H2↑
4Na+O2=2Na2O
2Na +O2=Na2O2
板书设计
欢迎大家批评指正
