2.2.3 氯气的实验室制法(共26张PPT)
文档属性
| 名称 | 2.2.3 氯气的实验室制法(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 64.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 20:51:05 | ||
图片预览







文档简介
(共26张PPT)
走进奇妙的化学世界
必修第一册
第二章 海水中的重要
元素——钠和氯
第二节 氯及其氧化物
第3课时 氯气的实验室制法
氯气的发现应该归功于瑞典化学家舍勒,舍勒发现氯气是在1774年,当时他正在研究软锰矿(即二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种有强烈刺激性气味的黄绿色气体,这种气体就是氯气。
现在这种方法仍然是实验室制取氯气的重要方法之一
舍勒是怎样在实验室制取氯气的
加热
Cl2
软锰矿(MnO2)
浓盐酸(HCl)
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
学习
目标
PART
01
PART
02
第3课时
氯气的实验室制法
能根据物质的性质和物质间的转化关系设计方案制备氯气
掌握氯气的实验室制法
氯气的实验室制法
药品:
软锰矿MnO2
+
盐酸
加热
原理:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
+4 -1 +2 0
浓盐酸的作用:
还原性、酸性
讨论1:写出对应离子方程式。
MnO2 + 4H+ + 2Cl- ==Mn2+ + Cl2↑ + 2H2O
△
注意:①反应物要用浓盐酸; ②此反应必须加热。
讨论3:请你分析这个反应中,两种药品的作用。若实验室缺少MnO2或者浓盐酸,可以用什么药品替代?
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
讨论2:足量MnO2和含4x36.5gHCl的浓盐酸加热制得Cl2的质量 (填“小于”“等于”或“大于”) 71g,
原因:
随着反应进行,浓盐酸变稀
(盐酸当稀到一定程度不再与足量MnO2反应)
小于
实验室中还可以用KMnO4、K2Cr2O7等强氧化剂和浓盐酸来制取Cl2。
K2Cr2O7 + 14HCl(浓) = 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
+6
+7
+3
+2
知识拓展:在舍勒的基础上,法国化学家贝托莱(1748-1822)将软锰矿、浓硫酸、NaCl固体混合,加热,制得了Cl2。
MnO2 + 2H2SO4(浓) + 2NaCl = MnSO4 + Na2SO4 + Cl2↑ + 2H2O
△
-1
请从氧化还原反应与离子反应的本质分析上述反应发生的原理。
(1)应用上述装置(如右图)能否收集到纯净干燥的氯气?如果不能,杂质是什么。
杂质HCl气体和水蒸气。
(2)如果要除去以上两种杂质,得到纯净干燥的氯气,需要选择何试剂?
Cl2(HCl、 H2O)
饱和食盐水
浓硫酸
资料信息:已知Cl2能溶于水,常温常压下,在水中的溶解度约为1:2;某实验测得,在饱和食盐水中的溶解度约为1:1;HCl极易溶于水,常温常压下,在水(饱和食盐水)中的溶解度约为1:500。
不能。浓盐酸会挥发,且含有水蒸气。
【思考与讨论】
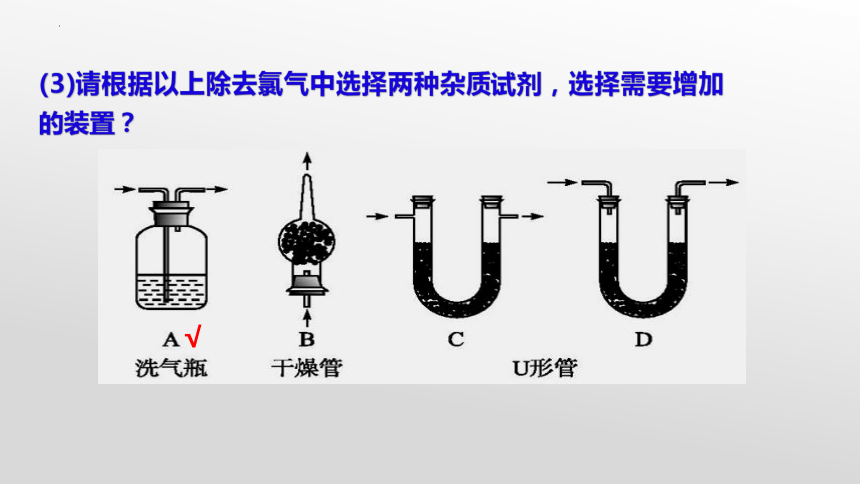
(3)请根据以上除去氯气中选择两种杂质试剂,选择需要增加的装置?
√
【改进装置】
除HCl杂质
干燥Cl2
收集
气体
吸收Cl2
饱和NaCl
浓H2SO4
浓NaOH
(1)请观察右边装置,NaOH溶液的作用是什么?
提示:湿润的KI淀粉试纸变蓝:
Cl2 + 2KI =2KCl + I2
提示:吸收多余的氯气,防止污染环境:
Cl2 + 2NaOH = NaCl + NaClO + H2O
(2)如何确定氯气已经收集满?
【思考与讨论】
实验中加热温度不宜过高,为什么?
避免Cl2中混有大量的HCl杂质。
发生装置
除杂装置
收集装置
尾气处理装置
Cl2 (HCl、H2O)
Cl2 (H2O)
Cl2
气体成分:
氯气的实验室制法
总结:
氯气的实验室制法
小结:
制备气体
发生装置
收集装置
反应物:MnO2 (s) 、
浓盐酸 (aq)
反应条件:加热
固液加热
产物:Cl2
性质:ρ氯气>ρ空气
溶于水
与水反应
向上排空气法
【化学与生活】
在清扫厕所时,清洁人员误以为浴厕清洁剂(主要成分是盐酸)与漂白液混合,清洁效果会更强,结果混合后产生氯气,并冒出大量浓烟。
请尝试写出产生氯气的化学方程式。
2HCl+ NaClO = NaCl+H2O+ Cl2↑
气体 制取原理(方程式) 反应物状态 反应 条件 装置图
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl = CaCl2 + CO2↑+H2O
固体+固体
固体+液体
固体+液体
加热
不加热
不加热
回顾初中所学的氧气、二氧化碳等气体的实验室制取方法,将相关内容填入下表。讨论氯气的制备装置和它们一样吗?如果一样,属于哪一种?如果不一样,请类比归纳氯气的制备装置。
(1)依据实验室O2与CO2制取、收集方法,请你观察这些装置有什么特点?
Zn与H2SO4反应制取H2
加热KMnO4
制取O2
CaCO3与盐酸反应制取CO2
(2)根据上述装置图归纳氧气、二氧化碳是怎样收集的?依据是什么?
提示:氧气用了排水法收集,二氧化碳和氯气都用了向上排空气法收集。
小结: 依据气体的密度、气体在水中的溶解性,以及是否与水反应,选择收集装置。
【思考与讨论】
结合O2、CO2等气体的实验室制取方法,讨论:
设计实验室制取气体的装置时,应考虑哪些方面?
考虑 装置的选取依据 和 装置的连接顺序:
1) 发生装置
反应物状态
反应条件
2) 净化装置
除杂、干燥
3) 收集装置
气体的密度
气体的溶解性
4) 尾气处理
气体的性质
(1)气体发生装置
选用依据
反应物状态
反应条件
固体加热型
固液不加热型
H2、CO2等
液-固、液-液加热型
Cl2等
O2等
(2) 净化装置
除杂/干燥装置
液态试剂
固态试剂
常见干燥剂:
浓硫酸、碱石灰、NaOH(S)、
、CaO、无水CaCl2 等
(3) 收集装置
① 排空气法:
② 排水法:
(4) 尾气处理装置
① 吸收式:
吸收溶解度较大气体 (如NH3、HCl等),要加装 安全瓶 或 防倒吸 装置,如:
② 燃烧式/收集式:
发生装置
除杂装置(如需要)
收集装置
尾气处理装置
(如需要)
反应物状态、反应条件
气体及所含杂质的性质
气体的密度、气体在水中溶解性、是否与水反应等
气体的性质
选择和组装实验室制取气体的装置时,应该考虑装置的选取依据和连接顺序。
总结:
实验目的
实验室制取纯净干燥的氯气
反应原理
核心元素→类别、化合价变化→试剂选择
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
装置设计
发生→除杂(如需要)→收集→尾气处理(如需要)
操作事项
药品加入的顺序,化学反应条件的控制等
△
氯气的实验室制法
方法总结:
1.据台湾媒体报道,北县中和市锦和中学的部分学生,在清扫厕所时误以为浴厕清洁剂(主要成分是盐酸)与漂白液混合,清洁效果会更强,结果混合后产生氯气,并冒出大量浓烟,九名学生疑似氯气吸入过多,身体不适被送往双和医院,诊治后幸无大碍。 请尝试写出产生氯气的化学方程式。
2HCl+ NaClO = NaCl+H2O+ Cl2↑
2.实验室制取并收集氯气,有关描述正确的是( )
A.发生装置应先加热再逐滴加入浓盐酸
B.饱和食盐水可以用饱和碳酸氢钠溶液代替
C.若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的氧化性较强
D.可以通过观察集气瓶中气体的颜色判断氯气是否收集满
D
3.实验室中为进行有关氯气的性质实验,需要4瓶体积为100mL的氯气。(常温下,氯气的密度为2.91 g/L。)
(1)制取4瓶氯气,理论上需要MnO2的质量是多少
(2)实际称取的MnO2固体的质量必须适当多于理论量,主要原因是什么
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
【答案】1.426g 实际称取的MnO2固体的质量必须适当多于理论量
【解析】需制备氯气0.1×2.91×4=1.164g,根据反应方程式可计算需要MnO2的质量是1.426g。实际实验中不能实现全部转化,要考虑损耗,所以实际称取的MnO2固体的质量必须适当多于理论量。
4.(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
下列收集Cl2的正确装置是__________。
C
2.对比上述C装置与教材中氯气收集的装置,有什么区别,哪个更合理。
C装置更合理。因为氯气和氢氧化钠反应后,会导致导管口压强减小,容易产生倒吸。
谢谢欣赏
走进奇妙的化学世界
必修第一册
第二章 海水中的重要
元素——钠和氯
第二节 氯及其氧化物
第3课时 氯气的实验室制法
氯气的发现应该归功于瑞典化学家舍勒,舍勒发现氯气是在1774年,当时他正在研究软锰矿(即二氧化锰),当他使软锰矿与浓盐酸混合并加热时,产生了一种有强烈刺激性气味的黄绿色气体,这种气体就是氯气。
现在这种方法仍然是实验室制取氯气的重要方法之一
舍勒是怎样在实验室制取氯气的
加热
Cl2
软锰矿(MnO2)
浓盐酸(HCl)
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
学习
目标
PART
01
PART
02
第3课时
氯气的实验室制法
能根据物质的性质和物质间的转化关系设计方案制备氯气
掌握氯气的实验室制法
氯气的实验室制法
药品:
软锰矿MnO2
+
盐酸
加热
原理:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
+4 -1 +2 0
浓盐酸的作用:
还原性、酸性
讨论1:写出对应离子方程式。
MnO2 + 4H+ + 2Cl- ==Mn2+ + Cl2↑ + 2H2O
△
注意:①反应物要用浓盐酸; ②此反应必须加热。
讨论3:请你分析这个反应中,两种药品的作用。若实验室缺少MnO2或者浓盐酸,可以用什么药品替代?
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
讨论2:足量MnO2和含4x36.5gHCl的浓盐酸加热制得Cl2的质量 (填“小于”“等于”或“大于”) 71g,
原因:
随着反应进行,浓盐酸变稀
(盐酸当稀到一定程度不再与足量MnO2反应)
小于
实验室中还可以用KMnO4、K2Cr2O7等强氧化剂和浓盐酸来制取Cl2。
K2Cr2O7 + 14HCl(浓) = 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
+6
+7
+3
+2
知识拓展:在舍勒的基础上,法国化学家贝托莱(1748-1822)将软锰矿、浓硫酸、NaCl固体混合,加热,制得了Cl2。
MnO2 + 2H2SO4(浓) + 2NaCl = MnSO4 + Na2SO4 + Cl2↑ + 2H2O
△
-1
请从氧化还原反应与离子反应的本质分析上述反应发生的原理。
(1)应用上述装置(如右图)能否收集到纯净干燥的氯气?如果不能,杂质是什么。
杂质HCl气体和水蒸气。
(2)如果要除去以上两种杂质,得到纯净干燥的氯气,需要选择何试剂?
Cl2(HCl、 H2O)
饱和食盐水
浓硫酸
资料信息:已知Cl2能溶于水,常温常压下,在水中的溶解度约为1:2;某实验测得,在饱和食盐水中的溶解度约为1:1;HCl极易溶于水,常温常压下,在水(饱和食盐水)中的溶解度约为1:500。
不能。浓盐酸会挥发,且含有水蒸气。
【思考与讨论】
(3)请根据以上除去氯气中选择两种杂质试剂,选择需要增加的装置?
√
【改进装置】
除HCl杂质
干燥Cl2
收集
气体
吸收Cl2
饱和NaCl
浓H2SO4
浓NaOH
(1)请观察右边装置,NaOH溶液的作用是什么?
提示:湿润的KI淀粉试纸变蓝:
Cl2 + 2KI =2KCl + I2
提示:吸收多余的氯气,防止污染环境:
Cl2 + 2NaOH = NaCl + NaClO + H2O
(2)如何确定氯气已经收集满?
【思考与讨论】
实验中加热温度不宜过高,为什么?
避免Cl2中混有大量的HCl杂质。
发生装置
除杂装置
收集装置
尾气处理装置
Cl2 (HCl、H2O)
Cl2 (H2O)
Cl2
气体成分:
氯气的实验室制法
总结:
氯气的实验室制法
小结:
制备气体
发生装置
收集装置
反应物:MnO2 (s) 、
浓盐酸 (aq)
反应条件:加热
固液加热
产物:Cl2
性质:ρ氯气>ρ空气
溶于水
与水反应
向上排空气法
【化学与生活】
在清扫厕所时,清洁人员误以为浴厕清洁剂(主要成分是盐酸)与漂白液混合,清洁效果会更强,结果混合后产生氯气,并冒出大量浓烟。
请尝试写出产生氯气的化学方程式。
2HCl+ NaClO = NaCl+H2O+ Cl2↑
气体 制取原理(方程式) 反应物状态 反应 条件 装置图
O2
CO2
2KClO3 2KCl + 3O2↑
2KMnO4 K2MnO4 + MnO2 + O2↑
2H2O2 2H2O + O2↑
CaCO3 + 2HCl = CaCl2 + CO2↑+H2O
固体+固体
固体+液体
固体+液体
加热
不加热
不加热
回顾初中所学的氧气、二氧化碳等气体的实验室制取方法,将相关内容填入下表。讨论氯气的制备装置和它们一样吗?如果一样,属于哪一种?如果不一样,请类比归纳氯气的制备装置。
(1)依据实验室O2与CO2制取、收集方法,请你观察这些装置有什么特点?
Zn与H2SO4反应制取H2
加热KMnO4
制取O2
CaCO3与盐酸反应制取CO2
(2)根据上述装置图归纳氧气、二氧化碳是怎样收集的?依据是什么?
提示:氧气用了排水法收集,二氧化碳和氯气都用了向上排空气法收集。
小结: 依据气体的密度、气体在水中的溶解性,以及是否与水反应,选择收集装置。
【思考与讨论】
结合O2、CO2等气体的实验室制取方法,讨论:
设计实验室制取气体的装置时,应考虑哪些方面?
考虑 装置的选取依据 和 装置的连接顺序:
1) 发生装置
反应物状态
反应条件
2) 净化装置
除杂、干燥
3) 收集装置
气体的密度
气体的溶解性
4) 尾气处理
气体的性质
(1)气体发生装置
选用依据
反应物状态
反应条件
固体加热型
固液不加热型
H2、CO2等
液-固、液-液加热型
Cl2等
O2等
(2) 净化装置
除杂/干燥装置
液态试剂
固态试剂
常见干燥剂:
浓硫酸、碱石灰、NaOH(S)、
、CaO、无水CaCl2 等
(3) 收集装置
① 排空气法:
② 排水法:
(4) 尾气处理装置
① 吸收式:
吸收溶解度较大气体 (如NH3、HCl等),要加装 安全瓶 或 防倒吸 装置,如:
② 燃烧式/收集式:
发生装置
除杂装置(如需要)
收集装置
尾气处理装置
(如需要)
反应物状态、反应条件
气体及所含杂质的性质
气体的密度、气体在水中溶解性、是否与水反应等
气体的性质
选择和组装实验室制取气体的装置时,应该考虑装置的选取依据和连接顺序。
总结:
实验目的
实验室制取纯净干燥的氯气
反应原理
核心元素→类别、化合价变化→试剂选择
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
装置设计
发生→除杂(如需要)→收集→尾气处理(如需要)
操作事项
药品加入的顺序,化学反应条件的控制等
△
氯气的实验室制法
方法总结:
1.据台湾媒体报道,北县中和市锦和中学的部分学生,在清扫厕所时误以为浴厕清洁剂(主要成分是盐酸)与漂白液混合,清洁效果会更强,结果混合后产生氯气,并冒出大量浓烟,九名学生疑似氯气吸入过多,身体不适被送往双和医院,诊治后幸无大碍。 请尝试写出产生氯气的化学方程式。
2HCl+ NaClO = NaCl+H2O+ Cl2↑
2.实验室制取并收集氯气,有关描述正确的是( )
A.发生装置应先加热再逐滴加入浓盐酸
B.饱和食盐水可以用饱和碳酸氢钠溶液代替
C.若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的氧化性较强
D.可以通过观察集气瓶中气体的颜色判断氯气是否收集满
D
3.实验室中为进行有关氯气的性质实验,需要4瓶体积为100mL的氯气。(常温下,氯气的密度为2.91 g/L。)
(1)制取4瓶氯气,理论上需要MnO2的质量是多少
(2)实际称取的MnO2固体的质量必须适当多于理论量,主要原因是什么
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
【答案】1.426g 实际称取的MnO2固体的质量必须适当多于理论量
【解析】需制备氯气0.1×2.91×4=1.164g,根据反应方程式可计算需要MnO2的质量是1.426g。实际实验中不能实现全部转化,要考虑损耗,所以实际称取的MnO2固体的质量必须适当多于理论量。
4.(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
下列收集Cl2的正确装置是__________。
C
2.对比上述C装置与教材中氯气收集的装置,有什么区别,哪个更合理。
C装置更合理。因为氯气和氢氧化钠反应后,会导致导管口压强减小,容易产生倒吸。
谢谢欣赏
