人教版必修一第三章 典型含铁物质的性质和转化
文档属性
| 名称 | 人教版必修一第三章 典型含铁物质的性质和转化 |

|
|
| 格式 | docx | ||
| 文件大小 | 214.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-04 20:53:47 | ||
图片预览




文档简介
单元名称与课时 典型含铁物质的性质与转化 3课时 探究补铁剂FeSO4的化学性质 硫酸亚铁的制备 检验补铁剂中铁的价态
单元课标要求
【课标要求】 1.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类,同类物质具有相似的性质,一定条件下各类物质可以相互转化,认识元素在物质中可以有不同的价态,可以通过氧化还原反应实现含有不同价态同种元素的物质的转化。 2.结合真实情境中的应用实例或通过实验探究了解铁及其重要化合物的主要性质,了解这些物质在生产生活中的应用。 【学业要求】 1.能依据物质类别和元素价态列举某种元素的典型代表物。能利用电离、离子反应、氧化还原反应等概念对常见的反应进行分类和分析说明。 2.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析解释有关实验现象。 3.能利用典型代表物的性质和反应,设计常见物质制备、分离、提纯检验等简单任务的方案。能从物质类别和元素价态变化的视角说明物质的转化路径。 4.能说明常见元素及其化合物的应用对社会发展的价值、对环境的影响。能有意识运用所学的知识或寻求相关证据参与社会性议题的讨论。 【相关教学指导思想和重要策略】 1.发挥核心概念对元素化合物学习的指导作用 2.紧密联系生产和生活实际,创设丰富多样的真实问题情境。
单元学习目标
在人教版高中化学必修教材中,本主题位于必修第一册第三章。根据课标及教材分析,确定如下单元学习目标: 1.通过有序书写含铁元素的物质的化学式的任务,发展从物质类别和元素价态两个角度认识物质的元素观,培养模型认知核心素养。 2.通过含铁元素物质的性质预测及制备任务,学习铁盐、亚铁盐的化学性质,掌握基于“价类”二维图,基于物质类别和元素价态两个角度预测和验证物质性质的思路方法,发展证据推理、模型认知及科学探究的核心素养。 3.通过铁单质、Fe(OH)2、Fe(OH)3、FeO、Fe2O3、Fe3O4的性质及用途梳理,进一步体会物质类别和元素价态视角研究物质性质的重要价值,体会性质决定用途的一般思路。 4.在实验探究过程中,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。
单元组织框架导图
第 1 课时 探究补铁剂FeSO4的化学性质
一、课时目标
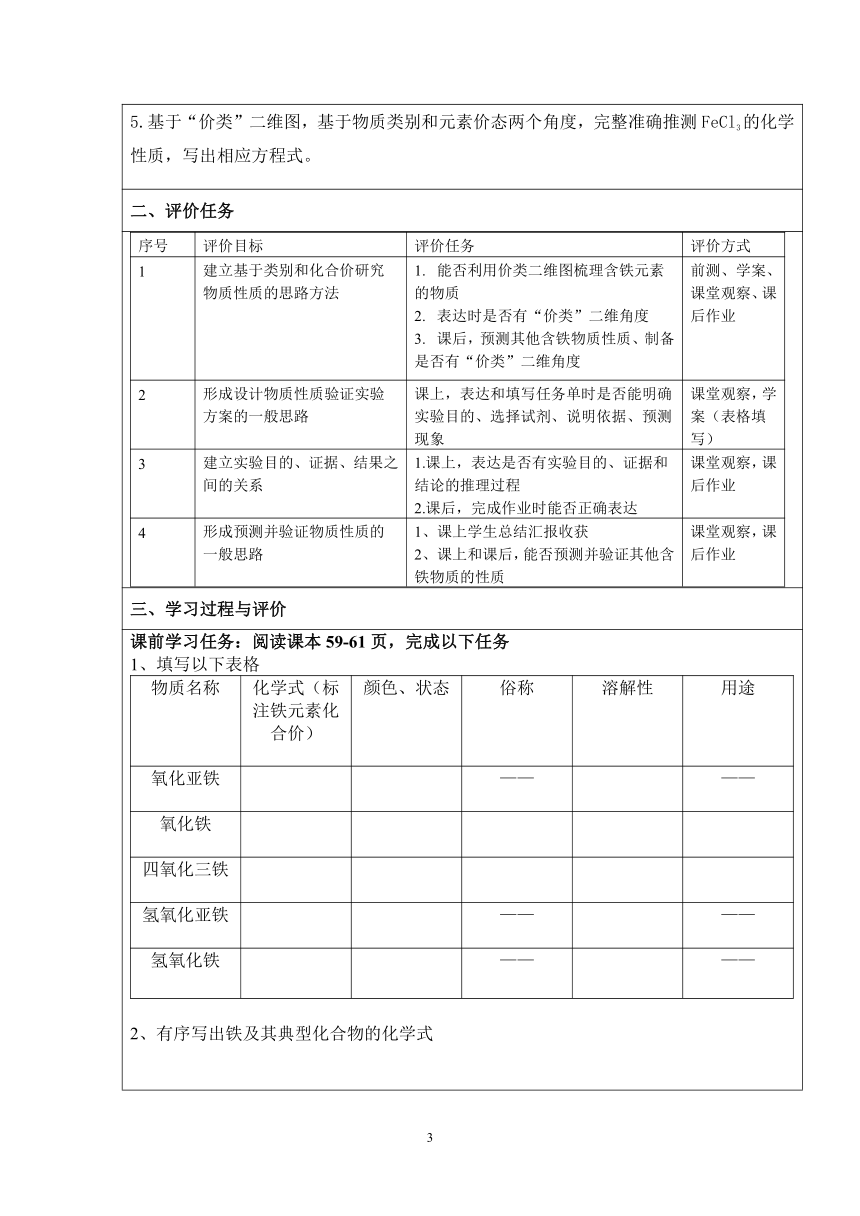
1.通过书写含铁元素的物质的化学式,从物质类别和元素价态两个角度完整有序写出含铁元素的典型物质的化学式。 2.通过“价类”二维图,基于物质类别和元素价态两个角度预测出FeSO4的化学性质, 3.通过预测出的FeSO4的化学性质,设计实验进行论证,并写出相应的化学方程式或离子方程式。 4.通过FeSO4性质实验的探究过程,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。 5.基于“价类”二维图,基于物质类别和元素价态两个角度,完整准确推测FeCl3的化学性质,写出相应方程式。
二、评价任务
序号评价目标评价任务评价方式1建立基于类别和化合价研究物质性质的思路方法能否利用价类二维图梳理含铁元素的物质 表达时是否有“价类”二维角度 课后,预测其他含铁物质性质、制备是否有“价类”二维角度前测、学案、课堂观察、课后作业2形成设计物质性质验证实验方案的一般思路课上,表达和填写任务单时是否能明确实验目的、选择试剂、说明依据、预测现象课堂观察,学案(表格填写)3建立实验目的、证据、结果之间的关系1.课上,表达是否有实验目的、证据和结论的推理过程 2.课后,完成作业时能否正确表达课堂观察,课后作业4形成预测并验证物质性质的一般思路课上学生总结汇报收获 课上和课后,能否预测并验证其他含铁物质的性质课堂观察,课后作业
三、学习过程与评价
课前学习任务:阅读课本59-61页,完成以下任务 1、填写以下表格 物质名称化学式(标注铁元素化合价)颜色、状态俗称溶解性用途氧化亚铁————氧化铁四氧化三铁氢氧化亚铁————氢氧化铁————
2、有序写出铁及其典型化合物的化学式 课中学习: 展示课前学习任务2:有序写出含铁物质的化学式(评价:能否利用价类二维图梳理含铁元素的物质) 学习活动一:基于价类二维图预测硫酸亚铁的化学性质,说出理论依据 评价任务一:预测硫酸亚铁的性质是否有“价类”二维角度,是否全面 学习活动二:根据提供的实验药品设计实验方案验证你的预测 实验药品:氯化钡溶液、氯化钠溶液、氢氧化钠溶液、盐酸、氯水、KMnO4溶液、Zn、Cu 实验目的 选择试剂选择理由预测产物和现象
评价任务二:表达和填写任务单时是否能明确实验目的、选择试剂、说明依据、预测现象。 学习活动三:动手实验,验证预测 实验目的及试剂实验现象结论和离子方程式验证 , 试剂 证明: 离子方程式:
评价任务三:实验操作是否规范,是否能准确描述实验现象及正确书写相应化学或离子方程式 学习活动四:归纳总结硫酸亚铁的化学性质,构建转化模型 评价任务四:知识迁移,根据价类二维图预测FeCl3的化学性质
四、作业与检测(深度认知的作业)
1、除去下列物质中含有的少量杂质,括号内为杂质,写出除杂试剂的化学式和反应的离子方程式 (1)FeCl3(FeCl2) , 。 (2)FeSO4(CuSO4) , 。 2、下列试剂不能使Fe2+转化为Fe3+是( ) ①新制氯水②NaCl溶液③酸性KMnO4溶液④H2O2溶液⑤盐酸⑥NaNO3溶液 A.①②③ B.①③④ C.②④⑤ D.②⑤⑥ 3、 已知有以下相互转化关系,试回答: (1)写出B的化学式:________,D的化学式:________。 (2)写出由E转变成F的化学方程式:______________________________________。 (3)写出由A转变成B的离子方程式:______________________________________。 (4)向G溶液加入A的离子方程式:________________________________________。
五、学后反思
通过本节内容学习,你对元素化合物学习有什么方法上的认识? 如何制备Fe(OH)2?
第 2课时 硫酸亚铁的制备
一、课时目标与单元地位
1.通过设计硫酸亚铁的制备实验,基于“价类”二维角度,说出多种方案,并分别阐述理论依据。 2.通过硫酸亚铁的制备任务,学习铁盐、亚铁盐的化学性质,构建含铁物质的转化模型,能正确书写相关化学方程式及离子方程式。 3.通过FeSO4的制备实验过程,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。
二、学习过程与评价
学习活动一:设计制备硫酸亚铁的方法,并阐述理论依据 方案一、 方案二、 方案三、 方案四、 评价任务一:是否运用“价类”二维思想设计硫酸亚铁的制备 学习活动二:动手实验制备硫酸亚铁,并验证产物,小组汇报。 评价任务二:检验学生动手能力及表达能力 学习活动三:总结反思,构建转化模型 评价任务三:画出价类二维图,并画出转化关系
三、作业与检测(深度认知的作业)
设计制备Fe(OH)2的方案: 2.在FeCl3和CuCl2混合溶液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( ) A.Fe2+ B.Fe3+和Fe2+ C.Cu2+和Fe2+ D.Cu2+ 3.要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳方案是( ) ①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液 A.①② B.③① C.③② D.①②③ 4.已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。 (1)写出A、C、F、G的化学式: A________,C________,F________,G________。 (2)检验D中阳离子的方法为______________________________________________。 (3)保存C溶液时要加固体A的原因___________________________________。 (4)写出下列转化的离子方程式或化学方程式。 ①E→F:________________________________________________________________。 ②C→D:________________________________________________________________。
学后反思
制备的FeSO4溶液如何保存?
第 3课时 补铁剂中铁元素价态确定
一、课时目标与单元地位
通过设计铁元素价态的实验,能完整准确描述出铁元素可能价态,培养严密的思维能力。 通过设计铁元素价态检验方案,写出Fe2+、Fe3+的检验方法 3.在实验探究过程中,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。
二、学习过程与评价
情境引入:缺铁性贫血大家都知道吧,缺了铁就要补铁。 实物展示:补铁药剂 学习活动一:预测补铁剂中铁元素的化合价 评价任务一:能完整表述出铁元素可能价态。 学习活动二:根据预测结果设计检验方案,并阐述理论依据 若含Fe3+,检验方法: 若含Fe2+,检验方法: 若为Fe3+和Fe2+,检验方法: 评价任务二:能写出Fe2+、Fe3+的检验方法 学习活动三:评价实验方案,选出最佳实验验方案 评价任务三:说出各种方案的优缺点,选出最佳方案 学习活动四:动手实验检验补铁药剂中铁的价态,并进行小组汇报 评价任务四:学生能规范操作,记录实验现象,汇报实验结果。 学习活动五:归纳总结,形成检验思路 评价任务五:归纳总结出上述思路
三、作业与检测(深度认知的作业)
1.某固体样品,检验含有Fe2O3的操作是________________________________。 2.检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( ) A.稀HNO3 B.溴水 C.KSCN溶液 D.酸性KMnO4溶液 3.下列离子的检验方法合理的是( ) A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+ C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+ D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明溶液中含有Fe2+,不含有Mg2+ 4.下列有关铁及其化合物的说法正确的是( ) A.Fe3O4可以制防锈油漆、红色颜料 B.铁与水蒸气在高温下反应的产物为Fe2O3和H2 C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤 D.Fe3+与KSCN反应产生红色沉淀
四、学后反思
学习完铁和铁的化合物,画出“价类”二维图,构建转化模型,写出有关化学方程式和离子方程式,总结反思元素化合物的学习方法。
单元课标要求
【课标要求】 1.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类,同类物质具有相似的性质,一定条件下各类物质可以相互转化,认识元素在物质中可以有不同的价态,可以通过氧化还原反应实现含有不同价态同种元素的物质的转化。 2.结合真实情境中的应用实例或通过实验探究了解铁及其重要化合物的主要性质,了解这些物质在生产生活中的应用。 【学业要求】 1.能依据物质类别和元素价态列举某种元素的典型代表物。能利用电离、离子反应、氧化还原反应等概念对常见的反应进行分类和分析说明。 2.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析解释有关实验现象。 3.能利用典型代表物的性质和反应,设计常见物质制备、分离、提纯检验等简单任务的方案。能从物质类别和元素价态变化的视角说明物质的转化路径。 4.能说明常见元素及其化合物的应用对社会发展的价值、对环境的影响。能有意识运用所学的知识或寻求相关证据参与社会性议题的讨论。 【相关教学指导思想和重要策略】 1.发挥核心概念对元素化合物学习的指导作用 2.紧密联系生产和生活实际,创设丰富多样的真实问题情境。
单元学习目标
在人教版高中化学必修教材中,本主题位于必修第一册第三章。根据课标及教材分析,确定如下单元学习目标: 1.通过有序书写含铁元素的物质的化学式的任务,发展从物质类别和元素价态两个角度认识物质的元素观,培养模型认知核心素养。 2.通过含铁元素物质的性质预测及制备任务,学习铁盐、亚铁盐的化学性质,掌握基于“价类”二维图,基于物质类别和元素价态两个角度预测和验证物质性质的思路方法,发展证据推理、模型认知及科学探究的核心素养。 3.通过铁单质、Fe(OH)2、Fe(OH)3、FeO、Fe2O3、Fe3O4的性质及用途梳理,进一步体会物质类别和元素价态视角研究物质性质的重要价值,体会性质决定用途的一般思路。 4.在实验探究过程中,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。
单元组织框架导图
第 1 课时 探究补铁剂FeSO4的化学性质
一、课时目标
1.通过书写含铁元素的物质的化学式,从物质类别和元素价态两个角度完整有序写出含铁元素的典型物质的化学式。 2.通过“价类”二维图,基于物质类别和元素价态两个角度预测出FeSO4的化学性质, 3.通过预测出的FeSO4的化学性质,设计实验进行论证,并写出相应的化学方程式或离子方程式。 4.通过FeSO4性质实验的探究过程,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。 5.基于“价类”二维图,基于物质类别和元素价态两个角度,完整准确推测FeCl3的化学性质,写出相应方程式。
二、评价任务
序号评价目标评价任务评价方式1建立基于类别和化合价研究物质性质的思路方法能否利用价类二维图梳理含铁元素的物质 表达时是否有“价类”二维角度 课后,预测其他含铁物质性质、制备是否有“价类”二维角度前测、学案、课堂观察、课后作业2形成设计物质性质验证实验方案的一般思路课上,表达和填写任务单时是否能明确实验目的、选择试剂、说明依据、预测现象课堂观察,学案(表格填写)3建立实验目的、证据、结果之间的关系1.课上,表达是否有实验目的、证据和结论的推理过程 2.课后,完成作业时能否正确表达课堂观察,课后作业4形成预测并验证物质性质的一般思路课上学生总结汇报收获 课上和课后,能否预测并验证其他含铁物质的性质课堂观察,课后作业
三、学习过程与评价
课前学习任务:阅读课本59-61页,完成以下任务 1、填写以下表格 物质名称化学式(标注铁元素化合价)颜色、状态俗称溶解性用途氧化亚铁————氧化铁四氧化三铁氢氧化亚铁————氢氧化铁————
2、有序写出铁及其典型化合物的化学式 课中学习: 展示课前学习任务2:有序写出含铁物质的化学式(评价:能否利用价类二维图梳理含铁元素的物质) 学习活动一:基于价类二维图预测硫酸亚铁的化学性质,说出理论依据 评价任务一:预测硫酸亚铁的性质是否有“价类”二维角度,是否全面 学习活动二:根据提供的实验药品设计实验方案验证你的预测 实验药品:氯化钡溶液、氯化钠溶液、氢氧化钠溶液、盐酸、氯水、KMnO4溶液、Zn、Cu 实验目的 选择试剂选择理由预测产物和现象
评价任务二:表达和填写任务单时是否能明确实验目的、选择试剂、说明依据、预测现象。 学习活动三:动手实验,验证预测 实验目的及试剂实验现象结论和离子方程式验证 , 试剂 证明: 离子方程式:
评价任务三:实验操作是否规范,是否能准确描述实验现象及正确书写相应化学或离子方程式 学习活动四:归纳总结硫酸亚铁的化学性质,构建转化模型 评价任务四:知识迁移,根据价类二维图预测FeCl3的化学性质
四、作业与检测(深度认知的作业)
1、除去下列物质中含有的少量杂质,括号内为杂质,写出除杂试剂的化学式和反应的离子方程式 (1)FeCl3(FeCl2) , 。 (2)FeSO4(CuSO4) , 。 2、下列试剂不能使Fe2+转化为Fe3+是( ) ①新制氯水②NaCl溶液③酸性KMnO4溶液④H2O2溶液⑤盐酸⑥NaNO3溶液 A.①②③ B.①③④ C.②④⑤ D.②⑤⑥ 3、 已知有以下相互转化关系,试回答: (1)写出B的化学式:________,D的化学式:________。 (2)写出由E转变成F的化学方程式:______________________________________。 (3)写出由A转变成B的离子方程式:______________________________________。 (4)向G溶液加入A的离子方程式:________________________________________。
五、学后反思
通过本节内容学习,你对元素化合物学习有什么方法上的认识? 如何制备Fe(OH)2?
第 2课时 硫酸亚铁的制备
一、课时目标与单元地位
1.通过设计硫酸亚铁的制备实验,基于“价类”二维角度,说出多种方案,并分别阐述理论依据。 2.通过硫酸亚铁的制备任务,学习铁盐、亚铁盐的化学性质,构建含铁物质的转化模型,能正确书写相关化学方程式及离子方程式。 3.通过FeSO4的制备实验过程,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。
二、学习过程与评价
学习活动一:设计制备硫酸亚铁的方法,并阐述理论依据 方案一、 方案二、 方案三、 方案四、 评价任务一:是否运用“价类”二维思想设计硫酸亚铁的制备 学习活动二:动手实验制备硫酸亚铁,并验证产物,小组汇报。 评价任务二:检验学生动手能力及表达能力 学习活动三:总结反思,构建转化模型 评价任务三:画出价类二维图,并画出转化关系
三、作业与检测(深度认知的作业)
设计制备Fe(OH)2的方案: 2.在FeCl3和CuCl2混合溶液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( ) A.Fe2+ B.Fe3+和Fe2+ C.Cu2+和Fe2+ D.Cu2+ 3.要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳方案是( ) ①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液 A.①② B.③① C.③② D.①②③ 4.已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。 (1)写出A、C、F、G的化学式: A________,C________,F________,G________。 (2)检验D中阳离子的方法为______________________________________________。 (3)保存C溶液时要加固体A的原因___________________________________。 (4)写出下列转化的离子方程式或化学方程式。 ①E→F:________________________________________________________________。 ②C→D:________________________________________________________________。
学后反思
制备的FeSO4溶液如何保存?
第 3课时 补铁剂中铁元素价态确定
一、课时目标与单元地位
通过设计铁元素价态的实验,能完整准确描述出铁元素可能价态,培养严密的思维能力。 通过设计铁元素价态检验方案,写出Fe2+、Fe3+的检验方法 3.在实验探究过程中,发展学生对实验目的、实验证据、实验结论之间关系的认识,提升证据推理与模型认知素养,发展学生科学探究水平。
二、学习过程与评价
情境引入:缺铁性贫血大家都知道吧,缺了铁就要补铁。 实物展示:补铁药剂 学习活动一:预测补铁剂中铁元素的化合价 评价任务一:能完整表述出铁元素可能价态。 学习活动二:根据预测结果设计检验方案,并阐述理论依据 若含Fe3+,检验方法: 若含Fe2+,检验方法: 若为Fe3+和Fe2+,检验方法: 评价任务二:能写出Fe2+、Fe3+的检验方法 学习活动三:评价实验方案,选出最佳实验验方案 评价任务三:说出各种方案的优缺点,选出最佳方案 学习活动四:动手实验检验补铁药剂中铁的价态,并进行小组汇报 评价任务四:学生能规范操作,记录实验现象,汇报实验结果。 学习活动五:归纳总结,形成检验思路 评价任务五:归纳总结出上述思路
三、作业与检测(深度认知的作业)
1.某固体样品,检验含有Fe2O3的操作是________________________________。 2.检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( ) A.稀HNO3 B.溴水 C.KSCN溶液 D.酸性KMnO4溶液 3.下列离子的检验方法合理的是( ) A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+ C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+ D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明溶液中含有Fe2+,不含有Mg2+ 4.下列有关铁及其化合物的说法正确的是( ) A.Fe3O4可以制防锈油漆、红色颜料 B.铁与水蒸气在高温下反应的产物为Fe2O3和H2 C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤 D.Fe3+与KSCN反应产生红色沉淀
四、学后反思
学习完铁和铁的化合物,画出“价类”二维图,构建转化模型,写出有关化学方程式和离子方程式,总结反思元素化合物的学习方法。
