水溶液中的离子反应与平衡单元教学设计
文档属性
| 名称 | 水溶液中的离子反应与平衡单元教学设计 |  | |
| 格式 | pptx | ||
| 文件大小 | 44.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-05 11:03:03 | ||
图片预览







文档简介
(共22张PPT)
基于核心素养目标下的单元整体教学设计
你真的了解喝的“水”么?
——水溶液中的离子反应与平衡
CONTENTS
目录
单元评价设计
单元背景分析
01
单元目标分析
02
单元结构设计
03
04
单元课时设计
04
05
PART ONE
单元背景分析
课标分析
教材分析
学情分析
01
单元背景分析
课标分析
内容要求
单元背景分析
课标分析
学业要求
单元背景分析
教材地位
本单元内容实际上是应用前一章所学习的化学平衡原理,探讨水溶液中离子间的相互作用,理论与实践兼而有之。电离平衡,水解平衡,沉淀溶解平衡的过程分析,体现了化学平衡理论的指导作用。pH的应用,盐类水解反应的应用,沉淀溶解平衡的应用,体现了理论知识在生产生活中的应用价值。酸碱中和滴定的介绍及相应的实验活动,则是在培养学生的实验操作技能,从教学功能看,这一章是前一章所有知识的延伸,拓展和巩固。
单元背景分析
教材分析
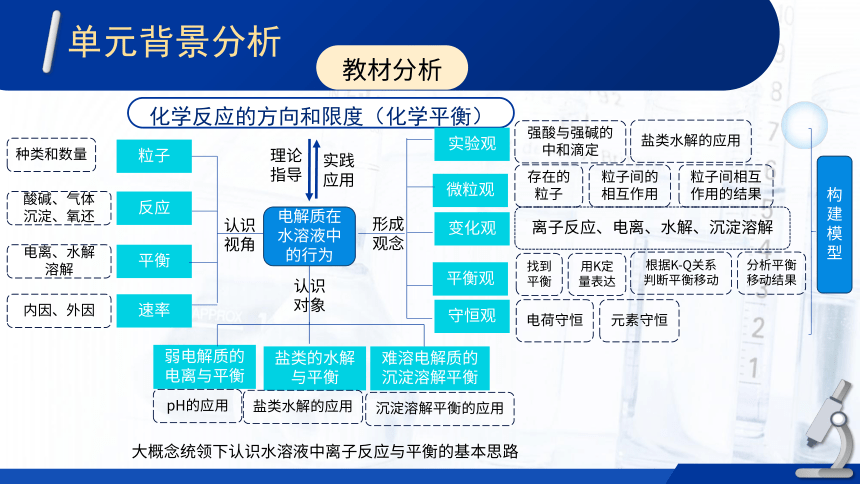
电解质在水溶液中的行为
微粒观
变化观
平衡观
存在的粒子
弱电解质的电离与平衡
盐类的水解与平衡
难溶电解质的沉淀溶解平衡
粒子间的相互作用
粒子间相互作用的结果
离子反应、电离、水解、沉淀溶解
找到平衡
用K定量表达
根据K-Q关系判断平衡移动
分析平衡移动结果
化学反应的方向和限度(化学平衡)
反应
粒子
平衡
速率
种类和数量
酸碱、气体
沉淀、氧还
电离、水解
溶解
内因、外因
认识视角
认识对象
形成观念
大概念统领下认识水溶液中离子反应与平衡的基本思路
理论指导
实践应用
pH的应用
盐类水解的应用
沉淀溶解平衡的应用
实验观
守恒观
强酸与强碱的中和滴定
盐类水解的应用
电荷守恒
元素守恒
构建模型
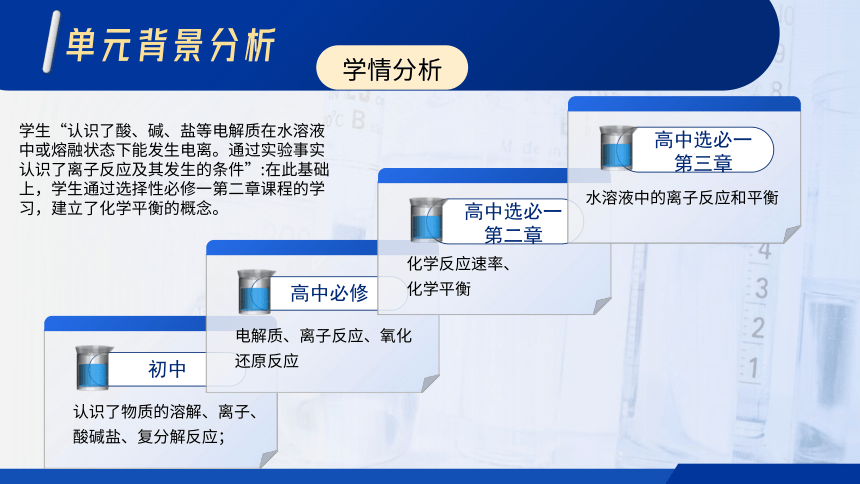
初中
认识了物质的溶解、离子、酸碱盐、复分解反应;
高中必修
电解质、离子反应、氧化还原反应
高中选必一
第二章
化学反应速率、
化学平衡
单元背景分析
学情分析
高中选必一
第三章
水溶液中的离子反应和平衡
学生“认识了酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。通过实验事实认识了离子反应及其发生的条件”:在此基础上,学生通过选择性必修一第二章课程的学习,建立了化学平衡的概念。
PART TWO
02
单元目标分析
单元目标
1. 能用化学用语正确表示水溶液中的离子反应与平衡,能通过实验证明水溶液中存在的离子平衡,能举例说明离子反应与平衡在生产、生活中的应用。
2. 能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。
3. 能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
4. 能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
评价目标
1. 通过对电离、水解、沉淀溶解平衡方程式的书写和点评,诊断并发展学生概念理解的水平。
2. 通过对水溶液中的离子平衡以及图像的应用、判断和分析,诊断并发展学生对水溶液中的离子反应与平衡的认识进阶和认识思路的结构化水平。
3. 通过对各类离子浓度、pH的计算,诊断并发展学生对化学价值的认识水平。
4.通过运用电荷守恒、元素守恒对实际问题的分析和解决,诊断并发展学生提炼学科观念和思维方法的水平。
单元目标分析
PART THREE
03
单元结构设计
认识生活中常见的各类饮用水、碳酸饮料等。
认识“水”
依据不同溶液的酸碱性选择合适的饮料
选择“水”
探究苏打水溶液呈碱性的原因,并自制气泡水、苏打水、气泡苏打水
自制“水”
单元结构设计
利用氢氧化镁处理酸性工业废水,制作水处理器
处理“水”
第4节
认知进阶
第3节
第2节
第1节
弱电解质的电离和电离平衡常数
水的电离和溶液的酸碱性
盐类水解以及盐类水解的应用
沉淀溶解平衡和溶解平衡的应用
单元结构设计
核心知识
任务线
情境线
核心素养
宏观辨识
微观探析
证据推理
模型认知
科学态度
社会责任
科学探究
创新意识
变化观念
平衡思想
弱电解质的电离与电离平衡
沉淀溶解平衡及应用
盐类的水解、水解平衡以及应用
水的电离与pH的计算
问题线
认识“水”:认识生活中常见的各类饮用水、碳酸饮料等
选择“水”:依据不同溶液的酸碱性选择合适的饮用水
自制“水”:探究苏打水溶液呈碱性的原因,并自制气泡水、苏打水、气泡苏打水
处理“水”:处理工业废水,自制水处理器
生活中不同的饮用水都有哪些区别?
碳酸饮料饮料的酸性从何而来?
任务一:饮用水pH的测定
任务二:理解纯水的电离过程
任务三:选择适合人体的饮料
任务四:探究苏打水呈碱性的原因水解的影响因素
任务五:探究盐类水解的影响因素
任务六:应用水解平衡原理解决问题
任务一:氢氧化镁处理酸性印染废水的原理探析。
任务二:氢氧化镁还可以除去废水中的 Cu2+等重金属离子的原理探析。
任务三:肾结石形成和预防的原理探析。
任务一:从分类的角度认识强弱电解质。
任务二:认识弱电解质的电离平衡,运用电离平衡描述和解释化学现象。
任务三:构建电离平衡模型,应用模型解释弱电解质在水溶液中发生的变化。
不同种饮用水,pH也不同,在生活中应当如何选择?
苏打水为什么呈现碱性?
如何自制气泡水、苏打水、气泡苏打水?
氢氧化镁作为难溶物为什么可以配成溶液做漱口水?它处理工业废水的原理是什么?
肾结石是如何形成的?
如何自制水处理器?
PART FOUR
04
单元课时设计
情境线 任务线 活动线 知识线 素养线
以认识生活中常见的各类饮饮品为载体,讨论弱电解质的电离平衡。 任务一:从分类的角度认识强弱电解质。 1. 用电导仪测量各种饮用水的导电情况。 2.分析各种饮用水导电能力不同的原因。 3.对比各种饮用水与NaCl、HCl等物质,得出弱电解质概念。 理解强电解质和弱电解质的概念 证据推理与模型认知
科学探究与创新意识
任务二:认识弱电解质的电离平衡,运用电离平衡描述和解释化学现象。 4.以醋酸为例分析弱电解质在水溶液中的电离有什么特点?并通过实验验证醋酸在水溶液中存在电离平衡。 5.掌握如何用化学用语表示醋酸的电离过程?并仿照化学平衡常数的表达式写出醋酸电离平衡常数的表达式。 通过弱电解质溶液电离平衡常数的计算判断弱电解质的强弱 宏观辨识与微观探析
变化观念与平衡思想
任务三:构建电离平衡模型,应用模型解释弱电解质在水溶液中发生的变化。 6.依据化学平衡移动原理,结合电离平衡常数,分析影响醋酸电离平衡的因素有哪些? 7.通过溶液导电实验证明溶液导电能力的强弱还与电解质的浓度等因素有关。 明确电解质的强弱是指电解质在水中的电离程度,而不是在水溶液中的导电能力 证据推理与模型认知
变化观念与平衡思想
第一节 电离平衡(2课时)
情境线 任务线 活动线 知识线 素养线
通过对市售的不同饮料的酸碱性的测定和计算,讨论溶液的酸碱性与pH的关系及水的电离过程。 任务一:饮用水pH的测定 1.回顾初中学习的pH的作用及测定方法,介绍pH试纸和pH计 2.对常见市售饮料的pH进行测定 3. 构建pH计算模型 pH的概念、测定及计算 证据推理与模型认知
任务二:理解纯水的电离过程 4.设计纯水的导电性实验并加以验证 5.构建水的电离的图示模型 6.借助水的电离平衡和pH计算模型认识水的离子积 水的电离 宏观辨识与微观探析
变化观念与平衡思想
科学探究与创新意识
任务三:选择适合人体的饮料 7.对溶液的酸碱性与pH进行再认识 8.阅读血液的酸碱平衡,讨论饮料酸碱性对人体的影响 pH的计算 pH调控的意义 变化观念与平衡思想
科学态度与社会责任
第二节 水的电离和溶液的pH(2课时)
第三节 盐类的水解(2课时)
情境线 任务线 活动线 知识线 素养线
以探究碱性苏打水、完成自制水为载体,研究讨论盐类水解平衡及其在生产生活中的应用。 任务一:探究苏打水呈碱性的原因水解的影响因素 1.基于苏打水理解盐类水解的原理。 2.基于NaHCO3探析盐类水解的规律。 盐类水解的原理和规律 宏观辨识与微观探析
变化观念与平衡思想
任务二:探究盐类水解的影响因素 3.迁移化学平衡移动的影响因素——反应物的性质和反应条件 4.探究反应条件对FeCl3水解平衡的影响 5.分析温度及胃酸对苏打水中存在平衡的影响 影响盐类水解的主要因素 宏观辨识与微观探析
变化观念与平衡思想
科学探究与创新意识
任务三:应用水解平衡原理解决问题 6.分析除油污应选择碳酸钠还是碳酸氢钠 7.理解泡沫灭火器的原理 盐类水解的应用 变化观念与平衡思想
科学态度与社会责任
情境线 任务线 活动线 知识线 素养线
以处理工业废水为载体,研究讨论沉淀溶解平衡及其在生产生活中的应用。 任务一:氢氧化镁处理酸性印染废水的原理探析。 1. 分析难溶的氢氧化镁为何会使溶液显碱性。 2.模拟酸性废水,并向废水中滴加氢氧化镁观察pH的变化。 3. 利用符号表征该平衡过程。 沉淀溶解平衡 溶度积常数 证据推理与模型认知
科学探究与创新意识
变化观念与平衡思想
任务二:氢氧化镁还可以除去废水中的 Cu2+等重金属离子的原理探析。 4.从平衡移动的角度解释除去Cu2+的过程,写出该反应的方程式。 5.通过计算判断经氢氧化镁处理过的废水是否达标。 6. 小组合作自制水处理器 沉淀溶解平衡的应用 宏观辨识与微观探析
变化观念与平衡思想
任务三:肾结石形成和预防的原理探析。 7.从网上查找形成肾结石和常见预防与治疗的方法。 8.解释为什么多喝水,多吃富含镁离子的蔬菜可以预防肾结石。 9. 利用沉淀溶解平衡的知识讨论与研究水垢的形成与去除。 沉淀溶解平衡的应用 科学态度与社会责任
第四节 沉淀溶解平衡(2课时)
PART FIVE
05
单元评价设计
表现性评价
通过课堂任务,如:测量各类饮品的导电性、pH等小组实验
能设计实验方案并完成实验(3)
操作正确,能利用实验结果分析原理(2)
能合作交流完成实验,并且可以反思成败(3)
纸笔性评价
通过评价测试题,一般考试时间75分钟,满分100分,设计难度系数0.75
了解知识,基本合格(1)
理解理论,熟练作答(2)
掌握知识,合理应用(3)
学习过程表现性评价
通过课后作业以及随堂检测
书写工整且正确(1)
书写工整正确,且逻辑思维强(2)
可灵活应用概念及原理,作答准确无误(3)
单元评价设计
需要评价的活动 评价目标 素养功能 及水平 评价标准(划分三个层次,随着分数增加,标准也提高) 评价方式
测量各种溶液的导电性、pH以及与活泼金属反应的快慢。 1.诊断学生对强弱电解质概念的认知情况。 证据推理与模型认知 1分 2分 3分
通过学生的发言及时反馈,形成表现性评价。
通过学生分析讨论以及完成分析报告进行反馈,形成学习过程表现性评价。
通过学生讨论分析,回答连续性的问题串,最终得出结论进行评价,形成表现性评价;通过章节测试或作业反馈进行评价,形成纸笔性评价。
通过学生实验探究、讨论发言进行反馈,形成表现性评价。
能基于实验现象能说出电解质有强弱之分。 能基于经验能预测实验现象,对现象进行解释并得出结论。 能基于经验、信息、理解,明确电解质的强弱是指电解质在水中的电离程度而非导电能力。 学习电离平衡常数 2. 诊断并发展学生推理应用已有知识的能力。 证据推理与模型认知;变化观念与平衡思想 能运用化学平衡理论来学习电离平衡。 能自主写出电离平衡常数表达式。 能分析弱电解质在水中达到电离平衡的过程并绘制出溶质分子、离子浓度随时间变化的曲线图。 运用弱电解质电离模型分析水的电离 3. 诊断并发展学生迁移应用知识的能力。 宏观辨识与微观探析;变化观念与平衡思想;科学探究与创新意识 能结合醋酸的电离对水的电离进行讨论,能清楚酸中水电离出的C(H+)、酸电离出的C(H+)及溶液中的C(H+)三者之间的关系。 能认识水的离子积常数以及表达式中C(H+)与C(OH-)的含义。 能认识水的离子积常数与温度之间的关系。 探究盐溶液呈现不同酸碱性的原因 4.诊断并发展学生提出问题-实验探究-得出结论-微观探析的学习思路的养成情况。 宏观辨识与微观探析;科学探究与创新意识 能形成盐类水解的分析模型。 能够探究影响盐类水解的因素。 能利用盐类水解的原理解决实际问题。 利用可溶电解质的溶解平衡建构难溶电解质的沉淀溶解平衡 5.诊断并发展学生定量分析平衡体系的能力。 宏观辨识与微观探析;科学探究与创新意识 能知道物质在水中溶与不容是相对的。 能理解溶度积常数与难溶电解质的性质和温度有关。 能运用化学平衡移动原理理解沉淀的生成、溶解及转化。 通过学生的分析报告进行反馈,形成学习过程表现性评价。
敬请斧正
基于核心素养目标下的单元整体教学设计
你真的了解喝的“水”么?
——水溶液中的离子反应与平衡
CONTENTS
目录
单元评价设计
单元背景分析
01
单元目标分析
02
单元结构设计
03
04
单元课时设计
04
05
PART ONE
单元背景分析
课标分析
教材分析
学情分析
01
单元背景分析
课标分析
内容要求
单元背景分析
课标分析
学业要求
单元背景分析
教材地位
本单元内容实际上是应用前一章所学习的化学平衡原理,探讨水溶液中离子间的相互作用,理论与实践兼而有之。电离平衡,水解平衡,沉淀溶解平衡的过程分析,体现了化学平衡理论的指导作用。pH的应用,盐类水解反应的应用,沉淀溶解平衡的应用,体现了理论知识在生产生活中的应用价值。酸碱中和滴定的介绍及相应的实验活动,则是在培养学生的实验操作技能,从教学功能看,这一章是前一章所有知识的延伸,拓展和巩固。
单元背景分析
教材分析
电解质在水溶液中的行为
微粒观
变化观
平衡观
存在的粒子
弱电解质的电离与平衡
盐类的水解与平衡
难溶电解质的沉淀溶解平衡
粒子间的相互作用
粒子间相互作用的结果
离子反应、电离、水解、沉淀溶解
找到平衡
用K定量表达
根据K-Q关系判断平衡移动
分析平衡移动结果
化学反应的方向和限度(化学平衡)
反应
粒子
平衡
速率
种类和数量
酸碱、气体
沉淀、氧还
电离、水解
溶解
内因、外因
认识视角
认识对象
形成观念
大概念统领下认识水溶液中离子反应与平衡的基本思路
理论指导
实践应用
pH的应用
盐类水解的应用
沉淀溶解平衡的应用
实验观
守恒观
强酸与强碱的中和滴定
盐类水解的应用
电荷守恒
元素守恒
构建模型
初中
认识了物质的溶解、离子、酸碱盐、复分解反应;
高中必修
电解质、离子反应、氧化还原反应
高中选必一
第二章
化学反应速率、
化学平衡
单元背景分析
学情分析
高中选必一
第三章
水溶液中的离子反应和平衡
学生“认识了酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。通过实验事实认识了离子反应及其发生的条件”:在此基础上,学生通过选择性必修一第二章课程的学习,建立了化学平衡的概念。
PART TWO
02
单元目标分析
单元目标
1. 能用化学用语正确表示水溶液中的离子反应与平衡,能通过实验证明水溶液中存在的离子平衡,能举例说明离子反应与平衡在生产、生活中的应用。
2. 能从电离、离子反应、化学平衡的角度分析溶液的性质,如酸碱性、导电性等。
3. 能进行溶液pH的简单计算,能正确测定溶液pH,能调控溶液的酸碱性。能选择实例说明溶液pH的调控在工农业生产和科学研究中的重要作用。
4. 能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
评价目标
1. 通过对电离、水解、沉淀溶解平衡方程式的书写和点评,诊断并发展学生概念理解的水平。
2. 通过对水溶液中的离子平衡以及图像的应用、判断和分析,诊断并发展学生对水溶液中的离子反应与平衡的认识进阶和认识思路的结构化水平。
3. 通过对各类离子浓度、pH的计算,诊断并发展学生对化学价值的认识水平。
4.通过运用电荷守恒、元素守恒对实际问题的分析和解决,诊断并发展学生提炼学科观念和思维方法的水平。
单元目标分析
PART THREE
03
单元结构设计
认识生活中常见的各类饮用水、碳酸饮料等。
认识“水”
依据不同溶液的酸碱性选择合适的饮料
选择“水”
探究苏打水溶液呈碱性的原因,并自制气泡水、苏打水、气泡苏打水
自制“水”
单元结构设计
利用氢氧化镁处理酸性工业废水,制作水处理器
处理“水”
第4节
认知进阶
第3节
第2节
第1节
弱电解质的电离和电离平衡常数
水的电离和溶液的酸碱性
盐类水解以及盐类水解的应用
沉淀溶解平衡和溶解平衡的应用
单元结构设计
核心知识
任务线
情境线
核心素养
宏观辨识
微观探析
证据推理
模型认知
科学态度
社会责任
科学探究
创新意识
变化观念
平衡思想
弱电解质的电离与电离平衡
沉淀溶解平衡及应用
盐类的水解、水解平衡以及应用
水的电离与pH的计算
问题线
认识“水”:认识生活中常见的各类饮用水、碳酸饮料等
选择“水”:依据不同溶液的酸碱性选择合适的饮用水
自制“水”:探究苏打水溶液呈碱性的原因,并自制气泡水、苏打水、气泡苏打水
处理“水”:处理工业废水,自制水处理器
生活中不同的饮用水都有哪些区别?
碳酸饮料饮料的酸性从何而来?
任务一:饮用水pH的测定
任务二:理解纯水的电离过程
任务三:选择适合人体的饮料
任务四:探究苏打水呈碱性的原因水解的影响因素
任务五:探究盐类水解的影响因素
任务六:应用水解平衡原理解决问题
任务一:氢氧化镁处理酸性印染废水的原理探析。
任务二:氢氧化镁还可以除去废水中的 Cu2+等重金属离子的原理探析。
任务三:肾结石形成和预防的原理探析。
任务一:从分类的角度认识强弱电解质。
任务二:认识弱电解质的电离平衡,运用电离平衡描述和解释化学现象。
任务三:构建电离平衡模型,应用模型解释弱电解质在水溶液中发生的变化。
不同种饮用水,pH也不同,在生活中应当如何选择?
苏打水为什么呈现碱性?
如何自制气泡水、苏打水、气泡苏打水?
氢氧化镁作为难溶物为什么可以配成溶液做漱口水?它处理工业废水的原理是什么?
肾结石是如何形成的?
如何自制水处理器?
PART FOUR
04
单元课时设计
情境线 任务线 活动线 知识线 素养线
以认识生活中常见的各类饮饮品为载体,讨论弱电解质的电离平衡。 任务一:从分类的角度认识强弱电解质。 1. 用电导仪测量各种饮用水的导电情况。 2.分析各种饮用水导电能力不同的原因。 3.对比各种饮用水与NaCl、HCl等物质,得出弱电解质概念。 理解强电解质和弱电解质的概念 证据推理与模型认知
科学探究与创新意识
任务二:认识弱电解质的电离平衡,运用电离平衡描述和解释化学现象。 4.以醋酸为例分析弱电解质在水溶液中的电离有什么特点?并通过实验验证醋酸在水溶液中存在电离平衡。 5.掌握如何用化学用语表示醋酸的电离过程?并仿照化学平衡常数的表达式写出醋酸电离平衡常数的表达式。 通过弱电解质溶液电离平衡常数的计算判断弱电解质的强弱 宏观辨识与微观探析
变化观念与平衡思想
任务三:构建电离平衡模型,应用模型解释弱电解质在水溶液中发生的变化。 6.依据化学平衡移动原理,结合电离平衡常数,分析影响醋酸电离平衡的因素有哪些? 7.通过溶液导电实验证明溶液导电能力的强弱还与电解质的浓度等因素有关。 明确电解质的强弱是指电解质在水中的电离程度,而不是在水溶液中的导电能力 证据推理与模型认知
变化观念与平衡思想
第一节 电离平衡(2课时)
情境线 任务线 活动线 知识线 素养线
通过对市售的不同饮料的酸碱性的测定和计算,讨论溶液的酸碱性与pH的关系及水的电离过程。 任务一:饮用水pH的测定 1.回顾初中学习的pH的作用及测定方法,介绍pH试纸和pH计 2.对常见市售饮料的pH进行测定 3. 构建pH计算模型 pH的概念、测定及计算 证据推理与模型认知
任务二:理解纯水的电离过程 4.设计纯水的导电性实验并加以验证 5.构建水的电离的图示模型 6.借助水的电离平衡和pH计算模型认识水的离子积 水的电离 宏观辨识与微观探析
变化观念与平衡思想
科学探究与创新意识
任务三:选择适合人体的饮料 7.对溶液的酸碱性与pH进行再认识 8.阅读血液的酸碱平衡,讨论饮料酸碱性对人体的影响 pH的计算 pH调控的意义 变化观念与平衡思想
科学态度与社会责任
第二节 水的电离和溶液的pH(2课时)
第三节 盐类的水解(2课时)
情境线 任务线 活动线 知识线 素养线
以探究碱性苏打水、完成自制水为载体,研究讨论盐类水解平衡及其在生产生活中的应用。 任务一:探究苏打水呈碱性的原因水解的影响因素 1.基于苏打水理解盐类水解的原理。 2.基于NaHCO3探析盐类水解的规律。 盐类水解的原理和规律 宏观辨识与微观探析
变化观念与平衡思想
任务二:探究盐类水解的影响因素 3.迁移化学平衡移动的影响因素——反应物的性质和反应条件 4.探究反应条件对FeCl3水解平衡的影响 5.分析温度及胃酸对苏打水中存在平衡的影响 影响盐类水解的主要因素 宏观辨识与微观探析
变化观念与平衡思想
科学探究与创新意识
任务三:应用水解平衡原理解决问题 6.分析除油污应选择碳酸钠还是碳酸氢钠 7.理解泡沫灭火器的原理 盐类水解的应用 变化观念与平衡思想
科学态度与社会责任
情境线 任务线 活动线 知识线 素养线
以处理工业废水为载体,研究讨论沉淀溶解平衡及其在生产生活中的应用。 任务一:氢氧化镁处理酸性印染废水的原理探析。 1. 分析难溶的氢氧化镁为何会使溶液显碱性。 2.模拟酸性废水,并向废水中滴加氢氧化镁观察pH的变化。 3. 利用符号表征该平衡过程。 沉淀溶解平衡 溶度积常数 证据推理与模型认知
科学探究与创新意识
变化观念与平衡思想
任务二:氢氧化镁还可以除去废水中的 Cu2+等重金属离子的原理探析。 4.从平衡移动的角度解释除去Cu2+的过程,写出该反应的方程式。 5.通过计算判断经氢氧化镁处理过的废水是否达标。 6. 小组合作自制水处理器 沉淀溶解平衡的应用 宏观辨识与微观探析
变化观念与平衡思想
任务三:肾结石形成和预防的原理探析。 7.从网上查找形成肾结石和常见预防与治疗的方法。 8.解释为什么多喝水,多吃富含镁离子的蔬菜可以预防肾结石。 9. 利用沉淀溶解平衡的知识讨论与研究水垢的形成与去除。 沉淀溶解平衡的应用 科学态度与社会责任
第四节 沉淀溶解平衡(2课时)
PART FIVE
05
单元评价设计
表现性评价
通过课堂任务,如:测量各类饮品的导电性、pH等小组实验
能设计实验方案并完成实验(3)
操作正确,能利用实验结果分析原理(2)
能合作交流完成实验,并且可以反思成败(3)
纸笔性评价
通过评价测试题,一般考试时间75分钟,满分100分,设计难度系数0.75
了解知识,基本合格(1)
理解理论,熟练作答(2)
掌握知识,合理应用(3)
学习过程表现性评价
通过课后作业以及随堂检测
书写工整且正确(1)
书写工整正确,且逻辑思维强(2)
可灵活应用概念及原理,作答准确无误(3)
单元评价设计
需要评价的活动 评价目标 素养功能 及水平 评价标准(划分三个层次,随着分数增加,标准也提高) 评价方式
测量各种溶液的导电性、pH以及与活泼金属反应的快慢。 1.诊断学生对强弱电解质概念的认知情况。 证据推理与模型认知 1分 2分 3分
通过学生的发言及时反馈,形成表现性评价。
通过学生分析讨论以及完成分析报告进行反馈,形成学习过程表现性评价。
通过学生讨论分析,回答连续性的问题串,最终得出结论进行评价,形成表现性评价;通过章节测试或作业反馈进行评价,形成纸笔性评价。
通过学生实验探究、讨论发言进行反馈,形成表现性评价。
能基于实验现象能说出电解质有强弱之分。 能基于经验能预测实验现象,对现象进行解释并得出结论。 能基于经验、信息、理解,明确电解质的强弱是指电解质在水中的电离程度而非导电能力。 学习电离平衡常数 2. 诊断并发展学生推理应用已有知识的能力。 证据推理与模型认知;变化观念与平衡思想 能运用化学平衡理论来学习电离平衡。 能自主写出电离平衡常数表达式。 能分析弱电解质在水中达到电离平衡的过程并绘制出溶质分子、离子浓度随时间变化的曲线图。 运用弱电解质电离模型分析水的电离 3. 诊断并发展学生迁移应用知识的能力。 宏观辨识与微观探析;变化观念与平衡思想;科学探究与创新意识 能结合醋酸的电离对水的电离进行讨论,能清楚酸中水电离出的C(H+)、酸电离出的C(H+)及溶液中的C(H+)三者之间的关系。 能认识水的离子积常数以及表达式中C(H+)与C(OH-)的含义。 能认识水的离子积常数与温度之间的关系。 探究盐溶液呈现不同酸碱性的原因 4.诊断并发展学生提出问题-实验探究-得出结论-微观探析的学习思路的养成情况。 宏观辨识与微观探析;科学探究与创新意识 能形成盐类水解的分析模型。 能够探究影响盐类水解的因素。 能利用盐类水解的原理解决实际问题。 利用可溶电解质的溶解平衡建构难溶电解质的沉淀溶解平衡 5.诊断并发展学生定量分析平衡体系的能力。 宏观辨识与微观探析;科学探究与创新意识 能知道物质在水中溶与不容是相对的。 能理解溶度积常数与难溶电解质的性质和温度有关。 能运用化学平衡移动原理理解沉淀的生成、溶解及转化。 通过学生的分析报告进行反馈,形成学习过程表现性评价。
敬请斧正
