基于盐碱地治理的盐类水解教学设计
文档属性
| 名称 | 基于盐碱地治理的盐类水解教学设计 |

|
|
| 格式 | doc | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-07 00:00:00 | ||
图片预览


文档简介
项目名称 基于盐碱地治理的盐类的水解教学 年级 高二
课时 1课时
项目背景 课标要求 内容要求:认识盐类水解的原理。学业要求:能用化学用语正确表示溶液中的离子反应与平衡;能从离子反应、平衡角度分析溶液的性质,如酸碱性等。
内容分析 盐类的水解平衡是建立在弱电解质的电离平衡和水的电离平衡基础之上的叠加平衡体系,是帮助学生从单平衡体系向多平衡体系发展的重要环节。进一步发展学生微粒观,平衡观,提高学生解决复杂问题的能力。以内蒙古“以废治废”盐碱地的治理为微项目,从脱硫钢渣的酸性和盐碱地的碱性两个方面展开讨论。将实际问题转化为硫酸铁溶液显酸性和碳酸钠溶液显碱性的化学问题上来。认识盐类的水解原理及规律,提高学生分析解决实际问题的能力。
学情分析 学生已经有了 “化学平衡”、“弱电解质电离平衡”、“水的电离平衡”等基本概念和理论,熟知判断溶液酸碱性的方法,具有一定的平衡观与微粒观。学生对盐类水解平衡的微观原理认知角度比较单一,往往只考虑弱电解质的生成,忽略水的电离平衡。对此,利用强酸弱碱盐进行实验探究,通过宏观辨识到微观探析自主搭建盐类水解模型,再通过强碱弱酸盐完善盐类水解模型,认识盐类水解的本质。
项目学习目标 1.通过实验探究学习,能够表述正盐溶液显酸碱性的原理,概括出盐类水解的概念。2.通过化学用语表示盐类的水解,能够准确书写盐类的水解离子方程式。3.通过“坐标纵向分析法”,能够总结盐类水解的一般规律 。4.通过“化学施肥策略”的分析讨论,感受盐类水解的社会价值。
重难点 1.通过实验探究学习,能够表述正盐溶液显酸碱性的原理,概括出盐类水解的概念。2.通过化学用语表示盐类的水解,能够准确书写盐类的水解离子方程式。
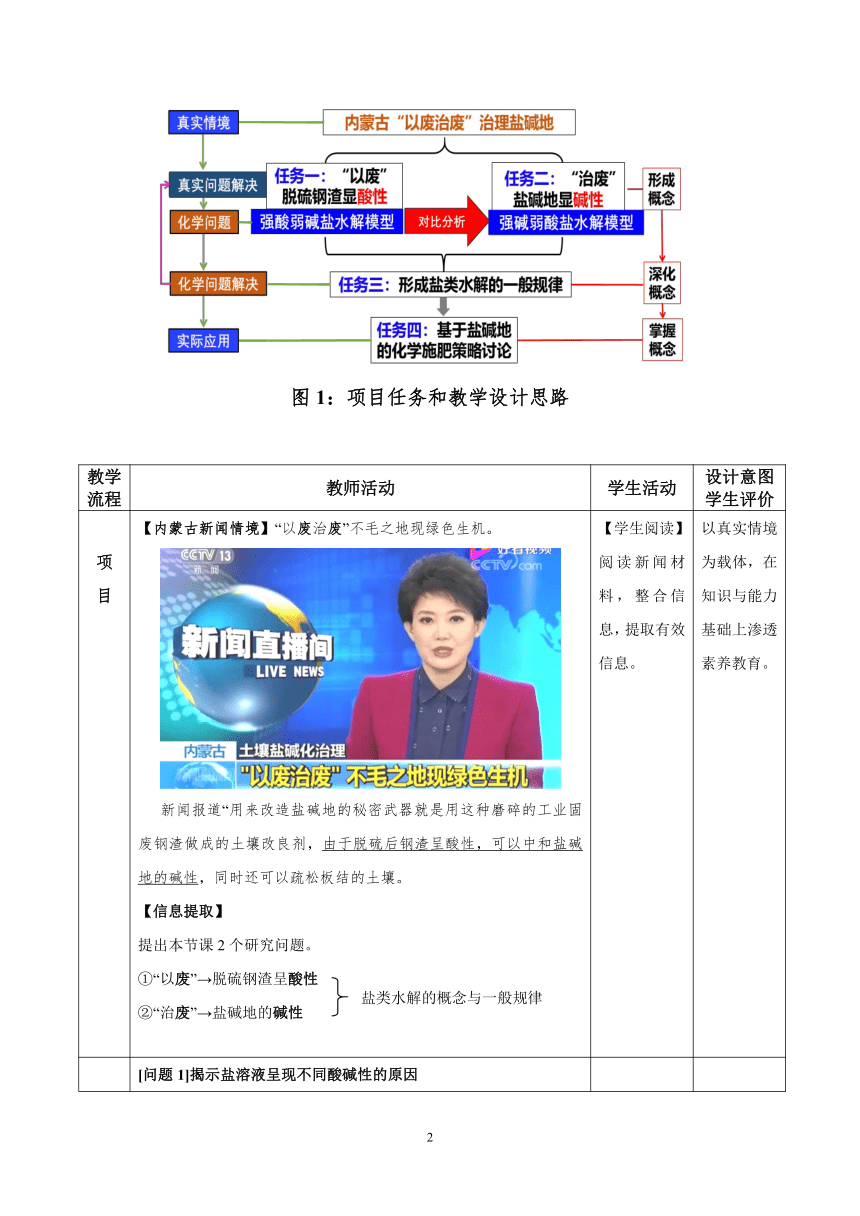
教学方法 在真实情境问题下,设计任务驱动,利用实验探究活动进行项目化学习。教学思路:宏观辨识→微观探析→化学表征→知识迁移
项目任务和教学流程:
图1:项目任务和教学设计思路
教学流程 教师活动 学生活动 设计意图学生评价
项目 【内蒙古新闻情境】“以废治废”不毛之地现绿色生机。新闻报道“用来改造盐碱地的秘密武器就是用这种磨碎的工业固废钢渣做成的土壤改良剂,由于脱硫后钢渣呈酸性,可以中和盐碱地的碱性,同时还可以疏松板结的土壤。【信息提取】提出本节课2个研究问题。①“以废”→脱硫钢渣呈酸性 ②“治废”→盐碱地的碱性 【学生阅读】阅读新闻材料,整合信息,提取有效信息。 以真实情境为载体,在知识与能力基础上渗透素养教育。
任务一以废∣探究脱硫后钢渣的酸性 [问题1]揭示盐溶液呈现不同酸碱性的原因【脱硫钢渣(钢渣土壤改良剂)信息转化】钢渣主要成分:CaO、Fe2O3、FeO、Al2O3、MgO、SiO2等脱硫产物:CaSO4、Fe2(SO4)3、Al2(SO4)3、MgSO4、SiO2等【实验室模拟钢渣土壤改良剂】(宏观辨识)配制Fe2(SO4)3溶液(不加酸酸化),进行化学分析。用pH计测量0.1mol/L的Fe2(SO4)3溶液pH值。实验探究1:实验探究Fe2(SO4)3溶液显酸性的原理。实验原理:已知Cu + 2Fe3+=== 2Fe2++ Cu2+猜想Mg + 2Fe3+=== 2Fe2++ Mg2+ 实验操作:取适量Fe2(SO4)3溶液于试管中,加入用砂纸打磨过的Mg条。观察实验现象。实验现象:①立即产生大量气泡(检验为H2) ②一段时间后出现红褐色沉淀结果分析:Fe(OH)3 → OH- H2 → H+【建立多元弱碱盐Fe2(SO4)3的水解模型】(微观探析)“多元弱碱盐Fe2(SO4)3的水解模型”*学生总结盐类水解的定义及实质。概念:盐电离出的离子在水中与水电离出的OH-或 H+生成弱电解质的过程,叫做盐类的水解。实质:促进水的电离 【学生回顾】Cu+2Fe3+=== 2Fe2++ Cu2+【学生回答】观察实验,描述实验现象【学生思考】学生思考“意外”现象对盐类水解原理的启示。【学生建构】学生从微粒水平,平衡水平描述盐类的水解原理【学生总结】学生总结归纳盐类水解的概念。 科学只有推翻旧理论,才能向前走。注重培养学生科学态度,提高学生关键能力。在高阶思维培育中内化学科本质价值。从“宏-微-符”三重表征上完成学生对盐类水解本质的认识进阶。落实目标1落实目标2
任务二治废∣探究盐碱地的碱性 [问题2]建立盐类水解的认知模型【身边的化学】实验探究2:从室外取少量内蒙古土壤于小烧杯中,加水溶解,静置分层,用pH计测其pH值。【实验室模拟盐碱地】配制0.1mol/LNa2CO3溶液,用pH试纸测其pH。【建立多元弱酸盐Na2CO3的水解模型】“多元弱酸盐Na2CO3的水解模型” *学生归纳总结盐类水解的条件:“弱根”和水。*学生归纳总结简单水解离子方程式的书写注意事项。模型建构: 盐 + H2O 碱 + 酸 △H>0注意事项:①一般水解用“ ”。②一般水解程度小,不用“↓、↑、= ”。 ③多元弱酸盐分步水解,以第一步为主。练一练:请同学们分析AlCl3、Na2S和CH3COONa溶液的酸碱性,并写出水解离子方程式。 【学生完善】学生对比分析多元弱碱盐和多元弱酸盐的水解。【学生总结】学生总结归纳盐类水解的条件。【学生练习】总结归纳简单水解离子方程式的书写规则,练习书写水解离子方程式。 诊断并发展对盐类水解认识思路的结构化水平,进一步完善盐类水解模型,提高学生证据推理与模型认知素养水平。落实目标1落实目标2
任务三盐类水解一般规律探究 【问题3】寻找盐类水解的一般规律活动1:小组实验,用pH试纸测试物质的量浓度均为0.1mol/L的CH3COONa溶液、Na2SO4溶液、NH4Cl溶液、Al2(SO4)3溶液的pH,探究盐类的水解规律。“盐类水解规律分布图” 【学生实验】小组实验,并分享结论。【学生讨论】利用坐标分析法,观察不同盐溶液的pH,归纳总结出盐类水解的一般规律。 一方面,利用坐标划分区域,从盐的类型寻找规律。另一方面,利用纵坐标表示pH,体现水解能力的强弱。直观体现盐类水解的规律。落实目标3
任务四化学施肥策略讨 论 【问题4】知识迁移与应用活动2:基于酸碱性的化学施肥策略讨论。根据盐类水解的一般规律,请同学们讨论分析以下问题:问题1:现有NH4Cl、K2CO3、FeSO4化肥,请同学们判断其水溶液的酸碱性。 问题2:思考盐碱地适合焚烧秸秆吗?问题3:你怎么理解“灰混粪,粪混灰,灰粪相混损肥分” 【学生回答】依据盐类水解的原理和规律,小组讨论分享。 利用盐类水解原理解决化肥施用的实际问题。培养学生科学态度和社会责任。落实目标4
板书设计 3-3-1盐类的水解一、盐类的水解原理 1.定义:盐电离出的离子在水中与水电离出的OH-或 H+生成弱电解质的过程2实质:促进水的电离3条件:“弱根”和“水”三、盐类的水解规律二、简单水解方程式书写 盐 + H2O 碱 + 酸 △H>0特点:一般水解程度小,不用“↓、↑、= ”。 (1)多元弱碱盐“一步水解”Fe3+ + 3H2O Fe(OH)3+ 3H+(2)多元弱酸盐“分步水解”CO32-+ H2O HCO3-+ OH-(主)HCO3-+ H2O H2CO3+ OH-(次)
项目检测 矿源黄腐酸钾是一种新型功能性肥料,能刺激作物快生根,多生根,健壮成长,增加叶绿素,改良土壤团结结构,疏松土壤。
作业设计 钢渣是冶炼工业中产生的废渣,其中产生率为粗钢产量的8%-15%,2012年全世界排钢渣量约1.8亿t。中国的钢渣产生量随着钢铁工业的快速发展而迅速递增,因此钢铁企业废渣的处理和资源化利用问题也越来越受重视。请同学们查阅资料,分析废钢渣处理后作净水剂的原理。
【项目反思】
该项目学习以“情境—问题—知识—素养”作为教学线索。通过对“以废治废”真实情境的研究,帮助学生分别建立盐碱地(多元弱酸盐溶液)显碱性和脱硫钢渣(多元弱碱盐溶液)显酸性的水解模型,同时提高学生分析和解决问题的能力。设计教学任务链,利用实验探究活动研究脱硫钢渣显酸性的原理(概念形成)→利用对比分析方法研究盐碱地显碱性的原理(概念完善)→小组活动探究盐类水解的一般规律(概念深化)→小组讨论盐碱地施肥策略(概念应用)。教师也可课后拓宽知识应用的角度,打开学生的视野,比如认识钢铁除锈剂,泡沫灭火器,泡腾崩解剂等。
盐类水解的概念与一般规律
元素守恒: 水参与反应
溶液显酸性:破坏了水的电离平衡
Fe3+结合OH-生成弱电解质
溶液显
酸性
电离平衡关系
Fe2(SO4)3= 2Fe3+ + 3SO42- H2O OH-+ H+
Fe(OH)3
促进水电离c(H+)>c(OH–)
+
水解离子方程式
盐 + H2O 酸 + 碱
Fe3+ + 3H2O Fe(OH)3+ 3H+
微粒
平衡
宏观
符号
CO32-结合H+生成弱电解质
溶液显
碱性
水解离子方程式
盐 + H2O 酸 + 碱
CO32-+ H2O HCO3-+ OH-
HCO3-+ H2O H2CO3+ OH-(次)
电离平衡关系
Na2CO3= 2Na+ +CO32- H2O OH-+ H+
HCO3- H2CO3
促进水电离c(OH–)>c(H+)
+
微粒
平衡
宏观
符号
弱根
弱碱— — 阳离子:NH4+ 等
弱酸
酸根:CH3COO– 等
酸式酸根:HCO3– 等
2.谁强显谁性
3.越弱
越水解
1413121110 9
8
7
6
5
4
3
2
1
0
8
8
13
12
11
10
9
8
7
6
5
4
3
2
1
0
碱性
中性
酸性
Fe2(SO4)3
Al2(SO4)3
NH4Cl
CH3COONa
Na2CO3
Na2SO4
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
强碱弱酸盐强碱弱酸盐强碱弱酸盐
强酸强碱盐
强酸弱碱盐
1.有弱
才水解
强酸 弱碱盐
强碱 弱酸盐
有弱才水解
越弱越水解
谁强显谁性
请同学们思考:黄腐酸是一类大分子有机弱酸混合物,试判断该化肥的水溶液酸碱性,并与产品信息对照是否统一。
水解
硫酸
钢渣(Fe2O3、Al2O3)
Fe2(SO4)3、Al2(SO4)3
Fe(OH)3胶体、Al(OH)3胶体
课时 1课时
项目背景 课标要求 内容要求:认识盐类水解的原理。学业要求:能用化学用语正确表示溶液中的离子反应与平衡;能从离子反应、平衡角度分析溶液的性质,如酸碱性等。
内容分析 盐类的水解平衡是建立在弱电解质的电离平衡和水的电离平衡基础之上的叠加平衡体系,是帮助学生从单平衡体系向多平衡体系发展的重要环节。进一步发展学生微粒观,平衡观,提高学生解决复杂问题的能力。以内蒙古“以废治废”盐碱地的治理为微项目,从脱硫钢渣的酸性和盐碱地的碱性两个方面展开讨论。将实际问题转化为硫酸铁溶液显酸性和碳酸钠溶液显碱性的化学问题上来。认识盐类的水解原理及规律,提高学生分析解决实际问题的能力。
学情分析 学生已经有了 “化学平衡”、“弱电解质电离平衡”、“水的电离平衡”等基本概念和理论,熟知判断溶液酸碱性的方法,具有一定的平衡观与微粒观。学生对盐类水解平衡的微观原理认知角度比较单一,往往只考虑弱电解质的生成,忽略水的电离平衡。对此,利用强酸弱碱盐进行实验探究,通过宏观辨识到微观探析自主搭建盐类水解模型,再通过强碱弱酸盐完善盐类水解模型,认识盐类水解的本质。
项目学习目标 1.通过实验探究学习,能够表述正盐溶液显酸碱性的原理,概括出盐类水解的概念。2.通过化学用语表示盐类的水解,能够准确书写盐类的水解离子方程式。3.通过“坐标纵向分析法”,能够总结盐类水解的一般规律 。4.通过“化学施肥策略”的分析讨论,感受盐类水解的社会价值。
重难点 1.通过实验探究学习,能够表述正盐溶液显酸碱性的原理,概括出盐类水解的概念。2.通过化学用语表示盐类的水解,能够准确书写盐类的水解离子方程式。
教学方法 在真实情境问题下,设计任务驱动,利用实验探究活动进行项目化学习。教学思路:宏观辨识→微观探析→化学表征→知识迁移
项目任务和教学流程:
图1:项目任务和教学设计思路
教学流程 教师活动 学生活动 设计意图学生评价
项目 【内蒙古新闻情境】“以废治废”不毛之地现绿色生机。新闻报道“用来改造盐碱地的秘密武器就是用这种磨碎的工业固废钢渣做成的土壤改良剂,由于脱硫后钢渣呈酸性,可以中和盐碱地的碱性,同时还可以疏松板结的土壤。【信息提取】提出本节课2个研究问题。①“以废”→脱硫钢渣呈酸性 ②“治废”→盐碱地的碱性 【学生阅读】阅读新闻材料,整合信息,提取有效信息。 以真实情境为载体,在知识与能力基础上渗透素养教育。
任务一以废∣探究脱硫后钢渣的酸性 [问题1]揭示盐溶液呈现不同酸碱性的原因【脱硫钢渣(钢渣土壤改良剂)信息转化】钢渣主要成分:CaO、Fe2O3、FeO、Al2O3、MgO、SiO2等脱硫产物:CaSO4、Fe2(SO4)3、Al2(SO4)3、MgSO4、SiO2等【实验室模拟钢渣土壤改良剂】(宏观辨识)配制Fe2(SO4)3溶液(不加酸酸化),进行化学分析。用pH计测量0.1mol/L的Fe2(SO4)3溶液pH值。实验探究1:实验探究Fe2(SO4)3溶液显酸性的原理。实验原理:已知Cu + 2Fe3+=== 2Fe2++ Cu2+猜想Mg + 2Fe3+=== 2Fe2++ Mg2+ 实验操作:取适量Fe2(SO4)3溶液于试管中,加入用砂纸打磨过的Mg条。观察实验现象。实验现象:①立即产生大量气泡(检验为H2) ②一段时间后出现红褐色沉淀结果分析:Fe(OH)3 → OH- H2 → H+【建立多元弱碱盐Fe2(SO4)3的水解模型】(微观探析)“多元弱碱盐Fe2(SO4)3的水解模型”*学生总结盐类水解的定义及实质。概念:盐电离出的离子在水中与水电离出的OH-或 H+生成弱电解质的过程,叫做盐类的水解。实质:促进水的电离 【学生回顾】Cu+2Fe3+=== 2Fe2++ Cu2+【学生回答】观察实验,描述实验现象【学生思考】学生思考“意外”现象对盐类水解原理的启示。【学生建构】学生从微粒水平,平衡水平描述盐类的水解原理【学生总结】学生总结归纳盐类水解的概念。 科学只有推翻旧理论,才能向前走。注重培养学生科学态度,提高学生关键能力。在高阶思维培育中内化学科本质价值。从“宏-微-符”三重表征上完成学生对盐类水解本质的认识进阶。落实目标1落实目标2
任务二治废∣探究盐碱地的碱性 [问题2]建立盐类水解的认知模型【身边的化学】实验探究2:从室外取少量内蒙古土壤于小烧杯中,加水溶解,静置分层,用pH计测其pH值。【实验室模拟盐碱地】配制0.1mol/LNa2CO3溶液,用pH试纸测其pH。【建立多元弱酸盐Na2CO3的水解模型】“多元弱酸盐Na2CO3的水解模型” *学生归纳总结盐类水解的条件:“弱根”和水。*学生归纳总结简单水解离子方程式的书写注意事项。模型建构: 盐 + H2O 碱 + 酸 △H>0注意事项:①一般水解用“ ”。②一般水解程度小,不用“↓、↑、= ”。 ③多元弱酸盐分步水解,以第一步为主。练一练:请同学们分析AlCl3、Na2S和CH3COONa溶液的酸碱性,并写出水解离子方程式。 【学生完善】学生对比分析多元弱碱盐和多元弱酸盐的水解。【学生总结】学生总结归纳盐类水解的条件。【学生练习】总结归纳简单水解离子方程式的书写规则,练习书写水解离子方程式。 诊断并发展对盐类水解认识思路的结构化水平,进一步完善盐类水解模型,提高学生证据推理与模型认知素养水平。落实目标1落实目标2
任务三盐类水解一般规律探究 【问题3】寻找盐类水解的一般规律活动1:小组实验,用pH试纸测试物质的量浓度均为0.1mol/L的CH3COONa溶液、Na2SO4溶液、NH4Cl溶液、Al2(SO4)3溶液的pH,探究盐类的水解规律。“盐类水解规律分布图” 【学生实验】小组实验,并分享结论。【学生讨论】利用坐标分析法,观察不同盐溶液的pH,归纳总结出盐类水解的一般规律。 一方面,利用坐标划分区域,从盐的类型寻找规律。另一方面,利用纵坐标表示pH,体现水解能力的强弱。直观体现盐类水解的规律。落实目标3
任务四化学施肥策略讨 论 【问题4】知识迁移与应用活动2:基于酸碱性的化学施肥策略讨论。根据盐类水解的一般规律,请同学们讨论分析以下问题:问题1:现有NH4Cl、K2CO3、FeSO4化肥,请同学们判断其水溶液的酸碱性。 问题2:思考盐碱地适合焚烧秸秆吗?问题3:你怎么理解“灰混粪,粪混灰,灰粪相混损肥分” 【学生回答】依据盐类水解的原理和规律,小组讨论分享。 利用盐类水解原理解决化肥施用的实际问题。培养学生科学态度和社会责任。落实目标4
板书设计 3-3-1盐类的水解一、盐类的水解原理 1.定义:盐电离出的离子在水中与水电离出的OH-或 H+生成弱电解质的过程2实质:促进水的电离3条件:“弱根”和“水”三、盐类的水解规律二、简单水解方程式书写 盐 + H2O 碱 + 酸 △H>0特点:一般水解程度小,不用“↓、↑、= ”。 (1)多元弱碱盐“一步水解”Fe3+ + 3H2O Fe(OH)3+ 3H+(2)多元弱酸盐“分步水解”CO32-+ H2O HCO3-+ OH-(主)HCO3-+ H2O H2CO3+ OH-(次)
项目检测 矿源黄腐酸钾是一种新型功能性肥料,能刺激作物快生根,多生根,健壮成长,增加叶绿素,改良土壤团结结构,疏松土壤。
作业设计 钢渣是冶炼工业中产生的废渣,其中产生率为粗钢产量的8%-15%,2012年全世界排钢渣量约1.8亿t。中国的钢渣产生量随着钢铁工业的快速发展而迅速递增,因此钢铁企业废渣的处理和资源化利用问题也越来越受重视。请同学们查阅资料,分析废钢渣处理后作净水剂的原理。
【项目反思】
该项目学习以“情境—问题—知识—素养”作为教学线索。通过对“以废治废”真实情境的研究,帮助学生分别建立盐碱地(多元弱酸盐溶液)显碱性和脱硫钢渣(多元弱碱盐溶液)显酸性的水解模型,同时提高学生分析和解决问题的能力。设计教学任务链,利用实验探究活动研究脱硫钢渣显酸性的原理(概念形成)→利用对比分析方法研究盐碱地显碱性的原理(概念完善)→小组活动探究盐类水解的一般规律(概念深化)→小组讨论盐碱地施肥策略(概念应用)。教师也可课后拓宽知识应用的角度,打开学生的视野,比如认识钢铁除锈剂,泡沫灭火器,泡腾崩解剂等。
盐类水解的概念与一般规律
元素守恒: 水参与反应
溶液显酸性:破坏了水的电离平衡
Fe3+结合OH-生成弱电解质
溶液显
酸性
电离平衡关系
Fe2(SO4)3= 2Fe3+ + 3SO42- H2O OH-+ H+
Fe(OH)3
促进水电离c(H+)>c(OH–)
+
水解离子方程式
盐 + H2O 酸 + 碱
Fe3+ + 3H2O Fe(OH)3+ 3H+
微粒
平衡
宏观
符号
CO32-结合H+生成弱电解质
溶液显
碱性
水解离子方程式
盐 + H2O 酸 + 碱
CO32-+ H2O HCO3-+ OH-
HCO3-+ H2O H2CO3+ OH-(次)
电离平衡关系
Na2CO3= 2Na+ +CO32- H2O OH-+ H+
HCO3- H2CO3
促进水电离c(OH–)>c(H+)
+
微粒
平衡
宏观
符号
弱根
弱碱— — 阳离子:NH4+ 等
弱酸
酸根:CH3COO– 等
酸式酸根:HCO3– 等
2.谁强显谁性
3.越弱
越水解
1413121110 9
8
7
6
5
4
3
2
1
0
8
8
13
12
11
10
9
8
7
6
5
4
3
2
1
0
碱性
中性
酸性
Fe2(SO4)3
Al2(SO4)3
NH4Cl
CH3COONa
Na2CO3
Na2SO4
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
强碱弱酸盐强碱弱酸盐强碱弱酸盐
强酸强碱盐
强酸弱碱盐
1.有弱
才水解
强酸 弱碱盐
强碱 弱酸盐
有弱才水解
越弱越水解
谁强显谁性
请同学们思考:黄腐酸是一类大分子有机弱酸混合物,试判断该化肥的水溶液酸碱性,并与产品信息对照是否统一。
水解
硫酸
钢渣(Fe2O3、Al2O3)
Fe2(SO4)3、Al2(SO4)3
Fe(OH)3胶体、Al(OH)3胶体
