第三章 第二节 金属材料 第2课时 物质的量在化学方程式计算中的应用--人教版高中化学必修第一册教学课件(共28张PPT)
文档属性
| 名称 | 第三章 第二节 金属材料 第2课时 物质的量在化学方程式计算中的应用--人教版高中化学必修第一册教学课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:06:33 | ||
图片预览








文档简介
(共28张PPT)
第2课时 物质的量在化学方程式 计算中的应用
第二节 金属材料
化学
学习目标
1.深刻理解化学方程式的含义,能根据化学方程式列出各物质的化学计量数及其比例关系。
2.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法,通过解题格式及思维过程的规范训练,培养严谨认真的科学态度。
3.加深对物质的量、物质的量浓度、气体摩尔体积等概念的理解,学会将物质的量、摩尔质量、气体摩尔体积、物质的量浓度等概念运用于化学方程式的计算,逐步健全以物质的量为中心的各物理量之间关系的知识网络。
学习重难点
重点 难点
1.了解化学计算中的常用方法。
2.认识物质的量在化学方程式计算中的应用,加深对化学方程式意义的理解。
化学方程式中的化学计量数之比等于反应中各物质粒子数目之比。例如化学方程式2H + O 2H O,化学计量数之比为2:1:2,就代表反应的氢分子、氧分子、水分子数目之比也是2:1:2。它直观体现了化学反应中各粒子间的数量关系,帮助我们进行物质的量等相关计算。
物质由分子、原子、离子构成。分子如H O,原子像金属中的原子(如Fe), 离子如NaCl中的Na 和Cl 。
自主学习
物质由哪些粒子构成?
化学方程式中的化学计量数与化学反应中粒子之间的数目有何关系?
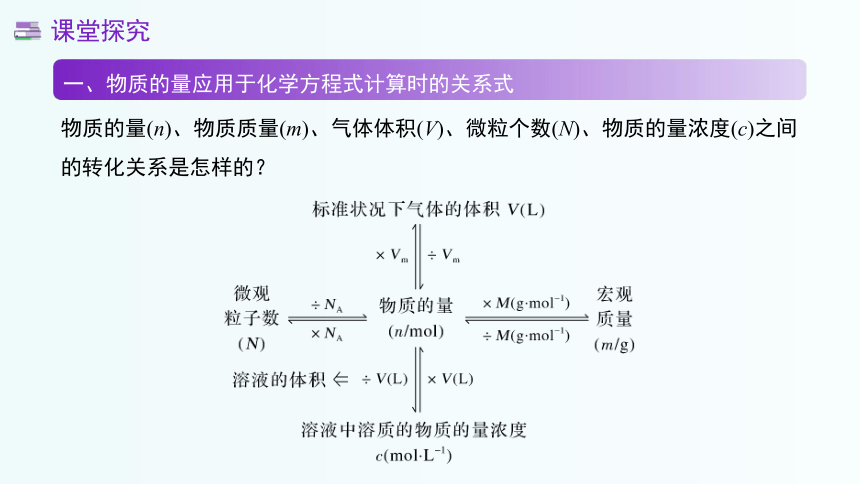
一、物质的量应用于化学方程式计算时的关系式
课堂探究
物质的量(n)、物质质量(m)、气体体积(V)、微粒个数(N)、物质的量浓度(c)之间的转化关系是怎样的?
一、物质的量应用于化学方程式计算时的关系式
物质的量与化学计量数可以应用到化学方程式计算。
在化学方程式中,化学计量数之比等于各物质的物质的量之比。例如反应2H2+O2 2H2O, H2、O2、H2O的化学计量数之比 为 2:1:2,那么在这个反应中,氢气、氧气、水的物质的量之比也是2:1:2。
通过已知一种反应物或生成物的物质的量,根据化学计量数之比就能计算出其他反应物或生成物的物质的量,这是化学方程式计算的重要依据。
物质的量与化学计量数的关系是否可应用到化学方程式计算中?
一、物质的量应用于化学方程式计算时的关系式
课堂探究
计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积表示,但要注意物质的量与其他各物理量之间的换算关系;只要做到两个量的单位“上下一致,左右相当”即可。
同一种物质用不同的物理量表示时,比例是相同的。例如1 mol氧化铜和80 g氧化铜完全相同。
问题1 为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一?
问题2 应用物质的量在化学方程式计算时,各种物质一定都用物质的量表示吗?
一、物质的量应用于化学方程式计算时的关系式
课堂探究
二、物质的量应用于化学方程式计算中的基本步骤
课堂探究
【问题1】观察化学方程式,回答下列问题:
H2+Cl2 2HCl
(1)化学计量数之比是多少?
(2)粒子数之比是多少?
(3)物质的量之比是多少?
1∶1∶2
1∶1∶2
1∶1∶2
提示:
将物质的量(n)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)等概念应用于化学方程式进行计算时,通过物质的量与化学计量数之间的关系以及物质的量与其他物理量之间的联系,能使化学计算变得更加简便。
二、物质的量应用于化学方程式计算中的基本步骤
课堂探究
【问题2】利用物质的量解化学方程式计算的步骤是怎样的?
(1)书写格式规范化:各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据量不足的物质进行计算。
根据化学方程式计算的注意事项
课堂探究
二、物质的量应用于化学方程式计算中的基本步骤
【例1】1克氢气和足量的氯气完全反应,可生成多少摩尔氯化氢?
解法1:设生成氯化氢的质量为x。
H2+Cl2
2HCl
2 73
1 x
x=36.5
生成的氯化氢的物质的量n(HCl)= =1 mol
=
=
课堂探究
【例1】1克氢气和足量的氯气完全反应,可生成多少摩尔氯化氢?
解法2:
n(H2)= = 0.5 mol。
设生成氯化氢的物质的量为x。
H2+Cl2 2HCl
1 2
0.5 x
x=1 mol
=
=
课堂探究
【例2】用8.7 g MnO2与100 g 36.5%的浓盐酸反应,消耗HCl的物质的量是多少?产生的Cl2在标准状况下的体积是多少?未参加反应的HCl的质量是多少?
根据化学方程式进行计算,当两种反应物的量均为已知时,首先须判断哪种物质过量,然后根据不过量的物质来进行计算。
课堂探究
根据化学方程式确定关系式时,首先要写出化学方程式,然后要找出方程式变化中的“中间量”,通过“中间量”找出“已知量”与“未知量”之间的物质的量的关系,如由硫黄制取H2SO4的三步反应:
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。然后将“关系式”当作化学方程式使用,一步计算求出未知量。
(1)根据化学方程式确定关系式
关系式法
课堂探究
课堂探究
S+O2 SO2、2SO2+O2 2SO3、SO3+H2O===H2SO4。
反应中已知量与未知量之间的关系:
已知量 -- 中间量 -- 中间量 -- 末知量
S ~ SO2 ~ SO3 ~ H2SO4
即S~H2SO4。
(2)根据原子守恒确定关系式
上述例子中也可以由硫原子守恒直接得出关系式“S~H2SO4”。
1.各物质的化学计量数之比=各物质的物质的量之比=各物质构成粒子的粒子数之比=相同条件下气体的体积之比。
2.解题时注意找出“中介”物质,建立已知量与未知量的数量关系,计算求解。
有关化学方程式计算的等式关系
课堂探究
【练习1】
课堂练习
(双选)下列说法正确的是( )
A.化学反应中,参加反应的各物质的质量之和等于反应后生成的各物质的质量之和
B.化学反应中,参加反应的各物质的物质的量之和等于反应后生成的各物质的物质的量之和
C.各反应物与各生成物的物质的量之比等于它们的质量之比
D.各反应物与各生成物之间物质的量之比等于它们的化学计量数之比
AD
【练习2】
课堂练习
现有A、B、C三种化合物,各取40 g相混合完全反应后,得18 g B和49 g C,还有D生成,已知D的相对分子质量为106,现将22 g A和11 g B反应,生成D的物质的量为 ( )
A.1 mol
B.0.5 mol
C.0.275 mol
D.0.25 mol
D
【练习3】
课堂练习
在FeO、Fe2O3、Fe3O4三种铁的氧化物中,与等质量铁元素相结合的氧元素的质量之比为( )
A.1∶3∶4
B.2∶3∶4
C.6∶9∶8
D.3∶8∶9
C
【练习4】
课堂练习
某二价金属1.3g与足量盐酸反应,生成448 mL(标准状况)H2,该金属为( )
A.Ca
B.Zn
C.Fe
D.Mg
B
【练习5】
课堂练习
1mol O2在放电条件下,有30%转化为臭氧,则放电后所得混合气体对H2的相对密度是( )
A.16
B.17.8
C.18.4
D.35.6
B
课堂练习
CO和H2混合气体V L,完全燃烧时用去同温、同压下 L O2,此混合气体中CO和H2的体积比是( )
A.1∶1
B.1∶3
C.2∶1
D.任意比
D
【练习6】
课堂练习
在一定温度和压强下,10体积气体A2与30体积气体B2,化合生成20体积某气体,则该气体的化学式为( )
A3B
AB3
A2B3
A3B2
B
【练习7】
课堂练习
等体积的KCl、MgCl2、AlCl3三种溶液,分别与等物质的量浓度、等体积的AgNO3溶液反应,恰好使Cl-完全沉淀为AgCl。则原来KCl、MgCl2、AlCl3溶液的物质的量浓度之比是( )
A.1∶2∶3
B.1∶1∶1
C.6∶3∶2
D.3∶2∶1
C
【练习8】
课堂练习
将等质量的Zn和Al分别加入足量的稀硫酸,完全反应后生成的气体在同温、同压下的体积比是( )
A.1∶3.6
B.1∶3
C.2∶3.6
D.2∶3
A
【练习9】
课堂小结
课下讨论:有关物质的量在化学方程式计算中常见的类型与解题技巧有哪些?
布置作业
谢谢大家
第2课时 物质的量在化学方程式 计算中的应用
第二节 金属材料
化学
学习目标
1.深刻理解化学方程式的含义,能根据化学方程式列出各物质的化学计量数及其比例关系。
2.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法,通过解题格式及思维过程的规范训练,培养严谨认真的科学态度。
3.加深对物质的量、物质的量浓度、气体摩尔体积等概念的理解,学会将物质的量、摩尔质量、气体摩尔体积、物质的量浓度等概念运用于化学方程式的计算,逐步健全以物质的量为中心的各物理量之间关系的知识网络。
学习重难点
重点 难点
1.了解化学计算中的常用方法。
2.认识物质的量在化学方程式计算中的应用,加深对化学方程式意义的理解。
化学方程式中的化学计量数之比等于反应中各物质粒子数目之比。例如化学方程式2H + O 2H O,化学计量数之比为2:1:2,就代表反应的氢分子、氧分子、水分子数目之比也是2:1:2。它直观体现了化学反应中各粒子间的数量关系,帮助我们进行物质的量等相关计算。
物质由分子、原子、离子构成。分子如H O,原子像金属中的原子(如Fe), 离子如NaCl中的Na 和Cl 。
自主学习
物质由哪些粒子构成?
化学方程式中的化学计量数与化学反应中粒子之间的数目有何关系?
一、物质的量应用于化学方程式计算时的关系式
课堂探究
物质的量(n)、物质质量(m)、气体体积(V)、微粒个数(N)、物质的量浓度(c)之间的转化关系是怎样的?
一、物质的量应用于化学方程式计算时的关系式
物质的量与化学计量数可以应用到化学方程式计算。
在化学方程式中,化学计量数之比等于各物质的物质的量之比。例如反应2H2+O2 2H2O, H2、O2、H2O的化学计量数之比 为 2:1:2,那么在这个反应中,氢气、氧气、水的物质的量之比也是2:1:2。
通过已知一种反应物或生成物的物质的量,根据化学计量数之比就能计算出其他反应物或生成物的物质的量,这是化学方程式计算的重要依据。
物质的量与化学计量数的关系是否可应用到化学方程式计算中?
一、物质的量应用于化学方程式计算时的关系式
课堂探究
计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积表示,但要注意物质的量与其他各物理量之间的换算关系;只要做到两个量的单位“上下一致,左右相当”即可。
同一种物质用不同的物理量表示时,比例是相同的。例如1 mol氧化铜和80 g氧化铜完全相同。
问题1 为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一?
问题2 应用物质的量在化学方程式计算时,各种物质一定都用物质的量表示吗?
一、物质的量应用于化学方程式计算时的关系式
课堂探究
二、物质的量应用于化学方程式计算中的基本步骤
课堂探究
【问题1】观察化学方程式,回答下列问题:
H2+Cl2 2HCl
(1)化学计量数之比是多少?
(2)粒子数之比是多少?
(3)物质的量之比是多少?
1∶1∶2
1∶1∶2
1∶1∶2
提示:
将物质的量(n)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)等概念应用于化学方程式进行计算时,通过物质的量与化学计量数之间的关系以及物质的量与其他物理量之间的联系,能使化学计算变得更加简便。
二、物质的量应用于化学方程式计算中的基本步骤
课堂探究
【问题2】利用物质的量解化学方程式计算的步骤是怎样的?
(1)书写格式规范化:各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据量不足的物质进行计算。
根据化学方程式计算的注意事项
课堂探究
二、物质的量应用于化学方程式计算中的基本步骤
【例1】1克氢气和足量的氯气完全反应,可生成多少摩尔氯化氢?
解法1:设生成氯化氢的质量为x。
H2+Cl2
2HCl
2 73
1 x
x=36.5
生成的氯化氢的物质的量n(HCl)= =1 mol
=
=
课堂探究
【例1】1克氢气和足量的氯气完全反应,可生成多少摩尔氯化氢?
解法2:
n(H2)= = 0.5 mol。
设生成氯化氢的物质的量为x。
H2+Cl2 2HCl
1 2
0.5 x
x=1 mol
=
=
课堂探究
【例2】用8.7 g MnO2与100 g 36.5%的浓盐酸反应,消耗HCl的物质的量是多少?产生的Cl2在标准状况下的体积是多少?未参加反应的HCl的质量是多少?
根据化学方程式进行计算,当两种反应物的量均为已知时,首先须判断哪种物质过量,然后根据不过量的物质来进行计算。
课堂探究
根据化学方程式确定关系式时,首先要写出化学方程式,然后要找出方程式变化中的“中间量”,通过“中间量”找出“已知量”与“未知量”之间的物质的量的关系,如由硫黄制取H2SO4的三步反应:
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。然后将“关系式”当作化学方程式使用,一步计算求出未知量。
(1)根据化学方程式确定关系式
关系式法
课堂探究
课堂探究
S+O2 SO2、2SO2+O2 2SO3、SO3+H2O===H2SO4。
反应中已知量与未知量之间的关系:
已知量 -- 中间量 -- 中间量 -- 末知量
S ~ SO2 ~ SO3 ~ H2SO4
即S~H2SO4。
(2)根据原子守恒确定关系式
上述例子中也可以由硫原子守恒直接得出关系式“S~H2SO4”。
1.各物质的化学计量数之比=各物质的物质的量之比=各物质构成粒子的粒子数之比=相同条件下气体的体积之比。
2.解题时注意找出“中介”物质,建立已知量与未知量的数量关系,计算求解。
有关化学方程式计算的等式关系
课堂探究
【练习1】
课堂练习
(双选)下列说法正确的是( )
A.化学反应中,参加反应的各物质的质量之和等于反应后生成的各物质的质量之和
B.化学反应中,参加反应的各物质的物质的量之和等于反应后生成的各物质的物质的量之和
C.各反应物与各生成物的物质的量之比等于它们的质量之比
D.各反应物与各生成物之间物质的量之比等于它们的化学计量数之比
AD
【练习2】
课堂练习
现有A、B、C三种化合物,各取40 g相混合完全反应后,得18 g B和49 g C,还有D生成,已知D的相对分子质量为106,现将22 g A和11 g B反应,生成D的物质的量为 ( )
A.1 mol
B.0.5 mol
C.0.275 mol
D.0.25 mol
D
【练习3】
课堂练习
在FeO、Fe2O3、Fe3O4三种铁的氧化物中,与等质量铁元素相结合的氧元素的质量之比为( )
A.1∶3∶4
B.2∶3∶4
C.6∶9∶8
D.3∶8∶9
C
【练习4】
课堂练习
某二价金属1.3g与足量盐酸反应,生成448 mL(标准状况)H2,该金属为( )
A.Ca
B.Zn
C.Fe
D.Mg
B
【练习5】
课堂练习
1mol O2在放电条件下,有30%转化为臭氧,则放电后所得混合气体对H2的相对密度是( )
A.16
B.17.8
C.18.4
D.35.6
B
课堂练习
CO和H2混合气体V L,完全燃烧时用去同温、同压下 L O2,此混合气体中CO和H2的体积比是( )
A.1∶1
B.1∶3
C.2∶1
D.任意比
D
【练习6】
课堂练习
在一定温度和压强下,10体积气体A2与30体积气体B2,化合生成20体积某气体,则该气体的化学式为( )
A3B
AB3
A2B3
A3B2
B
【练习7】
课堂练习
等体积的KCl、MgCl2、AlCl3三种溶液,分别与等物质的量浓度、等体积的AgNO3溶液反应,恰好使Cl-完全沉淀为AgCl。则原来KCl、MgCl2、AlCl3溶液的物质的量浓度之比是( )
A.1∶2∶3
B.1∶1∶1
C.6∶3∶2
D.3∶2∶1
C
【练习8】
课堂练习
将等质量的Zn和Al分别加入足量的稀硫酸,完全反应后生成的气体在同温、同压下的体积比是( )
A.1∶3.6
B.1∶3
C.2∶3.6
D.2∶3
A
【练习9】
课堂小结
课下讨论:有关物质的量在化学方程式计算中常见的类型与解题技巧有哪些?
布置作业
谢谢大家
