第四章 第三节 化学键 第2课时 共价键--人教版高中化学必修第一册教学课件(共44张PPT)
文档属性
| 名称 | 第四章 第三节 化学键 第2课时 共价键--人教版高中化学必修第一册教学课件(共44张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:08:22 | ||
图片预览










文档简介
(共44张PPT)
第2课时 共价键
第三节 化学键
化学
1.通过对比氯化钠的形成过程,学会分析氯化氢的形成过程,培养对比分析问题的能力。
2.能从原子结构角度理解共价键和共价化合物的概念及形成过程。
3.能用电子式和结构式表示共价单质分子和共价化合物。
4.能从化学键的角度让学生理解化学反应的本质,培养分析问题的能力。
学习目标
重点、难点:
共价键和共价化合物定义的理解,共价化合物的电子式和结构式。
学习重难点
导入新课
【问题1】离子键的定义及用电子式表示离子化合物的形成过程。
离子键是指阴、阳离子间通过静电作用所形成的化学键。
以氯化钠为例,其形成过程的电子式表示为
知识回顾
导入新课
知识回顾
【问题2】钠原子和氯原子形成稳定结构的途径是什么?
当钠原子和氯原子相遇时,钠原子将最外层的1个电子转移给氯原子,二者分别形成稳定的钠离子和氯离子,然后通过静电作用结合在一起,形成氯化钠这种离子化合物,从而达到稳定结构。
导入新课
知识回顾
【问题3】哪些元素化合时易形成离子键?
活泼金属元素与活泼非金属元素。
导入新课
知识回顾
【问题4】用电子式表示Na2S、MgCl2的形成过程。
Na2S的形成过程 MgCl2的形成过程
思考与讨论
导入新课
CO2
HCl
NH3
化学式: H2 Cl2
H2O
为什么不是: H3 Cl3
CO3
H2Cl
N2H3
H3O
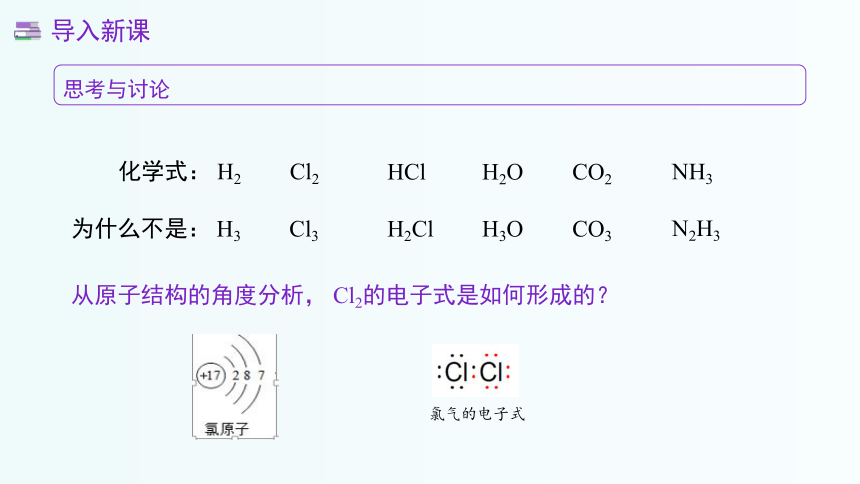
从原子结构的角度分析, Cl2的电子式是如何形成的?
氯气的电子式
导入新课
通常活泼的金属元素和活泼非金属元素的原子化合时易形成离子键。请思考,2个非金属元素的原子之间化合时,能形成离子键吗?为什么?
两个非金属元素的原子之间化合时不能形成离子键。因为非金属元素原子最外层电子数较多,倾向于共用电子对达到稳定结构,且它们之间电负性差值较小,难以发生电子完全转移形成阴、阳离子,同时原子提供大量能量实现电子完全转移较难,更易通过共用电子对形成共价键来降低能量达稳定态。
思考与讨论
阅读课本P114,思考2个氯原子如何形成1个氯分子及1个氢原子和1个氯原子如何形成1个氯化氢分子?思考非金属元素的原子之间结合时,通过什么方式达到稳定结构呢?
导入新课
思考与讨论
课堂探究
一、共价键
认识共价键的形成
+
··
Cl
··
·
·
·
··
Cl
··
·
·
·
··
Cl
··
·
·
·
··
Cl
··
·
·
·
+
··
Cl
··
·
·
·
H
·
··
Cl
··
·
·
·
H
·
2个Cl原子均达到8e-稳定结构
课堂探究
一、共价键
【问题1】分析Cl2和HCl共价键的不同之处。
Cl2:由同种原子形成共价键,共用电子对不偏移,成键原子不显电性;
HCl:由不同种原子形成共价键,共用电子对偏向Cl一方,Cl一方显负电性,H一方显正电性。
课堂探究
一、共价键
【问题2】金属原子与非金属原子之间能否形成共价键?
【问题3】离子化合物NaOH中氧原子和氢原子之间是不是共价键?
铝原子与氯原子可以通过共价键结合形成氯化铝。
NaOH虽然是离子化合物,但是氧原子和氢原子之间的作用力是共价键。一些复杂的离子化合物,如强碱、铵盐、含氧酸盐中都存在共价键。
课堂探究
一、共价键
1.定义:原子间通过共用电子对所形成的相互作用。
2.成键本质:原子间形成共用电子对。
3.成键粒子:原子。
4.成键元素:非金属与非金属或某些非金属与金属之间。
5.类型:非极性键(同种原子形成)、极性键(不同种原子形成)。
课堂探究
一、共价键
6.共价键的存在
(1)非金属单质:Cl2、O2、N2等(稀有气体除外)。
(2)复杂的离子化合物:NaOH、Na2O2、K2CO3、NH4Cl等。
(3)非金属的氧化物和氢化物:H2O、CO2、NH3等。
(4)酸:HCl、H2SO4、HNO3等。
(5)大多数有机化合物:CH4、酒精等。
课堂探究
二、共价化合物
定义
以共用电子对形成分子的化合物。
离子化合物NaOH中也含有共价键,可知含有共价键的化合物不一定是共价化合物。
课堂探究
二、共价化合物
与物质类别的关系
非金属氢化物: H2S、 HF 、NH3等
非金属氧化物:CO、CO2、H2O、SO2、SO3等
酸: HCl、 H2SO4 、HNO3等
大多数有机化合物:CH4、CH3CH2OH、CH3COOH等
常见类别
课堂探究
二、共价化合物
【特别提醒】一些特殊的物质
NH4Cl是一种离子化合物。铵根离子与氯离子之间存在着强烈的静电作用,这种静电作用就是离子键,使得氯化铵呈现出离子化合物的性质。
【问题1】NH4Cl是否是共价化合物?
AlCl3(共价化合物)、铵盐(离子化合物)
课堂探究
三、共价键的表示及分类
在化学上常用一根短线表示一对共用电子,其余的电子不标出。这样的式子称为结构式。
分子 电子式 结构式 空间结构
H2S H—S—H V形
NH3 三角锥形
CO2 直线形
CH4 正四面体形
课堂探究
三、共价键的表示及分类
总结:
书写共价分子时,各原子间通过共用电子对的偏移使所有原子的最外层电子均达到稳定结构。根据需要,有时原子间可能共用多对电子,共用电子对数由原子最外层未成对的电子数决定。
【问题1】用电子式表示H2O、F2的形成过程:
H2O的形成过程 F2的形成过程
课堂探究
三、共价键的表示及分类
注意事项:
a.不用箭头表示电子的偏移。
b.左边是原子的电子式,右边是分子的电子式,没有离子,用“ ”连接。
课堂探究
三、共价键的表示及分类
【问题2】写出H2O2的电子式和结构式,标出H2O2中H元素和O元素的化合价,并分析H2O2中的O—O间的共用电子对与O—H间的共用电子对在电子对的吸引能力上有没有不同?
氧原子吸引电子的能力强于氢原子,因此氧原子与氢原子的共用电子对偏向氧原子,氧原子与氧原子之间的共用电子对无偏向。
课堂探究
三、共价键的表示及分类
根据共用电子对是否偏移将共价键分为极性共价键和非极性共价键,有偏移的共价键是极性共价键,无偏移的共价键是非极性共价键,判断时可以根据成键元素来判断,同种元素形成的共价键是非极性共价键,不同种元素形成的共价键是极性共价键。
课堂探究
三、共价键的表示及分类
填写下面的表格:
键的类型 定义 形成条件 元素价态
极性共价键
非极性共价键
共用电子对偏向一方原子的共价键
不同种元素的原子之间
共用电子对偏向非金属性强的元素,非金属性强的元素显负电性
共用电子对无偏向的共价键
同种元素的原子之间
共用电子对无偏向,元素显0价
课堂探究
三、共价键的表示及分类
常见单质的电子式与结构式
氢气(H2 ) 氮气(N2 ) 氧气(O2) 氯气( Cl2 )
电子式
结构式
H H
··
…
N N
··
…
··
O O
:
:
:
:
:
:
Cl Cl
:
:
:
:
:
:
:
H-H
N≡N
O=O
Cl-Cl
一根短线“—”表示1对共用电子图示叫结构式。
课堂探究
三、共价键的表示及分类
H2O
CH4
CO2
HCl
H—Cl
V形
直线形
正四面体形
直线形
电子式
结构式
空间结构
常见化合物的电子式、结构式和空间结构
课堂探究
四、化学键
概念
相邻的原子之间强烈的相互作用。
分类
离子键
共价键
化学键
H—Cl
N≡N
O=O
H—H
H—O—O—H
共用电子对偏移
共用电子对不偏移
极性键
非极性键
课堂探究
四、化学键
化学反应的本质
旧键断裂,新键形成
课堂探究
四、化学键
【问题1】有化学键断裂的过程一定是化学反应吗?
不一定。如NaCl受热熔化断裂离子键,HCl溶于水断裂共价键,但都不是化学变化,NaCl溶液蒸发结晶,有离子键形成,但过程为物理变化,没有新物质生成。
课堂探究
四、化学键
分子间作用力
(1)概念:
分子间存在一种把分子聚集在一起的作用力,又称范德华力(比化学键弱得多)。
课堂探究
四、化学键
【问题2】为什么干冰升华、硫晶体熔化等都要吸收能量?
由分子构成的物质,其熔、沸点等物理性质主要由分子间作用力大小决定。
课堂探究
四、化学键
(2)分类:
范德华力
氢键:一种较强的分子间作用力,不是化学键。主要存在于 H2O、NH3、HF分子之间
键的强弱:化学键>氢键>范德华力
使物质的熔点和沸点升高,冰的密度低于液态水的密度。
(3)氢键对物质的性质的影响:
【练习1】
下列物质中,含有非极性键的离子化合物是( )
A.Na2O2
B.Na2O
C.NaOH
D.CaCl2
课堂练习
A
【练习2】
(双选)下列物质中,不含非极性键的分子是( )
A.Cl2
B.H2O
C.N2
D.CH4
课堂练习
BD
【练习3】
(双选)下列关于极性键的叙述不正确的是( )
A.由不同种元素原子形成的共价键
B.由同种元素的两个原子形成的共价键
C.分子中必定含有极性键
D.共用电子对必然偏向吸引电子能力强的原子一方
课堂练习
BC
【练习4】
下列化学键一定属于非极性键的是( )
A.共价化合物中的共价键
B.离子化合物中的化学键
C.H2O分子中的化学键
D.非金属单质双原子分子中的化学键
课堂练习
D
【练习5】
下列叙述正确的是( )
A.两个非金属原子之间可能形成离子键
B.非金属原子间不可能形成离子化合物
C.离子化合物中可能有共价键
D.共价化合物中可能有离子键
课堂练习
C
【练习6】
下列物质中,只含有非极性共价键的( )
A.NaOH
B.NaCl
C.H2
D.H2S
课堂练习
C
【练习7】
下列物质中,含有极性共价键的是( )
A.单质碘
B.氯化镁
C.溴化钾
D.水
课堂练习
D
【练习8】
(双选)下列粒子中,同时具有离子键和共价键的是( )
A.NH3
B.NH4Cl
C.H2S
D.KOH
课堂练习
BD
【练习9】
(双选)下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是( )
A.BF3
B.CCl4
C.CO2
D.PCl5
课堂练习
AD
【练习10】
(双选)下列电子式书写正确的是( )
课堂练习
AC
课堂小结
谢谢大家
第2课时 共价键
第三节 化学键
化学
1.通过对比氯化钠的形成过程,学会分析氯化氢的形成过程,培养对比分析问题的能力。
2.能从原子结构角度理解共价键和共价化合物的概念及形成过程。
3.能用电子式和结构式表示共价单质分子和共价化合物。
4.能从化学键的角度让学生理解化学反应的本质,培养分析问题的能力。
学习目标
重点、难点:
共价键和共价化合物定义的理解,共价化合物的电子式和结构式。
学习重难点
导入新课
【问题1】离子键的定义及用电子式表示离子化合物的形成过程。
离子键是指阴、阳离子间通过静电作用所形成的化学键。
以氯化钠为例,其形成过程的电子式表示为
知识回顾
导入新课
知识回顾
【问题2】钠原子和氯原子形成稳定结构的途径是什么?
当钠原子和氯原子相遇时,钠原子将最外层的1个电子转移给氯原子,二者分别形成稳定的钠离子和氯离子,然后通过静电作用结合在一起,形成氯化钠这种离子化合物,从而达到稳定结构。
导入新课
知识回顾
【问题3】哪些元素化合时易形成离子键?
活泼金属元素与活泼非金属元素。
导入新课
知识回顾
【问题4】用电子式表示Na2S、MgCl2的形成过程。
Na2S的形成过程 MgCl2的形成过程
思考与讨论
导入新课
CO2
HCl
NH3
化学式: H2 Cl2
H2O
为什么不是: H3 Cl3
CO3
H2Cl
N2H3
H3O
从原子结构的角度分析, Cl2的电子式是如何形成的?
氯气的电子式
导入新课
通常活泼的金属元素和活泼非金属元素的原子化合时易形成离子键。请思考,2个非金属元素的原子之间化合时,能形成离子键吗?为什么?
两个非金属元素的原子之间化合时不能形成离子键。因为非金属元素原子最外层电子数较多,倾向于共用电子对达到稳定结构,且它们之间电负性差值较小,难以发生电子完全转移形成阴、阳离子,同时原子提供大量能量实现电子完全转移较难,更易通过共用电子对形成共价键来降低能量达稳定态。
思考与讨论
阅读课本P114,思考2个氯原子如何形成1个氯分子及1个氢原子和1个氯原子如何形成1个氯化氢分子?思考非金属元素的原子之间结合时,通过什么方式达到稳定结构呢?
导入新课
思考与讨论
课堂探究
一、共价键
认识共价键的形成
+
··
Cl
··
·
·
·
··
Cl
··
·
·
·
··
Cl
··
·
·
·
··
Cl
··
·
·
·
+
··
Cl
··
·
·
·
H
·
··
Cl
··
·
·
·
H
·
2个Cl原子均达到8e-稳定结构
课堂探究
一、共价键
【问题1】分析Cl2和HCl共价键的不同之处。
Cl2:由同种原子形成共价键,共用电子对不偏移,成键原子不显电性;
HCl:由不同种原子形成共价键,共用电子对偏向Cl一方,Cl一方显负电性,H一方显正电性。
课堂探究
一、共价键
【问题2】金属原子与非金属原子之间能否形成共价键?
【问题3】离子化合物NaOH中氧原子和氢原子之间是不是共价键?
铝原子与氯原子可以通过共价键结合形成氯化铝。
NaOH虽然是离子化合物,但是氧原子和氢原子之间的作用力是共价键。一些复杂的离子化合物,如强碱、铵盐、含氧酸盐中都存在共价键。
课堂探究
一、共价键
1.定义:原子间通过共用电子对所形成的相互作用。
2.成键本质:原子间形成共用电子对。
3.成键粒子:原子。
4.成键元素:非金属与非金属或某些非金属与金属之间。
5.类型:非极性键(同种原子形成)、极性键(不同种原子形成)。
课堂探究
一、共价键
6.共价键的存在
(1)非金属单质:Cl2、O2、N2等(稀有气体除外)。
(2)复杂的离子化合物:NaOH、Na2O2、K2CO3、NH4Cl等。
(3)非金属的氧化物和氢化物:H2O、CO2、NH3等。
(4)酸:HCl、H2SO4、HNO3等。
(5)大多数有机化合物:CH4、酒精等。
课堂探究
二、共价化合物
定义
以共用电子对形成分子的化合物。
离子化合物NaOH中也含有共价键,可知含有共价键的化合物不一定是共价化合物。
课堂探究
二、共价化合物
与物质类别的关系
非金属氢化物: H2S、 HF 、NH3等
非金属氧化物:CO、CO2、H2O、SO2、SO3等
酸: HCl、 H2SO4 、HNO3等
大多数有机化合物:CH4、CH3CH2OH、CH3COOH等
常见类别
课堂探究
二、共价化合物
【特别提醒】一些特殊的物质
NH4Cl是一种离子化合物。铵根离子与氯离子之间存在着强烈的静电作用,这种静电作用就是离子键,使得氯化铵呈现出离子化合物的性质。
【问题1】NH4Cl是否是共价化合物?
AlCl3(共价化合物)、铵盐(离子化合物)
课堂探究
三、共价键的表示及分类
在化学上常用一根短线表示一对共用电子,其余的电子不标出。这样的式子称为结构式。
分子 电子式 结构式 空间结构
H2S H—S—H V形
NH3 三角锥形
CO2 直线形
CH4 正四面体形
课堂探究
三、共价键的表示及分类
总结:
书写共价分子时,各原子间通过共用电子对的偏移使所有原子的最外层电子均达到稳定结构。根据需要,有时原子间可能共用多对电子,共用电子对数由原子最外层未成对的电子数决定。
【问题1】用电子式表示H2O、F2的形成过程:
H2O的形成过程 F2的形成过程
课堂探究
三、共价键的表示及分类
注意事项:
a.不用箭头表示电子的偏移。
b.左边是原子的电子式,右边是分子的电子式,没有离子,用“ ”连接。
课堂探究
三、共价键的表示及分类
【问题2】写出H2O2的电子式和结构式,标出H2O2中H元素和O元素的化合价,并分析H2O2中的O—O间的共用电子对与O—H间的共用电子对在电子对的吸引能力上有没有不同?
氧原子吸引电子的能力强于氢原子,因此氧原子与氢原子的共用电子对偏向氧原子,氧原子与氧原子之间的共用电子对无偏向。
课堂探究
三、共价键的表示及分类
根据共用电子对是否偏移将共价键分为极性共价键和非极性共价键,有偏移的共价键是极性共价键,无偏移的共价键是非极性共价键,判断时可以根据成键元素来判断,同种元素形成的共价键是非极性共价键,不同种元素形成的共价键是极性共价键。
课堂探究
三、共价键的表示及分类
填写下面的表格:
键的类型 定义 形成条件 元素价态
极性共价键
非极性共价键
共用电子对偏向一方原子的共价键
不同种元素的原子之间
共用电子对偏向非金属性强的元素,非金属性强的元素显负电性
共用电子对无偏向的共价键
同种元素的原子之间
共用电子对无偏向,元素显0价
课堂探究
三、共价键的表示及分类
常见单质的电子式与结构式
氢气(H2 ) 氮气(N2 ) 氧气(O2) 氯气( Cl2 )
电子式
结构式
H H
··
…
N N
··
…
··
O O
:
:
:
:
:
:
Cl Cl
:
:
:
:
:
:
:
H-H
N≡N
O=O
Cl-Cl
一根短线“—”表示1对共用电子图示叫结构式。
课堂探究
三、共价键的表示及分类
H2O
CH4
CO2
HCl
H—Cl
V形
直线形
正四面体形
直线形
电子式
结构式
空间结构
常见化合物的电子式、结构式和空间结构
课堂探究
四、化学键
概念
相邻的原子之间强烈的相互作用。
分类
离子键
共价键
化学键
H—Cl
N≡N
O=O
H—H
H—O—O—H
共用电子对偏移
共用电子对不偏移
极性键
非极性键
课堂探究
四、化学键
化学反应的本质
旧键断裂,新键形成
课堂探究
四、化学键
【问题1】有化学键断裂的过程一定是化学反应吗?
不一定。如NaCl受热熔化断裂离子键,HCl溶于水断裂共价键,但都不是化学变化,NaCl溶液蒸发结晶,有离子键形成,但过程为物理变化,没有新物质生成。
课堂探究
四、化学键
分子间作用力
(1)概念:
分子间存在一种把分子聚集在一起的作用力,又称范德华力(比化学键弱得多)。
课堂探究
四、化学键
【问题2】为什么干冰升华、硫晶体熔化等都要吸收能量?
由分子构成的物质,其熔、沸点等物理性质主要由分子间作用力大小决定。
课堂探究
四、化学键
(2)分类:
范德华力
氢键:一种较强的分子间作用力,不是化学键。主要存在于 H2O、NH3、HF分子之间
键的强弱:化学键>氢键>范德华力
使物质的熔点和沸点升高,冰的密度低于液态水的密度。
(3)氢键对物质的性质的影响:
【练习1】
下列物质中,含有非极性键的离子化合物是( )
A.Na2O2
B.Na2O
C.NaOH
D.CaCl2
课堂练习
A
【练习2】
(双选)下列物质中,不含非极性键的分子是( )
A.Cl2
B.H2O
C.N2
D.CH4
课堂练习
BD
【练习3】
(双选)下列关于极性键的叙述不正确的是( )
A.由不同种元素原子形成的共价键
B.由同种元素的两个原子形成的共价键
C.分子中必定含有极性键
D.共用电子对必然偏向吸引电子能力强的原子一方
课堂练习
BC
【练习4】
下列化学键一定属于非极性键的是( )
A.共价化合物中的共价键
B.离子化合物中的化学键
C.H2O分子中的化学键
D.非金属单质双原子分子中的化学键
课堂练习
D
【练习5】
下列叙述正确的是( )
A.两个非金属原子之间可能形成离子键
B.非金属原子间不可能形成离子化合物
C.离子化合物中可能有共价键
D.共价化合物中可能有离子键
课堂练习
C
【练习6】
下列物质中,只含有非极性共价键的( )
A.NaOH
B.NaCl
C.H2
D.H2S
课堂练习
C
【练习7】
下列物质中,含有极性共价键的是( )
A.单质碘
B.氯化镁
C.溴化钾
D.水
课堂练习
D
【练习8】
(双选)下列粒子中,同时具有离子键和共价键的是( )
A.NH3
B.NH4Cl
C.H2S
D.KOH
课堂练习
BD
【练习9】
(双选)下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是( )
A.BF3
B.CCl4
C.CO2
D.PCl5
课堂练习
AD
【练习10】
(双选)下列电子式书写正确的是( )
课堂练习
AC
课堂小结
谢谢大家
