第四章 章末复习--人教版高中化学必修第一册教学课件(共44张PPT)
文档属性
| 名称 | 第四章 章末复习--人教版高中化学必修第一册教学课件(共44张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 990.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:10:20 | ||
图片预览










文档简介
(共44张PPT)
章末复习
第四章 物质结构 元素周期律
化学
1.理解和掌握原子核外电子的排布规律,能够正确书写前20号元素的原子结构示意图,能够熟练书写常见物质的电子式。
2.了解元素周期表的结构,理解元素周期表与原子结构的关系,会应用元素周期表。
3.巩固元素周期律的实质及内容,通过自主学习过程,培养自己总结问题、归纳问题的能力。
学习目标
4.能初步具有总结元素递变规律的能力,能把“位、构、性”初步联系起来并熟练运用。
重点、难点:
“位、构、性”三者之间的规律及其应用。
学习重难点
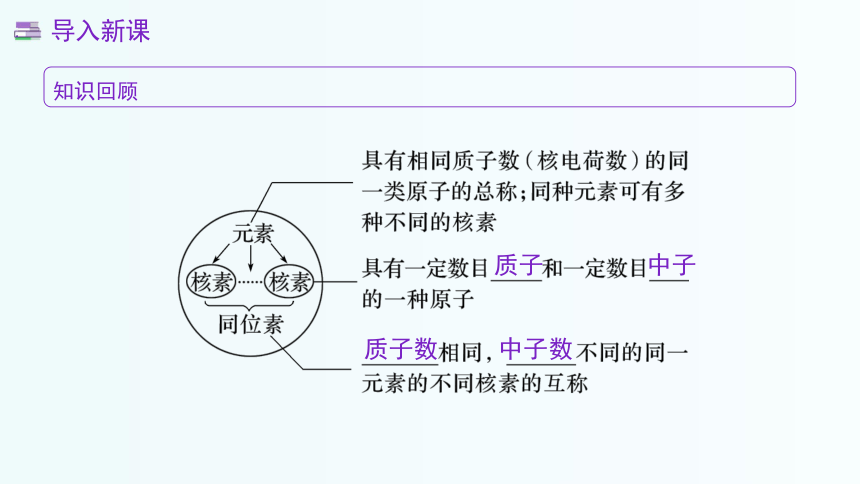
知识回顾
导入新课
质子
中子
质子数
中子数
导入新课
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素
B.的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
D
课堂探究
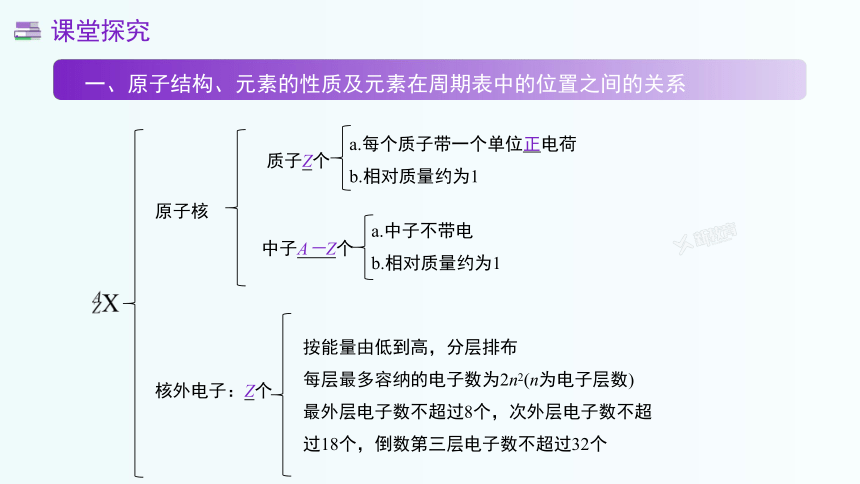
原子核
质子Z个
a.每个质子带一个单位正电荷
b.相对质量约为1
中子A-Z个
a.中子不带电
b.相对质量约为1
核外电子:Z个
按能量由低到高,分层排布
每层最多容纳的电子数为2n2(n为电子层数)
最外层电子数不超过8个,次外层电子数不超
过18个,倒数第三层电子数不超过32个
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
【问题1】原子如何构成,如何表示原子的结构?
原子由原子核和核外电子构成,原子核由质子和中子构成。用原子结构示意图表示原子结构。
总结:质子数决定元素的种类,中子数决定质量数,核外电子数决定元素的性质,电子层数=周期数,最外层电子数=主族序数。
【问题2】核外电子如何排布,排布规律是什么?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
核外电子分层排布,排布规律如下:
①每个电子层最多排2n2个电子;
②最外层排小于等于8个电子(K层只有2个电子),次外层排小于等于18个电子,倒数第三层排小于等于32个电子;
③先排能量低的电子层,后排能量高的电子层。
[例1-1]据报道,某些建筑材料会产生放射性同位素 从而对人体产生伤害。该同位素原子的中子数和质子数之差是( )
A.136
B.50
C.86
D.222
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
B
【规律总结】
质量数、质子数、中子数的关系:
原子中质子数和核电荷数、核外电子数的关系:
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
质子数=核电荷数=核外电子数
质量数=质子数+中子数
阴离子中质子数和核电荷数、核外电子数的关系:
阳离子中质子数和核电荷数、核外电子数的关系:
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
质子数=核电荷数=离子的核外电子数+离子电荷数
质子数=核电荷数=离子的核外电子数-离子电荷数
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
原子由原子核和核外电子构成,原子核由质子和中子构成。用原子结构示意图表示原子结构。
2.核素、同位素
【问题3】什么是核素、同位素?如何区分元素、核素、同位素?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
项目 元素
概念
特点
实例
具有相同核电荷数的一类原子的总称
元素的种类由质子数决定
总称氢元素
总称碳元素
总称氯元素
核素
具有一定数目的质子和中子的一种原子
核素的种类由质子数和中子数共同决定
表示8种不同的核素
同位素
同种元素的不同
核素之间的互称
同种元素的同位素的种类由中子数决定
氢元素有三种同位素
它们在周期表中占同一个位置
【规律总结】元素、核素、同位素三者的关系
[思考]我们又是如何确元素的相对原子量?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
元素
核素
核素
……
(同位素)
元素平均相对原子量:A=A1·x1+ A2·x2+ A3·x3……
[例1-2]Se是人体必需微量元素,下列有关和的说法正确的是( )
A.和互为同素异形体
B.和互为同位素
C.和分别含有44和46个质子
D.和都含有34个中子
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
B
3.周期表与原子结构的的关系
【问题4】元素周期表是如何编制的?元素周期表的结构又是怎样的?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵列。元素周期表的结构:7个周期(3个短周期、4个长周期)和16个族(7个主族、8个副族、1个0族
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
1编排原则
2结构
元素周期表
周期
族
短周期 第1、2、3周期
长周期 第4、5、6、7周期
主族:IA~VIIA
副族:IB~VIIB
0族:稀有气体
VIII族
[例1-3]钒被誉为“合金中的维生素”。钒元素的部分信息如图所示。请回答下列问题:
(1)钒原子的质子数为___,x=___。
(2)钒属于 (填“金属”或“非金属”)元素;钒的相对原子质量为 。
(3)钒元素位于元素周期表中的第___周期
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
23
2
金属
50.49
四
【问题1】元素周期表中元素的排列呈现出周期性的变化规律,元素的性质也呈现出了周期性的变化规律,主要表现在哪些方面?出现这些变化的原因是什么?
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
元素周期律的内容、元素化合价、原子半径等变化规律,原因是元素原子的核外电子排布呈周期性变化。
1.元素周期律
(1)概念:
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
元素的性质(原子半径、主要化合价)随着原子序数的递增而呈周期性的变化
1.元素周期律
(2)规律
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
①原子半径:同周期元素(稀有气体元素除外)从左到右,原子半径逐渐变小,同主族元素从上到下,原子半径逐渐变大。
②主要化合价: +1、 +2、+3 、 +4 、+5 、+6 、+7、0 、-4 、-3 、-2 、-1
原因:核外电子排布随着原子序数的递增而呈周期性的变化 (1~8)
[例2-1]某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX
B. H2X
C. XH3
D. XH4
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
B
【问题2】元素的性质与元素在周期表中的位置有什么关系?
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
同一主族:最外层电子数相同,从上到下核电荷数增多,电子层数增多,原子半径增大,原子核对最外层电子的吸引力减弱,失电子能力增强,还原性增强,金属性增强,得电子能力减弱,氧化性减弱,非金属性减弱。
同一周期:电子层数相同,从左到右,金属性逐渐减弱,非金属性逐渐增强。金属性越强,最高价氧化物对应水化物的碱性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,单质与氢气的反应条件越容易,生成的氢化物稳定性越强
[例2-2]同周期的三种元素X、Y、Z,已知它们的最高价含氧酸的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列叙述正确的是( )
A.非金属性:X>Y>Z
B. X、Y、Z形成的阴离子还原性逐渐减弱
C.原子半径:X>Y>Z
D. X、Y、Z的气态氢化物稳定性由弱到强
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
A
2.粒子半径大小的比较规律
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
(1)同周期元素(稀有气体元素除外)的原子半径:从左到右,原子半径逐渐减小。
(2)同主族元素的原子半径和离子半径:从上到下,原子(离子)半径逐渐增大。
(3)电子层结构相同的离子:核电荷数越大,离子半径越小。
(4)同种元素的粒子半径:同一元素的阳离子半径<相应原子半径,阴离子半径>相应原子半径;同种元素形成的不同价态的离子,价态越高,离子半径越小。
3.元素的金属性和非金属性强弱的判断依据
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
金属性强弱的判断依据:
(1)金属单质与水或者酸反应的快慢。
(2)最高价氧化物对应的水化物的碱性强弱。
(3)金属与盐溶液发生的金属间的置换反应。
3.元素的金属性和非金属性强弱的判断依据
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
非金属性强弱的判断依据:
(1)非金属单质与氢气反应的难易。
(2)气态氢化物的稳定性强弱。
(3)最高价氧化物对应的水化物的酸性强弱。
(4)非金属单质间的置换反应。
【迁移应用】
1.推断元素位置、结构和性质
右图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是( )
A.三种元素的原子半径的大小顺序是B<A<C
B.A元素最高价氧化物的对应化物具有强氧化性和不稳定性
C.B元素的氧化物、氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能跟水激烈反应的单质
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
A
2.比较或推断一些性质
R、W、X 、Y 、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是( m、n 均为正整数)( )
A .若 R(OH)n 为强碱,则W(OH)n+1也为强碱
B .若 HnXOm 为强酸,则Y是活泼非金属元素
C .若 Y的最低化合价为-2,则Z的最高正化合价为+6
D .若 X的最高正化合价为+5,则五种元素都是非金属元素
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
B
利用元素周期表及元素周期律我们可以比较或推断一些性质:
比较同主族元素的金属性、非金属性、最高价氧化物对应的水化物的酸碱性、氢化物的稳定性;
比较同周期元素及其化合物的性质;
比较不同周期元素的性质(先找出与其同周期元素作参照),推断一些未知元素及其化合物的性质。
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
【问题1】原子间为什么能相互结合?
课堂探究
三、从粒子间的相互作用来认识物质及其变化
原子结合的作用力:离子键、共价键。
化学键
离子键 形成离子化合物
共价键
极性键
非极性键
【问题2】哪些元素之间能形成离子键,哪些元素之间能形成共价键?又如何用电子式表示离子化合物和共价化合物?
课堂探究
三、从粒子间的相互作用来认识物质及其变化
一般来说活泼金属IA和IIA族和活泼非金属VIA和VIIA族之间可形成离子化合物,非金属元素之间一般能形成共价化合物(除铵盐)。
用电子式表示离子化合物时,需标出阳离子和阴离子所带的电荷,且阴离子及铵根离子需用方括号括起来,而用电子式表示共价化合物时,则不需要标出电荷和用方括号将阴离子括起来。
[例3-1]下列物质的电子式书写正确的是( )
课堂探究
三、从粒子间的相互作用来认识物质及其变化
A
[例3-1]
课堂探究
三、从粒子间的相互作用来认识物质及其变化
A. NH4Cl为离子化合物,氯离子需要标出最外层电子,正确的电子式为 。
B错误;氨中N的最外层应为8电子的稳定结构,应为 V 。
C错误;H2S为共价化合物,不带电荷。
[例3-2]根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2
⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是_________________________ (用序号回答,下同)。
(2)含有共价键的离子化合物是(用序号回答)_________________________ 。
(3)含有共价键的共价化合物是(用序号回答)_________________________ 。
(4)熔融状态时和固态时,都能导电的有(用序号回答)______________ 。
课堂探究
三、从粒子间的相互作用来认识物质及其变化
①
③⑤⑥
②④⑦
⑩
化学键类型判断中注意问题
(1)部分物质中不一定含有化学键。如稀有气体分子中不含化学键。
(2)离子化合物中一定含离子键,可能有共价键。共价化合物中只有共价键。
(3)金属与非金属形成的化合物不一定都是离子化合物,如AlCl3。
(4)只由非金属元素的化合物不一定共价化合物,也可能是离子化合物,如铵盐。
课堂探究
三、从粒子间的相互作用来认识物质及其变化
【练习1】
下列各组粒子中属于同位素的是( )
A.16O和18O
B.H2O和D2O
C.H2和D2
D.24Mg和24Na
课堂练习
A
【练习2】
下列物质中,只含有离子键,不含有共价键的是( )
A.HCl
B.KOH
C.CaCl2
D.CO2
课堂练习
C
【练习3】
下列递变情况中正确的是( )
A.Na、Mg、Al原子的最外层电子数依次减少
B.Si、P、S元素的最高正化合价依次降低
C.C、N、O的原子半径依次减小
D.Li、Na、K的金属性依次减弱
课堂练习
C
【练习4】
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
课堂练习
项目 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高或最 低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。
①在元素周期表中的位置是 。
Li
硼
第二周期第ⅥA族
【练习4】
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是 ,名称是 ;碱性最强的化合物的电子式是 ,属于 (填“离子”或“共价”)化合物。
(3)比较④和⑦的氢化物的稳定性: (用化学式表示)。
(4)用电子式表示①的氢化物的形成过程: 。
(5)写出⑦的最高价氧化物对应的水化物与它的氢化物反应的
化学方程式: 。
(6)写出②的最高价氧化物对应的水化物与⑤的氢化物水溶液反应的离子方程式
: 。
课堂练习
HClO4
高氯酸
离子
NH3>PH3
NH3+HNO3===NH4NO3
Mg(OH)2+2H+===Mg2++2H2O
【练习5】
短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表第ⅢA族,W与X属于同一主族。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)
B.由X、Y组成的化合物中均不含共价键
C.Y的最高价氧化物的水化物的碱性比Z的弱
D.X的简单气态氢化物的热稳定性比W的强
课堂练习
D
课堂小结
谢谢大家
章末复习
第四章 物质结构 元素周期律
化学
1.理解和掌握原子核外电子的排布规律,能够正确书写前20号元素的原子结构示意图,能够熟练书写常见物质的电子式。
2.了解元素周期表的结构,理解元素周期表与原子结构的关系,会应用元素周期表。
3.巩固元素周期律的实质及内容,通过自主学习过程,培养自己总结问题、归纳问题的能力。
学习目标
4.能初步具有总结元素递变规律的能力,能把“位、构、性”初步联系起来并熟练运用。
重点、难点:
“位、构、性”三者之间的规律及其应用。
学习重难点
知识回顾
导入新课
质子
中子
质子数
中子数
导入新课
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A.In是第五周期第ⅢA族元素
B.的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
D
课堂探究
原子核
质子Z个
a.每个质子带一个单位正电荷
b.相对质量约为1
中子A-Z个
a.中子不带电
b.相对质量约为1
核外电子:Z个
按能量由低到高,分层排布
每层最多容纳的电子数为2n2(n为电子层数)
最外层电子数不超过8个,次外层电子数不超
过18个,倒数第三层电子数不超过32个
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
【问题1】原子如何构成,如何表示原子的结构?
原子由原子核和核外电子构成,原子核由质子和中子构成。用原子结构示意图表示原子结构。
总结:质子数决定元素的种类,中子数决定质量数,核外电子数决定元素的性质,电子层数=周期数,最外层电子数=主族序数。
【问题2】核外电子如何排布,排布规律是什么?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
核外电子分层排布,排布规律如下:
①每个电子层最多排2n2个电子;
②最外层排小于等于8个电子(K层只有2个电子),次外层排小于等于18个电子,倒数第三层排小于等于32个电子;
③先排能量低的电子层,后排能量高的电子层。
[例1-1]据报道,某些建筑材料会产生放射性同位素 从而对人体产生伤害。该同位素原子的中子数和质子数之差是( )
A.136
B.50
C.86
D.222
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
B
【规律总结】
质量数、质子数、中子数的关系:
原子中质子数和核电荷数、核外电子数的关系:
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
质子数=核电荷数=核外电子数
质量数=质子数+中子数
阴离子中质子数和核电荷数、核外电子数的关系:
阳离子中质子数和核电荷数、核外电子数的关系:
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
质子数=核电荷数=离子的核外电子数+离子电荷数
质子数=核电荷数=离子的核外电子数-离子电荷数
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
原子由原子核和核外电子构成,原子核由质子和中子构成。用原子结构示意图表示原子结构。
2.核素、同位素
【问题3】什么是核素、同位素?如何区分元素、核素、同位素?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
项目 元素
概念
特点
实例
具有相同核电荷数的一类原子的总称
元素的种类由质子数决定
总称氢元素
总称碳元素
总称氯元素
核素
具有一定数目的质子和中子的一种原子
核素的种类由质子数和中子数共同决定
表示8种不同的核素
同位素
同种元素的不同
核素之间的互称
同种元素的同位素的种类由中子数决定
氢元素有三种同位素
它们在周期表中占同一个位置
【规律总结】元素、核素、同位素三者的关系
[思考]我们又是如何确元素的相对原子量?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
元素
核素
核素
……
(同位素)
元素平均相对原子量:A=A1·x1+ A2·x2+ A3·x3……
[例1-2]Se是人体必需微量元素,下列有关和的说法正确的是( )
A.和互为同素异形体
B.和互为同位素
C.和分别含有44和46个质子
D.和都含有34个中子
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
B
3.周期表与原子结构的的关系
【问题4】元素周期表是如何编制的?元素周期表的结构又是怎样的?
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵列。元素周期表的结构:7个周期(3个短周期、4个长周期)和16个族(7个主族、8个副族、1个0族
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
1编排原则
2结构
元素周期表
周期
族
短周期 第1、2、3周期
长周期 第4、5、6、7周期
主族:IA~VIIA
副族:IB~VIIB
0族:稀有气体
VIII族
[例1-3]钒被誉为“合金中的维生素”。钒元素的部分信息如图所示。请回答下列问题:
(1)钒原子的质子数为___,x=___。
(2)钒属于 (填“金属”或“非金属”)元素;钒的相对原子质量为 。
(3)钒元素位于元素周期表中的第___周期
课堂探究
一、原子结构、元素的性质及元素在周期表中的位置之间的关系
23
2
金属
50.49
四
【问题1】元素周期表中元素的排列呈现出周期性的变化规律,元素的性质也呈现出了周期性的变化规律,主要表现在哪些方面?出现这些变化的原因是什么?
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
元素周期律的内容、元素化合价、原子半径等变化规律,原因是元素原子的核外电子排布呈周期性变化。
1.元素周期律
(1)概念:
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
元素的性质(原子半径、主要化合价)随着原子序数的递增而呈周期性的变化
1.元素周期律
(2)规律
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
①原子半径:同周期元素(稀有气体元素除外)从左到右,原子半径逐渐变小,同主族元素从上到下,原子半径逐渐变大。
②主要化合价: +1、 +2、+3 、 +4 、+5 、+6 、+7、0 、-4 、-3 、-2 、-1
原因:核外电子排布随着原子序数的递增而呈周期性的变化 (1~8)
[例2-1]某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX
B. H2X
C. XH3
D. XH4
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
B
【问题2】元素的性质与元素在周期表中的位置有什么关系?
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
同一主族:最外层电子数相同,从上到下核电荷数增多,电子层数增多,原子半径增大,原子核对最外层电子的吸引力减弱,失电子能力增强,还原性增强,金属性增强,得电子能力减弱,氧化性减弱,非金属性减弱。
同一周期:电子层数相同,从左到右,金属性逐渐减弱,非金属性逐渐增强。金属性越强,最高价氧化物对应水化物的碱性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,单质与氢气的反应条件越容易,生成的氢化物稳定性越强
[例2-2]同周期的三种元素X、Y、Z,已知它们的最高价含氧酸的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列叙述正确的是( )
A.非金属性:X>Y>Z
B. X、Y、Z形成的阴离子还原性逐渐减弱
C.原子半径:X>Y>Z
D. X、Y、Z的气态氢化物稳定性由弱到强
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
A
2.粒子半径大小的比较规律
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
(1)同周期元素(稀有气体元素除外)的原子半径:从左到右,原子半径逐渐减小。
(2)同主族元素的原子半径和离子半径:从上到下,原子(离子)半径逐渐增大。
(3)电子层结构相同的离子:核电荷数越大,离子半径越小。
(4)同种元素的粒子半径:同一元素的阳离子半径<相应原子半径,阴离子半径>相应原子半径;同种元素形成的不同价态的离子,价态越高,离子半径越小。
3.元素的金属性和非金属性强弱的判断依据
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
金属性强弱的判断依据:
(1)金属单质与水或者酸反应的快慢。
(2)最高价氧化物对应的水化物的碱性强弱。
(3)金属与盐溶液发生的金属间的置换反应。
3.元素的金属性和非金属性强弱的判断依据
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
非金属性强弱的判断依据:
(1)非金属单质与氢气反应的难易。
(2)气态氢化物的稳定性强弱。
(3)最高价氧化物对应的水化物的酸性强弱。
(4)非金属单质间的置换反应。
【迁移应用】
1.推断元素位置、结构和性质
右图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下面叙述中不正确的是( )
A.三种元素的原子半径的大小顺序是B<A<C
B.A元素最高价氧化物的对应化物具有强氧化性和不稳定性
C.B元素的氧化物、氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中唯一能跟水激烈反应的单质
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
A
2.比较或推断一些性质
R、W、X 、Y 、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是( m、n 均为正整数)( )
A .若 R(OH)n 为强碱,则W(OH)n+1也为强碱
B .若 HnXOm 为强酸,则Y是活泼非金属元素
C .若 Y的最低化合价为-2,则Z的最高正化合价为+6
D .若 X的最高正化合价为+5,则五种元素都是非金属元素
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
B
利用元素周期表及元素周期律我们可以比较或推断一些性质:
比较同主族元素的金属性、非金属性、最高价氧化物对应的水化物的酸碱性、氢化物的稳定性;
比较同周期元素及其化合物的性质;
比较不同周期元素的性质(先找出与其同周期元素作参照),推断一些未知元素及其化合物的性质。
课堂探究
二、原子的结构、元素性质的周期性变化(难点)
【问题1】原子间为什么能相互结合?
课堂探究
三、从粒子间的相互作用来认识物质及其变化
原子结合的作用力:离子键、共价键。
化学键
离子键 形成离子化合物
共价键
极性键
非极性键
【问题2】哪些元素之间能形成离子键,哪些元素之间能形成共价键?又如何用电子式表示离子化合物和共价化合物?
课堂探究
三、从粒子间的相互作用来认识物质及其变化
一般来说活泼金属IA和IIA族和活泼非金属VIA和VIIA族之间可形成离子化合物,非金属元素之间一般能形成共价化合物(除铵盐)。
用电子式表示离子化合物时,需标出阳离子和阴离子所带的电荷,且阴离子及铵根离子需用方括号括起来,而用电子式表示共价化合物时,则不需要标出电荷和用方括号将阴离子括起来。
[例3-1]下列物质的电子式书写正确的是( )
课堂探究
三、从粒子间的相互作用来认识物质及其变化
A
[例3-1]
课堂探究
三、从粒子间的相互作用来认识物质及其变化
A. NH4Cl为离子化合物,氯离子需要标出最外层电子,正确的电子式为 。
B错误;氨中N的最外层应为8电子的稳定结构,应为 V 。
C错误;H2S为共价化合物,不带电荷。
[例3-2]根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2
⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是_________________________ (用序号回答,下同)。
(2)含有共价键的离子化合物是(用序号回答)_________________________ 。
(3)含有共价键的共价化合物是(用序号回答)_________________________ 。
(4)熔融状态时和固态时,都能导电的有(用序号回答)______________ 。
课堂探究
三、从粒子间的相互作用来认识物质及其变化
①
③⑤⑥
②④⑦
⑩
化学键类型判断中注意问题
(1)部分物质中不一定含有化学键。如稀有气体分子中不含化学键。
(2)离子化合物中一定含离子键,可能有共价键。共价化合物中只有共价键。
(3)金属与非金属形成的化合物不一定都是离子化合物,如AlCl3。
(4)只由非金属元素的化合物不一定共价化合物,也可能是离子化合物,如铵盐。
课堂探究
三、从粒子间的相互作用来认识物质及其变化
【练习1】
下列各组粒子中属于同位素的是( )
A.16O和18O
B.H2O和D2O
C.H2和D2
D.24Mg和24Na
课堂练习
A
【练习2】
下列物质中,只含有离子键,不含有共价键的是( )
A.HCl
B.KOH
C.CaCl2
D.CO2
课堂练习
C
【练习3】
下列递变情况中正确的是( )
A.Na、Mg、Al原子的最外层电子数依次减少
B.Si、P、S元素的最高正化合价依次降低
C.C、N、O的原子半径依次减小
D.Li、Na、K的金属性依次减弱
课堂练习
C
【练习4】
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
课堂练习
项目 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高或最 低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。
①在元素周期表中的位置是 。
Li
硼
第二周期第ⅥA族
【练习4】
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是 ,名称是 ;碱性最强的化合物的电子式是 ,属于 (填“离子”或“共价”)化合物。
(3)比较④和⑦的氢化物的稳定性: (用化学式表示)。
(4)用电子式表示①的氢化物的形成过程: 。
(5)写出⑦的最高价氧化物对应的水化物与它的氢化物反应的
化学方程式: 。
(6)写出②的最高价氧化物对应的水化物与⑤的氢化物水溶液反应的离子方程式
: 。
课堂练习
HClO4
高氯酸
离子
NH3>PH3
NH3+HNO3===NH4NO3
Mg(OH)2+2H+===Mg2++2H2O
【练习5】
短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表第ⅢA族,W与X属于同一主族。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)
B.由X、Y组成的化合物中均不含共价键
C.Y的最高价氧化物的水化物的碱性比Z的弱
D.X的简单气态氢化物的热稳定性比W的强
课堂练习
D
课堂小结
谢谢大家
