第三章 第一节 铁及其化合物 第2课时 铁的氢氧化物 铁盐和亚铁盐--人教版高中化学必修第一册教学课件(共38张PPT)
文档属性
| 名称 | 第三章 第一节 铁及其化合物 第2课时 铁的氢氧化物 铁盐和亚铁盐--人教版高中化学必修第一册教学课件(共38张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 149.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:10:34 | ||
图片预览











文档简介
(共38张PPT)
第2课时 铁的氢氧化物 铁盐和亚铁盐
第一节 铁及其化合物
化学
学习目标
1.了解铁的氢氧化物的颜色和化学性质。
2.了解铁盐和亚铁盐的转化。
3.了解铁离子的检验方法。
重点、难点:
氢氧化亚铁的制备、性质,亚铁离子和铁离子的转化及其检验。
学习重难点
导入新课
一、铁的氢氧化物
[情境设问]
在上一节课中,我们已经知道了铁是人体必需微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率高、耗资大的公共卫生问题。那么以下图片是我们身体内摄取铁元素的2个途径。
铁的试剂有很多,例如:葡萄糖酸亚铁、琥珀酸亚铁等,这说明补铁时补的都是亚铁离子。
导入新课
除了以上两个途径,我们生活中还有哪些摄取铁元素的途径?我们补铁补的是哪个离子?
那我们如何来检验补铁试剂中的亚铁离子呢?这节课我们来一起学习铁的氢氧化物及铁盐的有关知识。
一、铁的氢氧化物
课堂探究
Fe(OH)3
Fe(OH)2
一、铁的氢氧化物
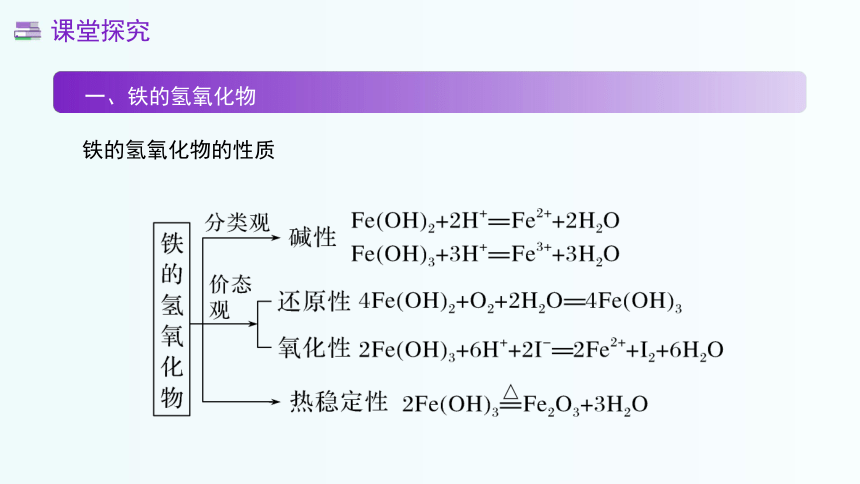
向氯化铁溶液中滴加氢氧化钠溶液有红褐色沉淀生成,该沉淀为氢氧化铁,反应的离子方程式为Fe3++3OH-=== Fe(OH)3↓
同学们在初中学习了氢氧化铁是红褐色沉淀,我们是不是可以用向补铁试剂的溶液中滴加氢氧化钠溶液的方法来检验其中的亚铁离子呢?那么我们来看一下实验视频
课堂探究
一、铁的氢氧化物
铁的氢氧化物的性质
课堂探究
一、铁的氢氧化物
Fe(OH)2具有强的还原性,极易被空气中的氧气氧化为Fe(OH)3,因此实验室 在制备Fe(OH)2时,要注意隔绝空气。常采取以下方法:
方法一: 有机覆盖层法 将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图所示
方法二: 还原性气体保护法 用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图所示
课堂探究
一、铁的氢氧化物
如何得到较为纯净的氢氧化亚铁呢?
课堂探究
一、铁的氢氧化物
可以。因为铁离子(Fe3+)与氢氧化钠(NaOH)反应会生成红褐色的氢氧化铁沉淀,化学方程式为Fe3+ + 3OH-==Fe(OH)3,通过观察是否产生红褐色沉淀就能判断溶液中是否存在铁离子。
1.为什么要将胶头滴管的尖嘴伸入液面以下进行反应?
2.是不是可以采用向溶液中加入氢氧化钠溶液的方法检验铁离子?
由视频我们可以得到氢氧化铁和氢氧化亚铁在颜色上有差异,两者都是碱,都可以与酸反应生成盐和水,另外氢氧化铁受热不稳定,会分解得到氧化铁和水,即2Fe(OH)3 Fe2O3+3H2O。
课堂探究
一、铁的氢氧化物
【问题讨论】
1. 请问上述两种方法可以制备较为纯净的白色Fe(OH)2沉淀的原因是什么?
方法一:用苯液封,装有NaOH溶液的胶头滴管插入液面以下慢慢挤出溶液;方法二:则利用反应产生的H2排尽装置中的空气;这些操作均能防止Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
课堂探究
一、铁的氢氧化物
【问题讨论】
2. 结合装置,请你分析和说明方法二能制备较为纯净的白色的Fe(OH)2沉淀的工作原理是什么?
方法二中打开止水夹a,铁粉与稀硫酸反应生成的氢气排出了装置内的空气,同时试管内剩余的氢气起到保护气的作用,然后关闭止水夹a,在压强的作用下,生成的硫酸亚铁溶液被压到右边与NaOH溶液混合,生成了白色Fe(OH)2沉淀,防止了Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
课堂探究
一、铁的氢氧化物
一、铁的氢氧化物
【易错点】
成功制备Fe(OH)2的关键
①由于Fe(OH)2具有很强的还原性,易被氧化为 Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。
制备原理:Fe2++2OH-===Fe(OH)2↓
成功关键:①溶液中不含Fe3+和O2等氧化性物质。
②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
课堂探究
2Fe3++Fe===3Fe2+
2Fe2++Cl2==2Fe3++2Cl-
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
1.从化合价不变角度预测Fe2+和Fe3+的性质
①具有盐的通性,与金属单质、碱、盐等发生反应如与碱(NaOH溶液)反应的离子方程式分别为
2.从化合价改变角度预测Fe2+和Fe3+的性质
①Fe2+具有氧化性和还原性,如硫酸亚铁与氯水反应的离子方程式为
②Fe3+具有氧化性,如硫酸铁与铁粉反应的离子方程式为
也具有一定的还原性。如在碱性条件下用NaClO氧化硫酸铁制备Na2FeO4。
课堂探究
一、铁的氢氧化物
(1)检验Fe3+:
(2)检验Fe2+:
向两支试管中分别加入氯化铁和氯化亚铁溶液,再分别滴加KSCN溶液,观察现象。
课堂探究
二、铁盐和亚铁盐
氯化铁溶液显黄色,向其中滴加KSCN溶液,观察到溶液变为红色,反应的离子方程式为Fe3++3SCN-===Fe(SCN)3,氯化亚铁溶液显浅绿色,滴加KSCN溶液后无变化。可以用这样的方法来检验溶液中的铁离子。铁离子的浓度较小的时候,这种检验方法的现象也比较明显,而且亚铁离子等离子的存在,不会对检验Fe3+产生干扰。
课堂探究
二、铁盐和亚铁盐
(3) 转化:Fe3+ Fe2+
向试管中加入一定量的氯化铁溶液,加入过量铁粉振荡,观察现象;再加入KSCN溶液,观察现象;最后滴加氯水,观察现象。
课堂探究
二、铁盐和亚铁盐
二、铁盐和亚铁盐
(1)Fe只具有还原性,可被弱氧化剂(H+、S等)氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。
(2)Fe2+既有氧化性,又有还原性,可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+,可被还原剂(Al、Zn等)还原为Fe。
(3)Fe3+具有氧化性,可被还原剂(Fe、Cu等)还原为Fe2+,可被还原剂(CO等)还原为Fe。
Fe2+、Fe3+、Fe之间的相互转化关系
课堂探究
向氯化铁溶液中加入铁粉,发现溶液的黄色褪去,再加KSCN溶液,发现溶液无变化,这说明铁粉将铁离子还原为亚铁离子,反应的离子方程式为Fe+2Fe3+ ==3Fe2+;向其中滴加氯水,发现溶液变为红色,说明氯水将亚铁离子氧化为铁离子,反应的离子方程式为Cl2+2Fe2+==2Fe3++2Cl-。
课堂探究
二、铁盐和亚铁盐
盐会被较强的还原剂还原为亚铁盐,亚铁盐会被较强的氧化剂氧化为铁盐,两者可以通过氧化还原反应进行相互转化:
二、铁盐和亚铁盐
根据上面的实验,同学们是否能理解铁盐和亚铁盐的转化方法呢?
课堂探究
1.食品中铁元素的测定问题总结
(1)检验铁元素是否存在的依据:把样品中的铁元素转变为Fe3+,Fe3+遇KSCN溶液变为红色。
(2)实验中必须用到的试剂为双氧水(或氯水)、 KSCN溶液。
(3)实验操作中根据选择的不同样品,可以考虑采用灼烧的方法,也可以用研磨的方法,也可以考虑用溶剂溶解,最后得到的试液一定要加入双氧水(或氯水)将其中的铁元素氧化为三价铁,然后加入KSCN溶液,看是否变红来检验是否存在铁元素。
课堂探究
二、铁盐和亚铁盐
2.补铁剂存放及使用的注意事项
(1)补铁剂的有效成分是亚铁盐(如FeSO4),Fe2+被氧化为Fe3+而失去补铁作用,因此需密封、隔绝O2存放,服用补铁剂时搭配维生素C可以增强补铁效果,这是因为维生素C可将Fe3+还原为Fe2+ 。
(2)服用补铁剂时不能和茶水同饮,因为茶水中含大量的鞣酸,鞣酸与Fe2+反应生成鞣酸亚铁,它的性质不稳定,很快被氧化成鞣酸铁而呈蓝黑色。
课堂探究
二、铁盐和亚铁盐
【练习1】
现榨的苹果汁在空气中会由绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁含有Cu2+
C.苹果汁含有OH-
D.苹果汁含有Na+
A
课堂练习
【解析】
苹果汁中含有丰富的铁元素,淡绿色为亚铁离子的颜色,棕黄色为三价铁离子的颜色,因此苹果汁在空气中颜色由淡绿色变为棕黄色,为Fe2+变成Fe3+,故答案为A。
课堂练习
【练习2】
在含有1 mol FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤,然后在空气中灼烧沉淀得到的固体物质是( )
A.Fe
B.FeO
C.Fe(OH)3
D.Fe2O3
D
课堂练习
【解析】
向硫酸亚铁溶液中加入钠,钠和水反应生成氢氧化钠和氢气,发生的反应为2Na+2H2O=2NaOH+H2↑,氢氧化钠和硫酸亚铁反应生成氢氧化亚铁沉淀,发生的反应为2NaOH+FeSO4=Fe(OH)2↓+Na2SO4,氢氧化亚铁被空气中的氧气氧化为氢氧化铁,发生的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,空气中灼烧沉淀氢氧化铁分解生成氧化铁,发生的反应为2Fe(OH)3 Fe2O3+3H2O,所以最后得到固体为氧化铁,故选D。
课堂练习
要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A.滴入KSCN溶液
B.通入氯气
C.加入铜粉
D.加入铁粉
D
【练习3】
课堂练习
【解析】
A项,滴入KSCN溶液可以检验Fe3+,不能除去 FeCl3,不符合题意;B项,通入氯气把FeCl2氧化为FeCl3,不符合题意;C项,加入铜粉与FeCl3反应生成FeCl2和CuCl2,引入新杂质,不符合题意;D项,加入铁粉与FeCl3反应生成 FeCl2,可以除去FeCl3杂质,符合题意。故选A。
课堂练习
将下列四种化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化的是( ) A.FeS
B.Fe2O3
C.FeCl3
D.Fe2(SO4)3
A
【练习4】
课堂练习
【解析】
硫化亚铁和稀盐酸反应生成氯化亚铁,溶液中没有铁离子,滴加硫氰化钾溶液没有颜色变化,加入氯水后氯水具有很强的氧化性,会把亚铁离子氧化成铁离子,溶液显示红色,故A正确;Fe2O3与盐酸反应生成了铁离子,滴加硫酸氢钾溶液后变成红色,故B错误;氯化铁溶液中存在铁离子,滴加硫酸氢钾溶液后变成红色,溶液颜色发生了变化,故C错误;硫酸铁液中存在铁离子,滴加硫酸氢钾溶液后变成红色,溶液颜色发生了变化,故D错误。故选A。
课堂练习
检验菠菜中是否含有铁元素,依次进行灼烧、溶解、过滤、检验四个实验步骤,下列图示装置或原理不合理的是( )
A.图甲用烧杯将菠菜灼烧成灰
B.图乙用浓盐酸溶解灰烬并加水稀释
C.图丙过滤得到含铁元素的滤液
D.图丁检验滤液中是否含Fe2+
A
课堂练习
【练习5】
【解析】
课堂练习
应该用坩埚灼烧菠菜,A错误;溶解时用到了烧杯,用玻璃棒搅拌可以加速溶解,B正确;过滤操作中漏斗末端应紧贴烧杯内壁,用玻璃棒引流,C正确;K3[Fe(CN)6]遇到Fe2+生成蓝色沉淀,D正确。 故选A。
探究补铁剂[主要成分:氯化血红素(含+2价铁)、富锌蛋白粉、维生素C、乳酸、葡萄糖浆]中铁元素是否变质。先取少量补铁剂,用酸性丙酮溶解后制成溶液。下列说法不正确的是( )
实验Ⅰ 取待测液,加入少量KSCN溶液,无明显现象;再加入少量H2O2,溶液不变红
实验Ⅱ 取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色
实验Ⅲ 取实验Ⅰ所得溶液,加入少量盐酸,无明显现象,继续加入H2O2至过量,溶液先变红后褪色
A.实验Ⅰ中加入KSCN溶液无明显现象,与KSCN溶液的用量无关
B.实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了
C.实验Ⅲ中溶液红色褪去,可能是H2O2将SCN-氧化了
D.实验说明,该补铁剂中+2价铁在酸性条件下才能被H2O2氧化
D
课堂练习
【练习6】
课堂练习
【解析】
取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色,说明与KSCN溶液的用量无关,故A正确;维生素C具有还原性,实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了,故B正确; H2O2具有强氧化性,SCN-具有还原性,继续加入H2O2至过量,溶液先变红后褪色,溶液红色褪去,可能是H2O2将SCN-氧化了,故C正确;没有对照实验,无法说明中性、碱性条件下,该补铁剂中+2价铁能否被H2O2氧化,故D错误。
课堂小结
布置作业
课本P77 第2、4、5、6题。
谢谢大家
第2课时 铁的氢氧化物 铁盐和亚铁盐
第一节 铁及其化合物
化学
学习目标
1.了解铁的氢氧化物的颜色和化学性质。
2.了解铁盐和亚铁盐的转化。
3.了解铁离子的检验方法。
重点、难点:
氢氧化亚铁的制备、性质,亚铁离子和铁离子的转化及其检验。
学习重难点
导入新课
一、铁的氢氧化物
[情境设问]
在上一节课中,我们已经知道了铁是人体必需微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率高、耗资大的公共卫生问题。那么以下图片是我们身体内摄取铁元素的2个途径。
铁的试剂有很多,例如:葡萄糖酸亚铁、琥珀酸亚铁等,这说明补铁时补的都是亚铁离子。
导入新课
除了以上两个途径,我们生活中还有哪些摄取铁元素的途径?我们补铁补的是哪个离子?
那我们如何来检验补铁试剂中的亚铁离子呢?这节课我们来一起学习铁的氢氧化物及铁盐的有关知识。
一、铁的氢氧化物
课堂探究
Fe(OH)3
Fe(OH)2
一、铁的氢氧化物
向氯化铁溶液中滴加氢氧化钠溶液有红褐色沉淀生成,该沉淀为氢氧化铁,反应的离子方程式为Fe3++3OH-=== Fe(OH)3↓
同学们在初中学习了氢氧化铁是红褐色沉淀,我们是不是可以用向补铁试剂的溶液中滴加氢氧化钠溶液的方法来检验其中的亚铁离子呢?那么我们来看一下实验视频
课堂探究
一、铁的氢氧化物
铁的氢氧化物的性质
课堂探究
一、铁的氢氧化物
Fe(OH)2具有强的还原性,极易被空气中的氧气氧化为Fe(OH)3,因此实验室 在制备Fe(OH)2时,要注意隔绝空气。常采取以下方法:
方法一: 有机覆盖层法 将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图所示
方法二: 还原性气体保护法 用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图所示
课堂探究
一、铁的氢氧化物
如何得到较为纯净的氢氧化亚铁呢?
课堂探究
一、铁的氢氧化物
可以。因为铁离子(Fe3+)与氢氧化钠(NaOH)反应会生成红褐色的氢氧化铁沉淀,化学方程式为Fe3+ + 3OH-==Fe(OH)3,通过观察是否产生红褐色沉淀就能判断溶液中是否存在铁离子。
1.为什么要将胶头滴管的尖嘴伸入液面以下进行反应?
2.是不是可以采用向溶液中加入氢氧化钠溶液的方法检验铁离子?
由视频我们可以得到氢氧化铁和氢氧化亚铁在颜色上有差异,两者都是碱,都可以与酸反应生成盐和水,另外氢氧化铁受热不稳定,会分解得到氧化铁和水,即2Fe(OH)3 Fe2O3+3H2O。
课堂探究
一、铁的氢氧化物
【问题讨论】
1. 请问上述两种方法可以制备较为纯净的白色Fe(OH)2沉淀的原因是什么?
方法一:用苯液封,装有NaOH溶液的胶头滴管插入液面以下慢慢挤出溶液;方法二:则利用反应产生的H2排尽装置中的空气;这些操作均能防止Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
课堂探究
一、铁的氢氧化物
【问题讨论】
2. 结合装置,请你分析和说明方法二能制备较为纯净的白色的Fe(OH)2沉淀的工作原理是什么?
方法二中打开止水夹a,铁粉与稀硫酸反应生成的氢气排出了装置内的空气,同时试管内剩余的氢气起到保护气的作用,然后关闭止水夹a,在压强的作用下,生成的硫酸亚铁溶液被压到右边与NaOH溶液混合,生成了白色Fe(OH)2沉淀,防止了Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
课堂探究
一、铁的氢氧化物
一、铁的氢氧化物
【易错点】
成功制备Fe(OH)2的关键
①由于Fe(OH)2具有很强的还原性,易被氧化为 Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。
制备原理:Fe2++2OH-===Fe(OH)2↓
成功关键:①溶液中不含Fe3+和O2等氧化性物质。
②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
课堂探究
2Fe3++Fe===3Fe2+
2Fe2++Cl2==2Fe3++2Cl-
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
1.从化合价不变角度预测Fe2+和Fe3+的性质
①具有盐的通性,与金属单质、碱、盐等发生反应如与碱(NaOH溶液)反应的离子方程式分别为
2.从化合价改变角度预测Fe2+和Fe3+的性质
①Fe2+具有氧化性和还原性,如硫酸亚铁与氯水反应的离子方程式为
②Fe3+具有氧化性,如硫酸铁与铁粉反应的离子方程式为
也具有一定的还原性。如在碱性条件下用NaClO氧化硫酸铁制备Na2FeO4。
课堂探究
一、铁的氢氧化物
(1)检验Fe3+:
(2)检验Fe2+:
向两支试管中分别加入氯化铁和氯化亚铁溶液,再分别滴加KSCN溶液,观察现象。
课堂探究
二、铁盐和亚铁盐
氯化铁溶液显黄色,向其中滴加KSCN溶液,观察到溶液变为红色,反应的离子方程式为Fe3++3SCN-===Fe(SCN)3,氯化亚铁溶液显浅绿色,滴加KSCN溶液后无变化。可以用这样的方法来检验溶液中的铁离子。铁离子的浓度较小的时候,这种检验方法的现象也比较明显,而且亚铁离子等离子的存在,不会对检验Fe3+产生干扰。
课堂探究
二、铁盐和亚铁盐
(3) 转化:Fe3+ Fe2+
向试管中加入一定量的氯化铁溶液,加入过量铁粉振荡,观察现象;再加入KSCN溶液,观察现象;最后滴加氯水,观察现象。
课堂探究
二、铁盐和亚铁盐
二、铁盐和亚铁盐
(1)Fe只具有还原性,可被弱氧化剂(H+、S等)氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。
(2)Fe2+既有氧化性,又有还原性,可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+,可被还原剂(Al、Zn等)还原为Fe。
(3)Fe3+具有氧化性,可被还原剂(Fe、Cu等)还原为Fe2+,可被还原剂(CO等)还原为Fe。
Fe2+、Fe3+、Fe之间的相互转化关系
课堂探究
向氯化铁溶液中加入铁粉,发现溶液的黄色褪去,再加KSCN溶液,发现溶液无变化,这说明铁粉将铁离子还原为亚铁离子,反应的离子方程式为Fe+2Fe3+ ==3Fe2+;向其中滴加氯水,发现溶液变为红色,说明氯水将亚铁离子氧化为铁离子,反应的离子方程式为Cl2+2Fe2+==2Fe3++2Cl-。
课堂探究
二、铁盐和亚铁盐
盐会被较强的还原剂还原为亚铁盐,亚铁盐会被较强的氧化剂氧化为铁盐,两者可以通过氧化还原反应进行相互转化:
二、铁盐和亚铁盐
根据上面的实验,同学们是否能理解铁盐和亚铁盐的转化方法呢?
课堂探究
1.食品中铁元素的测定问题总结
(1)检验铁元素是否存在的依据:把样品中的铁元素转变为Fe3+,Fe3+遇KSCN溶液变为红色。
(2)实验中必须用到的试剂为双氧水(或氯水)、 KSCN溶液。
(3)实验操作中根据选择的不同样品,可以考虑采用灼烧的方法,也可以用研磨的方法,也可以考虑用溶剂溶解,最后得到的试液一定要加入双氧水(或氯水)将其中的铁元素氧化为三价铁,然后加入KSCN溶液,看是否变红来检验是否存在铁元素。
课堂探究
二、铁盐和亚铁盐
2.补铁剂存放及使用的注意事项
(1)补铁剂的有效成分是亚铁盐(如FeSO4),Fe2+被氧化为Fe3+而失去补铁作用,因此需密封、隔绝O2存放,服用补铁剂时搭配维生素C可以增强补铁效果,这是因为维生素C可将Fe3+还原为Fe2+ 。
(2)服用补铁剂时不能和茶水同饮,因为茶水中含大量的鞣酸,鞣酸与Fe2+反应生成鞣酸亚铁,它的性质不稳定,很快被氧化成鞣酸铁而呈蓝黑色。
课堂探究
二、铁盐和亚铁盐
【练习1】
现榨的苹果汁在空气中会由绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁含有Cu2+
C.苹果汁含有OH-
D.苹果汁含有Na+
A
课堂练习
【解析】
苹果汁中含有丰富的铁元素,淡绿色为亚铁离子的颜色,棕黄色为三价铁离子的颜色,因此苹果汁在空气中颜色由淡绿色变为棕黄色,为Fe2+变成Fe3+,故答案为A。
课堂练习
【练习2】
在含有1 mol FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤,然后在空气中灼烧沉淀得到的固体物质是( )
A.Fe
B.FeO
C.Fe(OH)3
D.Fe2O3
D
课堂练习
【解析】
向硫酸亚铁溶液中加入钠,钠和水反应生成氢氧化钠和氢气,发生的反应为2Na+2H2O=2NaOH+H2↑,氢氧化钠和硫酸亚铁反应生成氢氧化亚铁沉淀,发生的反应为2NaOH+FeSO4=Fe(OH)2↓+Na2SO4,氢氧化亚铁被空气中的氧气氧化为氢氧化铁,发生的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,空气中灼烧沉淀氢氧化铁分解生成氧化铁,发生的反应为2Fe(OH)3 Fe2O3+3H2O,所以最后得到固体为氧化铁,故选D。
课堂练习
要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A.滴入KSCN溶液
B.通入氯气
C.加入铜粉
D.加入铁粉
D
【练习3】
课堂练习
【解析】
A项,滴入KSCN溶液可以检验Fe3+,不能除去 FeCl3,不符合题意;B项,通入氯气把FeCl2氧化为FeCl3,不符合题意;C项,加入铜粉与FeCl3反应生成FeCl2和CuCl2,引入新杂质,不符合题意;D项,加入铁粉与FeCl3反应生成 FeCl2,可以除去FeCl3杂质,符合题意。故选A。
课堂练习
将下列四种化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化的是( ) A.FeS
B.Fe2O3
C.FeCl3
D.Fe2(SO4)3
A
【练习4】
课堂练习
【解析】
硫化亚铁和稀盐酸反应生成氯化亚铁,溶液中没有铁离子,滴加硫氰化钾溶液没有颜色变化,加入氯水后氯水具有很强的氧化性,会把亚铁离子氧化成铁离子,溶液显示红色,故A正确;Fe2O3与盐酸反应生成了铁离子,滴加硫酸氢钾溶液后变成红色,故B错误;氯化铁溶液中存在铁离子,滴加硫酸氢钾溶液后变成红色,溶液颜色发生了变化,故C错误;硫酸铁液中存在铁离子,滴加硫酸氢钾溶液后变成红色,溶液颜色发生了变化,故D错误。故选A。
课堂练习
检验菠菜中是否含有铁元素,依次进行灼烧、溶解、过滤、检验四个实验步骤,下列图示装置或原理不合理的是( )
A.图甲用烧杯将菠菜灼烧成灰
B.图乙用浓盐酸溶解灰烬并加水稀释
C.图丙过滤得到含铁元素的滤液
D.图丁检验滤液中是否含Fe2+
A
课堂练习
【练习5】
【解析】
课堂练习
应该用坩埚灼烧菠菜,A错误;溶解时用到了烧杯,用玻璃棒搅拌可以加速溶解,B正确;过滤操作中漏斗末端应紧贴烧杯内壁,用玻璃棒引流,C正确;K3[Fe(CN)6]遇到Fe2+生成蓝色沉淀,D正确。 故选A。
探究补铁剂[主要成分:氯化血红素(含+2价铁)、富锌蛋白粉、维生素C、乳酸、葡萄糖浆]中铁元素是否变质。先取少量补铁剂,用酸性丙酮溶解后制成溶液。下列说法不正确的是( )
实验Ⅰ 取待测液,加入少量KSCN溶液,无明显现象;再加入少量H2O2,溶液不变红
实验Ⅱ 取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色
实验Ⅲ 取实验Ⅰ所得溶液,加入少量盐酸,无明显现象,继续加入H2O2至过量,溶液先变红后褪色
A.实验Ⅰ中加入KSCN溶液无明显现象,与KSCN溶液的用量无关
B.实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了
C.实验Ⅲ中溶液红色褪去,可能是H2O2将SCN-氧化了
D.实验说明,该补铁剂中+2价铁在酸性条件下才能被H2O2氧化
D
课堂练习
【练习6】
课堂练习
【解析】
取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色,说明与KSCN溶液的用量无关,故A正确;维生素C具有还原性,实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了,故B正确; H2O2具有强氧化性,SCN-具有还原性,继续加入H2O2至过量,溶液先变红后褪色,溶液红色褪去,可能是H2O2将SCN-氧化了,故C正确;没有对照实验,无法说明中性、碱性条件下,该补铁剂中+2价铁能否被H2O2氧化,故D错误。
课堂小结
布置作业
课本P77 第2、4、5、6题。
谢谢大家
