第四章 第一节 原子结构与元素周期表 第1课时 原子结构 核素--人教版高中化学必修第一册教学课件(共38张PPT)
文档属性
| 名称 | 第四章 第一节 原子结构与元素周期表 第1课时 原子结构 核素--人教版高中化学必修第一册教学课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 79.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:10:51 | ||
图片预览











文档简介
(共38张PPT)
第1课时 原子结构 核素
第一节 原子结构与元素周期表
化学
1.了解原子结构以及质量数、元素、核素、同位素、相对原子质量的概念。
2.初步形成将元素在周期表中的位置与元素组成微粒的结构联系起来的能力。
学习目标
重点、难点:
同位素、质量数和的含义。
学习重难点
导入新课
道尔顿模型(1803年):
坚实的、不可再分实心球
汤姆孙原子模型(1904年):
平均分布着正电荷的粒子,镶嵌着许多电子,中和了正电荷,从而形成中性原子。
卢瑟福原子模型(1911年):
中心有一个带正电荷的核,电子在它的周围沿着不同轨道运转,就像行星环绕太阳运转一样。
玻尔原子模型(1913年):
电子在原子核外空间的一定轨道上绕核做高速圆周运动。
原子结构模型的演变历程
导入新课
现代物质结构学说
材料一:现代物质结构学说认为原子由原子核与核外电子构成,电子在原子核外无确定轨道,而是按概率分布在原子核周围空间形成电子云,电子云的分布及变化决定了原子的化学性质以及原子间的相互作用和化学键的形成等。
电子云模型等现代物质结构学说的建立,使人们能够更深入地理解物质的微观结构和化学变化的本质,推动了化学及相关学科的发展,为材料科学、生命科学等领域的研究提供了重要的理论基础 。
材料引入
电子云模型
导入新课
材料二:自然界中的碳元素有多种同位素,碳-14是其中一种放射性同位素,它会以一定的速率进行衰变。
通过测量古代生物遗体或文物中碳- 14的剩余含量,并与正常大气中碳- 14的含量进行对比,再根据碳-14的衰变规律,就可以计算出该生物死亡或文物制作的年代,从而为考古学研究提供重要的时间依据。
材料引入
导入新课
氢弹制造
氢弹是利用核聚变反应释放巨大能量的一种核武器。在氢弹制造中,氢的同位素氘和氚是关键燃料。
碳- 14考古原理
材料引入
导入新课
原子
原子核
质子:相对质量近似为1,带1个单位正电荷
中子:相对质量近似为1,不带电
核外电子:带1个单位负电荷,质量很小(可忽略不计)
质子
电子
中子
知识回顾
导入新课
参考数据:
①1个核外电子的质量:9.10×10-31 kg
②1个质子的质量:1.6726231 × 10-27 kg
③1个中子的质量:1.6749286 ×10-27 kg
知识回顾
课堂探究
一、质量数
概念:
如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值。常用A表示。
课堂探究
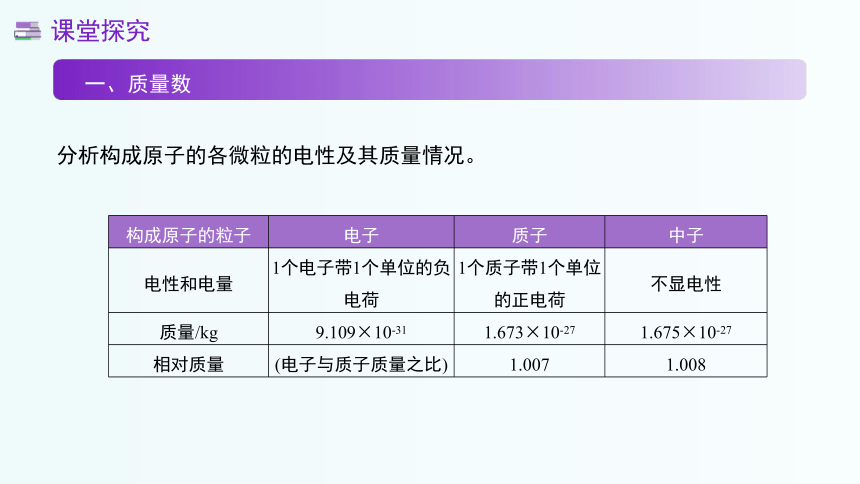
一、质量数
分析构成原子的各微粒的电性及其质量情况。
构成原子的粒子 电子 质子 中子
电性和电量 1个电子带1个单位的负电荷 1个质子带1个单位的正电荷 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 (电子与质子质量之比) 1.007 1.008
课堂探究
一、质量数
从表格得出原子的质量主要取决于哪种微粒?
构成原子的粒子间的两个关系
原子质量主要集中在原子核上,所以,原子质量主要由质子和中子的质量决定。
①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核电荷数=核外电子数。
课堂探究
一、质量数
在化学上,我们为了方便地表示某一原子。在元素符号的左下角标出其质子数,左上角标出质量数,即。
质量数
质子数
元素符号
S
16
32
质量数 A=32
质子数 Z=16
中子数 N=32-16=16
课堂探究
一、质量数
练习,填写表格
粒子符号 质子数(Z) 中子数(N) 质量数(A) 用X表示
①O 8 18
②Al 14 27
③Ar 18 22
④Cl
⑤H
10
13
17
1
18
0
40
35
1
课堂探究
二、核素
科学研究证明,同种元素原子的原子核中,中子数不一定相同。如组成氢元素的氢原子,就有以下三种。
原子符号 质子数 中子数 氢原子的名称和简称
氕(H)
氘(D)
氚(T)
1
0
1
1
1
2
课堂探究
二、核素
概念:
把具有一定数目质子和一定数目中子的一种原子称为核素。
上面的和就是三种核素。
课堂探究
三、同位素
和之间我们把它们互称为什么?
同位素:质子数相同,而中子数不同的同一元素的不同原子(即同一元素的不同核素互称为同位素)。
课堂探究
三、同位素
【问题1】什么是元素?到目前为止,人们已发现了118种元素,能否说已经发现了118种原子?
元素是具有相同核电荷数(即质子数)的一类原子的总称。例如,所有质子数为1的原子都属于氢元素。
不能说发现了118种原子。因为同一种元素可能有多种同位素。同位素是质子数相同但中子数不同的原子。
例如,氢元素有三种同位素,分别是氕(不含中子)、氘(含1个中子)和氚(含2个中子)。所以原子的种类远远多于元素的种类。
课堂探究
三、同位素
同位素的特性
①同位素在元素周期表里占据同一位置。
②同一元素的各种同位素的物理性质有差异,化学性质几乎完全相同。
③在天然存在的某种元素中,不论是游离态,还是化合态,各种同位素所占的丰度(各核素所占的百分比)一般是不变的。
课堂探究
三、同位素
[生活实例]
氢的同位素
氕:是水和有机物组成部分。
氘:核聚变原料,用于制造多种高科技产品。
氚:用于制造氢弹。
氧 – 18:
作科研示踪剂,也用于体育科学中评估能耗。
氙 – 128:
生产碘 - 125用于医学诊断和治疗、科研实验。
放射性同位素应用于诊断和治疗疾病
课堂探究
四、相对原子质量
什么是原子的相对原子质量?如何计算原子的相对原子质量?
相对原子质量的定义:
原子的相对原子质量是以一种碳原子(碳 - 12)质量的为标准,其他原子的质量跟它相比较所得到的比。
相对原子质量的算法是:Ar(X)=
课堂探究
四、相对原子质量
【问题1】原子(核素)的相对原子质量是不是就是该元素的相对质量?
不是,因为一种元素可以有多种原子(核素)。
课堂探究
四、相对原子质量
[练习]
的相对原子质量为34.969,在自然界的含量为75.77%,的相对原子质量为36.966,在自然界的含量为24.23%,
则氯元素的相对原子质量是 ,
氯元素的近似相对原子质量是 。
【解析】氯元素的相对原子质量=34.969×75.77%+36.966×24.23%≈35.453。
氯元素的近似相对原子质量=35×75.77%+37×24.23%=35.484 6≈35.5。
35.453
35. 5
课堂探究
四、相对原子质量
注意:
1.在元素周期表中所查到的相对原子质量就是元素的相对原子质量。
2.元素的近似相对原子质量是我们在计算中常用的。
课堂探究
五、阴、阳离子结构
填写下列表格并思考离子的核外电子数、质子数、电荷数之间的关系。
粒子符号 质子数(Z) 质量数(A) 中子数(N) 电荷数 核外电子数
11 23
17 37
12
1
10
20
1
18
结论:阳离子中核外电子数= - ;
阴离子中核外电子数= + 。
质子数
电荷数
质子数
电荷数
课堂探究
五、阴、阳离子结构
(1)一个信息丰富的符号解读
A——质量数
Z——核电荷数或质子数
n——离子所带的电荷数
b——化学式中原子的个数
(2)粒子中的数量关系
①分子或原子:质子数=核外电子数
②阳离子Xn+:质子数=核外电子数+n
③阴离子Xn-:质子数=核外电子数-n
课堂探究
六、原子核外电子排布
[材料分析]
根据数据分析电子运动的特征:
①速度:炮弹 2 km/s,人造卫星 7.8 km/s,宇宙飞船 11 km/s,氢核外电子2.2×108 m/s;
②乒乓球半径:4×10-2 m;原子半径:约10-10 m。
课堂探究
六、原子核外电子排布
[材料分析]
电子在原子核外是如何运动的?多电子的原子呢?有没有什么规律呢?
绕核运动,电子质量小;运动空间小;运动速度快。
课堂探究
六、原子核外电子排布
1.电子层
(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。
我们把不同的区域简化为不连续的壳层,也称作电子层。
(2)不同电子层的表示及能量关系
各电子层 由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远 能量高低 由低到高 课堂探究
六、原子核外电子排布
2.电子分层排布
(1)能量最低原理
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
课堂探究
六、原子核外电子排布
(2)电子层最多容纳的电子数
①第n层最多容纳2n2个电子。
如K、L、M、N层最多容纳的电子数分别为2、8、18、32。
②最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
③次外层最多能容纳的电子数不超过18个。
课堂探究
六、原子核外电子排布
3.核外电子排布的表示方法
原子(或离子)结构示意图
粒子符号
原子核
质子数(或核电荷数)
电子层
该电子层上的电子数
+11
2 8 1
Na
【练习1】
高铁动车车厢禁止吸烟,高铁装有的离子式烟雾传感器具有稳定性好、灵敏度高的特点,其主体是一个放有镅()放射源的电离室。下列关于的说法正确的是( )
A.核外电子数为95
B.质子数为146
C.质量数为146
D.中子数为95
课堂练习
A
【练习2】
一种中子数为9的氧原子的质量数为____,核外电子数为____,其二价氧离子的质量数为____,核外电子数为____。
课堂练习
17
8
17
10
【练习3】
太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为( )
A.238
B.144
C.94
D.50
课堂练习
D
【练习4】
与Na+具有相同电子数和质子数的微粒是( )
A.OH-
B.H2O
C.CH4
D.
课堂练习
D
课堂小结
谢谢大家
第1课时 原子结构 核素
第一节 原子结构与元素周期表
化学
1.了解原子结构以及质量数、元素、核素、同位素、相对原子质量的概念。
2.初步形成将元素在周期表中的位置与元素组成微粒的结构联系起来的能力。
学习目标
重点、难点:
同位素、质量数和的含义。
学习重难点
导入新课
道尔顿模型(1803年):
坚实的、不可再分实心球
汤姆孙原子模型(1904年):
平均分布着正电荷的粒子,镶嵌着许多电子,中和了正电荷,从而形成中性原子。
卢瑟福原子模型(1911年):
中心有一个带正电荷的核,电子在它的周围沿着不同轨道运转,就像行星环绕太阳运转一样。
玻尔原子模型(1913年):
电子在原子核外空间的一定轨道上绕核做高速圆周运动。
原子结构模型的演变历程
导入新课
现代物质结构学说
材料一:现代物质结构学说认为原子由原子核与核外电子构成,电子在原子核外无确定轨道,而是按概率分布在原子核周围空间形成电子云,电子云的分布及变化决定了原子的化学性质以及原子间的相互作用和化学键的形成等。
电子云模型等现代物质结构学说的建立,使人们能够更深入地理解物质的微观结构和化学变化的本质,推动了化学及相关学科的发展,为材料科学、生命科学等领域的研究提供了重要的理论基础 。
材料引入
电子云模型
导入新课
材料二:自然界中的碳元素有多种同位素,碳-14是其中一种放射性同位素,它会以一定的速率进行衰变。
通过测量古代生物遗体或文物中碳- 14的剩余含量,并与正常大气中碳- 14的含量进行对比,再根据碳-14的衰变规律,就可以计算出该生物死亡或文物制作的年代,从而为考古学研究提供重要的时间依据。
材料引入
导入新课
氢弹制造
氢弹是利用核聚变反应释放巨大能量的一种核武器。在氢弹制造中,氢的同位素氘和氚是关键燃料。
碳- 14考古原理
材料引入
导入新课
原子
原子核
质子:相对质量近似为1,带1个单位正电荷
中子:相对质量近似为1,不带电
核外电子:带1个单位负电荷,质量很小(可忽略不计)
质子
电子
中子
知识回顾
导入新课
参考数据:
①1个核外电子的质量:9.10×10-31 kg
②1个质子的质量:1.6726231 × 10-27 kg
③1个中子的质量:1.6749286 ×10-27 kg
知识回顾
课堂探究
一、质量数
概念:
如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值。常用A表示。
课堂探究
一、质量数
分析构成原子的各微粒的电性及其质量情况。
构成原子的粒子 电子 质子 中子
电性和电量 1个电子带1个单位的负电荷 1个质子带1个单位的正电荷 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 (电子与质子质量之比) 1.007 1.008
课堂探究
一、质量数
从表格得出原子的质量主要取决于哪种微粒?
构成原子的粒子间的两个关系
原子质量主要集中在原子核上,所以,原子质量主要由质子和中子的质量决定。
①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核电荷数=核外电子数。
课堂探究
一、质量数
在化学上,我们为了方便地表示某一原子。在元素符号的左下角标出其质子数,左上角标出质量数,即。
质量数
质子数
元素符号
S
16
32
质量数 A=32
质子数 Z=16
中子数 N=32-16=16
课堂探究
一、质量数
练习,填写表格
粒子符号 质子数(Z) 中子数(N) 质量数(A) 用X表示
①O 8 18
②Al 14 27
③Ar 18 22
④Cl
⑤H
10
13
17
1
18
0
40
35
1
课堂探究
二、核素
科学研究证明,同种元素原子的原子核中,中子数不一定相同。如组成氢元素的氢原子,就有以下三种。
原子符号 质子数 中子数 氢原子的名称和简称
氕(H)
氘(D)
氚(T)
1
0
1
1
1
2
课堂探究
二、核素
概念:
把具有一定数目质子和一定数目中子的一种原子称为核素。
上面的和就是三种核素。
课堂探究
三、同位素
和之间我们把它们互称为什么?
同位素:质子数相同,而中子数不同的同一元素的不同原子(即同一元素的不同核素互称为同位素)。
课堂探究
三、同位素
【问题1】什么是元素?到目前为止,人们已发现了118种元素,能否说已经发现了118种原子?
元素是具有相同核电荷数(即质子数)的一类原子的总称。例如,所有质子数为1的原子都属于氢元素。
不能说发现了118种原子。因为同一种元素可能有多种同位素。同位素是质子数相同但中子数不同的原子。
例如,氢元素有三种同位素,分别是氕(不含中子)、氘(含1个中子)和氚(含2个中子)。所以原子的种类远远多于元素的种类。
课堂探究
三、同位素
同位素的特性
①同位素在元素周期表里占据同一位置。
②同一元素的各种同位素的物理性质有差异,化学性质几乎完全相同。
③在天然存在的某种元素中,不论是游离态,还是化合态,各种同位素所占的丰度(各核素所占的百分比)一般是不变的。
课堂探究
三、同位素
[生活实例]
氢的同位素
氕:是水和有机物组成部分。
氘:核聚变原料,用于制造多种高科技产品。
氚:用于制造氢弹。
氧 – 18:
作科研示踪剂,也用于体育科学中评估能耗。
氙 – 128:
生产碘 - 125用于医学诊断和治疗、科研实验。
放射性同位素应用于诊断和治疗疾病
课堂探究
四、相对原子质量
什么是原子的相对原子质量?如何计算原子的相对原子质量?
相对原子质量的定义:
原子的相对原子质量是以一种碳原子(碳 - 12)质量的为标准,其他原子的质量跟它相比较所得到的比。
相对原子质量的算法是:Ar(X)=
课堂探究
四、相对原子质量
【问题1】原子(核素)的相对原子质量是不是就是该元素的相对质量?
不是,因为一种元素可以有多种原子(核素)。
课堂探究
四、相对原子质量
[练习]
的相对原子质量为34.969,在自然界的含量为75.77%,的相对原子质量为36.966,在自然界的含量为24.23%,
则氯元素的相对原子质量是 ,
氯元素的近似相对原子质量是 。
【解析】氯元素的相对原子质量=34.969×75.77%+36.966×24.23%≈35.453。
氯元素的近似相对原子质量=35×75.77%+37×24.23%=35.484 6≈35.5。
35.453
35. 5
课堂探究
四、相对原子质量
注意:
1.在元素周期表中所查到的相对原子质量就是元素的相对原子质量。
2.元素的近似相对原子质量是我们在计算中常用的。
课堂探究
五、阴、阳离子结构
填写下列表格并思考离子的核外电子数、质子数、电荷数之间的关系。
粒子符号 质子数(Z) 质量数(A) 中子数(N) 电荷数 核外电子数
11 23
17 37
12
1
10
20
1
18
结论:阳离子中核外电子数= - ;
阴离子中核外电子数= + 。
质子数
电荷数
质子数
电荷数
课堂探究
五、阴、阳离子结构
(1)一个信息丰富的符号解读
A——质量数
Z——核电荷数或质子数
n——离子所带的电荷数
b——化学式中原子的个数
(2)粒子中的数量关系
①分子或原子:质子数=核外电子数
②阳离子Xn+:质子数=核外电子数+n
③阴离子Xn-:质子数=核外电子数-n
课堂探究
六、原子核外电子排布
[材料分析]
根据数据分析电子运动的特征:
①速度:炮弹 2 km/s,人造卫星 7.8 km/s,宇宙飞船 11 km/s,氢核外电子2.2×108 m/s;
②乒乓球半径:4×10-2 m;原子半径:约10-10 m。
课堂探究
六、原子核外电子排布
[材料分析]
电子在原子核外是如何运动的?多电子的原子呢?有没有什么规律呢?
绕核运动,电子质量小;运动空间小;运动速度快。
课堂探究
六、原子核外电子排布
1.电子层
(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。
我们把不同的区域简化为不连续的壳层,也称作电子层。
(2)不同电子层的表示及能量关系
各电子层 由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远 能量高低 由低到高 课堂探究
六、原子核外电子排布
2.电子分层排布
(1)能量最低原理
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
课堂探究
六、原子核外电子排布
(2)电子层最多容纳的电子数
①第n层最多容纳2n2个电子。
如K、L、M、N层最多容纳的电子数分别为2、8、18、32。
②最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
③次外层最多能容纳的电子数不超过18个。
课堂探究
六、原子核外电子排布
3.核外电子排布的表示方法
原子(或离子)结构示意图
粒子符号
原子核
质子数(或核电荷数)
电子层
该电子层上的电子数
+11
2 8 1
Na
【练习1】
高铁动车车厢禁止吸烟,高铁装有的离子式烟雾传感器具有稳定性好、灵敏度高的特点,其主体是一个放有镅()放射源的电离室。下列关于的说法正确的是( )
A.核外电子数为95
B.质子数为146
C.质量数为146
D.中子数为95
课堂练习
A
【练习2】
一种中子数为9的氧原子的质量数为____,核外电子数为____,其二价氧离子的质量数为____,核外电子数为____。
课堂练习
17
8
17
10
【练习3】
太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为( )
A.238
B.144
C.94
D.50
课堂练习
D
【练习4】
与Na+具有相同电子数和质子数的微粒是( )
A.OH-
B.H2O
C.CH4
D.
课堂练习
D
课堂小结
谢谢大家
