第一章 第三节 氧化还原反应 第1课时 氧化还原反应--人教版高中化学必修第一册教学课件(共48张PPT)
文档属性
| 名称 | 第一章 第三节 氧化还原反应 第1课时 氧化还原反应--人教版高中化学必修第一册教学课件(共48张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:11:02 | ||
图片预览










文档简介
(共48张PPT)
第1课时 氧化还原反应
第三节 氧化还原反应
化学
1.通过分析探究氧化还原反应的特征和本质,掌握氧化还原反应的判断方法,培养证据推理与模型认知以及宏观辨识与微观探析的核心素养。
2.通过对氧化还原反应的学习,培养分类对比、由表及里以及逻辑推理的抽象思维方法。
学习目标
3.通过对氧化还原概念的辨析以及探究实验的设计和分析,培养观察、分析和解决问题的能力,树立科学正确的学习观念。
4.通过学习氧化还原反应在生活生产中的应用,感受化学的魅力以及对人类社会发展的重要作用,激发学习化学的热情。
学习重难点
重点、难点:
氧化还原反应的本质以及电子转移的表示方法。
导入新课
[情境引入]
在生活中我们无时无刻不在接触和发现各式各样的物质变化,像图中展示的这几种现象,涉及哪些物质,发生了怎样的变化?
苹果氧化
课堂探究
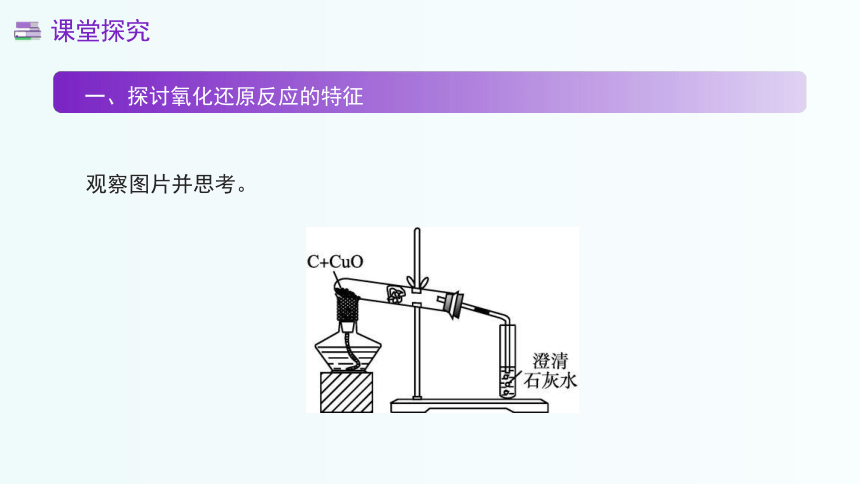
观察图片并思考。
一、探讨氧化还原反应的特征
课堂探究
铁在氧气中燃烧的反应现象。
铁在氧气中燃烧时,会剧烈燃烧,火星四射,并放出大量的热。同时,生成一种黑色的固体,这是四氧化三铁。反应的化学方程式为:3Fe+2O2===Fe3O4
一、探讨氧化还原反应的特征
点燃
课堂探究
碳在氧气中燃烧的反应现象。
碳在氧气中燃烧是一个典型的放热反应,会发出白光,并放出大量的热。同时,生成的气体能使澄清的石灰水变浑浊,这是因为生成了二氧化碳气体。反应的化学方程式为:C+O2===CO2
一、探讨氧化还原反应的特征
点燃
课堂探究
观察图片并思考。
一、探讨氧化还原反应的特征
课堂探究
一、探讨氧化还原反应的特征
请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成表格。
[从得失氧的角度认识氧化还原反应]
2CuO+C 2Cu+CO2↑
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 ________ __________
失氧物质 ___________ __________
C
氧化反应
CuO
还原反应
课堂探究
一、探讨氧化还原反应的特征
综上我们得到什么结论?
[从得失氧的角度认识氧化还原反应]
一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。也就是说,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
课堂探究
一、探讨氧化还原反应的特征
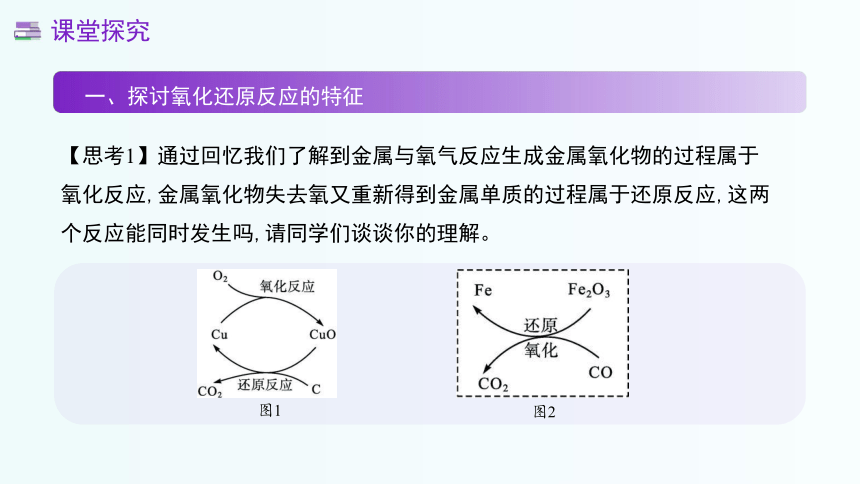
【思考1】通过回忆我们了解到金属与氧气反应生成金属氧化物的过程属于氧化反应,金属氧化物失去氧又重新得到金属单质的过程属于还原反应,这两个反应能同时发生吗,请同学们谈谈你的理解。
图1
图2
课堂探究
一、探讨氧化还原反应的特征
标出【思考1】中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
[从元素化合价升降的角度认识氧化还原反应]
课堂探究
一、探讨氧化还原反应的特征
标出【思考1】中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
[从元素化合价升降的角度认识氧化还原反应]
在这两个反应中,得氧物质C和CO发生氧化反应时,相应元素化合价升高。失氧物质CuO和Fe2O3发生还原反应时,相应元素化合价降低。
课堂探究
一、探讨氧化还原反应的特征
标出【思考1】中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
[从元素化合价升降的角度认识氧化还原反应]
凡是有元素化合价升降的反应都是氧化还原反应,物质所含元素化合价降低的反应称为氧化反应,物质所含元素化合价升高的反应称为还原反应。
课堂探究
一、探讨氧化还原反应的特征
请判断下列反应是否属于氧化还原反应。
(1)CH4+2O2 CO2+2H2O
(2)2Na+Cl2 2NaCl
(3)H2+Cl2 2HCl
[从元素化合价升降的角度认识氧化还原反应]
课堂探究
一、探讨氧化还原反应的特征
请判断下列反应是否属于氧化还原反应。
(4)Zn+H2SO4===ZnSO4+H2↑
(5)H2SO4 +2NaOH=== Na2SO4+2H2O
(6)2H2O2 2H2O+O2↑
[从元素化合价升降的角度认识氧化还原反应]
课堂探究
一、探讨氧化还原反应的特征
请判断下列反应是否属于氧化还原反应。
[从元素化合价升降的角度认识氧化还原反应]
(1)(2)(3)(4)(6)属于氧化还原反应。
课堂探究
二、探讨氧化还原反应的本质
利用原子结构示意图,从微观角度分析Na与Cl2反应、H2与Cl2反应的本质。
氧化还原反应 2Na+Cl2 ===2NaCl H2+Cl2 ===2HCl
形成过程图示
△
点燃
课堂探究
二、探讨氧化还原反应的本质
从电子转移的角度认识氧化还原反应。
氧化还原反应 2Na+Cl2 ===2NaCl H2+Cl2===2HCl
变化过程图示
△
点燃
课堂探究
二、探讨氧化还原反应的本质
氧化还原反应 2Na+Cl2 ===2NaCl H2+Cl2 ===2HCl
微观分析或解释 NaCl是通过 电子形成的,由于氯原子得1个电子,氯元素的化合价从0价降低到-1价,发生 反应;钠原子失去1个电子,钠元素的化合价从0价升高到+1价,发生 反应 HCl是通过 形成的,由于氯原子的得电子能力更强,共用电子对偏向氯原子,氯元素显 价,氢元素显 价。氯元素的化合价降低,发生 反应,氢元素化合价升高,发生 反应
得失
还原
氧化
共用电子对
负
正
还原
氧化
△
点燃
课堂探究
综上得到结论。
氧化还原反应的本质是电子转移(电子得失或共用电子对偏移),氧化还原反应的特征是有元素化合价的升降。
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
氯化钠的形成。
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原
反应与四种基本反应类型的关系。
①CO2+C 2CO
②2Fe+3Cl2 2FeCl3
③C+H2O(g) CO+H2
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原
反应与四种基本反应类型的关系。
④2H2O 2H2↑+O2↑
⑤Na2SO4+BaCl2===2NaCl+BaSO4↓
⑥H2O2+H2S===S↓+2H2O
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
(1)既是氧化还原反应,又是化合反应的为?
①②
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
(2)属于非氧化还原反应的为?
⑤
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
(3)不属于四种基本反应类型的为?
⑥
课堂探究
(4)属于置换反应的为?
③
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[双线桥法]
例如,Fe2O3+3H2===2Fe+3H2O
(1)标价态:写出变价元素的化合价。
(2)连双线:连接反应前后同种元素的不同价态的原子。
(3)注得失:元素化合价升高的标出“失去”,元素化合价降低的标出“得到”。
高温
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[双线桥法]
(4)算数目:按照原子个数计算得失电子的数目。
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[单线桥法]
(1)连单线:箭头由反应物中失电子元素出发,箭尾指向反应物中得电子元素。
(2)不需要标明“得到”或“失去”,只标明电子转移数目。
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[单线桥法]
例如,Fe2O3与H2的反应用单线桥法表示电子转移的数目如下:
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况。
WO3+3H2 W+3H2O
课堂探究
四、氧化还原反应中电子转移的表示方法
根据上述实例分析化合价的变化数与转移的电子数有什么关系?
原子失去1个电子,元素的化合价就升高1价;原子得到1个电子,元素的化合价就降低1价。化合价升高或降低总数等于转移电子数。
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
①MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
②Cl2+2NaOH===NaCl+NaClO+H2O
③2H2S+SO2===3S+2H2O
课堂探究
四、氧化还原反应中电子转移的表示方法
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
课堂探究
四、氧化还原反应中电子转移的表示方法
(1)双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
(2)表示氧化还原反应中化合价升降、物质被氧化或被还原等时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
两种“线桥”的比较。
古诗词中蕴含着丰富的化学知识,下列诗句涉及氧化还原反应的是( )
A.莫道雪融便无迹,雪融成水水成冰
B.粉身碎骨浑不怕,要留清白在人间
C.爆竹声中一岁除,春风送暖入屠苏
D.日照香炉生紫烟,遥看瀑布挂前川
课堂练习
【练习1】
D
下列有关3CO+Fe2O3 2Fe+3CO2反应的说法正确的是( )
A.CO被还原
B.Fe2O3被氧化
C.CO得到电子
D.Fe2O3发生还原反应
课堂练习
【练习2】
D
下列反应既是化合反应,又是氧化还原反应的是( )
A.CaO+H2O===Ca(OH)2
B.CO2+Na2CO3+H2O===2NaHCO3
C.H2+Cl2 2HCl
D.2Na2O2+4HCl===4NaCl+2H2O+O2↑
课堂练习
【练习3】
C
下面是实验室制备氧气的三种方法:
①2KMnO4 K2MnO4+MnO2+O2↑
②2KClO3 2KCl+3O2↑
③2H2O2 2H2O+O2↑
(1)反应①中的还原产物为 (填化学式)。
(2)反应②中Cl元素的化合价 (填“升高”或“降低”)。
课堂练习
【练习4】
K2MnO4、MnO2
降低
下面是实验室制备氧气的三种方法:
①2KMnO4 K2MnO4+MnO2+O2↑
②2KClO3 2KCl+3O2↑
③2H2O2 2H2O+O2↑
(3)反应③中化合价变化的元素为 (填元素名称) 。
(4)上述三个反应生成相同分子数的氧气,转移的电子个数 (填“相等”或“不相等”)。
课堂练习
【练习4】
氧元素
不相等
课堂小结
布置作业
完成学案【核心素养专练】。
请在课后通过观察、上网或者查阅资料找找生活中有哪些现象或在工业生产中有哪些原理应用了氧化还原反应。
谢谢大家
第1课时 氧化还原反应
第三节 氧化还原反应
化学
1.通过分析探究氧化还原反应的特征和本质,掌握氧化还原反应的判断方法,培养证据推理与模型认知以及宏观辨识与微观探析的核心素养。
2.通过对氧化还原反应的学习,培养分类对比、由表及里以及逻辑推理的抽象思维方法。
学习目标
3.通过对氧化还原概念的辨析以及探究实验的设计和分析,培养观察、分析和解决问题的能力,树立科学正确的学习观念。
4.通过学习氧化还原反应在生活生产中的应用,感受化学的魅力以及对人类社会发展的重要作用,激发学习化学的热情。
学习重难点
重点、难点:
氧化还原反应的本质以及电子转移的表示方法。
导入新课
[情境引入]
在生活中我们无时无刻不在接触和发现各式各样的物质变化,像图中展示的这几种现象,涉及哪些物质,发生了怎样的变化?
苹果氧化
课堂探究
观察图片并思考。
一、探讨氧化还原反应的特征
课堂探究
铁在氧气中燃烧的反应现象。
铁在氧气中燃烧时,会剧烈燃烧,火星四射,并放出大量的热。同时,生成一种黑色的固体,这是四氧化三铁。反应的化学方程式为:3Fe+2O2===Fe3O4
一、探讨氧化还原反应的特征
点燃
课堂探究
碳在氧气中燃烧的反应现象。
碳在氧气中燃烧是一个典型的放热反应,会发出白光,并放出大量的热。同时,生成的气体能使澄清的石灰水变浑浊,这是因为生成了二氧化碳气体。反应的化学方程式为:C+O2===CO2
一、探讨氧化还原反应的特征
点燃
课堂探究
观察图片并思考。
一、探讨氧化还原反应的特征
课堂探究
一、探讨氧化还原反应的特征
请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成表格。
[从得失氧的角度认识氧化还原反应]
2CuO+C 2Cu+CO2↑
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 ________ __________
失氧物质 ___________ __________
C
氧化反应
CuO
还原反应
课堂探究
一、探讨氧化还原反应的特征
综上我们得到什么结论?
[从得失氧的角度认识氧化还原反应]
一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。也就是说,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
课堂探究
一、探讨氧化还原反应的特征
【思考1】通过回忆我们了解到金属与氧气反应生成金属氧化物的过程属于氧化反应,金属氧化物失去氧又重新得到金属单质的过程属于还原反应,这两个反应能同时发生吗,请同学们谈谈你的理解。
图1
图2
课堂探究
一、探讨氧化还原反应的特征
标出【思考1】中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
[从元素化合价升降的角度认识氧化还原反应]
课堂探究
一、探讨氧化还原反应的特征
标出【思考1】中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
[从元素化合价升降的角度认识氧化还原反应]
在这两个反应中,得氧物质C和CO发生氧化反应时,相应元素化合价升高。失氧物质CuO和Fe2O3发生还原反应时,相应元素化合价降低。
课堂探究
一、探讨氧化还原反应的特征
标出【思考1】中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
[从元素化合价升降的角度认识氧化还原反应]
凡是有元素化合价升降的反应都是氧化还原反应,物质所含元素化合价降低的反应称为氧化反应,物质所含元素化合价升高的反应称为还原反应。
课堂探究
一、探讨氧化还原反应的特征
请判断下列反应是否属于氧化还原反应。
(1)CH4+2O2 CO2+2H2O
(2)2Na+Cl2 2NaCl
(3)H2+Cl2 2HCl
[从元素化合价升降的角度认识氧化还原反应]
课堂探究
一、探讨氧化还原反应的特征
请判断下列反应是否属于氧化还原反应。
(4)Zn+H2SO4===ZnSO4+H2↑
(5)H2SO4 +2NaOH=== Na2SO4+2H2O
(6)2H2O2 2H2O+O2↑
[从元素化合价升降的角度认识氧化还原反应]
课堂探究
一、探讨氧化还原反应的特征
请判断下列反应是否属于氧化还原反应。
[从元素化合价升降的角度认识氧化还原反应]
(1)(2)(3)(4)(6)属于氧化还原反应。
课堂探究
二、探讨氧化还原反应的本质
利用原子结构示意图,从微观角度分析Na与Cl2反应、H2与Cl2反应的本质。
氧化还原反应 2Na+Cl2 ===2NaCl H2+Cl2 ===2HCl
形成过程图示
△
点燃
课堂探究
二、探讨氧化还原反应的本质
从电子转移的角度认识氧化还原反应。
氧化还原反应 2Na+Cl2 ===2NaCl H2+Cl2===2HCl
变化过程图示
△
点燃
课堂探究
二、探讨氧化还原反应的本质
氧化还原反应 2Na+Cl2 ===2NaCl H2+Cl2 ===2HCl
微观分析或解释 NaCl是通过 电子形成的,由于氯原子得1个电子,氯元素的化合价从0价降低到-1价,发生 反应;钠原子失去1个电子,钠元素的化合价从0价升高到+1价,发生 反应 HCl是通过 形成的,由于氯原子的得电子能力更强,共用电子对偏向氯原子,氯元素显 价,氢元素显 价。氯元素的化合价降低,发生 反应,氢元素化合价升高,发生 反应
得失
还原
氧化
共用电子对
负
正
还原
氧化
△
点燃
课堂探究
综上得到结论。
氧化还原反应的本质是电子转移(电子得失或共用电子对偏移),氧化还原反应的特征是有元素化合价的升降。
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
氯化钠的形成。
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原
反应与四种基本反应类型的关系。
①CO2+C 2CO
②2Fe+3Cl2 2FeCl3
③C+H2O(g) CO+H2
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
从化合价变化角度判断以下反应是不是氧化还原反应,并思考氧化还原
反应与四种基本反应类型的关系。
④2H2O 2H2↑+O2↑
⑤Na2SO4+BaCl2===2NaCl+BaSO4↓
⑥H2O2+H2S===S↓+2H2O
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
(1)既是氧化还原反应,又是化合反应的为?
①②
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
(2)属于非氧化还原反应的为?
⑤
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
(3)不属于四种基本反应类型的为?
⑥
课堂探究
(4)属于置换反应的为?
③
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
三、寻找基本反应类型与氧化还原反应的关系
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[双线桥法]
例如,Fe2O3+3H2===2Fe+3H2O
(1)标价态:写出变价元素的化合价。
(2)连双线:连接反应前后同种元素的不同价态的原子。
(3)注得失:元素化合价升高的标出“失去”,元素化合价降低的标出“得到”。
高温
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[双线桥法]
(4)算数目:按照原子个数计算得失电子的数目。
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[单线桥法]
(1)连单线:箭头由反应物中失电子元素出发,箭尾指向反应物中得电子元素。
(2)不需要标明“得到”或“失去”,只标明电子转移数目。
课堂探究
四、氧化还原反应中电子转移的表示方法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
[单线桥法]
例如,Fe2O3与H2的反应用单线桥法表示电子转移的数目如下:
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况。
WO3+3H2 W+3H2O
课堂探究
四、氧化还原反应中电子转移的表示方法
根据上述实例分析化合价的变化数与转移的电子数有什么关系?
原子失去1个电子,元素的化合价就升高1价;原子得到1个电子,元素的化合价就降低1价。化合价升高或降低总数等于转移电子数。
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
①MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
②Cl2+2NaOH===NaCl+NaClO+H2O
③2H2S+SO2===3S+2H2O
课堂探究
四、氧化还原反应中电子转移的表示方法
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
课堂探究
四、氧化还原反应中电子转移的表示方法
标出变价元素的化合价,用双线桥法标出电子转移情况,其中①③同时用单线桥法标出电子转移情况。
课堂探究
四、氧化还原反应中电子转移的表示方法
(1)双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
(2)表示氧化还原反应中化合价升降、物质被氧化或被还原等时,用双线桥法较方便;表示电子转移的方向和数目时,用单线桥法较方便。
两种“线桥”的比较。
古诗词中蕴含着丰富的化学知识,下列诗句涉及氧化还原反应的是( )
A.莫道雪融便无迹,雪融成水水成冰
B.粉身碎骨浑不怕,要留清白在人间
C.爆竹声中一岁除,春风送暖入屠苏
D.日照香炉生紫烟,遥看瀑布挂前川
课堂练习
【练习1】
D
下列有关3CO+Fe2O3 2Fe+3CO2反应的说法正确的是( )
A.CO被还原
B.Fe2O3被氧化
C.CO得到电子
D.Fe2O3发生还原反应
课堂练习
【练习2】
D
下列反应既是化合反应,又是氧化还原反应的是( )
A.CaO+H2O===Ca(OH)2
B.CO2+Na2CO3+H2O===2NaHCO3
C.H2+Cl2 2HCl
D.2Na2O2+4HCl===4NaCl+2H2O+O2↑
课堂练习
【练习3】
C
下面是实验室制备氧气的三种方法:
①2KMnO4 K2MnO4+MnO2+O2↑
②2KClO3 2KCl+3O2↑
③2H2O2 2H2O+O2↑
(1)反应①中的还原产物为 (填化学式)。
(2)反应②中Cl元素的化合价 (填“升高”或“降低”)。
课堂练习
【练习4】
K2MnO4、MnO2
降低
下面是实验室制备氧气的三种方法:
①2KMnO4 K2MnO4+MnO2+O2↑
②2KClO3 2KCl+3O2↑
③2H2O2 2H2O+O2↑
(3)反应③中化合价变化的元素为 (填元素名称) 。
(4)上述三个反应生成相同分子数的氧气,转移的电子个数 (填“相等”或“不相等”)。
课堂练习
【练习4】
氧元素
不相等
课堂小结
布置作业
完成学案【核心素养专练】。
请在课后通过观察、上网或者查阅资料找找生活中有哪些现象或在工业生产中有哪些原理应用了氧化还原反应。
谢谢大家
