第一章 章末复习--人教版高中化学必修第一册教学课件(共43张PPT)
文档属性
| 名称 | 第一章 章末复习--人教版高中化学必修第一册教学课件(共43张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:13:11 | ||
图片预览











文档简介
(共43张PPT)
章末复习
第一章 物质及其变化
化学
学习目标
1.通过对常见物质进行分类,掌握物质分类的基本方法;通过物质间的转化关系,理解分类思想对化学研究与学习的重要意义。
2.掌握离子反应的实质,能从微观角度分析反应并解决问题。
3.完善氧化还原反应模型,掌握氧化还原反应的基本规律。
学习重难点
重点:
应用分类思想解决化学学习和研究中的问题,离子反应、氧化还原反应的基本原理及应用。
难点:
各物质之间的转化模型,离子反应发生的条件、氧化还原反应基本概念之间的联系。
课题引入
运用分类法去研究物质及其变化,不但可以使有关物质及其变化的知识变得系统化,而且借助分门别类的研究,还能发现物质及其变化的规律。今天咱们一起来总结一下本章所学内容。
导入新课
一、物质的分类及转化
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
①单质
金属单质:如铁、铜。它们具有金属光泽,良好的导电性、导热性和延展性。在化学反应中,金 属单质容易失去电子形成阳离子。例如铁能与硫酸铜溶液发生置换反应。
课堂探究
一、物质的分类及转化
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
①单质
非金属单质:如氧气、氢气。氧气是一种无色无味的气体,能支持燃烧,许多物质在氧气中燃烧会更加剧烈。氢气是密度最小的气体,具有可燃性。
课堂探究
一、物质的分类及转化
②化合物
氧化物
酸性氧化物:二氧化碳是典型的酸性氧化物。它能与碱反应生成盐和水。
碱性氧化物:氧化钙属于碱性氧化物。它能与酸反应生成盐和水。
课堂探究
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
一、物质的分类及转化
②化合物
酸:盐酸、硫酸。酸在水溶液中能电离出氢离子,具有酸性。例如盐酸与金属锌反应。
碱:氢氧化钠、氢氧化钙。碱在水溶液中能电离出氢氧根离子,能与酸发生中和反应。
课堂探究
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
一、物质的分类及转化
CO2与SO2均为酸性氧化物,你能否根据CO2的性质,推测SO2的性质?
①与水反应
二氧化碳与水反应:CO2 + H2O == H2CO3
二氧化硫与水反应:SO2 + H2O == H2SO3
课堂探究
一、物质的分类及转化
CO2与SO2均为酸性氧化物,你能否根据CO2的性质,推测SO2的性质?
②与碱反应
二氧化碳(少量)与氢氧化钠反应:2NaOH + CO2 == Na2CO3+H2O
二氧化碳(过量)与氢氧化钠反应:NaOH + CO2 == NaHCO3
二氧化硫(少量)与氢氧化钠反应:2NaOH + SO2 == Na2SO3+H2O
二氧化硫(过量)与氢氧化钠反应:NaOH + SO2 == NaHSO3
课堂探究
一、物质的分类及转化
CO2与SO2均为酸性氧化物,你能否根据CO2的性质,推测SO2的性质?
③与碱性氧化物反应
二氧化碳与氧化钙反应:CaO + CO2== CaCO3
二氧化硫与氧化钙反应:CaO + SO2 == CaSO3
课堂探究
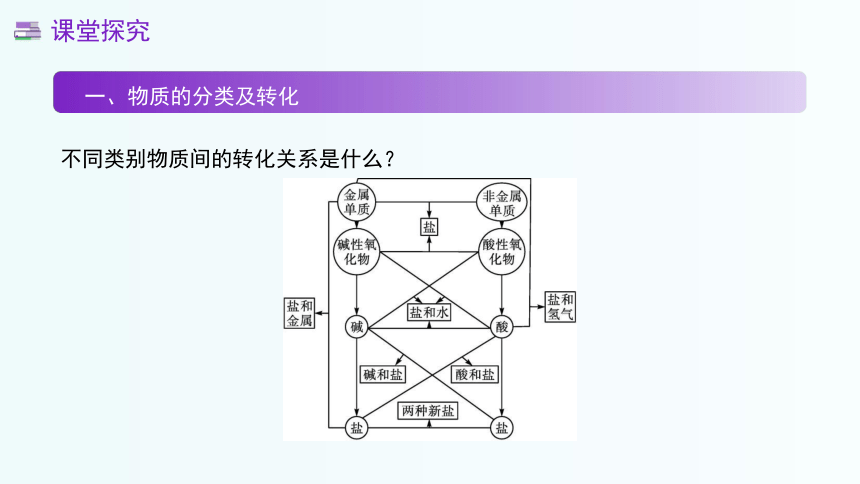
一、物质的分类及转化
不同类别物质间的转化关系是什么?
课堂探究
一、物质的分类及转化
不同类别物质间的转化关系是什么?
不同类别物质间的转化关系包括单质通过与氧气、氢气等反应转化为化合物;氧化物通过与水反应分别生成酸或碱;酸和碱通过中和反应或酸与金属反应生成盐;盐还可以通过和酸、碱、其他盐反应生成新的酸、碱、盐。
课堂探究
物质分为纯净物(含单质、化合物,化合物包括氧化物、酸、碱、盐等)和混合物,它们之间通过特定的化学性质和反应相互区别与联系。
课堂探究
一、物质的分类及转化
下列关于胶体的说法正确的是( )
A.胶体一定是液态的
B.胶体和溶液的本质区别是胶体有丁达尔效应
C.可用FeCl3溶液与NaOH溶液混合制备Fe(OH)3胶体
D.胶体一定是混合物
【针对练习1】
D
课堂探究
课堂探究
二、化学反应的分类
按反应形式分类:
化合反应:是指两种或两种以上的物质反应生成一种新物质的反应,特点是“多变一”。
分解反应:一种物质分解成两种或两种以上其他物质的反应,特点是“一变多”。
课堂探究
二、化学反应的分类
化合反应:
依据:反应物是多种,生成物是一种。
特征:多变一。
课堂探究
二、化学反应的分类
分解反应:
依据:反应物是一种,生成物是多种。
特征:一变多。
课堂探究
二、化学反应的分类
置换反应:
依据:一种单质和一种化合物生成另一种单质和另一种化合物。
特征:有单质参与和生成,成分交换。
课堂探究
二、化学反应的分类
复分解反应:
依据:两种化合物交换成分生成另外两种化合物。
特征:双交换,价不变,有沉淀、气体或水生成。
下列反应中不属于四大基本反应类型的是( )
A.SO2+2NaOH===Na2SO3+H2O
B.2Mg+O2 2MgO
C.2HNO3+Ba(OH)2=Ba(NO3)2+2H2O
D.Na2S+Cl2=S↓+2NaCl
【针对练习2】
A
课堂探究
课堂探究
三、离子反应
定义:
有离子参加或生成的反应,多发生在水溶液或离子化合物熔融状态。
课堂探究
三、离子反应
本质:
某些离子浓度发生改变。
课堂探究
三、离子反应
发生条件:
生成沉淀。
生成难电离物质(弱酸、弱碱、水)。
生成气体。
发生氧化还原反应。
课堂探究
三、离子反应
离子方程式:
概念:用实际参加反应的离子符号表示离子反应。
书写步骤:写、改、删、查。
课堂探究
三、离子反应
离子共存:
离子间反应生成沉淀、气体、弱电解质或发生氧化还原反应则不能大量共存。
课堂探究
三、离子反应
类型:
复分解型:酸、碱、盐间的离子交换,生成沉淀、难电离物或气体。
置换型:活泼金属与盐酸、稀硫酸的反应,活泼金属与不活泼金属的盐的反应
氧化还原型:有电子转移,依氧化性、还原性强弱进行。
课堂探究
三、离子反应
离子方程式:
定义:用实际参加反应的离子符号表示反应的式子。
意义:表示特定和同类离子反应。
课堂探究
三、离子反应
特点:
反应速率快,不受其他离子干扰。
下列离子方程式书写正确的是( )
A.碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.H2SO4溶液与Ba(OH)2溶液反应:Ba2+++H++OH-=BaSO4↓+H2O
C.碳酸氢钠溶液与氢氧化钠溶液反应:OH-+H+=H2O
D.铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu
【针对练习3】
C
课堂探究
下列在无色溶液中能大量共存的一组离子是( )
A.Ba2+、H+、S、OH-
B.Na+、Ca2+、C、N
C.K+、S、Na+、Fe2+
D.K+、S、OH-、N
【针对练习4】
D
课堂探究
课堂探究
三、离子反应
产生沉淀:
生成难溶盐:钙离子与碳酸根离子、钡离子与硫酸根离子、银离子与氯离子。
生成难溶碱:氢氧根离子与铜离子、亚铁离子、铁离子、镁离子、铝离子。
课堂探究
三、离子反应
产生气体:
氢离子与碳酸根离子、碳酸氢根离子。
课堂探究
三、离子反应
弱电解质问题:
生成水:氢离子与氢氧根离子。
生成弱酸:氢离子与硅酸根离子、醋酸根离子、氟离子、磷酸根离子。
生成弱碱:铵根离子与氢氧根离子。
课堂探究
三、离子反应
氧化还原反应问题:
强氧化性离子
【铁离子、高锰酸根离子、硝酸根离子(酸性环境中)、次氯酸根离子】与强还原性离子(硫离子、亚硫酸根离子、碘离子、亚铁离子)。
配平下列方程式。
(1) Fe+ Cl2 FeCl3
(2) HCl(浓)+ MnO2 MnCl2 + Cl2↑+ H2O
【针对练习6】
2
3
2
4
1
1
1
2
课堂探究
下列关于氧化还原反应的说法中,正确的是( )
A. 氧化还原反应的本质是元素化合价的升降
B. 氧化还原反应中不一定存在电子的转移
C. 氧化剂在反应中被氧化,还原剂在反应中被还原
D. 失电子的物质在反应中作还原剂,得电子的物质在反应中作氧化剂
【练习1】
D
课堂练习
下列反应中,属于离子反应的是( )
A. 氢气和氧气反应生成水
B. 甲烷和氧气反应生成二氧化碳和水
C. 盐酸和氢氧化钠溶液反应生成氯化钠和水
D. 碳酸钙在高温下分解为氧化钙和二氧化碳
【练习2】
C
课堂练习
下列关于离子反应的说法中,正确的是( )
A. 离子反应一定发生在溶液中
B. 离子反应中一定有离子参加
C. 离子反应中一定有沉淀生成
D. 离子反应中一定有气体放出
【练习3】
B
课堂练习
在氧化还原反应中,下列说法正确的是( )
A. 氧化剂被氧化,还原剂被还原
B. 氧化剂具有还原性,还原剂具有氧化性
C. 氧化剂得到电子,化合价降低
D. 还原剂失去电子,化合价升高并被还原
【练习4】
C
课堂练习
下列变化过程中,不包含氧化还原反应的是( )
A. 金属的冶炼
B. 动植物的呼吸
C. 食物腐败
D. 碳酸钙受热分解
【练习5】
D
课堂练习
本章小结
谢谢大家
章末复习
第一章 物质及其变化
化学
学习目标
1.通过对常见物质进行分类,掌握物质分类的基本方法;通过物质间的转化关系,理解分类思想对化学研究与学习的重要意义。
2.掌握离子反应的实质,能从微观角度分析反应并解决问题。
3.完善氧化还原反应模型,掌握氧化还原反应的基本规律。
学习重难点
重点:
应用分类思想解决化学学习和研究中的问题,离子反应、氧化还原反应的基本原理及应用。
难点:
各物质之间的转化模型,离子反应发生的条件、氧化还原反应基本概念之间的联系。
课题引入
运用分类法去研究物质及其变化,不但可以使有关物质及其变化的知识变得系统化,而且借助分门别类的研究,还能发现物质及其变化的规律。今天咱们一起来总结一下本章所学内容。
导入新课
一、物质的分类及转化
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
①单质
金属单质:如铁、铜。它们具有金属光泽,良好的导电性、导热性和延展性。在化学反应中,金 属单质容易失去电子形成阳离子。例如铁能与硫酸铜溶液发生置换反应。
课堂探究
一、物质的分类及转化
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
①单质
非金属单质:如氧气、氢气。氧气是一种无色无味的气体,能支持燃烧,许多物质在氧气中燃烧会更加剧烈。氢气是密度最小的气体,具有可燃性。
课堂探究
一、物质的分类及转化
②化合物
氧化物
酸性氧化物:二氧化碳是典型的酸性氧化物。它能与碱反应生成盐和水。
碱性氧化物:氧化钙属于碱性氧化物。它能与酸反应生成盐和水。
课堂探究
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
一、物质的分类及转化
②化合物
酸:盐酸、硫酸。酸在水溶液中能电离出氢离子,具有酸性。例如盐酸与金属锌反应。
碱:氢氧化钠、氢氧化钙。碱在水溶液中能电离出氢氧根离子,能与酸发生中和反应。
课堂探究
请写出几种所学过的化学物质,并将其进行分类,注意说明分类的依据是什么?
一、物质的分类及转化
CO2与SO2均为酸性氧化物,你能否根据CO2的性质,推测SO2的性质?
①与水反应
二氧化碳与水反应:CO2 + H2O == H2CO3
二氧化硫与水反应:SO2 + H2O == H2SO3
课堂探究
一、物质的分类及转化
CO2与SO2均为酸性氧化物,你能否根据CO2的性质,推测SO2的性质?
②与碱反应
二氧化碳(少量)与氢氧化钠反应:2NaOH + CO2 == Na2CO3+H2O
二氧化碳(过量)与氢氧化钠反应:NaOH + CO2 == NaHCO3
二氧化硫(少量)与氢氧化钠反应:2NaOH + SO2 == Na2SO3+H2O
二氧化硫(过量)与氢氧化钠反应:NaOH + SO2 == NaHSO3
课堂探究
一、物质的分类及转化
CO2与SO2均为酸性氧化物,你能否根据CO2的性质,推测SO2的性质?
③与碱性氧化物反应
二氧化碳与氧化钙反应:CaO + CO2== CaCO3
二氧化硫与氧化钙反应:CaO + SO2 == CaSO3
课堂探究
一、物质的分类及转化
不同类别物质间的转化关系是什么?
课堂探究
一、物质的分类及转化
不同类别物质间的转化关系是什么?
不同类别物质间的转化关系包括单质通过与氧气、氢气等反应转化为化合物;氧化物通过与水反应分别生成酸或碱;酸和碱通过中和反应或酸与金属反应生成盐;盐还可以通过和酸、碱、其他盐反应生成新的酸、碱、盐。
课堂探究
物质分为纯净物(含单质、化合物,化合物包括氧化物、酸、碱、盐等)和混合物,它们之间通过特定的化学性质和反应相互区别与联系。
课堂探究
一、物质的分类及转化
下列关于胶体的说法正确的是( )
A.胶体一定是液态的
B.胶体和溶液的本质区别是胶体有丁达尔效应
C.可用FeCl3溶液与NaOH溶液混合制备Fe(OH)3胶体
D.胶体一定是混合物
【针对练习1】
D
课堂探究
课堂探究
二、化学反应的分类
按反应形式分类:
化合反应:是指两种或两种以上的物质反应生成一种新物质的反应,特点是“多变一”。
分解反应:一种物质分解成两种或两种以上其他物质的反应,特点是“一变多”。
课堂探究
二、化学反应的分类
化合反应:
依据:反应物是多种,生成物是一种。
特征:多变一。
课堂探究
二、化学反应的分类
分解反应:
依据:反应物是一种,生成物是多种。
特征:一变多。
课堂探究
二、化学反应的分类
置换反应:
依据:一种单质和一种化合物生成另一种单质和另一种化合物。
特征:有单质参与和生成,成分交换。
课堂探究
二、化学反应的分类
复分解反应:
依据:两种化合物交换成分生成另外两种化合物。
特征:双交换,价不变,有沉淀、气体或水生成。
下列反应中不属于四大基本反应类型的是( )
A.SO2+2NaOH===Na2SO3+H2O
B.2Mg+O2 2MgO
C.2HNO3+Ba(OH)2=Ba(NO3)2+2H2O
D.Na2S+Cl2=S↓+2NaCl
【针对练习2】
A
课堂探究
课堂探究
三、离子反应
定义:
有离子参加或生成的反应,多发生在水溶液或离子化合物熔融状态。
课堂探究
三、离子反应
本质:
某些离子浓度发生改变。
课堂探究
三、离子反应
发生条件:
生成沉淀。
生成难电离物质(弱酸、弱碱、水)。
生成气体。
发生氧化还原反应。
课堂探究
三、离子反应
离子方程式:
概念:用实际参加反应的离子符号表示离子反应。
书写步骤:写、改、删、查。
课堂探究
三、离子反应
离子共存:
离子间反应生成沉淀、气体、弱电解质或发生氧化还原反应则不能大量共存。
课堂探究
三、离子反应
类型:
复分解型:酸、碱、盐间的离子交换,生成沉淀、难电离物或气体。
置换型:活泼金属与盐酸、稀硫酸的反应,活泼金属与不活泼金属的盐的反应
氧化还原型:有电子转移,依氧化性、还原性强弱进行。
课堂探究
三、离子反应
离子方程式:
定义:用实际参加反应的离子符号表示反应的式子。
意义:表示特定和同类离子反应。
课堂探究
三、离子反应
特点:
反应速率快,不受其他离子干扰。
下列离子方程式书写正确的是( )
A.碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.H2SO4溶液与Ba(OH)2溶液反应:Ba2+++H++OH-=BaSO4↓+H2O
C.碳酸氢钠溶液与氢氧化钠溶液反应:OH-+H+=H2O
D.铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu
【针对练习3】
C
课堂探究
下列在无色溶液中能大量共存的一组离子是( )
A.Ba2+、H+、S、OH-
B.Na+、Ca2+、C、N
C.K+、S、Na+、Fe2+
D.K+、S、OH-、N
【针对练习4】
D
课堂探究
课堂探究
三、离子反应
产生沉淀:
生成难溶盐:钙离子与碳酸根离子、钡离子与硫酸根离子、银离子与氯离子。
生成难溶碱:氢氧根离子与铜离子、亚铁离子、铁离子、镁离子、铝离子。
课堂探究
三、离子反应
产生气体:
氢离子与碳酸根离子、碳酸氢根离子。
课堂探究
三、离子反应
弱电解质问题:
生成水:氢离子与氢氧根离子。
生成弱酸:氢离子与硅酸根离子、醋酸根离子、氟离子、磷酸根离子。
生成弱碱:铵根离子与氢氧根离子。
课堂探究
三、离子反应
氧化还原反应问题:
强氧化性离子
【铁离子、高锰酸根离子、硝酸根离子(酸性环境中)、次氯酸根离子】与强还原性离子(硫离子、亚硫酸根离子、碘离子、亚铁离子)。
配平下列方程式。
(1) Fe+ Cl2 FeCl3
(2) HCl(浓)+ MnO2 MnCl2 + Cl2↑+ H2O
【针对练习6】
2
3
2
4
1
1
1
2
课堂探究
下列关于氧化还原反应的说法中,正确的是( )
A. 氧化还原反应的本质是元素化合价的升降
B. 氧化还原反应中不一定存在电子的转移
C. 氧化剂在反应中被氧化,还原剂在反应中被还原
D. 失电子的物质在反应中作还原剂,得电子的物质在反应中作氧化剂
【练习1】
D
课堂练习
下列反应中,属于离子反应的是( )
A. 氢气和氧气反应生成水
B. 甲烷和氧气反应生成二氧化碳和水
C. 盐酸和氢氧化钠溶液反应生成氯化钠和水
D. 碳酸钙在高温下分解为氧化钙和二氧化碳
【练习2】
C
课堂练习
下列关于离子反应的说法中,正确的是( )
A. 离子反应一定发生在溶液中
B. 离子反应中一定有离子参加
C. 离子反应中一定有沉淀生成
D. 离子反应中一定有气体放出
【练习3】
B
课堂练习
在氧化还原反应中,下列说法正确的是( )
A. 氧化剂被氧化,还原剂被还原
B. 氧化剂具有还原性,还原剂具有氧化性
C. 氧化剂得到电子,化合价降低
D. 还原剂失去电子,化合价升高并被还原
【练习4】
C
课堂练习
下列变化过程中,不包含氧化还原反应的是( )
A. 金属的冶炼
B. 动植物的呼吸
C. 食物腐败
D. 碳酸钙受热分解
【练习5】
D
课堂练习
本章小结
谢谢大家
