第二章 第三节 物质的量 第2课时 气体摩尔体积--人教版高中化学必修第一册教学课件(共35张PPT)
文档属性
| 名称 | 第二章 第三节 物质的量 第2课时 气体摩尔体积--人教版高中化学必修第一册教学课件(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 68.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:14:27 | ||
图片预览











文档简介
(共35张PPT)
第2课时 气体摩尔体积
第三节 物质的量
化学
1.通过对比、类比、归纳、演绎等多种思维活动,了解气体摩尔体积的含义,体会从物质的量的层次定量研究化学问题的意义,体会证据推理与模型认知的过程。
2.运用物质的量、气体摩尔体积、微粒个数之间的相互关系进行简单计算,建立以物质的量为中心的化学计算模型,知道从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学方法之一。
学习目标
重点:
建构以物质的量为中心的转化关系,感受宏观与微观相结合的思想。
难点:
物质的量、气体摩尔体积、物质的质量之间的转化关系的建构。
学习重难点
气体摩尔体积
(1)概念:单位物质的量的气体,所占的______叫气体摩尔体积,用符号_______表示,常用的单位有_________(或L·mol-1)和m3/mol(或m3·mol-1)。
(2)定义式:Vm= 。
(3)影响因素:气体摩尔体积的数值不是固定不变的,它取决于气体所处_________和________。在相同的温度和压强下,相同体积的任何气体都含有__________数目的粒子。
自主预习
体积
Vm
L/mol
温度
压强
相同
知识回顾
物质的量
[课题引入]
上节课学习了一个新的物理量——物质的量,通过物质的量,我们能将宏观质量与微观微粒个数联系起来,那么对气体物质来说,气体的体积与物质的量之间又具有什么关系?
回顾并结合学过的知识
【问题1】物质的量的计算公式。
知识回顾
物质的量
[课题引入]
物质的量与微粒数的换算,物质的量与物质质量的换算。
【问题2】物质的量计算公式的应用过程。
探究表格,观察实物体积模型。
课堂探究
一、影响物质体积大小的因素
[课题引入]
【问题1】观察并总结规律。
课堂探究
一、影响物质体积大小的因素
[课题引入]
1.在一定条件下,1mol不同固体、不同液体的体积是不同的。
2.在标准状况下,1mol不同气体的体积是相同的。
课堂探究
一、影响物质体积大小的因素
[课题引入]
物质的微观结构决定了物质的宏观表现
所以我们需要从微观角度来分析。
气球在挤压下体积容易变小,而铅球在挤压下体积很难发生变化,那么,决定物质体积大小的因素有哪些?
课堂探究
一、影响物质体积大小的因素
[互动探究]
气球
铅球
固体、液体、气体粒子的排列方式
课堂探究
一、影响物质体积大小的因素
[互动探究]
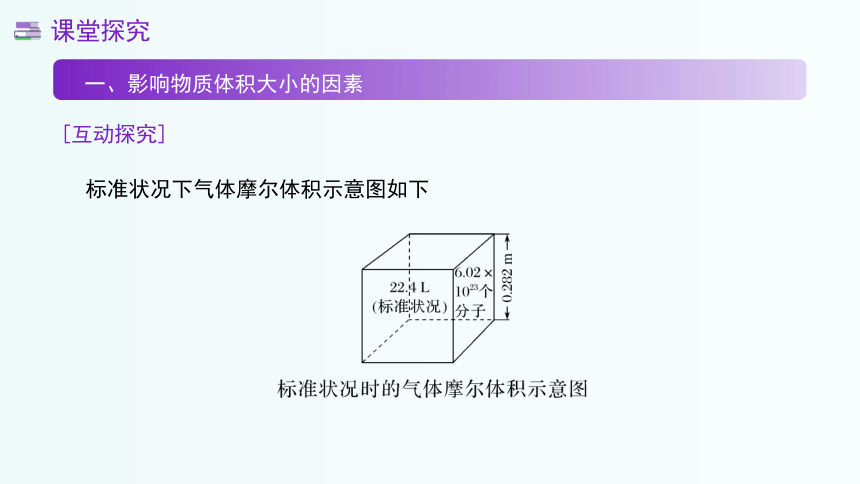
标准状况下气体摩尔体积示意图如下
课堂探究
一、影响物质体积大小的因素
[互动探究]
【问题1】气球在挤压下体积很容易变小,而铅球在挤压下体积很难发生变化,为什么?
课堂探究
一、影响物质体积大小的因素
气球中气体分子之间的距离大,而铅球中原子之间的距离小。
不同状态的物质,分子之间的距离不同,固体、液体分子之间的距离小,气体分子之间的距离大。
【问题2】固体、液体、气体分子之间的距离有何差异?
冰——水——水蒸气的变化:
课堂探究
一、影响物质体积大小的因素
观看实践视频:
课堂探究
一、影响物质体积大小的因素
冰熔化为水体积变大,因为分子间距变大。水变为水蒸气体积急剧增大,分子间距大幅增加。冰直接升华为水蒸气体积也显著增大,都是分子间距变化引起,总体积逐渐增大。
总之,从冰到水再到水蒸气,体积呈现逐渐增大的趋势,这是由于物质的状态变化导致分子间距离发生改变所引起的。
课堂探究
一、影响物质体积大小的因素
【总结】影响物质体积的因素:粒子数目、粒子的大小和粒子之间的距离。
课堂探究
一、影响物质体积大小的因素
【问题3】在相同条件下,粒子数目相同的固态、液态物质的体积不同,原因是什么?
固体、液体粒子之间的间距很小,影响固体和液体物质的体积的主要因素是粒子数目和粒子大小,由于不同固体粒子的大小不同,所以1mol固体或液体的体积不同。
【问题4】在相同条件下,粒子数目相同的气态物质的体积相同,原因是什么?
课堂探究
一、影响物质体积大小的因素
气体的体积与气体粒子之间的距离和粒子数目有关,当温度和压强一定时,影响气体的体积的因素为粒子之间的距离和粒子数目,故相同条件下,1mol气体的体积几乎相同。
阅读课本,解决气体摩尔体积相关问题。
【定义】
【符号】 。
【表达式】 。
【单位】 。
课堂探究
二、气体摩尔体积
在一定的温度和压强
下单位物质的量的气体所占的体积叫气体摩尔体积。
Vm
L/mol
Vm=
标准状况下的气体摩尔体积:
(1)1个条件:必须为标准状况。非标准状况下,1mol 气体的体积不一定是22.4L,因此在使用气体摩尔体积时,一定要看清气体所处的状况。
(2)1种状态:必须为气体。水、酒精、CCl4等物质在标准状况下不是气体。
(3)2个数据:“1mol ”“约22.4L”。
课堂探究
二、气体摩尔体积
【问题1】标准状况下,1mol任何物质的体积都约为22.4L吗?
课堂探究
二、气体摩尔体积
不是。在标准状况下,1mol气体的体积约为22.4L,而1mol固体或液体的体积均不是22.4L。
不是。气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,但混合气体中气体之间不能发生化学反应。
【问题2】气体摩尔体积的适用范围是气体,是否必须为纯净的气体?
【问题3】当1mol气体的体积为22.4L时,能否说明该气体一定处于标准状况?
课堂探究
二、气体摩尔体积
不能。标准状况下,1 mol气体的体积约为22.4 L,但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标准状况下,比如适当的升高温度(气体膨胀)、增大压强(压缩气体),也能使任意1 mol气体的体积变为22.4 L。
气体摩尔体积的适用范围:
气体摩尔体积的适用范围是气体,可以是单一组分的气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。需要注意的是混合气体中气体之间不能发生化学反应。
课堂探究
二、气体摩尔体积
课堂拓展
三、气体摩尔体积的应用
阿伏伽德罗定律
解释:同温同压下,气体粒子间的平均距离相等,故体积相同时,气体粒子数相等,其物质的量也相等。
课堂拓展
三、气体摩尔体积的应用
阿伏加德罗定律及其推论
【练习1】
标准状况下,某气体体积为11.2L,求该气体含有的分子数。
课堂练习
解:n==0.5mol,
N =n·NA=0.5mol×6.02×1023mol-1=3.01×1023 。
【练习2】
两个体积相同的容器,一个盛NO,另一个盛N2和O2,在同温、同压下,两容器内的气体一定具有相同的( )
A.电子总数
B.质子总数
C.分子总数
D.质量
课堂练习
C
【练习3】
在标准状况下,1 L X2气体与3 L Y2气体化合生成2 L气体化合物,则该化合物的化学式为( )
A.XY3
B.XY
C.X3Y
D.X2Y3
课堂练习
A
【练习4】
下列关于CO和CO2的说法正确的是( )
A.质量相等时,分子数之比为7∶11
B.同温、同压下,密度之比为7∶11
C.物质的量相同时,体积之比为1∶1
D.原子数相同时,物质的量之比为2∶3
课堂练习
B
【练习5】
下列关于决定物质体积的因素的说法不正确的是( )
A.物质的体积取决于粒子数目、粒子大小和粒子之间的距离
B.在相同条件下,粒子数目相同的任何气体都具有相同的体积
C.同温、同压下,1 mol任何物质所占有的体积均相同
D.等质量的H2,压强越小,温度越高,气体所占的体积越大
课堂练习
C
【练习6】
(1)与17 g NH3所含分子数相同的氧气的体积(标准状况)是 L,所含氧原子数是 (用含NA的式子表示)。
(2)某3.65 g气体在标准状况下的体积是2.24 L,则其摩尔质量是 。
课堂练习
22.4
2NA
36.5 g·mol-1
课堂小结
第三节 物质的量
第2课时 气体摩尔体积
一、影响物质体积大小的因素
物质的体积←
课堂小结
第三节 物质的量
第2课时 气体摩尔体积
二、气体摩尔体积
1.定义:单位物质的量的气体所占的体积
2.符号:Vm ,单位:L·mol-1
3.表达式:Vm=
4.对象:任何气体(纯净气体或混合气体)
5.标准状况下: Vm约为22.4 L·mol-1
6.标准状况:温度为0 ℃、压强为101 kPa
布置作业
1.课本P61第2题及P63第6题。
2.课下讨论:是不是只有在标准状况下1 mol气体的体积才是22.4 L?
3.请在课后观察家里的燃气表,上网或者查阅资料弄明白各数字的含义,记录月初、月末的燃气表读数,计算自己家一个月所用天然气(CH4)的质量。
谢谢大家
第2课时 气体摩尔体积
第三节 物质的量
化学
1.通过对比、类比、归纳、演绎等多种思维活动,了解气体摩尔体积的含义,体会从物质的量的层次定量研究化学问题的意义,体会证据推理与模型认知的过程。
2.运用物质的量、气体摩尔体积、微粒个数之间的相互关系进行简单计算,建立以物质的量为中心的化学计算模型,知道从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学方法之一。
学习目标
重点:
建构以物质的量为中心的转化关系,感受宏观与微观相结合的思想。
难点:
物质的量、气体摩尔体积、物质的质量之间的转化关系的建构。
学习重难点
气体摩尔体积
(1)概念:单位物质的量的气体,所占的______叫气体摩尔体积,用符号_______表示,常用的单位有_________(或L·mol-1)和m3/mol(或m3·mol-1)。
(2)定义式:Vm= 。
(3)影响因素:气体摩尔体积的数值不是固定不变的,它取决于气体所处_________和________。在相同的温度和压强下,相同体积的任何气体都含有__________数目的粒子。
自主预习
体积
Vm
L/mol
温度
压强
相同
知识回顾
物质的量
[课题引入]
上节课学习了一个新的物理量——物质的量,通过物质的量,我们能将宏观质量与微观微粒个数联系起来,那么对气体物质来说,气体的体积与物质的量之间又具有什么关系?
回顾并结合学过的知识
【问题1】物质的量的计算公式。
知识回顾
物质的量
[课题引入]
物质的量与微粒数的换算,物质的量与物质质量的换算。
【问题2】物质的量计算公式的应用过程。
探究表格,观察实物体积模型。
课堂探究
一、影响物质体积大小的因素
[课题引入]
【问题1】观察并总结规律。
课堂探究
一、影响物质体积大小的因素
[课题引入]
1.在一定条件下,1mol不同固体、不同液体的体积是不同的。
2.在标准状况下,1mol不同气体的体积是相同的。
课堂探究
一、影响物质体积大小的因素
[课题引入]
物质的微观结构决定了物质的宏观表现
所以我们需要从微观角度来分析。
气球在挤压下体积容易变小,而铅球在挤压下体积很难发生变化,那么,决定物质体积大小的因素有哪些?
课堂探究
一、影响物质体积大小的因素
[互动探究]
气球
铅球
固体、液体、气体粒子的排列方式
课堂探究
一、影响物质体积大小的因素
[互动探究]
标准状况下气体摩尔体积示意图如下
课堂探究
一、影响物质体积大小的因素
[互动探究]
【问题1】气球在挤压下体积很容易变小,而铅球在挤压下体积很难发生变化,为什么?
课堂探究
一、影响物质体积大小的因素
气球中气体分子之间的距离大,而铅球中原子之间的距离小。
不同状态的物质,分子之间的距离不同,固体、液体分子之间的距离小,气体分子之间的距离大。
【问题2】固体、液体、气体分子之间的距离有何差异?
冰——水——水蒸气的变化:
课堂探究
一、影响物质体积大小的因素
观看实践视频:
课堂探究
一、影响物质体积大小的因素
冰熔化为水体积变大,因为分子间距变大。水变为水蒸气体积急剧增大,分子间距大幅增加。冰直接升华为水蒸气体积也显著增大,都是分子间距变化引起,总体积逐渐增大。
总之,从冰到水再到水蒸气,体积呈现逐渐增大的趋势,这是由于物质的状态变化导致分子间距离发生改变所引起的。
课堂探究
一、影响物质体积大小的因素
【总结】影响物质体积的因素:粒子数目、粒子的大小和粒子之间的距离。
课堂探究
一、影响物质体积大小的因素
【问题3】在相同条件下,粒子数目相同的固态、液态物质的体积不同,原因是什么?
固体、液体粒子之间的间距很小,影响固体和液体物质的体积的主要因素是粒子数目和粒子大小,由于不同固体粒子的大小不同,所以1mol固体或液体的体积不同。
【问题4】在相同条件下,粒子数目相同的气态物质的体积相同,原因是什么?
课堂探究
一、影响物质体积大小的因素
气体的体积与气体粒子之间的距离和粒子数目有关,当温度和压强一定时,影响气体的体积的因素为粒子之间的距离和粒子数目,故相同条件下,1mol气体的体积几乎相同。
阅读课本,解决气体摩尔体积相关问题。
【定义】
【符号】 。
【表达式】 。
【单位】 。
课堂探究
二、气体摩尔体积
在一定的温度和压强
下单位物质的量的气体所占的体积叫气体摩尔体积。
Vm
L/mol
Vm=
标准状况下的气体摩尔体积:
(1)1个条件:必须为标准状况。非标准状况下,1mol 气体的体积不一定是22.4L,因此在使用气体摩尔体积时,一定要看清气体所处的状况。
(2)1种状态:必须为气体。水、酒精、CCl4等物质在标准状况下不是气体。
(3)2个数据:“1mol ”“约22.4L”。
课堂探究
二、气体摩尔体积
【问题1】标准状况下,1mol任何物质的体积都约为22.4L吗?
课堂探究
二、气体摩尔体积
不是。在标准状况下,1mol气体的体积约为22.4L,而1mol固体或液体的体积均不是22.4L。
不是。气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,但混合气体中气体之间不能发生化学反应。
【问题2】气体摩尔体积的适用范围是气体,是否必须为纯净的气体?
【问题3】当1mol气体的体积为22.4L时,能否说明该气体一定处于标准状况?
课堂探究
二、气体摩尔体积
不能。标准状况下,1 mol气体的体积约为22.4 L,但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标准状况下,比如适当的升高温度(气体膨胀)、增大压强(压缩气体),也能使任意1 mol气体的体积变为22.4 L。
气体摩尔体积的适用范围:
气体摩尔体积的适用范围是气体,可以是单一组分的气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。需要注意的是混合气体中气体之间不能发生化学反应。
课堂探究
二、气体摩尔体积
课堂拓展
三、气体摩尔体积的应用
阿伏伽德罗定律
解释:同温同压下,气体粒子间的平均距离相等,故体积相同时,气体粒子数相等,其物质的量也相等。
课堂拓展
三、气体摩尔体积的应用
阿伏加德罗定律及其推论
【练习1】
标准状况下,某气体体积为11.2L,求该气体含有的分子数。
课堂练习
解:n==0.5mol,
N =n·NA=0.5mol×6.02×1023mol-1=3.01×1023 。
【练习2】
两个体积相同的容器,一个盛NO,另一个盛N2和O2,在同温、同压下,两容器内的气体一定具有相同的( )
A.电子总数
B.质子总数
C.分子总数
D.质量
课堂练习
C
【练习3】
在标准状况下,1 L X2气体与3 L Y2气体化合生成2 L气体化合物,则该化合物的化学式为( )
A.XY3
B.XY
C.X3Y
D.X2Y3
课堂练习
A
【练习4】
下列关于CO和CO2的说法正确的是( )
A.质量相等时,分子数之比为7∶11
B.同温、同压下,密度之比为7∶11
C.物质的量相同时,体积之比为1∶1
D.原子数相同时,物质的量之比为2∶3
课堂练习
B
【练习5】
下列关于决定物质体积的因素的说法不正确的是( )
A.物质的体积取决于粒子数目、粒子大小和粒子之间的距离
B.在相同条件下,粒子数目相同的任何气体都具有相同的体积
C.同温、同压下,1 mol任何物质所占有的体积均相同
D.等质量的H2,压强越小,温度越高,气体所占的体积越大
课堂练习
C
【练习6】
(1)与17 g NH3所含分子数相同的氧气的体积(标准状况)是 L,所含氧原子数是 (用含NA的式子表示)。
(2)某3.65 g气体在标准状况下的体积是2.24 L,则其摩尔质量是 。
课堂练习
22.4
2NA
36.5 g·mol-1
课堂小结
第三节 物质的量
第2课时 气体摩尔体积
一、影响物质体积大小的因素
物质的体积←
课堂小结
第三节 物质的量
第2课时 气体摩尔体积
二、气体摩尔体积
1.定义:单位物质的量的气体所占的体积
2.符号:Vm ,单位:L·mol-1
3.表达式:Vm=
4.对象:任何气体(纯净气体或混合气体)
5.标准状况下: Vm约为22.4 L·mol-1
6.标准状况:温度为0 ℃、压强为101 kPa
布置作业
1.课本P61第2题及P63第6题。
2.课下讨论:是不是只有在标准状况下1 mol气体的体积才是22.4 L?
3.请在课后观察家里的燃气表,上网或者查阅资料弄明白各数字的含义,记录月初、月末的燃气表读数,计算自己家一个月所用天然气(CH4)的质量。
谢谢大家
