第二章 章末复习--人教版高中化学必修第一册教学课件(共38张PPT)
文档属性
| 名称 | 第二章 章末复习--人教版高中化学必修第一册教学课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-06 11:15:05 | ||
图片预览









文档简介
(共38张PPT)
章末复习
第二章 海水中的重要元素——钠和氯
化学
1.通过钠、氯及其化合物的复习归纳,形成基于元素认识物质性质的核心观念和关键能力,构建宏观与微观相结合的学科认识思路和提出问题、猜想假设、设计方案、实验验证、得出结论的推理模式,进而掌握学习元素化合物知识的一般方法。
2.进一步树立以物质的量为核心的定量计算意识,强化物质的量是联系宏观量与微观量的桥梁观念,达成能运用物质的量进行相关计算和相关定量分析的学业要求。
学习目标
重点、难点:
1.对钠、氯及其化合物的性质的掌握与运用;物质的量的相关计算。
2.学习元素化合物的思路方法。
学习重难点
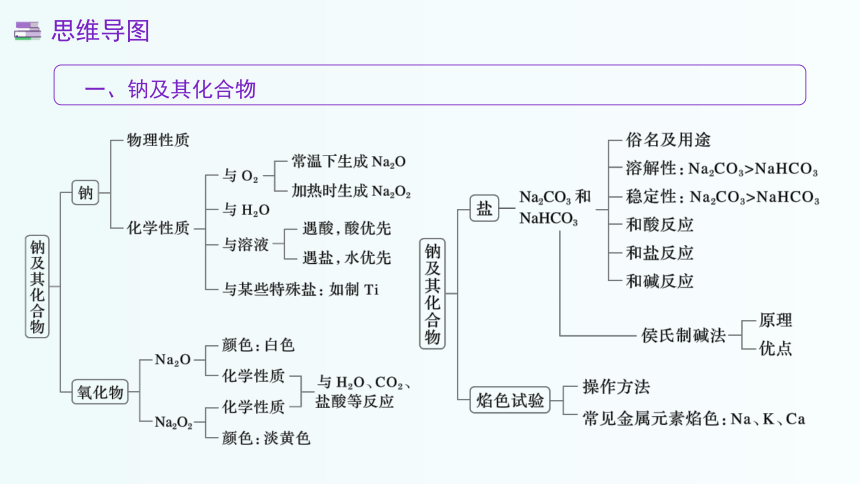
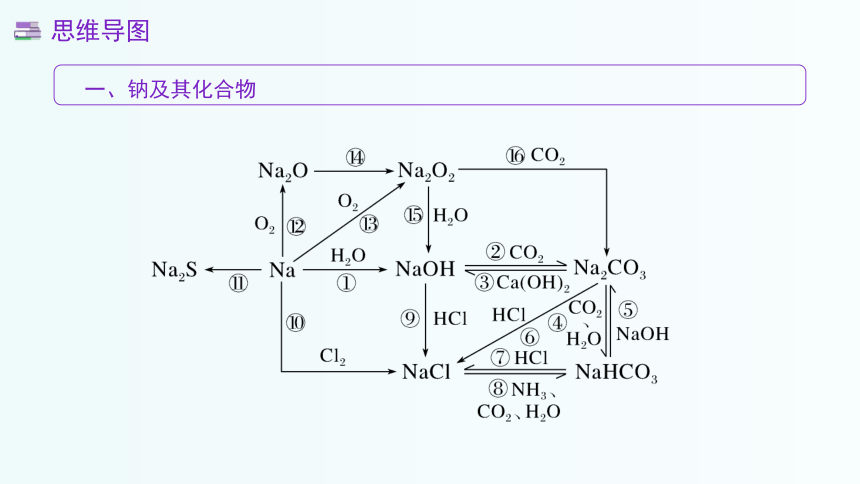
一、钠及其化合物
思维导图
一、钠及其化合物
思维导图
二、氯及其化合物
思维导图
氯离子的检验
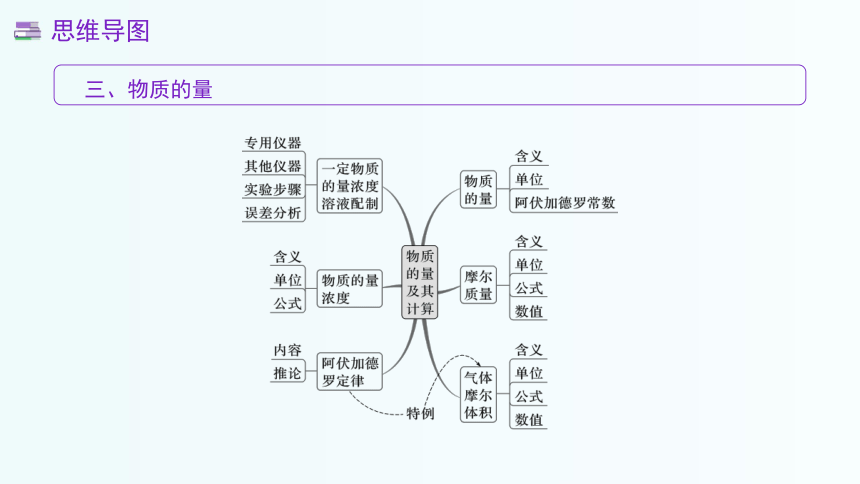
三、物质的量
思维导图
典型例题
一、宏观辨识与微观探析——物质的量
[例1]
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.22.4 L(标准状况)氩气含有的质子数为36NA
B.在标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
C.在标准状况下,2.24 L CCl4含有的氯原子数为0.4NA
D.14.4 g CO2和CO的混合气体,在标准状况下其体积为8.96 L。混合气体的平均摩尔质量 =36 g·mol-1
D
典型例题
一、宏观辨识与微观探析——物质的量
[例1]
【解析】A项,Ar为单原子分子,一分子氩气含有18个质子;B项,在标准状况下,2.24 L该混合气体中含有的分子数为0.1NA;C项,在标准状况下,CCl4为液态;D项,n(混合气体)= =0.4 mol,则混合气体的平均摩尔质量为 =36 g·mol-1,故D项正确。
典型例题
一、宏观辨识与微观探析——物质的量
[例2]
【解析】在标准状况下,溶于水的部分Cl2与水反应,故转移的电子数小于0.1NA。
设NA为阿伏加德罗常数的值。下列叙述不正确的是( )
A.某工业废气所含氮氧化物(NOx)的氮、氧元素的质量比约为7∶4,该氮氧化物可表示为N2O
B.不同条件下,23 g钠在空气中充分反应时,转移的电子数均为NA
C.在标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.25NA
D.在标准状况下,0.1 mol Cl2溶于水,转移的电子数为0.1NA
D
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是
(填字母)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
【解析】
11.9
BD
(2)溶液的浓度和密度不随所取溶液量的多少而变化。
(1)c(HCl)= =11.9mol·L-1。
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
16.8
【解析】根据c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液),则取浓盐酸的体积V(浓溶液)= ≈0.016 8 L=16.8 mL。
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响 (在括号内填A表示“偏大”,填B表示“偏小”,填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面。( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。( )
Ⅲ.定容摇匀后,发现液面低于刻度线,未做任何处理。( )
Ⅳ.定容时,俯视刻度线。( )
B
B
A
C
典型例题
一、宏观辨识与微观探析——物质的量
[以物质的量为核心的各个化学计量之间的关系]
典型例题
二、科学探究与创新意识
[例4]
过氧化钠与水反应后滴加酚酞溶液,溶液先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;②③中红色均不褪去。下列分析不正确的是( )
A.过氧化钠与水反应产生的气体为O2
B.过氧化钠与水反应需要MnO2作为催化剂
C.实验②③证明使溶液褪色的不是氢氧化钠或氧气
D.过氧化钠与水反应可能生成了具有漂白性的H2O2
B
典型例题
二、科学探究与创新意识
[例4]
【解析】过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,过氧化氢分解需要MnO2作为催化剂,B错误;实验②③作为对照实验,能证明使酚酞褪色的不是氢氧化钠或氧气,C正确;根据取反应后溶液加入二氧化锰后迅速产生大量气体,可判断过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
完成下列序号表示的化学方程式或离子方程式(① 填离子方程式,其余填化学方程式 ):
①_____________________________,
④_____________________________,
⑤_____________________________,
⑧______________________________________,
______________________________,
______________________________。
2Na+2H2O===2Na++2OH-+H2↑
Na2CO3+CO2+H2O===2NaHCO3
NaHCO3+NaOH===Na2CO3+H2O
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
2Na2O2+2H2O===4Na++4OH-+O2↑
2Na2O2+2CO2===2Na2CO3+O2
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
[例5]钠及其化合物的“价—类”二维图及部分转化关系如图所示,其中物质B为钠在常温下与氧气反应生成的一种氧化物。下列有关说法正确的是( )
A.物质B为酸性氧化物,物质类别A表
示碱
B.反应④可通过加入还原剂实现转化
C.钠放入硫酸铜溶液中可观察到红色固体析出
D.反应③会产生二氧化碳气体,因此NaHCO3可作膨松剂
D
【解析】物质B为Na2O,属于碱性氧化物,A错误;反应④是钠转化成NaOH,应加入氧化剂实现转化,B错误;钠放入硫酸铜溶液中会先和水反应,不能置换出硫酸铜中的铜,C错误;反应③是NaHCO3受热分解,会产生CO2气体,因此可作膨松剂,D正确。
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
[例5]
典型例题
二、科学探究与创新意识
[例6]以不同类别物质间的转化为线索,认识钠及其化合物。钠及其化合物的部分转化关系如图所示,下列分析不正确的是( )
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性不如Na2CO3
C.图中既能与某些酸反应,又能与某些碱反应的钠盐只有NaHCO3
D.上述转化中涉及的反应类型有分解反应、化合反应、置换反应等
C
[Na及其化合物的转化关系]
【解析】与碱反应生成盐与水的氧化物为酸性氧化物,二氧化碳与氢氧化钠反应生成碳酸钠和水,则反应③表明CO2具有酸性氧化物的性质,故A正确;碳酸氢钠受热分解生成碳酸钠,则反应④说明Na2CO3的稳定性强于NaHCO3,故B正确;碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸钠能与盐酸反应,所以图中既能与某些酸反应,又能与某些碱反应的钠盐还有Na2CO3,故C错误;④是分解反应,①是化合反应,②是置换反应,则上述转化中发生的反应有分解反应、化合反应、置换反应,故D正确。
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
[例6]
典型例题
三、科学态度与社会责任
[例7]
根据所给的信息和标志,判断下列说法错误的是( )
A B C D
《神农本草经》记载,麻黄能“止咳,逆上气” 碳酸氢钠药片
古代中国人已用麻黄治疗咳嗽 该药是抗酸药,服用时喝些醋能提高药效 看到有该标志的丢弃物,应远离并报警 贴有该标志的物品是可回收物
B
【解析】碳酸氢钠易与醋酸反应,若与醋同服,会降低药效。
用氯气对饮用水消毒,会使水中的有机物发生氯化,生成的有机含氯化合物对人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用具有强氧化性的高效消毒剂二氧化氯(ClO2)。二氧化氯极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
典型例题
三、科学态度与社会责任
[例8]
(1)欧洲一些国家用氯酸钠(NaClO3)氧化浓盐酸来制取二氧化氯,同时有氯气生成,且氯气的体积为二氧化氯的一半,这一反应的化学方程式是
。
典型例题
[例8]
三、科学态度与社会责任
【解析】(1)根据原子守恒可知,一定还有水和氯化钠生成,反应的化学方程式是2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2NaCl+2H2O。
2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2NaCl+2H2O
典型例题
三、科学态度与社会责任
[例8]
(2)浓盐酸在上述反应中显示出来的性质是 (填字母)。
A.只有还原性
B.还原性和酸性
C.只有氧化性
D.氧化性和酸性
B
【解析】(2)根据方程式可知,浓盐酸中氯元素的化合价从-1价升高到0价,失去电子,作为还原剂。同时还有氯化钠生成,所以浓盐酸还表现酸性。
典型例题
三、科学态度与社会责任
[例8]
(3)二氧化氯为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是氯气的 倍。
2.63
【解析】(3)设ClO2和Cl2的质量都是71 g,71 g氯气的物质的量是1 mol,在反应中得到2 mol电子。而71 g二氧化氯的物质的量约是1.052 mol,在反应中得到5.26 mol电子,其消毒的效率(以单位质量得到电子数表示)是氯气的 2.63倍。
典型例题
三、科学态度与社会责任
[例8]
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得二氧化氯,表示这一反应的化学方程式是 。和欧洲的方法相比,我国这一方法的主要优点是 。
2NaClO2+Cl2===2NaCl+2ClO2
对环境的污染较小
【解析】(4)由原子守恒可知,另外一种生成物是氯化钠,反应的化学方程式是2NaClO2+Cl2 === 2NaCl+2ClO2。由于生成的二氧化氯中不含氯气杂质,和欧洲的方法相比,我国这一方法的主要优点是对环境污染较小。
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
氯及其化合物的“价—类”二维图:
完成下列序号表示的化学方程式或离子方程式( ②③填离子方程式,①④填化学方程式):
① ;
② ;
③ ;
④ 。
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
Cl2+2OH-===Cl-+ClO-+H2O
Ca(ClO)2+CO2+H2O===CaCO3↑+2HClO
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
[例9]在学习了氯及其化合物的知识后,某同学绘制了如图所示的“价—类”二维图,已知:e、f的阳离子均为Na+。下列叙述正确的是( )
A.f为漂白粉的有效成分
B.由于c具有还原性,c可用作自来水消毒剂
C.b可使湿润的红色布条褪色,说明b具有漂白性
D.a的浓溶液和KMnO4在一定条件下反应可生成b
D
【解析】 f为NaClO,漂白粉的有效成分为Ca(ClO)2,A不正确;c为ClO2,具有强氧化性,是新型自来水消毒剂,B不正确;b为Cl2 ,不具有漂白性,C不正确。
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
[例10]物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图中分别为钠和氯及其化合物的“价—类”二维图,请回答下列问题:
(1)填写二维图中缺失的化学式:① 、② (含钠元素)。
Na2O、Na2O2
NaClO
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
(2)从物质类别角度看,HClO一般能与下列 (填字母)类别物质发生反应。
a.金属单质 b.非金属单质 c.酸性氧化物 d.碱性氧化物 e.酸 f.碱 g.盐
(3)实验室常用某固体和浓盐酸加热制取氯气,此反应的离子方程式为 。
(4)氢化钠(NaH)可在野外用作生氢剂,NaH用作生氢剂时的化学反应原理为NaH+H2O===NaOH+H2↑,标准状况下生成4480 mL H2转移电子的物质的量是 。
adfg
0.2mol
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
典型例题
三、科学态度与社会责任
【解析】 (1)二维图中对应横、纵坐标可知,缺失的化学式:
①为+1价钠的氧化物Na2O、Na2O2;②为+1价氯的盐NaClO。
(2)从物质类别角度看,HClO属于酸;酸一般能与金属、碱性氧化物、碱、某些盐发生反应。
(3)实验室常用二氧化锰和浓盐酸加热制取氯气。
(4)反应中NaH中氢元素的化合价由-1价变为0价,水中部分氢元素的化合价由+1价变为0价,电子转移关系为H2~e-,标准状况下生成4480 mL H2,即0.2 mol,则转移电子的物质的量是0.2 mol。
[Cl及其化合物的转化关系]
典型例题
三、科学态度与社会责任
[氯水的成分及性质]
(1)成分与性质
典型例题
三、科学态度与社会责任
[氯水的成分及性质]
(2)几点注意
①氯水中因HClO见光分解,随着HClO的消耗,最后成为盐酸,故久置氯水的酸性增强,无漂白性。因此,氯水要现用现配。
②Cl2尽管有较强的氧化性,但没有漂白性,氯水具有漂白性是因为Cl2与水反应生成了具有强氧化性的HClO。
③ClO-与Fe2+、I-、S2-、HS-、S等在水中因发生氧化还原反应不能大量共存。
典型例题
三、科学态度与社会责任
[氯水的成分及性质]
④液氯、新制氯水、久置氯水的比较
⑤氯水能使紫色石蕊溶液、蓝色石蕊试纸、pH试纸等先变红后褪色。不能用pH试纸测定氯水的pH。
物质 液氯 新制氯水 久置氯水
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
粒子种类 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H2O、H+、Cl-、OH-
课堂小结
谢谢大家
章末复习
第二章 海水中的重要元素——钠和氯
化学
1.通过钠、氯及其化合物的复习归纳,形成基于元素认识物质性质的核心观念和关键能力,构建宏观与微观相结合的学科认识思路和提出问题、猜想假设、设计方案、实验验证、得出结论的推理模式,进而掌握学习元素化合物知识的一般方法。
2.进一步树立以物质的量为核心的定量计算意识,强化物质的量是联系宏观量与微观量的桥梁观念,达成能运用物质的量进行相关计算和相关定量分析的学业要求。
学习目标
重点、难点:
1.对钠、氯及其化合物的性质的掌握与运用;物质的量的相关计算。
2.学习元素化合物的思路方法。
学习重难点
一、钠及其化合物
思维导图
一、钠及其化合物
思维导图
二、氯及其化合物
思维导图
氯离子的检验
三、物质的量
思维导图
典型例题
一、宏观辨识与微观探析——物质的量
[例1]
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.22.4 L(标准状况)氩气含有的质子数为36NA
B.在标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
C.在标准状况下,2.24 L CCl4含有的氯原子数为0.4NA
D.14.4 g CO2和CO的混合气体,在标准状况下其体积为8.96 L。混合气体的平均摩尔质量 =36 g·mol-1
D
典型例题
一、宏观辨识与微观探析——物质的量
[例1]
【解析】A项,Ar为单原子分子,一分子氩气含有18个质子;B项,在标准状况下,2.24 L该混合气体中含有的分子数为0.1NA;C项,在标准状况下,CCl4为液态;D项,n(混合气体)= =0.4 mol,则混合气体的平均摩尔质量为 =36 g·mol-1,故D项正确。
典型例题
一、宏观辨识与微观探析——物质的量
[例2]
【解析】在标准状况下,溶于水的部分Cl2与水反应,故转移的电子数小于0.1NA。
设NA为阿伏加德罗常数的值。下列叙述不正确的是( )
A.某工业废气所含氮氧化物(NOx)的氮、氧元素的质量比约为7∶4,该氮氧化物可表示为N2O
B.不同条件下,23 g钠在空气中充分反应时,转移的电子数均为NA
C.在标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.25NA
D.在标准状况下,0.1 mol Cl2溶于水,转移的电子数为0.1NA
D
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是
(填字母)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
【解析】
11.9
BD
(2)溶液的浓度和密度不随所取溶液量的多少而变化。
(1)c(HCl)= =11.9mol·L-1。
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
16.8
【解析】根据c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液),则取浓盐酸的体积V(浓溶液)= ≈0.016 8 L=16.8 mL。
典型例题
一、宏观辨识与微观探析——物质的量
[例3]
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响 (在括号内填A表示“偏大”,填B表示“偏小”,填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面。( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。( )
Ⅲ.定容摇匀后,发现液面低于刻度线,未做任何处理。( )
Ⅳ.定容时,俯视刻度线。( )
B
B
A
C
典型例题
一、宏观辨识与微观探析——物质的量
[以物质的量为核心的各个化学计量之间的关系]
典型例题
二、科学探究与创新意识
[例4]
过氧化钠与水反应后滴加酚酞溶液,溶液先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;②③中红色均不褪去。下列分析不正确的是( )
A.过氧化钠与水反应产生的气体为O2
B.过氧化钠与水反应需要MnO2作为催化剂
C.实验②③证明使溶液褪色的不是氢氧化钠或氧气
D.过氧化钠与水反应可能生成了具有漂白性的H2O2
B
典型例题
二、科学探究与创新意识
[例4]
【解析】过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,过氧化氢分解需要MnO2作为催化剂,B错误;实验②③作为对照实验,能证明使酚酞褪色的不是氢氧化钠或氧气,C正确;根据取反应后溶液加入二氧化锰后迅速产生大量气体,可判断过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
完成下列序号表示的化学方程式或离子方程式(① 填离子方程式,其余填化学方程式 ):
①_____________________________,
④_____________________________,
⑤_____________________________,
⑧______________________________________,
______________________________,
______________________________。
2Na+2H2O===2Na++2OH-+H2↑
Na2CO3+CO2+H2O===2NaHCO3
NaHCO3+NaOH===Na2CO3+H2O
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
2Na2O2+2H2O===4Na++4OH-+O2↑
2Na2O2+2CO2===2Na2CO3+O2
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
[例5]钠及其化合物的“价—类”二维图及部分转化关系如图所示,其中物质B为钠在常温下与氧气反应生成的一种氧化物。下列有关说法正确的是( )
A.物质B为酸性氧化物,物质类别A表
示碱
B.反应④可通过加入还原剂实现转化
C.钠放入硫酸铜溶液中可观察到红色固体析出
D.反应③会产生二氧化碳气体,因此NaHCO3可作膨松剂
D
【解析】物质B为Na2O,属于碱性氧化物,A错误;反应④是钠转化成NaOH,应加入氧化剂实现转化,B错误;钠放入硫酸铜溶液中会先和水反应,不能置换出硫酸铜中的铜,C错误;反应③是NaHCO3受热分解,会产生CO2气体,因此可作膨松剂,D正确。
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
[例5]
典型例题
二、科学探究与创新意识
[例6]以不同类别物质间的转化为线索,认识钠及其化合物。钠及其化合物的部分转化关系如图所示,下列分析不正确的是( )
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性不如Na2CO3
C.图中既能与某些酸反应,又能与某些碱反应的钠盐只有NaHCO3
D.上述转化中涉及的反应类型有分解反应、化合反应、置换反应等
C
[Na及其化合物的转化关系]
【解析】与碱反应生成盐与水的氧化物为酸性氧化物,二氧化碳与氢氧化钠反应生成碳酸钠和水,则反应③表明CO2具有酸性氧化物的性质,故A正确;碳酸氢钠受热分解生成碳酸钠,则反应④说明Na2CO3的稳定性强于NaHCO3,故B正确;碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸钠能与盐酸反应,所以图中既能与某些酸反应,又能与某些碱反应的钠盐还有Na2CO3,故C错误;④是分解反应,①是化合反应,②是置换反应,则上述转化中发生的反应有分解反应、化合反应、置换反应,故D正确。
典型例题
二、科学探究与创新意识
[Na及其化合物的转化关系]
[例6]
典型例题
三、科学态度与社会责任
[例7]
根据所给的信息和标志,判断下列说法错误的是( )
A B C D
《神农本草经》记载,麻黄能“止咳,逆上气” 碳酸氢钠药片
古代中国人已用麻黄治疗咳嗽 该药是抗酸药,服用时喝些醋能提高药效 看到有该标志的丢弃物,应远离并报警 贴有该标志的物品是可回收物
B
【解析】碳酸氢钠易与醋酸反应,若与醋同服,会降低药效。
用氯气对饮用水消毒,会使水中的有机物发生氯化,生成的有机含氯化合物对人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用具有强氧化性的高效消毒剂二氧化氯(ClO2)。二氧化氯极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
典型例题
三、科学态度与社会责任
[例8]
(1)欧洲一些国家用氯酸钠(NaClO3)氧化浓盐酸来制取二氧化氯,同时有氯气生成,且氯气的体积为二氧化氯的一半,这一反应的化学方程式是
。
典型例题
[例8]
三、科学态度与社会责任
【解析】(1)根据原子守恒可知,一定还有水和氯化钠生成,反应的化学方程式是2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2NaCl+2H2O。
2NaClO3+4HCl(浓)===2ClO2↑+Cl2↑+2NaCl+2H2O
典型例题
三、科学态度与社会责任
[例8]
(2)浓盐酸在上述反应中显示出来的性质是 (填字母)。
A.只有还原性
B.还原性和酸性
C.只有氧化性
D.氧化性和酸性
B
【解析】(2)根据方程式可知,浓盐酸中氯元素的化合价从-1价升高到0价,失去电子,作为还原剂。同时还有氯化钠生成,所以浓盐酸还表现酸性。
典型例题
三、科学态度与社会责任
[例8]
(3)二氧化氯为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是氯气的 倍。
2.63
【解析】(3)设ClO2和Cl2的质量都是71 g,71 g氯气的物质的量是1 mol,在反应中得到2 mol电子。而71 g二氧化氯的物质的量约是1.052 mol,在反应中得到5.26 mol电子,其消毒的效率(以单位质量得到电子数表示)是氯气的 2.63倍。
典型例题
三、科学态度与社会责任
[例8]
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得二氧化氯,表示这一反应的化学方程式是 。和欧洲的方法相比,我国这一方法的主要优点是 。
2NaClO2+Cl2===2NaCl+2ClO2
对环境的污染较小
【解析】(4)由原子守恒可知,另外一种生成物是氯化钠,反应的化学方程式是2NaClO2+Cl2 === 2NaCl+2ClO2。由于生成的二氧化氯中不含氯气杂质,和欧洲的方法相比,我国这一方法的主要优点是对环境污染较小。
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
氯及其化合物的“价—类”二维图:
完成下列序号表示的化学方程式或离子方程式( ②③填离子方程式,①④填化学方程式):
① ;
② ;
③ ;
④ 。
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
Cl2+2OH-===Cl-+ClO-+H2O
Ca(ClO)2+CO2+H2O===CaCO3↑+2HClO
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
[例9]在学习了氯及其化合物的知识后,某同学绘制了如图所示的“价—类”二维图,已知:e、f的阳离子均为Na+。下列叙述正确的是( )
A.f为漂白粉的有效成分
B.由于c具有还原性,c可用作自来水消毒剂
C.b可使湿润的红色布条褪色,说明b具有漂白性
D.a的浓溶液和KMnO4在一定条件下反应可生成b
D
【解析】 f为NaClO,漂白粉的有效成分为Ca(ClO)2,A不正确;c为ClO2,具有强氧化性,是新型自来水消毒剂,B不正确;b为Cl2 ,不具有漂白性,C不正确。
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
[例10]物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图中分别为钠和氯及其化合物的“价—类”二维图,请回答下列问题:
(1)填写二维图中缺失的化学式:① 、② (含钠元素)。
Na2O、Na2O2
NaClO
典型例题
三、科学态度与社会责任
[Cl及其化合物的转化关系]
(2)从物质类别角度看,HClO一般能与下列 (填字母)类别物质发生反应。
a.金属单质 b.非金属单质 c.酸性氧化物 d.碱性氧化物 e.酸 f.碱 g.盐
(3)实验室常用某固体和浓盐酸加热制取氯气,此反应的离子方程式为 。
(4)氢化钠(NaH)可在野外用作生氢剂,NaH用作生氢剂时的化学反应原理为NaH+H2O===NaOH+H2↑,标准状况下生成4480 mL H2转移电子的物质的量是 。
adfg
0.2mol
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
典型例题
三、科学态度与社会责任
【解析】 (1)二维图中对应横、纵坐标可知,缺失的化学式:
①为+1价钠的氧化物Na2O、Na2O2;②为+1价氯的盐NaClO。
(2)从物质类别角度看,HClO属于酸;酸一般能与金属、碱性氧化物、碱、某些盐发生反应。
(3)实验室常用二氧化锰和浓盐酸加热制取氯气。
(4)反应中NaH中氢元素的化合价由-1价变为0价,水中部分氢元素的化合价由+1价变为0价,电子转移关系为H2~e-,标准状况下生成4480 mL H2,即0.2 mol,则转移电子的物质的量是0.2 mol。
[Cl及其化合物的转化关系]
典型例题
三、科学态度与社会责任
[氯水的成分及性质]
(1)成分与性质
典型例题
三、科学态度与社会责任
[氯水的成分及性质]
(2)几点注意
①氯水中因HClO见光分解,随着HClO的消耗,最后成为盐酸,故久置氯水的酸性增强,无漂白性。因此,氯水要现用现配。
②Cl2尽管有较强的氧化性,但没有漂白性,氯水具有漂白性是因为Cl2与水反应生成了具有强氧化性的HClO。
③ClO-与Fe2+、I-、S2-、HS-、S等在水中因发生氧化还原反应不能大量共存。
典型例题
三、科学态度与社会责任
[氯水的成分及性质]
④液氯、新制氯水、久置氯水的比较
⑤氯水能使紫色石蕊溶液、蓝色石蕊试纸、pH试纸等先变红后褪色。不能用pH试纸测定氯水的pH。
物质 液氯 新制氯水 久置氯水
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
粒子种类 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H2O、H+、Cl-、OH-
课堂小结
谢谢大家
